Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.40 no.2 Bogotá May/Aug. 2011
PREPARACIÓN DE CARBONES ACTIVADOS A PARTIR DE RESIDUOS DE LLANTAS. ACTIVACIÓN FÍSICA Y QUÍMICA
PREPARATION OF ACTIVATED CARBONS FROM WASTE TIRE. PHYSICAL AND CHEMICAL ACTIVATION
PREPARAÇÃO DE CARVÕES ATIVADOS A PARTIR DE RESÍDUOS DE PNEUS. ACTIVAÇÃO FÍSICA E QUÍMICA
Melina Cantillo Castrillón1, Liliana Giraldo1,2, Juan Carlos Moreno3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, Colombia.
3 Departamento de Química, Facultad de Ciencias, Universidad de los Andes. Bogotá, Colombia.
Recibido: 25/05/11 - Aceptado: 05/09/11
RESUMEN
Se preparan carbones activados por activación química de residuos de llantas con soluciones acuosas de diferente concentración de dos activantes químicos (H3PO4 y KOH) y por activación física con CO2.
Los carbones activados caracterizados por determinación de isotermas de adsorción de N2 a 77 K, que muestran la forma típica de estructuras mesoporosas, que permiten calcular el área superficial específica para los carbones activados obtenidos que presentaron valores entre 25,4 y 157,3 m2g-1.
Las entalpías de inmersión de los carbones activados en benceno y agua se encuentran entre 3,12 y 27,6 Jg-1 y 9,81 y 30,6 Jg-1, respectivamente, y muestran el tipo de interacciones superficiales que pueden tener los sólidos porosos obtenidos con diferentes adsorbatos.
Se encontró un comportamiento lineal directamente proporcional para la relación entre el volumen de microporo y el área superficial, y una relación de segundo orden entre el área superficial y la entalpía de inmersión en benceno. De acuerdo con las condiciones de preparación se obtienen sólidos porosos adecuados para la adsorción de compuestos en fase líquida dado su mayor volumen de mesoporos.
Palabras clave: activación química, activación física, entalpía de inmersión, carbón activado, residuos de llantas.
ABSTRACT
Activated carbons are prepared by chemical activation from waste tire with aqueous solutions at different concentrations of two activating agents-H3PO4 and KOH--and by physical activation with CO2.
The activated carbons are characterized by the determination of adsorption isotherms N2 at 77 K, which show the form typical of structures mesoporous and allow calculating the surface specific area, for the activated carbons obtained that presented values between 25,4 and 157,3 m2g-1.
The immersion enthalpies of the activated carbons in benzene and water present values that are between 3,12 and 27,6 Jg-1 and 9,81 and 30,6 Jg-1, respectively, and show the surface interactions type that can have the porous solids obtained with different adsorbates.
A directly linear proportional behavior for the relation between the micropore volume and the surface area, and a relation of the second order between the surface area and the immersion enthalpy in benzene were found. In agreement with the conditions of preparation, the solid porous obtained are adapted for the adsorption of compounds in liquid phase because of its major mesoporous volume.
Key words: chemical activation, physical activation, immersion enthalpies, activated carbon, waste tire.
RESUMO
Se preparam carvões ativados por activação química de resíduos de llantas com soluções acuosas de diferente concentração de duas activantes químicos (H3PO4 e KOH), e por activação física com CO2.
Os carvões ativados se caracterizam por determinação de isotermas de adsorção de N2 a 77 K, que mostram a forma característica de estruturas mesoporosas, permitem calcular o área superficial específica para os carvões ativados obtidos que apresentaram valores entre 25,4 e 157,3 m2g-1.
As entalpías de imersão dos carvões ativados em benzeno e água, encontram-se entre 3,12 e 27,6 Jg-1 e 9,81 e 30,6 Jg-1, respectivamente e mostram o tipo de interações superficiais que podem ter os sólidos porosos obtidos com diferentes adsorbatos.
Encontrou-se um comportamento linear diretamente proporcional para a relação entre o volume de microporo e o área superficial e uma relação de segundo ordem entre o área superficial e a entalpía imersão em benzeno; de acordo às condições de preparação se obtêm sólidos porosos adequados para a adsorção de compostos em fase líquida dado seu maior volume de mesoporos.
Palavras-chave: Ativação química, ativação fisica, entalpia de imersão, carvão ativado, resíduos de pneus.
INTRODUCCIÓN
El manejo y el control de los residuos sólidos es cada vez más difícil debido a las grandes cantidades producidas. Entre estos materiales se encuentran las llantas usadas, un material compuesto principalmente por una matriz polimérica (copolímero butadieno-estireno), caucho natural o sintético; materiales de relleno como el negro de humo; y algunos refuerzos como fibras de vidrio y acero (1). La degradación de las llantas es compleja porque su estructura química (2) impide su reciclaje aplicando calor para darles una nueva forma, como sucede con los materiales termoplásticos. Sin embargo, por pirólisis de los residuos de las llantas se pueden obtener gases, líquidos y sólidos, estos últimos constituidos aproximadamente en un 40% por negro de humo (3,4).
Se han propuesto diferentes alternativas para utilizar las llantas usadas: obtención de combustibles, precursores de productos químicos, recuperación de sus sólidos de relleno, entre otros. Un proceso útil es el uso de los residuos de llantas en la producción de carbón activado porque su composición química con alto contenido de carbono las convierte en un buen precursor para obtener este tipo de adsorbentes (5).
La composición química de la llanta -que involucra la presencia de diferentes materiales (6)- y su estructura física compacta dificultan el desarrollo de la porosidad del material debido a que el negro de humo tiene una estructura rígida que obstaculiza la accesibilidad de los agentes activantes al inhibir la reacción con estos; en consecuencia, las llantas deben ser carbonizadas inicialmente y luego activadas utilizando temperaturas superiores a 1273 K y tiempos de activación superiores a 5 horas. Estas condiciones aumentan el costo del proceso para obtener un desarrollo de porosidad apreciable. En este artículo se propone trabajar en condiciones moderadas (sin carbonización previa antes de la activación química y tiempos de activación de dos horas) para el desarrollo de la porosidad y evaluar los carbones activados obtenidos en tales condiciones (7,8).
La capacidad de adsorción de los carbones activados de diferentes compuestos está determinada por sus propiedades físicas y químicas. Para conocer estas características se aplican distintas técnicas; una de estas es la adsorción de gases y vapores en sólidos, que es una de las más usadas para el estudio de la textura porosa. En la caracterización textural de un sólido, los parámetros por determinar son la superficie específica, el volumen y la distribución de tamaño de poros (9,10).
También se emplean técnicas energéticas en la caracterización de los sólidos porosos: por ejemplo, la calorimetría de inmersión se usa para conocer, según las condiciones termodinámicas de un sistema, el calor producido cuando se pone en contacto un sólido con un líquido de inmersión, y por tanto la entalpía del proceso. El efecto térmico de este contacto cuando el solvente es no polar, como el benceno, con el cual el sólido no tiene interacciones químicas, se puede relacionar con el área superficial del sólido mediante modelos que combinan parámetros de adsorción y energía (11); cuando el sólido se sumerge en agua, la entalpía que se determina se relaciona con la interacción específica con los sitios químicos superficiales (12).
En este artículo se expone cómo preparar carbones activados mediante activación física con CO2 a dos temperaturas de activación (1123 y 1223 K), y activación química con soluciones de ácido fosfórico e hidróxido de potasio a diferentes concentraciones, con igual tiempo de activación en los dos procesos, a partir de residuos de llantas que se someten a condiciones moderadas de preparación como impregnación directa del sólido en la activación química y posterior tratamiento térmico a 1123 K
MATERIALES Y MÉTODOSPreparación del carbón activado
Las llantas se limpian con aire a presión para retirar sólidos adheridos, luego se cortan en pedazos de aproximadamente 40 cm, que se trituran en un molino de cuchillas y se tamizan a un tamaño aproximado de 10 mm, para realizar los procesos de carbonización y activación.
El sólido triturado se divide en tres porciones: dos se activan químicamente, una se impregna con soluciones de H3PO4 con concentraciones 20, 40 y 60% p/p y la otra porción se impregna con soluciones de KOH al 20 y 40% p/p. La impregnación con el agente activante se realiza durante 48 horas, luego se seca en una mufla a una temperatura de 393 K por 24 horas (4). Estas muestras impregnadas se carbonizan en un horno horizontal a una velocidad de calentamiento de 10 K min-1 hasta llegar a una temperatura de 1123 K, que se mantiene durante dos horas. Finalmente se lavan con agua destilada hasta alcanzar un pH neutro.
Para la activación física, se emplea la tercera porción del material triturado que se carboniza a la temperatura de mayor pérdida de peso que refleja el análisis termogravimétrico de los residuos de 923 K durante 2 horas; posteriormente se realiza la activación con el agente oxidante CO2 a la misma condición de tiempo que se usa en la activación química, y a dos temperaturas de activación de 1123 y 1223 K.
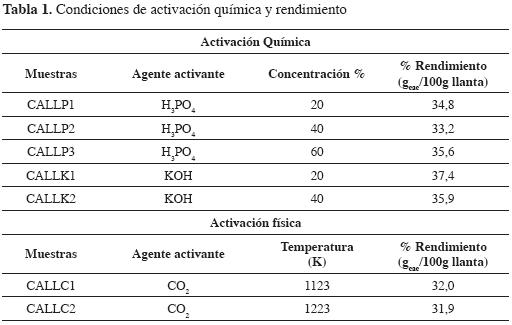
Los carbones activados obtenidos con las condiciones anteriores se denominan carbón activado de llanta (CALL), seguido de P, K, C, que se refiere al agente activante, solución de ácido fosfórico, solución de hidróxido de potasio y C dióxido de carbono. A continuación de estos se coloca el número que indica el orden en la serie de menor a mayor concentración o temperatura; por ejemplo, el carbón activado CALLP2 se obtiene al activar la llanta con solución de H3PO4 al 40%
Caracterización textural de los carbones activados
Se realiza la caracterización mediante la determinación de la isoterma de adsorción de N2 a 77 K usando un equipo Quantachrome, Autosorb 3-B. El cálculo de volumen de microporo se realiza por medio del modelo de Dubinin-Radushkevich y el área superfi-cial se obtiene mediante el modelo de BET (10).
Determinación de las entalpías de inmersión
Para determinar el efecto térmico que produce la inmersión del carbón activado en el solvente, se usa un microcalorímetro de conducción de calor con una celda calorimétrica en acero inoxidable (13, 14). En la celda se colocan 10 mL del solvente que va a utilizarse, mantenidos en un termostato a 298 K; se pesa una muestra de carbón activado de aproximadamente 0,100 g y se coloca dentro de la celda calorimétrica en una ampolleta de vidrio. Se ensambla el microcalorímetro. Cuando el equipo alcanza una temperatura de alrededor de 298 K, se inicia el registro de potencial eléctrico de salida del calorímetro por un periodo de aproximadamente 15 minutos tomando lecturas de potencial cada 20 segundos. Luego se rompe la ampolleta de vidrio, se registra el efecto térmico generado y se continúan las lecturas de potencial por aproximadamente 15 minutos más. Por último, se calibra eléctricamente.
RESULTADOS Y DISCUSIÓNEn la Tabla 1 se observan los rendimientos obtenidos en la activación de las llantas a distintas condiciones experimentales. Se obtienen rendimientos de entre el 32 y el 37%, con valores más altos para los sólidos activados químicamente con soluciones de KOH. La activación física en la que se han empleado dos temperaturas para el proceso tiene el mismo porcentaje de rendimiento, alrededor de 32%, aunque las características de la superficie sean diferentes (Tabla 2). Los rendimientos son comparables a los obtenidos por Edward (15) en carbones activados a partir de llantas por carbonización y posterior activación química con H2SO4, y física con CO2 en tiempos entre 2 y 16 horas. Para tiempos entre 2 y 4 horas, se obtienen rendimientos de alrededor del 35%, similares a los de este trabajo.
Características de textura
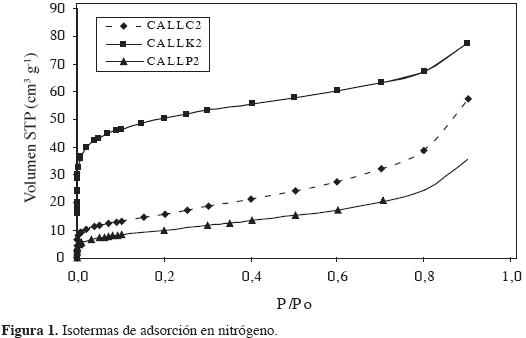
Las características texturales de los carbones activados obtenidos se determinan por medio de la isoterma de adsorción de nitrógeno a 77 K. En la Figura 1 se observan las isotermas de adsorción obtenidas para algunos de los carbones activados preparados: el carbón activado CALLK2 presenta el valor más alto de área superficial; los carbones activados CALLP2 y CALLC2 tienen propiedades similares. La isoterma de adsorción para la muestra CALLK2 es de tipo I según la clasificación de la IUPAC, característica de carbones microporosos, en los que los poros se llenan a bajas presiones relativas en un proceso de adsorción física de gases (16). Para este carbón activado se obtiene una capacidad de adsorción de alrededor de 60 cm3g-1. Las muestras CALLC2 y CALLP2 tienen isotermas tipo II, características de carbones mesoporosos con un punto de inflexión en la curva, lo cual indica la formación de una monocapa (17). La forma de las isotermas indica la obtención de sólidos porosos con formación de microporos, en el primer caso, y de mesoporos, en el caso de las muestras CALLC2 y CALLP2.
Los resultados obtenidos en las isotermas revelan que los procesos de activación producen sólidos con diferentes características según el precursor que, de acuerdo con reportes de otros trabajos, se trata térmicamente antes de realizar la activación (18).
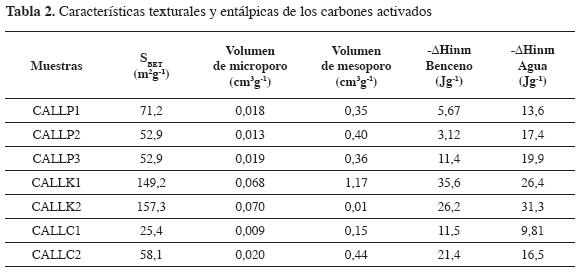
En la Tabla 2 aparecen las características texturales de los carbones activados, los valores de área superficial y de volúmenes de microporos y mesoporos. El análisis de estos resultados se puede realizar con respecto a cada uno de los agentes activantes: para las muestras activadas con soluciones de H3PO4 se obtienen sólidos mesoporosos con volúmenes de entre 0,35 y 0,40 cm3g-1; la activación con soluciones de KOH indica que la solución de mayor concentración produce una interacción mayor con el precursor y un sólido microporoso con un valor de área superficial de 152 m2g-1. Cuando se usa la solución de menor concentración, el carbón activado obtenido es mesoporoso, lo cual se puede explicar por la dificultad de penetración del activante en el precursor. Este resultado contrasta con los resultados obtenidos por Evans (19) para un material carbonoso obtenido a partir de sacarosa y KOH en el que obtienen sólidos esencialmente microporosos y con valores de área superficial superiores a 2000 m2g-1.
En la activación física se observa que, a mayor temperatura, el CO2 produce una porosidad mayor.
En la Tabla 2 se presentan los resultados obtenidos para las entalpías de inmersión de los carbones activados en benceno y agua. Se observa que los valores más altos corresponden a las muestras activadas con solución de hidróxido de potasio (CALLK) tanto para las calorimetrías en agua como en benceno.
Con el propósito de apreciar el tipo de interacción de los adsorbentes, se suelen poner en contacto con líquidos de diferente naturaleza. Cuando los valores de las entalpías de inmersión de los sólidos en agua son mayores que las entalpías de inmersión en benceno, como ocurre en este trabajo, los carbones activados con soluciones de ácido fosfórico y de KOH de 40% son hidrofílicos, en tanto que los carbones activados obtenidos por activación física presentan un carácter hidrofóbico. En trabajos de anteriores de nuestro laboratorio (20), los carbones activados a partir de materiales lignocelulósicos por activación física son de carácter hidrofóbico, como sucede en este trabajo a los carbones activados CALLC, preparados con CO2 por activación física. Esto indica que dicha activación disminuye los sitios polares en la superficie de los sólidos porosos.
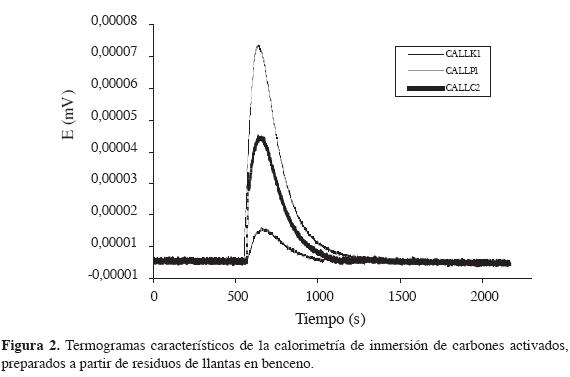
En la Figura 2 se representan los termogramas obtenidos por inmersión en benceno de algunos de los carbones activados preparados para cada uno de los agentes activantes, que tienen distintas áreas superficiales. Se observa como aumenta el área bajo la curva del pico generado por el efecto exotérmico en la inmersión, el cual es proporcional al calor total producido; por tanto, el carbón activado CALLK1 tiene el mayor valor para la entalpía de inmersión en benceno (-35,6 Jg-1). La inmersión de carbones activados en un solvente no polar produce un efecto térmico relacionado con la interacción del solvente con la superficie de los sólidos; su intensidad es mayor cuando dichos sólidos son microporosos, como se puede ver en los trabajos de Stoeckli (21), que proponen la caracterización de carbones activados por medio de técnicas calorimétricas.
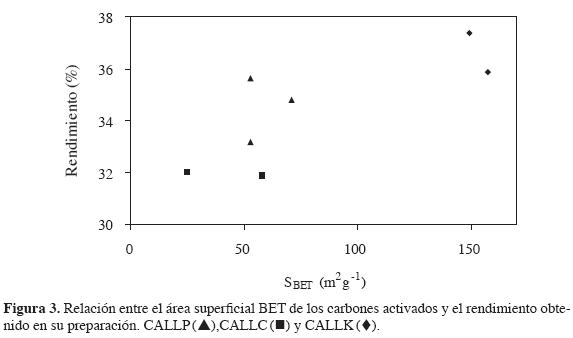
Una vez preparados los carbones activados a partir de residuos de llantas en condiciones que incluyen tiempos de activación de 2 horas y sin carbonización previa para la impregnación química, se determinan sus propiedades superficiales para analizar los resultados de acuerdo con dichas condiciones de preparación. Así, se establece una relación (Figura 3) entre el rendimiento y el área superficial , aunque se haya anotado que los porcentajes de rendimiento son similares para los carbones activados obtenidos.
El valor de área superficial de dos de los carbones activados con ácido fosfórico es igual. El carbón que se activa con la solución de menor concentración tiene área superficial mayor, con redimientos entre 33 y 35%, debido a que, en la activación con ácido fosfórico, el fósforo puede quedar incluido como metafosfatos en la estructura carbonosa, lo que se refleja en valores mayores de rendimiento, de alrededor de 35% para la muestra activada a la concentración más alta de ácido fosfórico (22).
Para los carbones activados con soluciones de hidróxido de potasio, el rendimiento disminuye con el aumento del área superficial, es decir, que una mayor porosidad produce una pérdida de masa mayor en el precursor y hace que el rendimiento sea menor.
Los carbones activados por activación física tienen el mismo valor de rendimiento: 32%, para las dos temperaturas de activación de 1123 y 1223 K, pero un área superficial mayor para el carbón activado obtenido a la temperatura más alta con características mesoporosas.
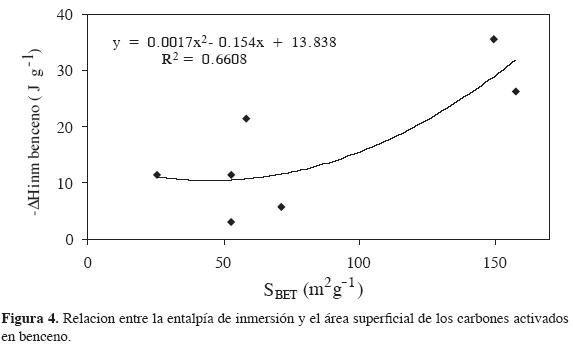
La Figura 4 indica la relación entre la entalpia de inmersión de los carbones activados en benceno en función del área superficial, cuyos valores tienen una alta dispersión entre sí, reflejada en el coeficiente de correlación R2 de 0,6608. Se aprecia un comportamiento creciente de la entalpía de inmersión de los carbones activados en benceno con respecto al aumento del area superficial BET, que se ajusta a una ecuación de segundo orden. Esto se puede explicar por la misma naturaleza porosa de los carbones activados, que no es en esencia microporosa (23). Se observa que la entalpía de inmersión en benceno de los carbones activados CALLK y CALLC es proporcional a sus áreas superficiales, a diferencia de la entalpía de las muestras CALLP, en las cuales el calor de inmersión es menor a pesar de tener un área superficial BET mayor que las muestras activadas con CO2. Este comportamiento puede ser explicado por la obstrucción parcial de la estructura del carbón activado con acido fosfórico (24).
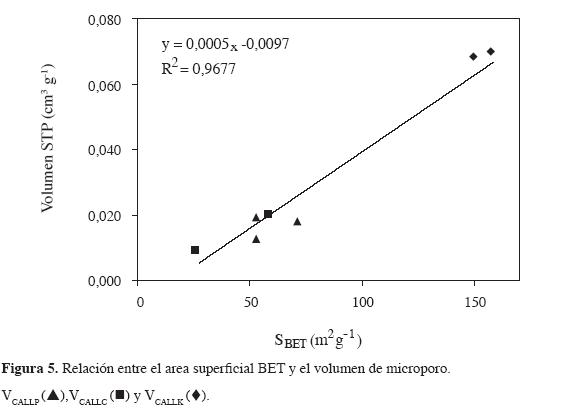
En la Figura 5 se observa que la relación entre el volumen de microporo de los carbones activados, obtenida por el modelo Dubinin-Radushkevich, con valores bajos entre 0,01 y 0,07 cm3g-1, correlaciona de manera lineal con el área superficial obtenida por el modelo BET. Esta relación tiene un coeficiente de correlación de 0,9677, que indica la dispersión entre los parámetros, la cual se debe a que la preparación experimental de los sólidos es diferente.
La relación revela que el desarrollo de área superficial y de microporos influye en la capacidad de adsorción de nitrógeno y en la intensidad de la interacción energética con el benceno. Un comportamiento similar al anterior se establece para la relación del área superficial con el volumen de mesoporos cuyos valores son mayores que los del volumen de microporos para la mayoría de los carbones activados preparados. Esto permite decir que los sólidos son mesoporosos.
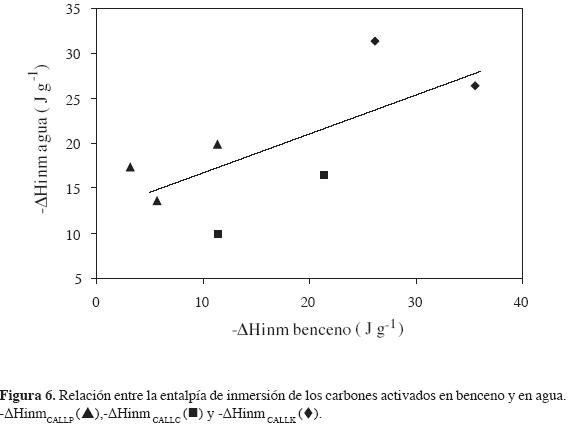
En la Figura 6 se observa la relación entre las entalpías de inmersión de los sólidos en benceno y en agua. Se aprecian dos tendencias: una de valores de entalpía de inmersión en agua más altos, que corresponden a los carbones activados con ácido fosfórico, y de las muestras que se activan con hidróxido de potasio en mayor concentración. La otra tiene valores más bajos que corresponden a las muestras activadas físicamente y la que tiene el mayor volumen de mesoporos.
La tendencia general indica que al aumentar la entalpía de inmersión de los carbones activados en benceno también aumenta la entalpía de inmersión de estos en agua y que los carbones activados obtenidos tienen mayores valores para la entalpía de inmersión de los sólidos en agua, lo que indica su carácter hidrófilico.
CONCLUSIONES
En las condiciones de preparación propuestas en este artículo se obtuvieron carbones activados con áreas superficiales entre 25,4 y 157,3 m2g-1 y volumenes de mesoporo entre 0,01 y 1,17 cm3g-1, que representan un desarrollo en las características superficiales. Esto indica que el material precursor genera sólidos mesoporosos al ser activado en condiciones de bajos tiempos de activación y sin carbonización previa en la activación química.
Se observa un mayor desarrollo de microporosidad y de area superficial en los carbones activados por activación química con hidróxido de potasio, cuyos valores más altos de estos parámetros se obtienen para la muestra CALLK2, de 0,07 cm3g-1, para el volumen de microporo, y 157,3 m2g-1 para el área superficial.
Se determinaron las entalpías de inmersión de los carbones activados en benceno y agua, obteniendo valores entre 3,12 y 27,6 y 9,81 y 30,6 Jg-1, respectivamente. Estos resultados indican que los sólidos son de naturaleza hidrofílica. La relación directamente proporcional entre las entalpías de inmersión del conjunto de carbones activados en benceno y agua revela el desarrollo conjunto de poros y de sitios activos en los carbones activados.
AGRADECIMIENTOS
Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia, y al Acta de Acuerdo entre los departamentos de Química de las dos universidades. Se agradece a la Dirección de Investigación Sede Bogotá DIB de la Universidad Nacional de Colombia, Proyecto 13764.
REFERENCIAS BIBLIOGRÁFICAS
1. Kaminsky, W.; Mennerich, C. Pyrolysis of synthetic tire rubber in a fluidised-bed reactor to yield 1,3-butadiene, styrene and carbon black. J. Anal. Appl. Pyrol. 2001. 58-59: 803-811. [ Links ]
2. Li, L.; Liu, S.; Tan, Z. Application of activated carbon derived from scrap tires for adsorption of Rhodamine B. J. Environmen. Sci. 2010. 22(8): 1273-1280. [ Links ]
3. Olazar, M.; Arabiorrutia, M.; López, G.; Aguado, R.; Bilbao, J. Effect of acid catalysts on scrap tyre pyrolysis under fast heating conditions. J. Anal. Appl. Pyrol. 2008. 82: 199-204. [ Links ]
4. Troca Torrado, C.; Alexandre Franco, M.; Fernández González, C.; Alfaro Domínguez, M.; Gómez Serrano, V. Development of adsorbents from used tire rubber Their use in the adsorption of organic and inorganic solutes in aqueous solution. Fuel Proces. Technol. 2011. 92: 206-212. [ Links ]
5. Tanthapanichakoon, W.; Ariyadejwanich, P.; Japthon, P. Adsorption-desorption characteristics of phenol and reactive dyes from aqueous solution on mesoporous activated carbon prepared from waste tires. Water Research. 2005. 39: 1347-1353. [ Links ]
6. Knocke, W.; Hemphill, L.H. Mercury (II) adsorption by waste rubber. Water Research. 1981. 15(2): 275-282. [ Links ]
7. Mui, E.; Ko, D.; McKay, G. Production of active carbons from waste tyres-A review. Carbon. 2004. 42: 2789-2805. [ Links ]
8. Zabaniotou, A.; Madau, P.; Oudenne, P.D. Active carbon production from used tire in two-stage procedure: Industrial pyrolysis and bench scale activation with H2O-CO2 mixture. J. Anal. Appl. Pyrol. 2004. 72: 289-297. [ Links ]
9. Rodríguez Reinoso, F.; Molina Sabio, M. Textural and chemical characterization of microporous carbons. Adv in Colloid and Interf Sci. 1998. 76-77: 271-294. [ Links ]
10. Bansal, R.C.; Donnet, J.B.; Stoeckli F. Active Carbon. New York, Marcel Dekker Inc. 1988. p. 112. [ Links ]
11. Moreno, J.C.; Giraldo, L. Instrumentación calorimétrica aplicada a la determinación de entalpías de inmersión de sólidos porosos. En: Moreno J. C. Sólidos porosos. Preparación, caracterización y aplicaciones. Bogotá, Ediciones Uniandes. 2007. p. 404. [ Links ]
12. Giraldo, L.; Moreno, J.C. Immersion enthalpy and the constant of Langmuir model in the 3-chloro phenol adsorption on activated carbon. J. Therm. Anal. Cal. 2010. 100(2): 695-700. [ Links ]
13. Giraldo, L.; Moreno, J.C.; Huertas, J.I. Heats conduction micro-calorimeter with metallic reaction cells. Instrumentation Science & Technology. 2002. 30 (2): 177-186. [ Links ]
14. Rodríguez, G.; Giraldo, L.; Moreno, J.C. Evaluación de la señal generada en un calorímetro de conducción de calor en la determinación de entalpías de inmersión para caracterización de sólidos porosos. Afinidad. Revista de Química Teórica y Aplicada. 2009. 66(539): 1-9. [ Links ]
15. Edward, L.K.; Cheung, M.W.H.; Valix, M.; McKay, G. Dye adsorption onto activated carbons from tyre rubber waste using surface coverage analysis. J. Colloid Interface Sci. 2010. 347: 290-300. [ Links ]
16. Martin-Martínez, J.M. Adsorción física de gases y vapores por carbones. Universidad de Alicante. 1988. p. 465. [ Links ]
17. Rouquerol, F.; Rouquerol, J.; Sing, K.S.W. Adsorption by powders and porous solids. Principles, methodology and applications. San Diego, Academic Press. 1999. p. 178. [ Links ]
18. Rozada, F.; Otero, M.; Parra, J.B.; Morán, A.; García, A.I. Producing adsorbents from sewage sludge and discarded tyres. Characterization and utilization for the removal of pollutants from water. Chem. Enginee. Journal. 2005. 114: 161-169. [ Links ]
19. Evans, M.J.B.; Halliop, E.; MacDonald, J.A.F. The production of chemically-activated carbon. Carbon. 1999. 37: 269-274. [ Links ]
20. Giraldo, L.; Moreno, J.C. Calorimetric determination of activated carbons in aqueous solutions. J Therm Anal Cal. 2007. 89: 589-594. [ Links ]
21. Stoeckli, F.; Centeno, T.A. On the characterization of microporous carbons by immersion calorimetry alone. Carbon. 1997. 35: 1097-1100. [ Links ]
22. Marsh, H; Rodríguez-Reinoso, F. Activate carbon. Gran Bretaña, Elsevier Science and Technology Books. 2006. p. 326-327. [ Links ]
23. Moreno, J. C.; Giraldo, L.; Gómez, A. Applicability of the Stoeckli-Bansal- Donnet equation for the determination of total area of activated carbons by microcalorimetry of immersion. Inst. Sci. and Technol. 1998. 5: 533-541. [ Links ]
24. Vargas, D.P.; Giraldo, L.; Silvestre-Albero, J; Moreno Pirajan, J.C. CO2 adsorption on binderless activated carbon monoliths. Adsorption. 2011. 17: 497-504. [ Links ]