Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.40 no.3 Bogotá Sept./Dec. 2011
EFECTO DEL VANADIO EN CATALIZADORES DERIVADOS DE MATERIALES TIPO HIDROTALCITA EN DESHIDROGENACIÓN OXIDATIVA DE PROPANO
EFFECT OF VANADIUM IN CATALYSTS DERIVED FROM HYDROTALCITE-LIKE MATERIALS IN OXIDATIVE DEHIDROGENATION OF PROPANE
EFEITO DO VANÁDIO EM CATALISADORES DERIVADOS DE MATERIAIS TIPO HIDROTALCITA NA DESIDROGENAÇÃO OXIDATIVA DE PROPANO
Santiago Mesa1, Johana Arboleda1, Sandra Amaya1, Adriana Echavarría1
1 Instituto de Química, Facultad de Ciencias Exactas y Naturales, Grupo Catalizadores y Absorbentes, Universidad de Antioquia, Medellín, Colombia. aechavar@udea.edu.co
Recibido: 17/08/11- Aceptado: 02/12/11
RESUMEN
Dos nuevos materiales tipo hidrotalcita, basados en NiCoCr y NiCoFe, se obtuvieron por el método hidrotérmico. Estos materiales se modificaron con especies de vanadio por intercambio iónico. Los sólidos se caracterizaron usando difracción de rayos X (DRX), análisis elemental (absorción atómica), y análisis termogravimétrico (ATG). Los sólidos con y sin intercambio se trataron térmicamente para obtener los respectivos óxidos mixtos, que posteriormente se evaluaron en la reacción de deshidrogenaciónoxidativa de propano (Dhop) a una velocidad espacial de 50 mL/min g y en un rango de temperatura comprendido entre 250 y 500 °C. Los estudios catalíticos mostraron un efecto positivo al incorporar el vanadio para el material NiCoCr, mientras que para el sistema NiCoFe modificado se observó una disminución en su actividad catalítica.
Palabras clave: hidrotalcitas, propileno, vanadio, catálisis heterogénea.
ABSTRACT
Two novel hydrotalcite-like materials have been synthesized by hydrothermal treatment. Using ionic exchange method, the materials have been modified with vanadium species. Characterization of the materials was carried out by X-Ray diffraction (XRD), chemical analyses (atomic absorption), and Thermogravimetric analyses (TGA). Modified and non-modified materials have been calcined in order to obtain respective mixed oxides, which were tested in oxidative dehydrogenation of propane (ODHP) at a space velocity of 50 mL/min g with a temperature range between 250-500 °C. The catalytic studies showed a positive effect by incorporating vanadium for NiCoCr system, while for the NiCoFe modified system a decrease in catalytic activity was shown.
Key words: Hydrotalcite, propylene, vanadium, heterogeneous catalysis.
RESUMO
Dois novos materiais tipo hidrotalcita baseados em NiCoCr e NiCoFe obtiveram-se pelo método hidrotérmico. Esses materiais foram modificados com espécies de vanádio por troca iônica. Os materiais caracterizaram-se usando difração de raios X (DRX), análise elementar (absorçãoatômica) e análisetermogravimétrica (ATG). Os sólidos com e sem troca foram tratados termicamente para obter os respectivos óxidos mistos, que posteriormente se avaliaram na reação de desidrogenaçãooxidativa de propano (DHOP) a uma velocidade espacial de 50 mL/min g e em uma faixa de temperatura entre 250 a 500 °C. Os estudos catalíticos mostraram um efeito positivo ao incorporar o vanádio para o material NiCoCr, enquanto para o sistema NiCoFe modificado foi observada uma diminuiçãona sua atividade catalítica.
Palavras-chave: hidrotalcitas, propileno, vanádio, catáliseheterogênea.
INTRODUCCIÓN
La deshidrogenación de alcanos es una ruta atractiva para convertir parafinas de bajo costo en hidrocarburos insaturados de mayor valor agregado. Más aún, la deshidrogenaciónoxidativa de propano (Dhop) ha recibido mayor atención debido a que se espera un incremento significativo en la demanda de propileno (1-3); además presenta las siguientes ventajas frente a los procesos convencionales: i) El producto preferente de la reacción es el propeno. ii) Bajas temperaturas de reacción, lo que disminuye costos y reduce el impacto ambiental (4, 5). Por consiguiente, se han adelantado investigaciones para el desarrollo de nuevos catalizadores activos en Dhop, entre ellos se encuentran los materiales tipo hidrotalcita, también conocidos como hidróxidos dobles laminares (HDLs) o arcillas aniónicas. Este tipo de materiales presentan una estructura tipo brucita, Mg(OH)2, en el que el catión Mg2+ está rodeado octaédricamente por seis aniones OH- y los diferentes octaedros [Mg(OH)6]-4 comparten aristas, formando láminas infinitas (6). Estas capas están apiladas unas sobre otras y se encuentran unidas por puentes de hidrógeno. Cuando los iones Mg2+ son parcialmente sustituidos por iones trivalentes (con radio iónico similar), se genera un exceso de carga positiva en la lámina, que se compensa por un anión ubicado entre dos láminas tipo brucita (6).
La fórmula general de los materiales tipo hidrotalcita es:
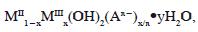
donde MII y MIII son los iones divalentes y trivalentes, respectivamente; An- es el anión de compensación de carga y x es la fracción molar del catión trivalente y también la carga electrostática entre las láminas tipo brucita y el anión interlaminar (7).
La modificación de hidrotalcitas se ha logrado principalmente mediante la incorporación de un anión metálico de interés dentro del espacio interlaminar, lo cual puede presentar ventajas respecto a una hidrotalcita no modificada en una reacción específica. Así, para la reacción de deshidrogenaciónoxidativa de propano (Dhop), se han usado principalmente especies de vanadio y molibdeno como metal de interés (4). Del mismo modo, el níquel metálico y los compuestos con níquel son efectivos en hidrogenación catalítica de enlaces insaturados y, de igual forma, los iones de níquel pueden introducirse dentro de la lámina tipo brucita (8, 9). Dula et al. (10) lograron la incorporación de especies de vanadio en una hidrotalcita de MgAl que se evaluó en la reacción de Dhop en un rango de temperatura de 550 a 800 °C, obteniendo selectividades hacia el propeno entre el 25 y 75 %. Mitchell et al. (11) obtuvieron una serie de hidrotalcitas modificadas con molibdeno y se valoraron en la reacción de deshidrogenación de propano (DHP) en las que se alcanzaron resultados de selectividad del 100 % pero con conversiones por debajo del 5 %.
Continuando con la búsqueda de nuevos materiales que puedan ser promisorios para Dhop, en el presente trabajo se evaluaron cuatro catalizadores derivados de materiales tipo hidrotalcita en los sistemas NiCoFe y NiCoCr y sus correspondientes modificaciones con especies de vanadio, resultando los sistemas NiCoFe-V y NiCoCr-V. Los estudios catalíticos se desarrollaron en un rango de temperaturas entre 250-500 °C, velocidad espacial (Vs) de 50 mL/min g y presión atmosférica.
MATERIALES Y MÉTODOS
Síntesis
Preparación de los materiales
Se prepararon dos precursores trimetálicosNiCoFe y NiCoCr por el método hidrotérmico con relación molar equivalente a 1,5/1,5/1,0, la cual se estableció a partir de la fórmula convencional de las hidrotalcitas, donde MII/MIII es 3 (7). El precursor NiCoFe se sintetizó partiendo de dos soluciones acuosas preparadas por separado, una con sales de Ni, Co y Fe (solución A), y la otra conteniendo Na2CO3 y NaOH (solución B). La solución B se adicionó gota a gota a la solución A, por medio de una bomba dosificadora a una velocidad de 0,50 mL/min, para dar lugar a la formación de un gel con un pH final de 11. El gel resultante se dejó en agitación aproximadamente 30 min.
El precursor NiCoCr se sintetizó a partir de dos soluciones, una solución A, con sales de Ni, Co y Cr y una solución B, con Na2CO3 y NaOH; ambas soluciones se adicionaron simultáneamente, gota a gota a 25 °C, con un control de pH de 10. El gel resultante permaneció en agitación durante tres horas.
Una vez obtenido el gel de cada uno de los precursores, se llevaron a la estufa en reactores de acero inoxidable con recubrimiento interno de teflón, a una temperatura de 130°C por un periodo de 24 h. Los sólidos resultantes se filtraron y lavaron con agua desionizada hasta obtener un pH cercano a 7, y finalmente se secaron a 70 °C.
Modificación con vanadio
El intercambio aniónico de los materiales NiCoFe y NiCoCr con vanadio se basó en métodos descritos en las referencias bibliográficas (12, 13), que se modificaron como se describe a continuación. Se preparó una suspensión en un beaker, agregando 2 g del precursor NiCoFe ó NiCoCr en 50 mL de agua desionizada. La suspensión se agitó durante 3 h aproximadamente, hasta alcanzar un pH estable, alrededor de 6. Por separado, se preparó una solución con 2 g de NH4VO3 en 100 mL de agua desionizada y se ajustó el pH hasta 10 con una solución de NaOH 2 M. Posteriormente, la solución de vanadio se adicionó gota a gota a la suspensión que contenía el precursor, manteniendo el sistema con agitación constante y pH entre 9 y 11, a una temperatura de 55 °C. Luego de agregar toda la solución de NH4VO3, la suspensión resultante se dejó con agitación durante 8 h aproximadamente. El sólido se recuperó por filtración, se lavó con abundante agua desionizada y se secó. Ambos precursores modificados se denominaron NiCoFe-V y NiCoCr-V.
Preparación de los catalizadores
Los catalizadores se obtuvieron mediante la calcinación de los materiales modificados y no modificados. Este proceso se realizó en una mufla Fischer Scientific con una velocidad de calentamiento de 5 °C/min hasta 500 °C durante 3 h; de este proceso se obtuvieron cuatro catalizadores denominados NiCoFec500, NiCoCrc500, NiCoFe-Vc500, NiCoCr-Vc500.
Caracterización
Los precursores y catalizadores se caracterizaron por difracción de rayos X (DRX) en un difractómetroRigaku, usando una fuente de radiación de cobre con longitud de onda λ=1,5418 Å, operado a 40 kV y 30 mA, velocidad igual a 2 °/min y en un rango 2θ de 3 - 70° para los precursores, y 3 - 40° para los catalizadores. El análisis térmico (ATG) se realizó en el equipo TA Instruments Hi-Res ATG 2950 bajo atmósfera de nitrógeno en un rango de temperatura de 30 a 800 °C, con una velocidad de calentamiento de 10 °C/min. Para el análisis químico, las muestras que contenían Ni, Co, Fe y Cr se disolvieron en una mezcla de ácidos minerales (HNO3 y HCl) empleando un espectrómetro Thermo Scientific ICE Series 3000 para hacer las medidas de absorbancia. Las interferencias asociadas a cada uno de los metales se corrigieron con la ayuda de una llama de óxido nitroso-acetileno. La ionización se evitó con sal de potasio para las muestras y los estándares. Los análisis mediante esta técnica se realizaron por duplicado, y el error relativo asociado a esta es del orden del 1 al 2 %.
Evaluación catalítica
La reacción se llevó a cabo en un reactor de cuarzo alimentado con propano al 99,50 % y aire seco, con una relación molar propano/oxígeno de 2. Con base en estudios previos, se definieron las siguientes condiciones de reacción: temperaturas entre 200 y 500 °C, velocidad espacial de 50 mL/min.g y 0,42 g de catalizador. Los ensayos catalíticos se efectuaron por duplicado.
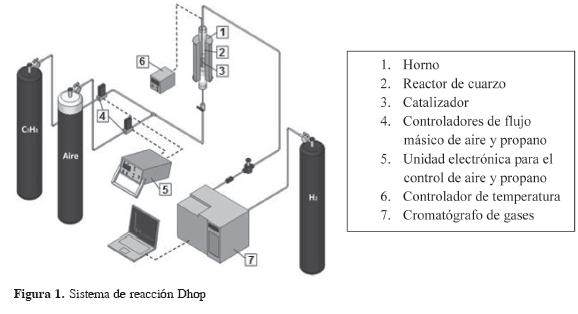
El análisis de los productos de reacción se desarrolló en un cromatógrafoShimadzu GC-9A, con un detector de conductividad térmica, conectado en línea al sistema de reacción (ver Figura 1), utilizando columnas Molecular Sieve 5A (MS), con una longitud de 2,50 m, con un diámetro externo de 0,6 cm, y Porapack Q (PQ) columna de acero inoxidable 316, con una longitud de 2,45 m, un diámetro externo de 0,6 cm y con un tamaño de partícula correspondiente a la malla 80/100.
RESULTADOS Y DISCUSIÓN
Difracción de rayos X (DRX)
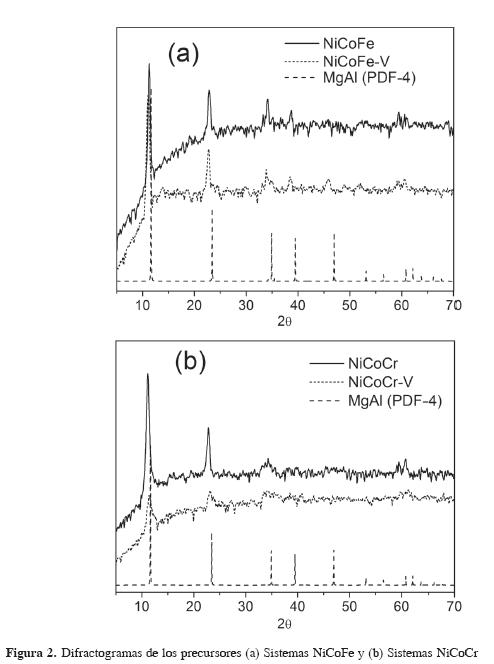
Los difractogramas de los precursores NiCoFe, NiCoCr, NiCoFe-V y NiCoCr-V se muestran en la Figura 2. Se observa que los sólidos son isoestructurales a la fase tipo hidrotalcita de fórmula
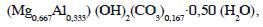
obtenida a partir de la base de datos PDF-4 (01-089-0460), reportada por Bellotto et al. (14). No hay presencia de otras fases o impurezas cristalinas. Se percibe un desplazamiento en la posición de los picos hacia ángulos menores de los difractogramas de los precursores con respecto al patrón obtenido en la base de datos, lo que se puede atribuir a la variación en su composición y a la naturaleza trimetálica de los materiales sintetizados en este trabajo.
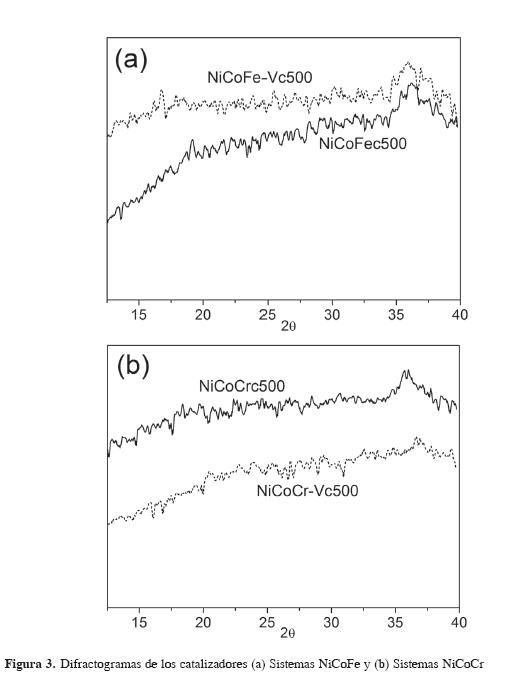
En la Figura 3 se presentan los difractogramas de los catalizadores probados en la reacción. Como se puede ver, estos materiales no exhiben señales definidas entre 35 y 38 ° en 2Θ, rango en el cual se encuentran señales características de óxidos mixtos de Cr y Fe según la base de datos PDF-4, sin embargo, dada la amorficidad de los difractogramas, no es posible realizar una determinación precisa de los óxidos formados.
Análisis químicos y térmicos
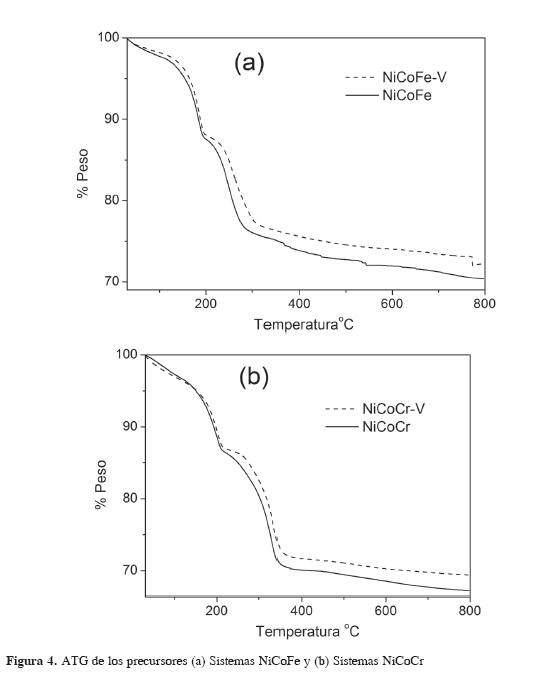
Las curvas correspondientes a los análisis térmicos ATG para los materiales NiCoFe, NiCoCr, NiCoFe-V y NiCoCr-V se reportan en la Figura 4.
En los análisis térmicos se observan tres eventos bien definidos para los materiales: El primer evento, entre 100 y 200 °C, corresponde a la pérdida de agua fisisorbida y agua interlaminar; el segundo evento, entre 200 y 340 °C, se le atribuye a la deshidroxilación de las láminas tipo brucita; y por último, el tercer evento, aproximadamente por encima de los 340 °C, corresponde a la descarboxilación del material (7). Adicionalmente, se puede observar que los materiales modificados con vanadio alcanzan la estabilidad térmica más rápidamente que los no modificados, esto se debe, quizás, a que los primeros presentan menor cantidad de carbonatos en el espacio interlaminar -alrededor de un 3,5 a 4,5 %- con lo cual se puede inferir que las especie de vanadio sustituyeron los carbonatos presentes en el espacio interlaminar en aproximadamente un 1,0 %.
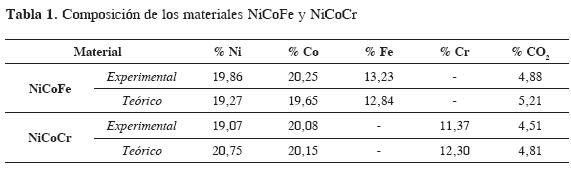
El análisis elemental por absorción atómica permitió cuantificar el contenido de Ni, Co, Cr y Fe en los sistemas de NiCoFe y NiCoCr; los resultados obtenidos se muestran en la Tabla 1 Este análisis, en complemento con los análisis térmicos donde se cuantificó el contenido de volátiles (CO2 y H2O), permitió determinar las fórmulas químicas de los nuevos materiales, partiendo de la fórmula general de las hidrotalcitas
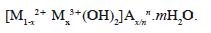
Para cada uno de los materiales sin modificar, la fórmula propuesta es:
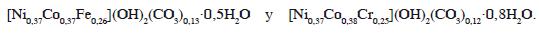
En la Tabla 1 se comparan los resultados obtenidos experimentalmente y los teóricos calculados a partir de la fórmula química propuesta.
Los eventos térmicos asociados al ATG, descritos anteriormente, corresponden a una reacción de descomposición del material. De acuerdo con esto, y tomando como ejemplo el material NiCoFe, se presenta la reacción global durante el tratamiento térmico:
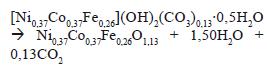
Por medio de los análisis de absorción atómica también se logró determinar el contenido de vanadio en los materiales modificados NiCoFe-V y NiCoCr-V, que se encontró alrededor de 1,70 % para ambos materiales. Este resultado está de acuerdo con los análisis térmicos obtenidos, en el que se encontró una disminución en el contenido de carbonato en ambos materiales con respecto a los sólidos sin modificar, cercano al porcentaje de vanadio encontrado.
Asimismo, por medio de los análisis térmicos, se fijó la temperatura de calcinación de 500 °C para los materiales modificados y sin modificar, para obtener los catalizadores que posteriormente se evaluaron en la reacción de deshidrogenaciónoxidativa de propano.
Evaluación catalítica
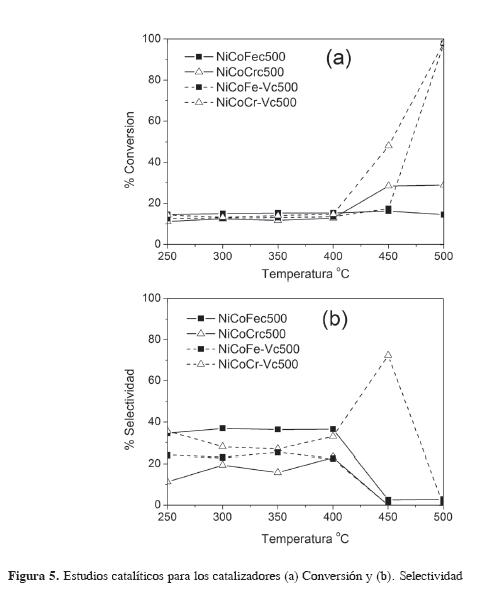
En la Figura 5 se relacionan los resultados de conversión para los cuatro materiales, donde se presenta una tendencia similar entre ellos, con una conversión cercana al 15 %, entre 250 - 400 °C. Sin embargo, para los catalizadores con contenido de vanadio, se evidencia un aumento significativo en la conversión a partir de 400 °C, esto se atribuye a que este metal es altamente activo en la reacción, y se puede observar el gran incremento en la conversión al incorporar pequeñas cantidades de vanadio en el catalizador (15, 16).
Los resultados de selectividad -que se muestran en la Figura 5- destacan el catalizador NiCoCr-Vc500, el cual alcanza una selectividad mayor del 70 % a 450 °C, superando el resultado obtenido con el catalizador sin modificar. Mientras que para los sistemas basados en Ni, Co y Fe, el mejor resultado de selectividad se logró para el sistema sin modificar, presentando un aumento de aproximadamente 10 % con respecto al material modificado. Sin embargo ambos catalizadores fueron poco selectivos a temperaturas por encima de 450 °C.
De igual forma, se visualiza que el catalizador modificado de NiCoCr presenta resultados de selectividad más altos que su homólogo de NiCoFe, en todo el rango de temperaturas, especialmente a 450 °C; esto puede indicar que el vanadio tuvo una influencia positiva en el catalizador con cromo que no se evidenció en el material con hierro. Sin embargo, es necesario realizar más estudios catalíticos y del material para establecer el comportamiento del vanadio, especialmente en el catalizador con hierro.
CONCLUSIONES
A través del método hidrotérmico se logró obtener dos materiales laminares tipo hidrotalcita con composiciones novedosas, siendo posible la incorporación de metales, cuya combinación resultó ser interesante en la reacción de Dhop.
Los análisis térmicos, en combinación con el análisis elemental, fueron determinantes para proponer y ajustar la fórmula química; de igual forma fue posible confirmar la incorporación exitosa de los metales en los sistemas sin modificar. En cuanto a los materiales modificados, se pudo evidenciar, por medio del análisis elemental y análisis térmicos, la presencia de vanadio en los materiales modificados, posiblemente incorporado en la zona interlaminar, ya que el análisis termogravimétrico mostró disminución de carbonatos, lo cual sugiere sustitución de estas especies por vanadio.
A través del intercambio aniónico con especies de vanadio se obtuvieron dos catalizadores, NiCoFe-Vc500 y NiCoCr-Vc500, este último presentó la mayor actividad que los demás materiales sintetizados en este trabajo, con selectividad hacia propeno superior al 70 % y conversión de propano igual a 48 %, lo que resulta promisorio para reacciones de deshidrogenación de alcanos usando sistemas basados en cromo y vanadio.
AGRADECIMIENTOS
Los autores agradecen el apoyo de la Universidad de Antioquia en la financiación del proyectos CODI Mediana cuantía y Sostenibilidad 2011-2012, al programa Jóvenes investigadores de la Universidad de Antioquia y a Colciencias por la financiación a la estudiante de doctorado Sandra Amaya.
REFERENCIAS BIBLIOGRÁFICAS
1. Tullo, A.H. Propylene on demand. Chemical and Engineering News. 2003. 81:15-16. [ Links ]
2. Bhasin, M. M.; McCain, J. H.; Vora, B.V.; Imai, T.; Pujadó, P. R. Dehydrogenation and oxydehydrogenation of paraffins to olefins. Applied Catalysis A: General. 2011. 221:397-419. [ Links ]
3. Tallman, M. J.; Eng. C. Consider new catalytic routes for olefins production. Hydrocarbon Processing. 2008. 87:95-101. [ Links ]
4. Cavani, F.; Ballarini, N.; Cericola, A. Oxidative dehydrogenation of ethane and propane: how far from commercial implementation. Catalysis Today. 2007. 127:113-131. [ Links ]
5. Ren, T.; Patel, M.; Blok, K. Olefins from conventional and heavy feedstocks: Energy use in stream cracking and alternative processes. Energy. 2006. 31:425-451. [ Links ]
6. Kovanda, F.; Kolousek, D.; Cílová, Z.; Hulínský,V. Crystallization of synthetic hydrotalcite under hidrotermal conditions. Applied Clay Science. 2005. 28:101-109. [ Links ]
7. Cavani, F.; Trifirò, F.; Vaccari, A. Hydrotalcite-type anionic clays: preparation, properties and applications. Catalysis Today. 1993. 11:173-301. [ Links ]
8. Auerbach, S. M.; Carrado, K.A; Dutta, P.K.. Handbook of layered materials. New York. Marcel Dekker. 2004. pp. 373-474. [ Links ]
9. Jian-Hui Li, Cai-Cai Wang, Chuan-Jing Huang, Yi-Fei Sun, Wei-Zheng Weng, Hui-Lin Wan. Mesoporous nickel oxides as effective catalysts for oxidative dehydrogenation of propane to propene. Applied Catalysis A: General. 2010. 382:99-105. [ Links ]
10. Dula, R.; Wciso, K.; Stoch, J.; Grzybowska, B.; Serwicka, E. M.; Kooli, F.; Bahranowski, K.; Gawe, A.. Layered double hydroxide-derived vanadium catalysts for oxidative dehydrogenation of propane: Influence of interlayer-doping versus layer-doping. Applied Catalysis A: General. 2002. 230:281-291. [ Links ]
11. Mitchell, P. C. H.; Wass, S. A. Propane dehydrogenation over molibdenum catalysts. Applied catalysis A:General. 2005. 225:153-165. [ Links ]
12. Bahranowski, K.; Bueno, G.; Cortés Corberán, V.; Kooli, F.; Serwicka, E. M.; Valenzuela, R.X; Wcislo, K. Oxidative dehydrogenation of propane over calcined vanadate-exchanged Mg,Al-layered double hydroxides. Applied Catalysis A: General. 99. 185:65-73. [ Links ]
13. Han, K.S.; Guerlou-Demourgues, L.; Delmas, C. A new metavanadate inserted layered double hydroxide prepared by chemie douce'. Solid State Ionics. 1996. 84:227-238. [ Links ]
14. Bellotto, M., Rebours, B., Clause, O., Lynch, J., Bazin, D., Elkaim, E. A reexamination of hydrotalcite crystal chemistry. Journal of Physical Chemistry. 1996. 100:8527. [ Links ]
15. Bulanek, R.; Kaluzova, A.; Setnicka, M.; Zukal, A.; Cicmanec, P.; Mayerova, J. Study of vanadium based mesoporous silicas for oxidative dehydrogenation of propane and n-butane. Catalysis Today. In press. 2011. [ Links ]
16. Crapanzano, S.; Babich, I. V.; Lefferts, L. The effect of V in La2Ni1-xVxO4+1.5x+β on selective oxidative dehydrogenation of propane: Stabilization of lattice oxygen. Applied Catalysis A: General. 2010. 385:14-21. [ Links ]