Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.40 no.3 Bogotá Sept./Dec. 2011
OXIDACIÓN DE LA SUPERFICIE DE CARBÓN ACTIVADO MEDIANTE HNO3 Y H2O2: EFECTO SOBRE LA REMOCIÓN DE NÍQUEL (II) EN SOLUCIÓN ACUOSA
ACTIVATED CARBON SURFACE OXIDATION BY HNO3 AND H2O2: EFFECT ON THE REMOVAL OF NICKEL (II) FROM AQUEOUS SOLUTION
OXIDAÇÃO DA SUPERFÍCIE DE CARVÃO ATIVADO POR MEIO DE HNO3 E H2O2: EFEITO NA REMOÇÃO DE NÍQUEL (II) EM SOLUÇÃO AQUOSA
Paola Rodríguez Estupiñan1, Liliana Giraldo1,2, Juan Carlos Moreno3
1 Universidad Nacional de Colombia, sede Bogotá, Facultad de Ciencias, Departamento de Química, Grupo de Calorimetría. Av Cra 30 45-03- Bogotá D.C., Código Postal 111321, Colombia.
2 Universidad Nacional de Colombia, sede Bogotá, Facultad de Ciencias, Departamento de Química, Grupo de Calorimetría. Av Cra 30 45-03- Bogotá D.C., Código Postal 111321, Colombia. lgiraldogu@unal.edu.co
3 Departamento de Química, Facultad de Ciencias, Universidad de los Andes. Bogotá, D.C., Colombia.
Recibido: 21/08/11-Aceptado 30/12/11
RESUMEN
Este trabajo analiza el efecto de la modificación de la química superficial de un carbón activado granular, CAG, por oxidación con ácido nítrico, CAG-N, y peróxido de hidrogeno, CAG-P en la adsorción de iones níquel desde solución acuosa.
Las muestras obtenidas se caracterizaron a través de diferentes técnicas; la química superficial se evaluó por determinaciones de acidez y basicidad total, punto de carga cero y espectroscopia IR, que muestran el efecto del agente oxidante. Los parámetros texturales, como área superficial BET y volúmenes de poro, se evaluaron mediante adsorción de gases. Los valores de área superficial BET de los sólidos se encuentran entre 816 y 876 m2g-1, adicionalmente se determinaron entalpías de inmersión de los carbones activados en agua y benceno.
Finalmente, los resultados experimentales de la adsorción desde solución se ajustaron a los modelos de Langmuir, Freundlich, Redlich-Peterson y Toth, y se encontró el mejor ajuste para este último. Los valores de la capacidad de adsorción determinadas por el modelo de Langmuir están entre 29,68 y 50,97 mg g-1, lo que indica que la capacidad de adsorción depende, en gran medida, de la química superficial del sólido.
Palabras clave: carbón activado granular, química superficial, grupos funcionales, entalpía de inmersión, adsorción de iones níquel (II)
ABSTRACT
In this work is studied the effect in the surface chemistry modification of a granular activated carbon, CAG, by oxidation with nitric acid, CAG-N, and hydrogen peroxide, CAG-P, in the nickel ions adsorption from aqueous solution.
The samples were characterized by different techniques, surface chemistry was evaluated by acidity and basicity total determinations, point of zero charge and IR spectroscopy that show the effect of oxidant agent. The textural parameters such as BET surface area and pore volumes were evaluated by gas adsorption. The BET surface area values of the solids are between 816 and 876 m2g-1; additionally were determined immersion enthalpies in water and benzene.
Finally, the experimental results of the adsorption from solution were adjusted to the Langmuir's, Freundlich's, Redlich-Peterson's and Toth's models, and were found the best adjustment for the latter. The capacity adsorption determined by Langmuir's model is between 29.68 50.97 mg g-1, which indicates that the adsorption capacity depends to a great extent on the solid surface chemistry.
Key words: Granular activated carbon, surface chemistry, functional groups, enthalpy of immersion, ion nickel (II).
RESUMO
Neste trabalho se estudou o efeito na da modificação da química superficial de um carvão ativado granular, CAG, por oxidação com ácido nítrico, CAG-N, e peróxido de hidrogênio, CAG-P na adsorção de íons níquel desde solução aquosa.
As mostras obtidas foram caracterizadas por diferentes técnicas; a química superficial foi avaliada por determinações de acidez e basicidade total, ponto de ônuszero e espectroscopia IR, que mostram o efeito do agente oxidante. Os parâmetrostexturais, como área superficial BET e volumes de poro se avaliaram mediante adsorção de gases. Os valores de área superficial BET dos sólidos se encontram entre 816 e 876 m2g-1, adicionalmente se determinaram entalpias de imersão dos carvõesativados em água e benzeno.
Finalmente, os resultados experimentais da adsorção desde soluçãoforam ajustados aos modelos de Langmuir, Freundlich, Redlich-Peterson e Toth, e se encontrou o melhor ajuste para esse último. Os valores da capacidade de adsorção determinados pelo modelo de Langmuir estão entre 29,68 e 50,97 mg g-1, o que indica que a capacidade de adsorção depende em grande parte da química superficial do sólido.
Palavras-chave: carvão ativado granular, química superficial, grupos funcionais, entalpia de imersão, íons níquel (II).
INTRODUCCIÓN
El níquel se clasifica como un residuo tóxico para humanos, plantas y animales; suele acumularse en los tejidos de los organismos y causa daños sistémicos ocasionando la aparición de gran cantidad de enfermedades. Para minimizar los efectos de los metales tóxicos considerados contaminantes prioritarios (1), en solución se han implementado técnicas de tratamiento de aguas residuales entre las que se encuentran la precipitación, el intercambio iónico, extracción con solventes y electrodeposición. Estas técnicas no son siempre eficientes, por tanto, la adsorción sobre sólidos porosos es una técnica alternativa a las antes mencionadas (2, 3).
El carbón activado es un adsorbente versátil debido a la posibilidad que se tiene para diseñar sus propiedades texturales y que, además, en una fase posterior, se pueden modificar sus propiedades químicas mediante tratamientos de impregnación u oxidación en fase gas o líquida; esto con el objetivo de aumentar la capacidad de adsorción, para considerar la importancia de las interacciones específicas de las sustancias en solución y los grupos funcionales sobre la superficie (3, 4). Tanto la textura como la química superficial del carbón activado son propiedades que influyen en la adsorción, en fase líquida, cuando el adsorbato es una especie cargada, como en el caso particular de los iones Ni(II); esto lleva al uso de técnicas de caracterización para estudiar la textura de los sólidos porosos como la fisisorción de nitrógeno y dióxido de carbono a 77 K y 273 K, respectivamente, que permite determinar el área superficial y volumen de poro (5) y otras que admiten caracterizar la química superficial como las técnicas volumétricas del método propuesto por Boehm (6), determinación de punto de carga cero (7) y la espectroscopia infrarroja.
La química superficial también se pone de manifiesto cuando se determinan las entalpías de inmersión de los carbones activados en solventes de tipo apolar y polar que suministran información sobre la hidrofobicidad del carbón activado y su capacidad de interacción con la solución en la que se encuentran los iones (8).
En este trabajo se modificó la química superficial de un carbón activado granular por oxidación con dos agentes oxidantes en fase líquida, y se observó la variación en la capacidad de adsorción de iones níquel desde solución acuosa por medio de la determinación de isotermas de adsorción cuyos valores experimentales se ajustaron a varios modelos.
MATERIALES Y MÉTODOS
Oxidación del carbón activado
El carbón activado granular, CAG, se obtiene a partir de la cáscara de coco mediante activación física; el material se tamizó a un tamaño de 0,5 mm, parte del material base se modificó usando dos agentes oxidantes: ácido nítrico y peróxido de hidrógeno en solución.
Para el tratamiento con HNO3 se usaron 30 g del material base CAG que se mezclaron con 600 mL de una solución 5 M del ácido durante 8 horas, a la temperatura de ebullición de la solución; posteriormente se filtró la mezcla y el carbón activado se lavó con agua destilada hasta que el pH de las aguas de lavado fue de aproximadamente 6,8; finalmente el carbón activado se secó en una estufa a una temperatura de 100 °C por 24 h y se almacenó en frascos plásticos en atmosfera de nitrógeno. Posteriormente, en el tratamiento con de peróxido de hidrógeno se empleó una solución 10 M a temperatura ambiente durante 18 h y se sometió al mismo proceso de secado y almacenamiento especificado anteriormente. Las muestras se denominan CAG-N y CAG-P para el tratamiento con ácido nítrico y peróxido de hidrógeno, respectivamente.
Caracterización textural
Los parámetros texturales de área superficial y volumen de poros de las muestras de carbón activado se evaluaron por adsorción física de N2 a 77 K y CO2 a 273 K en un equipo automático Autosorb 3B, Quantachrome; el área superficial aparente y el volumen de microporo se determinaron mediante los modelos de BET y de Dubinin - Radushkevich, respectivamente.
Caracterización química
Acidez y basicidad total
Los parámetros de acidez y basicidad total se evaluaron por el método de Boehm (6); para esto se pesaron 1,000 g de cada muestra y se adicionaron a 50 mL de una solución 0,1 M de NaOH para determinar la acidez, o 50 mL de una solución de HCl 0,1 M para determinar la basicidad, considerando que en cada mezcla se neutralizan los grupos ácidos y básicos presentes en la superficie de los carbones activados. Las mezclas se mantuvieron a una temperatura de 298 K y agitación constante durante 5 días. Posteriormente, se toma una alícuota de 10 mL de cada solución sobrenadante y se titula con una solución de NaOH o HCl previamente estandarizada, según corresponda.
Punto de carga cero
La determinación del pH en el punto de carga cero, pHPCC, se valoró mediante el método de titulación de masas (8), para lo cual se pesa diferentes cantidades de carbón activado entre 0,010 y 0,600g, y se colocan en frascos de vidrio de 50 mL, a esta se adicionan 10 mL de solución 0,1 M de NaCl. Las mezclas se mantuvieron a 298 K y agitación constante durante 2 días, posteriormente se midió el pH de cada solución con un pHmetro CG 840B Schott.
Espectroscopia IR
Los espectros IR se tomaron en un equipo Nicolet Impact 410 FT-IR con una celda de reflectancia difusa. La muestra se pulverizó y se conformó una pastilla con KBr.
Determinación de entalpías de inmersión
Las entalpías de inmersión de los carbones activados en agua y benceno se determinaron en un microcalorímetro de conducción de calor de construcción local, que usa como sensores térmicos termopilas de materiales semiconductores y como depósito de calor un bloque de aluminio en el que se inserta una celda en acero inoxidable de 15 mL de capacidad en la que se ponen 10 mL del solvente (9, 10). Se pesa 0,100 g del carbón activado en un ampolleta de vidrio que se pone en la celda calorimétrica y se empieza a capturar el potencial eléctrico por aproximadamente 40 minutos hasta obtener la línea base estable; se realiza la inmersión de la muestra, se registra el aumento de potencial producto del mojado del sólido, y finalmente se espera hasta que se regrese de nuevo a la línea base y se realiza la calibración eléctrica (8, 11).
Determinación de la capacidad de adsorción de niquel (II) en solución acuosa
Las soluciones del ion Ni(II) se prepararon a partir de NiCl2. 6H2O reactivo, grado analítico, marca Merk® y agua doblemente destilada. El rango de concentraciones para el estudio de adsorción del ión fue 100 a 500 mgL-1. La lectura de la curva de calibración y de las soluciones de las isotermas se realizó en un espectrofotómetro de absorción atómica Perkin Elmer, Analyst 300. Para la curva de calibración se prepararon 100 mL de soluciones de Ni(II), de concentraciones entre 0,5 y 20 mgL-1.
Isotermas de adsorción en solución
Se colocaron 50 mL de cada una de las soluciones de Ní(II) en frascos de vidrio de 100 mL. Luego se agregaron 0,500 g de carbón activado a la solución. A las mezclas se les ajustó el pH a 6 y se mantuvieron a temperatura constante de 298 K durante 100 h hasta que se alcanzó el equilibrio, agitando esporádicamente. Al finalizar el tiempo, la mezcla se filtra para remover el carbón activado y se determinó la concentración de Ní(II) remanente por absorción atómica.
RESULTADOS Y DISCUSIÓN
Caracterización textural
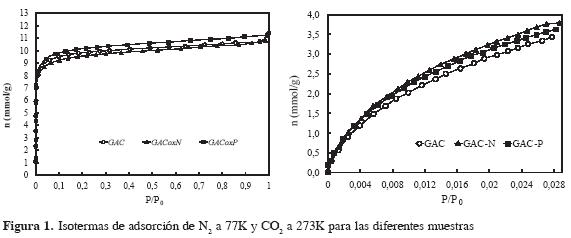
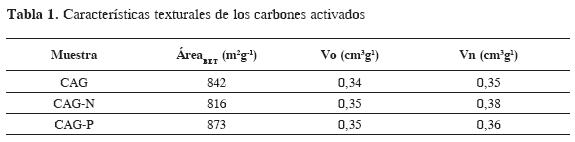
Las isotermas de adsorción de gases obtenidas para los carbones activados se muestran en la Figura 1. Las isotermas de adsorción de N2 se clasifican en el tipo I, según la clasificación de la IUPAC, con la presencia de un codo a bajas presiones relativas, característico de sólidos microporosos. A partir del análisis de las isotermas de adsorción N2 y CO2 se determinaron el área superficial BET, volumen de microporosidad (Vo) y volumen de microporosidad estrecha (Vn), mediante la aplicación de los modelos BET y Dubinin-Raduskevich a los datos experimentales, como se muestra en la Tabla 1.
Se observa que el proceso de oxidación con acido nítrico ocasionó una disminución en el área superficial, esto se explica considerando que la oxidación con ácido nítrico promueve la formación de grupos oxigenados superficiales en los bordes de las aperturas de los poros; estos grupos son principalmente carboxílicos y carbonilos (12). En cuanto a la oxidación con peróxido de hidrogeno, se observó un aumento del área superficial, considerando que, sumado al proceso de formación de grupos superficiales oxigenados, también se produce la apertura de ciertas estructuras porosas (13).
El volumen de microporosidad total (Vo) se obtiene, por un lado, mediante la aplicación del modelo Dubinin-Radushkevich, DR a los datos experimentales de adsorción de N2; por otro lado, la microporosidad estrecha (Vn) se evalúa mediante la determinación de isotermas de adsorción de CO2 a 273 K; así, en ausencia de restricciones cinéticas y difusionales, los valores Vn y Vo son similares, evidenciando estructuras porosas de dimensiones uniformes, mientras que la diferencia entre estos dos valores denota un rango de microporosidad (14, 15). Para el caso de los carbones activados de este trabajo, se observan diferencias entre los volúmenes de microporos de N2 y CO2 que se hallan entre 2,8 y 7,9 %, que indican mayor penetración del CO2 en el sólido carbonoso.
Los resultados muestran un aumento de la microporosidad con el proceso de oxidación, siendo mayor para el carbón activado CAG-N; el cambio de la estructura porosa se debe a la formación y reestructuración de grupos oxigenados superficiales (15).
Caracterización de la química superficial
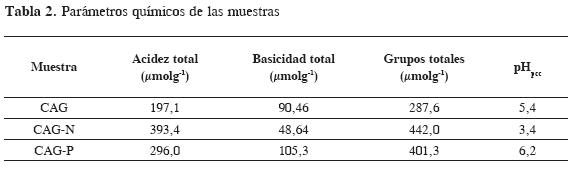
Considerando el papel de la química superficial en la adsorción de metales disueltos en solución acuosa, se evalúan los cambios químicos que se producen en la superficie del sólido. En la Tabla 2 se presentan los resultados obtenidos para las determinaciones de acidez y basicidad total y punto de carga cero.
De acuerdo con los tratamientos a los que fue sometido el carbón activado de partida, se evidencian cambios en los parámetros de acidez y basicidad total, que están relacionados con la cantidad y tipo de grupos funcionales presentes en la superficie del sólido. Por un lado, se favorece principalmente la formación de grupos ácidos con el tratamiento con acido nítrico y una disminución de los grupos básicos, y por la oxidación con el peróxido de hidrógeno, también aumenta la cantidad de grupos ácidos y se presenta un leve aumento en la cantidad de grupos básicos, tal como se reporta en otros trabajos (16). Por otro lado, los valores de punto de carga cero son consistentes con los cambios en la química superficial general de cada muestra, de acuerdo con el tratamiento aplicado.
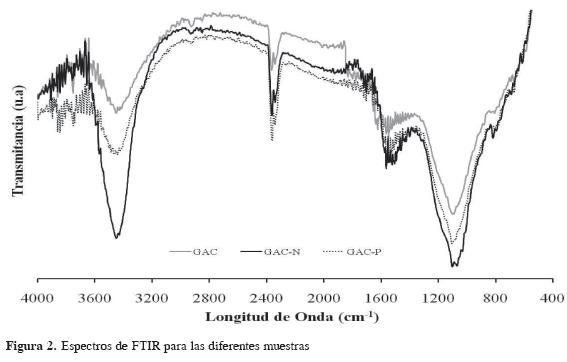
Los espectros IR de los carbones activados se presentan en la Figura 2, y son consistentes con los valores de acidez y basicidad total; se observa, después del proceso de oxidación, un aumento de las intensidades de los picos que son característicos de grupos funcionales oxigenados. En los espectros se notan cuatro bandas de interés: una ubicada entre a 3200 a 3600 cm-1, asociada a vibraciones de estiramiento O-H en alcoholes y ácidos carboxílicos; otra a 2908, vinculado a grupos de ácidos carboxílicos y carbonilos, una tercera, a 1527 cm-1, relacionada a grupos quinonas y a 1709 cm-1, asociada vibraciones de estiramientos C-OH de grupos alcoholes. En el caso de la muestra CAG-N, el pico sobre 3400 cm-1 aumenta su intensidad con respecto a la muestra original, evidenciando, por un lado, un aumento en la cantidad de grupos como los ácidos carboxílicos, por otro, en el espectro de la muestra CAG-P, la banda ubicada sobre 1709 cm-1 aumenta la intensidad, lo que sugiere una mayor concentración de grupos fenólicos (17).
Calorimetría de Inmersión
La entalpía de inmersión de un sólido en un líquido está relacionada con la estructura porosa y con la química superficial del sólido. Para evaluar la estructura porosa del sólido, las moléculas del líquido de mojado no deben presentan interacciones específicas con este, así la entalpía de inmersión será proporcional al área superficial accesible a la molécula del líquido. La superficie química del material se evalúa cuando el líquido de inmersión presenta interacciones específicas, de este modo, la entalpía de inmersión del carbón activado en agua será un indicativo del carácter hidrofóbico o hidrofílico de la superficie del sólido (18).
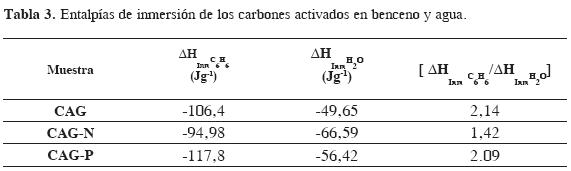
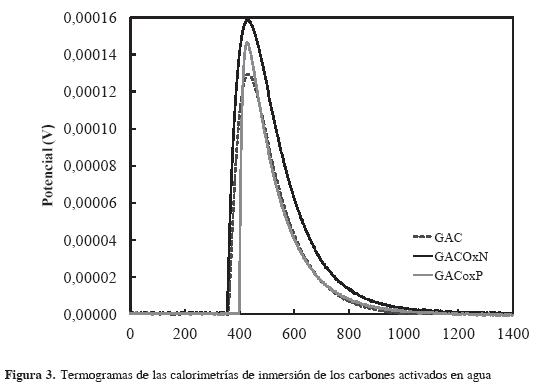
Los resultados obtenidos para las entalpías de inmersión de los carbones activados en agua y benceno -todas de carácter exotérmico- se presentan en la Tabla 3. Se muestran en la Figura 3 los termogramas obtenidos de la inmersión de los tres carbones activados en agua.
Los resultados obtenidos para las entalpías de inmersión de los carbones activados en los dos solventes muestran que el carbón activado CAG-N presenta el menor valor para la inmersión en benceno de -94,98 Jg-1 y el mayor, para la inmersión en agua de -66,59 Jg-1, lo que indica que este sólido es el que tiene el menor carácter hidrofóbico que influye en la adsorción de los iones Ni(II) .
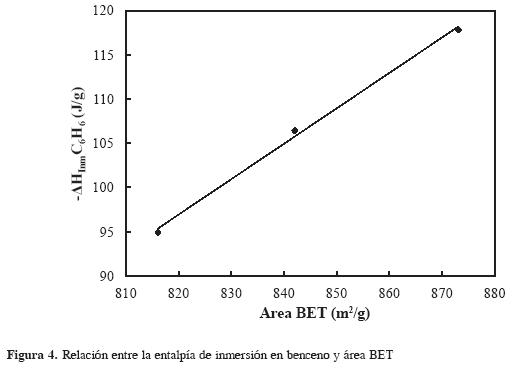
Las diferencias en las entalpías de inmersión de los carbones activados en los dos solventes es indicativo del cambio en los parámetros texturales como en la química superficial, en el caso de la calorimetría en benceno -como se observa en la Figura 4- existe una relación lineal con respecto al aumento en el área BET de las muestras.
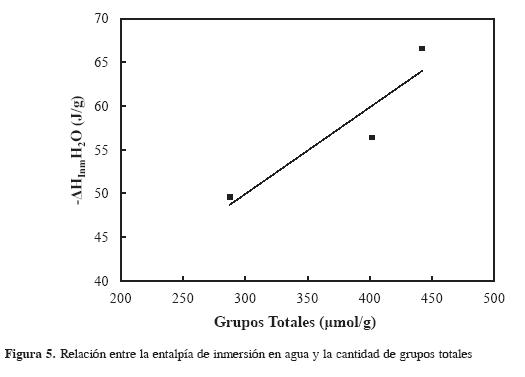
La diferencia de las entalpías de inmersión en agua de las muestras es un indicativo del cambio en la química superficial (19), producto de los tratamientos a los que se sometió el carbón activado original, es decir, al desarrollo de los grupos superficiales presentes en la superficie del sólido, así, una mayor cantidad de grupos superficiales oxigenados, como en el caso de CAG-N, produce una mayor entalpía de inmersión, resultado de las interacciones establecidas entre la molécula polar del agua y los grupos superficiales oxigenados desarrollados en la muestra.
En la Figura 5 se presenta la relación entre la entalpía de inmersión de los carbones activados en agua y el contenido total de grupos químicos superficiales, que es directamente proporcional y muestra que el carbón activado original, con un total de grupos químicos de 287,6 µmolg-1 , es el que presenta el menor valor de entalpía de inmersión en agua.
Determinación de la capacidad de adsorción de níquel en solución acuosa
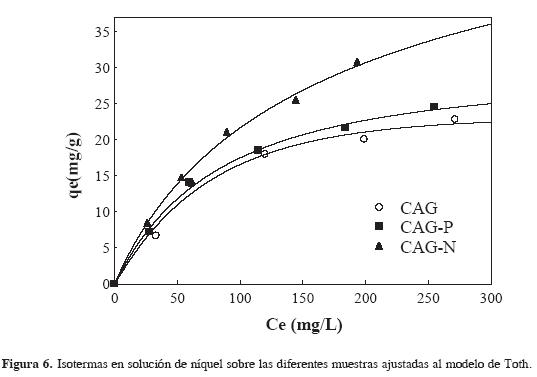
Los experimentos de adsorción del ión níquel se realizaron a pH 6, ya que, de acuerdo con el diagrama de especies a este pH, la especie en solución será el catión hexaacuoniquel (II), que es la especie química presente en el proceso de cuantificación, proporcional a la cantidad de Ni(II); según lo anterior, no se formarán especies hidróxidos pues se precipitarían. La remoción de los iones se atribuye principalmente a la interacción con los grupos funcionales; en la Figura 6 se muestran las isotermas obtenidas para la adsorción de los iones Ni (II) desde solución acuosa y su ajuste al modelo de Toth.
La importancia de los grupos oxigenados en la superficie del carbón activado en la adsorción de iones Ni(II) desde solución acuosa se ha estudiado por varios autores (20,21); en general se considera que el proceso de adsorción de iones disueltos en soluciones acuosas se debe principalmente a las interacciones específicas establecidas entre los grupos funcionales y los iones mediante diferentes mecanismos, como son:
Formación de complejos metálicos como COOH-M
Reacciones donor-aceptor de electrones (3).
Dichas interacciones especificas se ven favorecidas cuando el sólido ha sido sometido a un proceso de oxidación, como el que se describe en este trabajo; debido a esto, se observa una mayor capacidad de adsorción en la muestra que presenta una mayor cantidad de grupos funcionales desarrollados por el proceso de oxidación con acido nítrico (CAG-N), lo que indica que se lleva a cabo a través del mecanismo de formación de complejos metálicos como COOH-M.
Los datos experimentales obtenidos de las isotermas de adsorción para las soluciones acuosas de Ni(II) sobre las muestras de carbón activado se analizaron por medio de los modelos de Langmuir, Freundlich, Redlich-Peterson y Toth, cuyas expresiones matemáticas son respectivamente las siguientes:
Modelo de Langmuir
Donde Qe (mgg-1) es la cantidad de soluto adsorbido en condiciones de equilibrio; Ce (mgg-1), la concentración en equilibrio; Qo (mgg-1), la capacidad de adsorción en la monocapa, y KL(Lg-1), una constante de adsorción en el equilibrio.
Modelo de Freundlich
KF (Lg-1) es una constante de la adsorción en equilibrio y n es una constante característica asociada al grado de favorabilidad de la adsorción.
Modelo de Redlich-Peterson
KRP (Lg-1) y aRP (Lmg-1) son constantes de la isoterma y b es un exponente que se encuentra entre 0 y 1. El modelo de Redlich-Peterson incorpora las características de los modelos de Langmuir y Freundlich así: Langmuir, cuando b=1; la Ley de Henry, cuando b=0, y Freundlich, cuando (KRP y aRP<<1, b = 1); por tanto, un mecanismo que no contempla una adsorción ideal en monocapa (22).
Modelo de Toth
KT (mgg-1) y aT (Lmg-1) son constantes de la adsorción de la isoterma de Toth y t es el exponente de la isoterma de Toth. Este modelo se basa en la teoría de potencial y es aplicable a la adsorción heterogénea que supone una distribución de energía cuasi-gaussiano (18).
En la Tabla 4 se encuentran resumidos los parámetros resultantes de la linealización de los datos de adsorción aplicando los modelos de Langmuir, Freundlich, Redlich-Peterson y Toth. Los parámetros de ajuste de los modelos se calculan por el método de mínimos cuadrados, empleando el algoritmo de optimización de Rosenbrock y quasi-Newton.
Para establecer el diseño de un sistema de adsorción, es conveniente obtener la correlación más apropiada para los datos de equilibrio. Con este fin se usan varios modelos para describir la naturaleza del equilibrio de adsorción. A los modelos convencionales de Langmuir y Freundlich se han sumado otros que intentan superar sus limitaciones; entre estos se presentan los modelos propuestos por Redlich y Peterson y Toth, que cuentan con tres parámetros, y se usan a menudo para representar los datos de sistemas con superficies heterogeneas (23).
Para el caso específico del sistema estudiado, se encontró que los modelos de dos y tres parámetros que mejor ajustaron a los datos experimentales fueron el modelo de Langmuir y Toth, respectivamente; sin embargo, el modelo de Toth presentó los mejores coeficientes de correlación. Acerca de este modelo es importante recordar que aT y KT son analogos a KL y Q0 de los parámetros de Langmuir y t es un exponente que representa el grado de heterogeneidad si t≠1 (24); para las muestras trabajadas, este parametro t fue mayor a uno en las muestras CAG Y CAG-P y menor a uno en la muestra CAG-N; los parámetros KT y aT siguieron la secuencia CAG>GAC-P>CAG-N; adicionalmente, este modelo se deriva de la teoría de potencial que asume, además, una distribución energética cuasi-gaussiana, es decir que la mayoría de los sitios presentan una menor energía con respecto a la energía máxima de adsorción; esto es coherente, teniendo en cuenta que, en la mayoría de los casos, las superficies del sólido poroso son de tipo heterogéneo debido a la naturaleza química de la superficie expuesta a las moléculas de adsorbato (23, 25).
CONCLUSIONES
Se presenta la modificación de una muestra de carbón activado con agentes oxidantes, soluciones de HNO3 y H2O2 y su caracterización textural, química y energética; los sólidos se emplean en la adsorción de iones Ni (II) en solución acuosa; los resultados obtenidos permiten concluir lo siguiente:
La adsorción de iones metálicos en solución es dependiente, en gran medida, de la química superficial de los carbones activados; así, las muestras modificadas presentaron un aumento en la capacidad de adsorción, debido a que en el proceso de oxidación con agentes oxidantes, como el acido nítrico y el peróxido de hidrógeno, incorporan grupos oxigenados en la superpie de los carbones. Las determinación de acidez total, con valores entre 197,1 y 393,4 µmolg-1 y la basicidad total, con valores entre 48,64 y 105,3 µmolg-1 y los espectros IR muestran que este tipo de tratamientos favorece la formación de grupos como ácidos carboxílicos y fenólicos. De igual manera, las entalpías de inmersión de los carbones activados en agua muestran un incremento debido al desarrollo de los grupos funcionales superficiales.
Los modelos de Langmuir, Freundlich, Redlich-Peterson y Toth se usaron para ajustar los datos experimentales de las isotermas de adsorción de los iones Ni(II); se encontró el mejor ajuste para el modelo de Toth que presenta tres parámetros.
La mayor adsorción de Ni(II) se obtiene para el carbón activado oxidado con solución de ácido nítrico con un valor de alrededor de 50 mgg-1 para la adsorción en la monocapa, que señala la mayor acidez total con predominio de grupos carboxílicos e indica la influencia de la química superficial de los carbones activados en la adsorción de Ni(II).
AGRADECIMIENTOS
Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia y al Acta de Acuerdo entre los departamentos de Química de las dos universidades; igualmente, a la Dirección de Investigación, DIB, sede Bogotá, de la Universidad Nacional de Colombia, proyecto 11940 y al Programa de Jóvenes Investigadores de Colciencias, proyecto 13762.
REFERENCIAS BIBLIOGRÁFICAS
1. Seong-Rin, L.; Schoenung, J. M. Human health and ecological toxicity potentials due to heavy metal content in waste electronic devices with flat panel displays. Journal of Hazardous Materials. 2010. 177: 251-259. [ Links ]
2. Faur-Brasquet, C.; Kadirvelu,K.; Le Cloirec, P. Removal of metal ions from aqueous solution by adsorption onto activated carbon cloths: adsorption competition with organic matter. Carbon. 2002. 40: 2387-2392. [ Links ]
3. Spahis, N.; Addoun, A.; Mahmoudi, H.; N. Ghaffour. Purification of water by activated carbon prepared from olive stones. Desalination. 2008. 222: 519-527. [ Links ]
4. Moreno-Castilla, C.; Álvarez-Merino, M.A.; Pastrana-Martínez, L.M.; López-Ramón, M.V. Adsorption mechanisms of metal cations from water on an oxidized carbon surface. Journal of Colloid and Interface Science. 2010. 345: 461-466. [ Links ]
5. Burg, P.; Cagniant, D. Characterization of Carbon Surface Chemistry. En: Chemistry and Physics of Carbon. Pensilvania. CRC Press Taylor & Francis Group. 2008: 129-169. [ Links ]
6. Boehm, H.P. Some aspects of the surface chemistry of carbon blacks and other carbons. Carbon. 1994. 32: 759-769. [ Links ]
7. Babic, B.M.; Milonjic, S.K.; Polovina, M.J.; Kaludierovic, B.V. Point of zero charge and intrinsic equilibrium constants of activated carbon cloth. Carbon, 1999. 37: 477-481. [ Links ]
8. Stoeckli, F.; Moreno-Castilla, C.; Carrasco-Marín, F.; López-Ramón, M. V. Distribution of surface oxygen complexes on activated carbons from immersion calorimetry, titration and temperature programmed desorption techniques. Carbon. 2001. 39: 2235-2237. [ Links ]
9. Giraldo, L.; Moreno, J.C.; Huertas, J. Heat conduction Micro-calorimeter with metallic reaction cells. Instrumentation Science & Technology. 2002. 30: 177-186. [ Links ]
10. Rodríguez, G.; Giraldo, L.; Moreno, J.C. Evaluación de la señal generada en un calorímetro de conducción de calor en la determinación de entalpías de inmersión para caracterización de sólidos porosos. Afinidad. Revista de QuímicaTeúrica y Aplicada. 2009. 66: 1-9. [ Links ]
11. Giraldo L.; Moreno-Piraján., J.C. Immersion enthalpy variation of surface-modified mineral activated carbon in lead (II) aqueous solution adsorption: the relation between immersion enthalpy and adsorption capacity. Ecletica Química. 2006. 31: 15-21. [ Links ]
12. Daud, W.; Houshamnd, A.H. Textural characteristics, surface chemistry and oxidation of activated carbon. Journal of Natural Gas Chemistry . 2010. 19: 267-279. [ Links ]
13. Yin, C.Y.; Aroua, M.K.; Daud, W. Review of modifications of activated carbon for enhancing contaminant uptakes from aqueous solutions. Separation and Purification Technology. 2007. 52: 403-415. [ Links ]
14. Marsh,H.; Rodríguez-Reinoso F. Chapter 4. Characterization of Activated Carbon En: Activated Carbon: Elsevier, 2006. pp. 143-242. [ Links ]
15. Silvestre-Albero A.; Silvestre-Albero J.; Sepúlveda-Escribano A.; Rodríguez-Reinoso, F. Ethanol removal using activated carbon: Effect of porous structure and surface chemistry. Microporous and Mesoporous Materials. 2009. 120: 62-68. [ Links ]
16. Petit, C.M.; Peterson, G.W.; Mahle, J.; Bandosz, T.J. The effect of oxidation on the surface chemistry of sulfur-containing carbons and their arsine adsorption capacity. Carbon. 2010. 48: 1779-1787. [ Links ]
17. Figueiredo, J.L.; Pereira, M.F.R.; Freitas, M.M.A.; Órfão, J.J.M. Modification of the surface chemistry of activated carbons. Carbon. 1999. 37: 1379-1389. [ Links ]
18. Rodríguez-Reinoso, F.; Molina-Sabio, M.; González, M.T. Effect of Oxygen Surface Groups on the Immersion Enthalpy of Activated Carbons in Liquids of Different Polarity. Langmuir. 1997. 13: 2354-2358. [ Links ]
19. López-Ramón, M.V.; Stoeckli, F.; Moreno-Castilla, C.; Carrasco-Marín, F. Specific and non-specific interactions of water molecules with carbon surfaces from immersion calorimetry. Carbon. 2000. 38: 825-829. [ Links ]
20. Puziy, A.M.; Poddubnaya, O.I.; Martínez-Alonso, A.; Suárez-García, F.; Tascón, J.M.D. Synthetic carbons activated with phosphoric acid: I. Surface chemistry and ion binding properties Carbon .2002. 40: 1493-1505. [ Links ]
21. Gao, Z.; Bandosz, T.J.; Zhao, Z.; Hand, M.; Qiua, J. Investigation of factors affecting adsorption of transition metals on oxidized carbon nanotubes. Journal of Hazardous Materials. 2009. 167: 357-365. [ Links ]
22. Gimbert, F.; Morin-Crini N.; Renault, F.; Badot P-M.; Crini, G. Adsorption isotherm models for dye removal by cationized starch-based material in a single component system: Error analysis. Journal Hazardous Materials. 2008. 157: 34-46. [ Links ]
23. Febrianto, J.; Kosasih A.N.; Sunarso, J.; Ju, Y-H.; Indraswati, N.; Ismadji, S. Equilibrium and kinetic studies in adsorption of heavy metals using biosorbent: A summary of recent studies. Journal of Hazardous Materials. 2009.162: 616-645. [ Links ]
24. Malusis, M.A.; Maneval, J.E.; Barben, E.J.; Shackelford C.D.; Daniels E.R. Influence of adsorption on phenol transport through soil-bentonite vertical barriers amended with activated carbon. Journal of Contaminant Hydrology. 2010. 116: 58-72. [ Links ]
25. Foo, K.Y.; Hameed, B.H.. Insights into the modeling of adsorption isotherm systems. Chemical Engineering Journal. 2010. 156: 2-10 [ Links ]