Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.41 no.1 Bogotá Jan./Apr. 2012
EVALUACIÓN DE LA ACTIVIDAD CITOTÓXICA Y ANTIMICROBIANA DEL COMPUESTO [Ag(phen)2]salH)
EVALUATION OF THE CITOTOXICITY AND ANTIMICROBIAL ACTIVITY OF THE [Ag(phen)2]salH COMPOUND
AVALIAÇÂO DA ACTIVIDADE CITOTÓXICA E ANTIMICROBIANA DO COMPOSTO [Ag(phen)2]salH
Daniel F. Moyano1, Liz E. Murcia1, Diana A. Parra2, Ana E. Burgos1,3, Fabio A. Aristizabal 2
1 Universidad Nacional de Colombia - Sede Bogotá, Facultad de Ciencias, Departamento de Química, Grupo de Investigación en Química de Coordinación y Bioinorgánica, Laboratorio de Química de Coordinación, Av. Cra 30 45-03, Bogotá D.C., Colombia.
2 Universidad Nacional de Colombia - Sede Bogotá, Facultad de Ciencias, Departamento de Farmacia, Av. Cra 30 45-03, Bogotá D.C., Colombia.
Recibido: 21/11/11- Aceptado: 9/03/12
RESUMEN
En este artículo se evaluó la actividad antimicrobiana y citotóxica de un nuevo complejo de plata(I) con el ión salicilato y 1,10-fenantrolina. La caracterización de este compuesto se realizó por espectroscopia de resonancia magnética nuclear de protón y carbono-13 (RMN 1H y 13C), espectroscopia de absorción en la región de infrarrojo (IR), análisis térmico (TG/DSC) y análisis elemental (CHN). Los resultados obtenidos a través de estos métodos sugieren la formación del compuesto con fórmula empírica [Ag(phen)2] salH. Cuando fue comparada la actividad antimicrobiana y citotóxica de este complejo con otros compuestos de plata(I) y cobre(II) de actividad conocida, se observó que el ligante 1,10-fenantrolina incrementa estas propiedades. El compuesto en estudio, presenta la mayor inhibición del crecimiento bacteriano, los microorganismos Gram positivos fueron los más susceptibles. La actividad citotóxica fue evaluada en un panel de cinco líneas celulares tumorales humanas: MDA-MB231, PC-3, HT-29, HEp-2 y A549. A las concentraciones evaluadas, el compuesto produjo una respuesta citotóxica dosis-dependiente en todas las líneas celulares tumorales, particularmente para las líneas tumorales HT-29, MDA-MB231 y A549. Todo esto, sugiere su gran potencial para usos quimioterapéuticos.
Palabras clave: complejos de plata(I), 1,10-fenantrolina, actividad antimicrobiana, actividad citotóxica.
ABSTRACT
This article evaluated the antimicrobial and cytotoxic activity of a new complex of silver(I) with the salicylate ion and 1,10-phenanthroline. The characterization of this compounds was performed by nuclear magnetic resonance spectroscopy of proton and carbon-13 (RMN 1H y 13C), spectroscopy absorption in the infrared (IR), thermal analysis (TG/DCS) and elemental analysis (CHN). The results ob-tained through these methods suggest the formation of the compound with empiri-cal formula Ag(phen)2]salH 4. When was compared the antimicrobial activity and cytotoxicity of the complex with other compounds of silver(I) and copper(II) of known activity, we observed that 1, 10-phenalthroline ligand increases these properties. The compound under study has the highest inhibition of bacterial growth, Gram-positive microorganisms were the most susceptible. The cytotoxic activity was tested against a panel of fve human cancer cell lines: MDA-MB231, PC-3, HT-29, HEp-2 and A549. At the concentrations tested, the compound pro-duced a dose-dependent cytotoxic res-ponse against all tumor cell lines, parti-cularly against the HT-29, MDA-MB231 and A549 cell lines. All this suggests its potential chemotherapeutic use.
Key words: complexes of silver(I), 1,10-phenanthroline, antimicrobial ac-tivity, cytotoxic activity.
RESUMO
Neste artigo avaliou-se a atividade antimicrobiana e citotóxica de um novo complexo de prata(I) com o íon sali-cilato e 1,10-fenantrolina. A caracterização deste composto foi realizada por espectroscopia de ressonância magnética nuclear de próton e carbono-13 (RMN 1H e 13C), espectroscopia de absorção na região de infravermelho (IV), análise térmico (TG/DSC), análi-se elementar (CHN). Os resultados ob-tidos através destes métodos sugerem a formação do composto com fórmula empírica [Ag(phen)2]salH. Quando foi comparada a atividade antimicrobiana e citotóxica deste complexo com outros compostos de prata(I) e cobre(II) de ati-vidade conhecida, observou-se que o ligante 1,10-fenantrolina aumenta essas propriedades. O composto em estudo apresenta maior inibição do crescimento bacteriano, os microorganismos Gram-positivos foram os mais suscetíveis. A atividade citotóxica foi avaliada em um painel de cinco linhas de células tu-morais humanas: MDA-MB231, PC-3, HT-29, HEp-2 e A549. Com as concen-trações avaliadas, o composto deu uma resposta citotóxica dose–dependência em todas as linhagens de células tumo-rais, particularmente para as linhas de células tumorais HT-29, MDA-MB231 e A549. Tudo isso, sugere, um grande potencial para aplicações em quimioterapia.
Palavras-chave: complexos de prata(I), 1,10-fenantrolina, atividad antimicrobiana, atividade citotóxica
INTRODUCCION
El estudio de compuestos de plata con actividad antimicrobiana, antimicótica, antiviral, anticancerígena y el uso de la plata como biocida en solución, suspensión, y en especial en forma de nano partículas ha tenido en la últimos años un gran auge debido a las propiedades que presenta la plata, en la actualidad se utiliza un gran número de compuestos que contienen plata (1). La plata al entrar en contacto con hongos y bacterias, afecta negativamente el metabolismo celular de los sistemas de transferencia de electrones, y el transporte del sustrato de la célula microbiana. Se ha estudiado ampliamente el mecanismo seguido por los compuestos de platino (2), en el cual se propone que debido a la estructura química, favorece la interacción de estos complejos con la doble hélice de ADN inhibiendo su replicación (3). Asimismo se reporta otro mecanismo de tipo catalítico para compuestos de cobre, en el cual algunos complejos pueden neutralizar radicales altamente reactivos que son conocidos como promotores de cáncer (4).
No obstante, a pesar de su importante potencial quimioterapéutico, los principales inconvenientes de los complejos de plata, son por un lado, su baja solubilidad en medio acuoso y por otro, el efecto de cargas eléctricas sobre los ligantes; lo anterior modifica la interacción de la molécula con el medio e impide la eficiencia de su transporte hasta el interior de la célula, por lo cual se investigan sistemas que faciliten la integración al complejo celular (5).
En este artículo se presenta la síntesis y caracterización de un nuevo complejo de plata, [Ag(phen)2]salH, con el objeto de obtener un compuesto con mayor biodisponibilidad, y para explorar el potencial farmacológico asociado a los ligantes salicilato y 1,10-fenantro-lina, ambos con actividades biológicas comprobadas, tanto analgésica como antifúngica, respectivamente (6, 7). También, se reporta el estudio de la actividad citotóxica, recuperación celular y actividad antimicrobiana del complejo de plata; las pruebas antimicrobianas y de recuperación celular se realizaron con el objetivo de establecer un posible mecanismo antitumoral del compuesto. Las pruebas catalíticas han mostrado, el mecanismo mediador de la disminución en la viabilidad celular, que está relacionado con especies reactivas de oxígeno (ROS) (reactive oxygen species) como el H2O2 (4), ya que muchas células tumorales aumentan la tasa de metabolismo en comparación con las células normales, que llevaría al aumento del número de ROS y la inducción a la muerte celular por apoptosis (8). Por otro lado, la actividad antimicrobiana mostrará, si estos complejos poseen un mecanismo de acción antibacteriano interno debido a la presencia de iones libres de plata, que interactúan con el ADN (9). En cuanto al ensayo de recuperación celular mostrará una aproximación del mecanismo citotóxico o citostático del compuesto.
MATERIALES Y MÉTODOS
General
La síntesis de [Cu(salH)2(H2O)2] 1, [Ag2(salH)2] 2 y [Cu(sal)(phen)] 3, se realizó de acuerdo con lo reportado en literatura (10, 11), paralelamente la síntesis de 1 y 2 se realizó a partir de la mezcla estequiométrica 2:1 de salicilato de sodio y el hidróxido del metal correspondiente en medio acuoso, se encontraron rendimientos semejantes a los reportados en la literatura y su pureza fue comprobada mediante el análisis de cromatografía de capa fna. Los análisis espectrales de RMN-1H y RMN-13C fueron realizados en un espectrofotómetro Bruker DPx-400 Avance (los desplazamientos químicos fueron medidos con respecto a tetrametilsilano), los espectros de absorción en la región de infrarrojo (FT-IR) se tomaron en un equipo Perkin–Elmer Pa-ragon 500 con una resolución de 4 cm-1 a 16 scans, y los análisis termogravimétricos (TG y DTA) se registraron en un equipo Shimadzu DTG-60, en el que se usaron cerca de 1,5 a 2,0 mg de muestra por análisis, en crisol de alúmina y bajo atmósfera de aire, 40mL-min, 5k-min. El análisis elemental se realizó en un equipo CHN-660, carbon-hydrogen-nitrogen determinator, Leco Corporation ST. Jo-seph, MI USA.
Síntesis y caracterización de [Ag(phen)2]salH
La síntesis del complejo [Ag(phen)2] salH, se llevó a cabo mezclando 2,00 mmol de [Ag2(salH)2(H2O)2] y 2,50 mmol de 1,10-fenantrolina en 25 mL de etanol, se mantuvo el sistema en refujo durante 12 horas. Se obtuvo un sólido de color amarillo claro, que posteriormente fue fltrado y lavado con etanol. Rendimiento del 79%, punto de fusión: 230 ± 2°C, soluble en agua y DMSO.
Ensayos de actividad antimicrobiana
Las pruebas de actividad antimicrobiana se realizaron aplicando el método de difiusión de disco de Kirby-Bauer (12), poniendo como blancos, cuatro discos humedecidos en solución acuosa de Ampicilina® 500µM, agua, ácido salicílico 500µM y 1,10-fenantrolina 500µM, respectivamente. Por otra parte, se organizaron cuatro discos humedecidos con solución acuosa de cada uno de los compuestos sintetizados, bajo las mismas condiciones. La prueba se realizó sobre un microorganismo Gram positivo (Mi-crococcus luteus) y un Gram negativo (Escherichia coli) en agar de crecimiento selectivo propio de cada especie.
Ensayos de actividad citotóxica
Cultivos celulares
Se emplearon cinco líneas de difierente origen tumoral humano, de crecimiento adherente en monocapa: carcinoma de mama (MDA-MB231), carcinoma de próstata (PC-3), adenocarcinoma colo-rectal (HT-29), carcinoma de laringe (HEp-2) y adenocarcinoma de pulmón (A549), todas obtenidas de la Ameri-can Type Culture Collection (ATCC). Las cinco líneas se mantuvieron en medio mínimo esencial (MEM) (Sigma), suplementado con 5% de Suero Fetal Bovino (FBS) (Gibco), penicilina 100 UI/mL y estreptomicina a 100 µg/mL (Gibco) en frascos de cultivo celular de 25 cm2 de área, a 37 °C, en atmósfera con 5% de CO2 y 100% de humedad relativa.
Valoraciones de actividad citotóxica
Las células en crecimiento exponencial, con un 90% de confuencia, se trataron con una solución de tripsina 0,025%, EDTA 0,03% durante 5 minutos a 37°C, como resultado se obtuvo una suspensión celular que se contó en una cámara de Neubauer, empleando el método de exclusión del colorante azul de trypan. Las células fueron inoculadas en placas de 96 pozos con fondo plano en las densidades celulares previamente establecidas (13, 14): MDA-MB231 y PC-3: 1,0x104; HT-29: 2x104; HEp-2 y A549: 7,5x103 células por pozo. Las placas se preincubaron por 24 horas para permitir adherencia de las células en los pozos, posteriormente se retiró el medio y se adicionó el tratamiento (MEM + compuesto), incubando por un periodo de 48 horas.
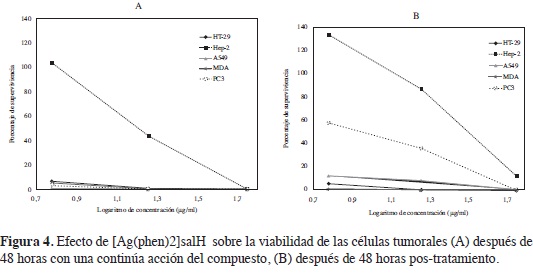
Para evaluar el efecto citotóxico del compuesto, se empleó el método fuo-rométrico indirecto de reducción de Resazurina (15). El tratamiento fue retirado y se reemplazó por 100 µL/pozo de una solución de resazurina (10%) en medio de cultivo y se incubó por 4 horas a 37°C. Posteriormente se leyó por fuorometría la formación de resorufna (producto de la reducción de la resazurina por las células viables), empleando un filtro de excitación de longitud de onda de 530 nm y un filtro de emisión de 590 nm en un lector de placas TECAN GENios. Fueron calculados los porcentajes de supervivencia relativa a las células control de crecimiento y se crearon curvas de porcentaje de supervivencia en función del logaritmo de la concentración.
Valoración de la recuperación celular
La resazurina no tiene efectos tóxicos sobre las células (16), característica que permitió evaluar la recuperación celular de las líneas celulares, 48 horas más tarde, de la exposición al tratamiento, para observar el posible mecanismo del compuesto: citostático o citotóxico. Después de la lectura en el lector de placas, se retiró el medio con la rezazurina y se reemplazó por 100 µL/pozo de MEM suplementado únicamente con penicilina 100 UI/mL y estreptomicina a 100 mg/mL, incubando por un periodo de 48 horas. Posteriormente, se siguió el procedimiento anteriormente descrito, para evaluar el efecto citotóxico, leyendo en el lector de placas TECAN GENios y creando las curvas de porcentaje de supervivencia en función del logaritmo de la concentración.
Tratamientos
Se preparó una solución stock del complejo 4, usando dimetilsulfóxido (DMSO) y a la hora de haberse adicionado a las células, se prepararon diluciones en medio de cultivo (MEM). El tratamiento se evaluó en tres diluciones seriadas, con 56 µg/mL como concentración máxima. La concentración fnal de DMSO no fue mayor a 0,2% v/v, para evitar la interferencia de este solvente en los resultados. En todas las valoraciones se empleo doxorubicina HCl, como control positivo de actividad citotóxica y se evaluó el efecto del DMSO en MEM, como control negativo.
Análisis estadísticos
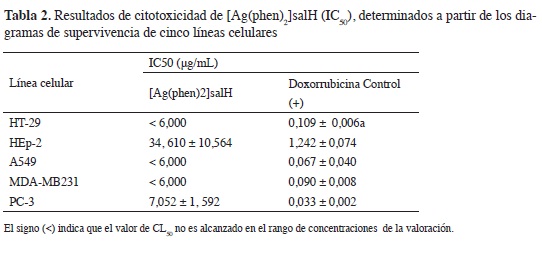
Las difierencias signifcativas fueron determinadas usando un análisis de va-rianza (ANOVA). Los valores de IC50 (concentración de compuesto que causa el 50% de reducción de la viabilidad celular) fueron obtenidos de una regresión no lineal, usando GraphPad 5.0-Prism software. Los controles y tratamientos se evaluaron por triplicado para cada concentración y se realizó una repetición del ensayo. Los valores de IC50 se expresaron en µg/mL ± SD (Desviación estándar de la media).
RESULTADOS Y DISCUSIÓN
Síntesis y caracterización de [Ag(phen)2]salH
La composición química del complejo fue confrmada por análisis elemental (CHN). Estos resultados obtenidos concuerdan con los calculados, y sugieren la obtención de un compuesto de formula mínima [Ag(phen)2]salH.
El complejo [Ag(phen)2]salH, presenta en su espectro de absorción en la región de infrarrojo dos bandas a 448 cm-1 y 269 cm-1 que fueron atribuías a los estiramientos simétricos y asimétricos del grupo N-Ag, respectivamente. Las cuales están ausentes en el complejo [Ag2(salH)2], las bandas en 534 cm-1 y 668 cm-1 (17), propias de los modos vibracionales del grupo C=O-Ag (18), están presentes en éste compuesto y ausentes en [Ag(phen)2]salH. Estos resultados sugieren que el ion salicilato es el contraión y no el ligante de la esfera de coordinación.
El espectro de RMN de 1H (400 MHz, DMSO) para el compuesto [Ag(phen)2] salH presenta los siguientes desplazamientos químicos: δ 5 6,58 (2H, m, señal perteneciente a los hidrógenos H-1 y H-3 del salH), δ 7,11 (1H, td, señal perteneciente a hidrógeno H-2 del salH), δ 7,66 (1H, dd, señal del hidrógeno H-4 salH), δ 7,99 (4H, q, señal perteneciente a los hidrógenos H-2 y H-7 de la phen), δ 8,21 (4H, s, H-4 y H-5 phen), δ 8,76 (4H, d, H-3 y H-6 phen) y 6δ 9,16 (4H, d, señal perteneciente al H-1 y H-8 phen). Al analizar las integrales de las señales de RMN-1H, se sugiere la presencia de dos moléculas de 1,10-fenantrolina por cada ión salicilato.
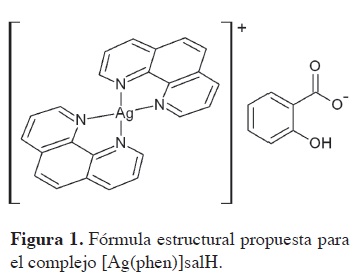
Espectro de RMN de 13C (400 MHz, DMSO) del complejos [Ag(phen)2]salH presenta desplazamientos en δ 115,6 (correspondientes al C-3 y C-5 salH), 6 124,8 (C-2 y C-7 phen), δ 127,1 (C-4 y C-5 phen), δ 128,9 (C-ll y C-12 phen), δ 129,8 (C-6 salH), δ 131,1 (C-4 salH), δ 1383 (C-3 y C-6 phen), δ 141,9 (C-9 y C-10 phen), δ 151,2 (C-l y C-8 phen) y δ 171,1 (COO salH). La correspondencia y asignación de las señales fueron corroboradas con el experimento de HMQC Estos resultados indican que se obtuvo el complejo [Ag(phen)2]salH (Figura 1).
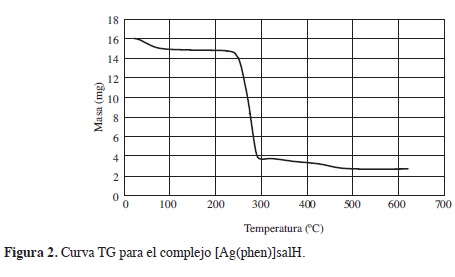
Analizando la curva TG (Figura 2), del [Ag(phen)2]salH, se observa la descomposición térmica del compuesto en varios eventos: el primero ocurre entre 20°C y 60°C con una pérdida de masa aproximada 5,6%, correspondiente a la salida de moléculas de agua por la humedad del compuesto, seguido de una franja de estabilidad entre 60°C y 230°C. Inmediatamente, ocurre un segundo evento, entre 230°C y 300°C, aproximadamente, asociado con el punto de fusión y ter-modescomposición del compuesto, con pérdida de masa aproximada de 85%. Un tercer evento ocurre entre 300°C y 500 °C, con pérdida de masa de 7,3%, asociado a termodescomposición. Seguido de una franja de estabilidad entre 500°C y 620 °C.
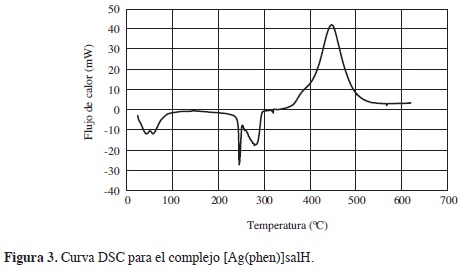
La curva DSC para [Ag(phen)2]salH (Figura 3), presenta cuatro eventos térmicos: el primer evento endotérmico, se relaciona con la salida de las moléculas de agua correspondiente a la humedad del compuesto, entre 40°C y 54°C. El segundo y tercer evento endotérmico entre 245°C y 281°C, están asociados con el punto de fusión seguido de la descomposición del compuesto. El último evento exotérmico, a una temperatura de 445°C, asociado con el proceso de oxidación-reducción de la plata o cambios de fase. Por semejanza con otros compuestos con ligantes similares, tales como el sulfato de bis(diamin)plata(I) (17), que forma complejos de plata(I) cuadrado planares por ser un elemento d10, se propone la estructura del compuesto de plata obtenido como [Ag(phen)2]salH.
Ensayos de actividad antimicrobiana
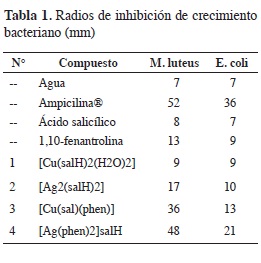
Cuando se comparan los halos de inhibición de los compuestos de plata con los de cobre (Tabla 1), se observa que los compuestos de plata presentan mayores halos de inhibición. Los compuestos 3 y 4 que presentan en su estructura el ligante fenantrolina, muestran un aumento significativo en la inhibición del crecimiento bacteriano con respecto a los compuestos 1 y 2. Se reporta en la literatura que el complejo [Cu(phen)2]+2 presenta actividad antimicrobiana reconocida (2), pero su alta densidad de carga dificulta el fácil transporte por la membrana celular. Con la entidad [Ag(phen)2]+, debido a su menor densidad de carga, se busca obtener mayor biodisponibilidad; el compuesto es soluble en agua lo que puede facilitar aún más el transporte hasta las cercanías de las células y en los medios entre estas.
También, se observa que la inhibición de la actividad microbiana (Tabla 1), fue mayor sobre la bacteria Gram positiva, que posee la pared celular más gruesa y menos selectiva con respecto a la Gram negativa. La bacteria E. coli es más selectiva al ingreso del compuesto dentro de su sistema celular, debido a la complejidad de su pared. Adicionalmente, esta difierencia en la actividad antimicrobiana se explicará mediante un mecanismo de acción antibacteriano interno de la célula. Dicho mecanismo ha sido estudiado en hongos para complejos de plata(I), encontrándose que la actividad biológica se debe a la interrupción de funciones mi-tocondriales (19), mientras que en bacterias se supone que la inhibición obedece a la presencia de iones libres de plata (9). Sin embargo, al existir complejos de plata insolubles en agua que presentan actividad antimicrobiana (20), se refuerza la idea de que la entidad de coordinación está involucrada en el mecanismo, posiblemente sea la que interactué con el ADN. El compuesto 4 debido a su naturaleza química, presenta mayor bio-disponibilidad y por consiguiente mejor actividad biológica, por lo que se sugiere que dicho compuesto tiene un importante potencial quimioterapéutico.
Ensayos de actividad citotóxica
Valoración de actividad citotóxica
El potencial quimioterapéutico del compuesto 4, fue determinado en cinco líneas celulares tumorales humanas: MDA-MB231, PC-3, HT-29, HEp-2 y A549. Todas las líneas celulares mostraron sensibilidad a la doxorubicina HCl, con valores de IC50 entre 0,03 y 1,24 µg/mL, lo que confrma su utilidad como reactivo biológico en estas valoraciones. El DMSO empleado como vehículo para las fracciones no mostró actividad en la concentración empleada 0,2%, lo que indica que no interfere en la actividad observada para las fracciones.
Los resultados indican que, como lo demuestran los valores de IC50 (determinado de los diagramas de supervivencia de las células), el compuesto 4, posee una respuesta citotóxica dosis-dependiente, que en la mayoría de líneas celulares fue de una magnitud similar al control positivo doxorrubicina (Figura 4 A, Tabla 2). Las líneas celulares más sensibles fueron: HT-29, MDA-MB231 y A549, sin embargo se debe resaltar, que todas las líneas tumorales mostraron en seguida de la exposición de 48 h con el compuesto, una reducción considerable de la supervivencia celular, proporcional al aumento de la concentración. El compuesto 4, posee una actividad citotóxica promisoria, porque todos los valores calculados para la IC50, están por debajo de 50 \igl mL, valor máximo de referencia sugerido por otros autores (21) y por el Instituto Nacional de Cáncer de los estados Unidos, para la selección de productos con posible actividad antineoplásica en valoraciones in vitro.
Valoración de la recuperación celular
En atención a elucidar un posible mecanismo antitumoral del compuesto, se evaluó la capacidad de recuperación de las cinco líneas celulares tumorales, a las 48 horas luego de retirar el tratamiento. Los resultados para el compuesto 4, refejaron una disminución de supervivencia celular para todas las concentraciones en todas las líneas celulares (Figura 4 B), observando que a la mayor concentración evaluada, prácticamente para todas las líneas celulares, no hay células viables. Esto permite sugerir, que el posible mecanismo antitumoral del compuesto evaluado, sea citotóxico y no citostático, porque las células no pudieron recuperarse en el tiempo posterior al tratamiento.
Los eventos responsables, de la reducción de viabilidad celular, aún no han sido establecidos por completo, al parecer perturban el funcionamiento de una amplia variedad de sistemas biológicos (22), inhiben la síntesis de ADN en una relación dosis dependiente, que no parece estar mediada a través de intercalación (3), al contrario de lo que ocurre con el control positivo doxorubicina, que bloquea la síntesis del ADN por intercalación. Estos complejos además alteran la función mitocondrial, al inducir el estrés oxidativo, incluyendo la retracción del citoplasma, la fragmentación nuclear (23). Por otro lado, la actividad antimicrobiana, permite sugerir que el posible mecanismo se dé por interacción con el ADN que conllevaría a muerte celular. Además, esto indica que el potencial de citotoxicidad presentado por el complejo 4, aumentó por la biodisponibilidad del núcleo [Ag(phen)2]+, porque la carga del ión puede hacerlo interaccionar con la membrana celular más fácilmente y los anillos aromáticos del complejo interaccionaran más fuerte con el ADN.
CONCLUSIONES
Los resultados obtenidos por las difierentes técnicas analíticas empleadas en este estudio permitieron elucidar la estructura del compuesto sintetizado de plata. Los resultados de la prueba de actividad antibacteriana mostraron que el mecanismo de actividad biológica del compuesto 4 corresponde a una posible interrupción de un proceso interno celular, mas no a la neutralización de radicales reactivos. Los resultados mostraron que bajo las condiciones de ensayo el compuesto resultó activo sobre las líneas celulares tumorales empleadas, destacándose su efecto sobre las líneas HT-29, MDA-MB231 y A549. El potencial quimio-terapéutico de este compuesto radica en la posibilidad de una mayor biodisponibilidad que presenta el ión [Ag(phen)2]+ debido a su solubilidad y densidad de carga. Los resultados encontrados son promisorios y abren perspectivas para la utilización de estos complejos en la segunda fase de estudio en células cancerígenas.
AGRADECIMIENTOS
Los autores agradecen el financiamiento de este proyecto con código N°. 201010016735 a la Dirección de Investigación Sede Bogotá (DIB) de la Universidad Nacional de Colombia.
REFERENCIAS BIBLIOGRÁFICAS
1. Suresh, D.; Balakrishna, M.S.; Rathinasamy, K.; Panda, D.; Mague, J.T. Large-bite(phosphite) ligand containing mesocyclic moieties: synthesis, reactivity, group 11 (Cu1, Au1) metal complexes and anticancer activity studies on a human cervical cancer (HeLa) cell line. Dalton Trans. 2008. 17: 2285-2292. [ Links ]
2. Natile, G.; Coluccia, M. Current status of trans-platinum compounds in cancer therapy. Coord. Chem. Rev. 2001. 216-217: 383-410. [ Links ]
3. Deegan, C.; McCann, M.; Devereux, M.; Coyle, B.; Egan, D. A. In vitro cancer chemotherapeutic activity of 1,10-phenanthroline (phen), [Ag2(phen)3(mal)]·2H2O, [Cu(phen)2(mal)]·2H2O and [Mn(phen)2(mal)]·2H2O (malH2 = malonic acid) using human cancer cells. Cancer Lett. 2007. 247: 224-233. [ Links ]
4. Devereux, M.; O'Shea, D.; O'Connor, M.; Grehan, H.; Connor, G.; McCann, M.; Rosair, M.; Lyng, F.; Kellett, A.; Walsh, M.; Egan, D.; Thati, B. Synthesis, cata-lase, superoxide dismutase and anti-tumour activities of copper(II) carboxylate complexes incorporating benzimidazole, 1,10-phenanthroline and bipyridine ligands: x-ray crys-tal structures of [Cu(BZA)2(bipy) (H2O)], [Cu(SalH)2(BZDH)2] and [Cu(CH3COO)2(5,6-DMBZDH)2] (SalH2 = salicylic acid; BZAH = benzoic acid; BZDH = benzimidazole and 5,6-DMBZDH = 5,6-di- methylbenzimidazole). Polyhedron. 2007. 26: 4073-4084. [ Links ]
5. Melaiye, A.; Sun, Z.; Hindi, K,; Milsted, A.; Ely, D.; Reneker, D. H.; Tessier, C. A.; Youngs, W. J. Silver(I)-Imidazole Cyclophane gem-Diol Complexes Encapsulated by Electrospun Tecophilic Nanof-bers: Formation of Nanosilver Particles and Antimicrobial Activity. J. Am. Chem. Soc. 2005. 127 (7): 2285-2291. [ Links ]
6. Chenoweth, M. B. Chelation as a mechanism of pharmacological action. Pharmacol. Rev. 1956. 8: 57-87. [ Links ]
7. Coyle, B.; Kinsellab, P.; McCanna, M.; Devereux, M.; O'Connorb, R.; Clynesb, M.; Kavanaghd, K. Induction of apoptosis in yeast and mammalian cells by exposure to 1,10-phenantroline metal complexes. Toxicol. In Vitro. 2004. 18: 63-70. [ Links ]
8. Huang, P.; Feng, L.; Oldham, E. A.; Keating, M. J.; Plunkett, W. Super-oxide dismutase as a target for the selective killing of cancer cells. Nature. 2000. 407: 390-395. [ Links ]
9. Bult, A.; Bajema, B. L.; Klasen, H.B.; Metting, H. J.; Fox, Ch. L. Remarks on the structure-activity relationship of some antibacterial silver non-sulfanilamide compounds. Pharm. Weekblad Sci. Edn. 1981. 3: 79-81. [ Links ]
10. Geraghty, M.; Sheridan, V.; Mc-Cann, M.; Devereux, M.; McKee, V. Synthesis and anti-candida activity of copper(II) and manganese(II) carboxylate complexes. x-ray crystal structures of [Cu(sal) (bipy)]·C2H5OH·H2O and [Cu(norb) (phen)2]·6.5H2O (salH2 = salicylic acid; norbH2 = cis-5-norbornene-endo-2,3-dicarboxylic acid; bipy = 2,2'-bypyridine; phen = 1,10-phen-anthroline). Polyhedron. 1999. 18: 2931-2939. [ Links ]
11. Coyle, B.; McCann, M.; Kavanagh, K.; Devereux, M.; McKee, V.; Kay-al, N.; Egan, D.; Deegan, C.; Finn, G. J. Synthesis, x-ray crystal structure, antifungal and anti-cancer activity of [Ag2(NH3)2(salH)2] (salH2 = salicylic acid). J. Inorg. Biochem. 2004.98: 1361-1366. [ Links ]
12. TML/MSH Microbiology Department. Antimicrobial Susceptibility Testing Manual: Appendix I – Disk dififusion. Policy #MI\ANTI\04\01\ v03. Toronto, Canada. 2005. [ Links ]
13. Cordero, C. P.; Aristizábal, F. A. Evaluación preliminar In vitro de actividad citotóxica en extractos vegetales, empleando métodos colorimétricos. Revista Colombiana de Biotecnología. 2002. 4: 100-106. [ Links ]
14. León, C. J.; Gómez, S. M.; Morantes, S. J.; Cordero, C.P.; Aristizabal, F. A. Caracterización del perfl de sensibilidad de un panel de líneas celulares para valoración de citotoxicidad in vitro. Biomédica. 2006. 26: 61-168. [ Links ]
15. O'Brien, J., Wilson, I.; Orton, T.; Pognan, F. Investigation of the Alamar Blue (Resazurin) fuorescent dye for the assessment of mammali-an cell citotoxicity. Eur. J. Biochem. 2005.267: 5421-5426. [ Links ]
16. Fields, R. D.; Lancaster, M. V. Du-al-attribute continuous monitoring of cell proliferation/cytotoxicity. Am. Biotechnol. Lab. 1993. 11: 48-50 [ Links ]
17. Morzyk-Ociepa, B.; Michalska, D. FT-Raman and infrared spectra of silver(I) complexes with glutarimi-date and 3,3-dimethylglutarimidate anions. Spectrochim. Acta, Part A. 1999. 55: 2671-2676. [ Links ]
18. Nakamoto, N. Infrared and Raman Spectra of inorganic and Coordina-tion Compounds. Milwaukee, WI. John Wiley & Sons, 1986. [ Links ]
19. McCann, M.; Coyle, B.; McKay, S.; McCormack, P.; Kavanagh, K.; Devereux, M.; McKee, V.; Kinsella, P.; O'Connor, R.; Clynes, M. Synthesis and x-ray crystal structure of [Ag(phendio)2]ClO4 (phendio = 1,10-phenanthroline-5,6-dione) and its effects on fungal and mam-malian cells. BioMetals. 2004. 17: 635-645. [ Links ]
20. Rowan, R.; Tallon, T.; Sheahan, A.M.; Curran, R.; McCann, M.; Kavanagh, K.; Devereux, M.; McKee, V. Synthesis, characterization and biological screening of some new Ag(I)-containing imidazole complexes. Polyhedron. 2006. 25: 1771-1778. [ Links ]
21. Mans, D. R.; Rocha, A. B.; Schwartsmann, G. Anticancer drug discovery and development in Brazil: targeted plant collection as a rational strategy to acquire candidate anti-cancer compounds. Oncologist. 2000. 5:185-98. [ Links ]
22. Butler, H.M.; Hurse, A.; Thursky, E.; Shulman, A. Bactericidal action of selected phenanthroline chelates and related compounds. Australian Journal of Experimental Biological and Medical Science. 1969. 47: 541–552. [ Links ]
23. Coyle, B.; Kinsella, P.; McCann, M. Devereux, M.; O'Connor, R.; Clynes, M.; Kavanagh, K. Induction of apoptosis in yeast and mammalian cells by exposure to 1, 10-phe-nanthroline metal complexes. Toxicol. In Vitro. 2004. 18: 63–70. [ Links ]