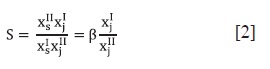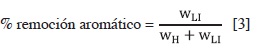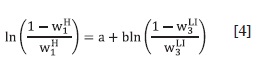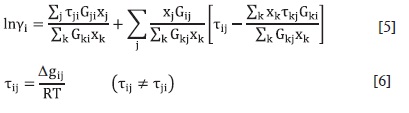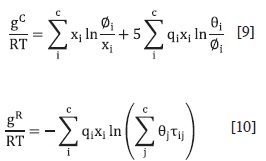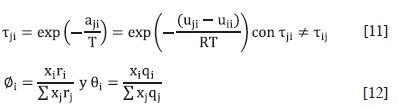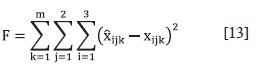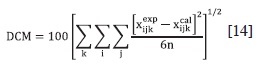Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.41 no.1 Bogotá Jan./Apr. 2012
ESTUDIO DEL EQUILIBRIO LÍQUIDO-LÍQUIDO DE BENCENO + (HEXANO, HEPTANO Y CICLOHEXANO) CON EL LÍQUIDO IÓNICO 1-ETIL-3-METILIMIDAZOLIO ETILSULFATO A 308,15 K
STUDY 0F LIQUID-LIQUID EQUILIBRIIM 0F BENZENE + (HEXAXE, HEPTME A\D CYCLOHEXAXE) WITH THE IOMC LIQUID 1-ETHYL-3-METHYLIMIDAZ0LIIM ETHYLSULFATE AT 308.15 K
ESTUDO DO EQUILÍBRIO LÍQUIDO-LÍQUIDO DE BENZENO + (HEXANO, HEPTANO E CICLO-HEXANO) COM O LÍQUIDO IÔNICO 1-ETIL-3-METILIMIDAZOLIO ETILSULFATO A 308,15 K
Marlon Martínez Reina1, Eliseo Amado González2,3 Yonny Mauricio Muñoz Muñoz4
1 Programa de Maestría en Química. Universidad de Pamplona, Pamplona, Norte de Santander, Colombia.
2 Km 1, vía Bucaramanga, L-206. Ibear. Universidad de Pamplona, Pamplona, Norte de Santander, Colombia.
4 Programa de Doctorado en Ingeniería Química. Universidad del Valle. Cali, Colombia.
Recibido: 01/02/12 – Aceptado 16/04/12
RESUMEN
Se determinó el equilibrio líquido-líquido (ELL) de los sistemas ternarios benceno + (hexano, heptano y ciclohexano) con el líquido iónico 1-etil-3-metilimidazolio etilsulfato (EMIM-EtSO4) a 308,15 K; la selectividad (S) y el coeficiente de distribución (β) se calcularon desde los datos experimentales que se utilizaron para determinar la capacidad del líquido iónico como solvente para la separación del aromático desde sus mezclas con hidrocarburos alifáticos. La región de inmiscibilidad aumentó en el siguiente orden: ciclohexano < hexano < heptano. La consistencia de los datos experimentales del ELL es evaluado usando la ecuación de Othmer-Tobias. La composición de las fases en equilibrio se correlacionó con los modelos para coeficientes de actividad NRTL y Uniquac.
Palabras clave: líquido iónico, equilibrio líquido-líquido, aromático, alifático, NRTL, Uniquac.
ABSTRACT
The equilibrium liquid-liquid (ELL) of ternary systems benzene + (hexane, heptane and cyclohexane) with the ionic liquid 1-ethyl-3-methylimidazolium ethylsulfate (EMIM-EtS04) at 308.15 K, selectivity (S) and the distribution coefficient (β) are calculated from experimental data. The ability of ionic liquid as solvent for separation of the aromatic from their mixtures with ali-phatic hydrocarbons is analyzed. The region of immiscibility increased in the following order: cyclohexane < hexane < heptane. The consistency of the experimental data of ELL is evaluated using the equation of Othmer-Tobias. The composition of the phases in equilibrium is correlated with the models for the activity coeffcient NRTL and UNIQUAC.
Key words: Liquid ionic, liquid – liquid equilibrium, aromatic, aliphatic, NRTL, UNIQUAC.
RESUMO
O equilíbrio líquido-líquido (ELL) de los sistemas ternários benzeno + (hexa-no, heptano e ciclo-hexano) com o líquido iônico 1-etil-3-metilimidazólio etilsulfato (EMIM-EtS04) com 308,15 K, seletividade (S) e o coeficiente de distribuição (β) são calculados a partir dos dados experimentais. Ela determina a capacidade de líquido iônico como solvente para a separação de aromático a partir de suas misturas com hidrocar-bonetos alifáticos. A região de imiscibilidade aumentou na seguinte ordem: ciclo-hexano < hexano < heptano. A consistência dos dados experimentais de ELL é avaliada usando a equação de Othmer-Tobias. A composição das fases de equilíbrio foi correlacionada com os modelos para coeficientes atividade NRTL e Uniquac.
Palavras-chave: líquido iônico, equilíbrio líquido-Líquido (ELL), aromático, alifáticos, NRTL, Uniquac.
INTRODUCCIÓN
En la industria petroquímica, los procesos de destilación para la separación de aromáticos desde compuestos alifáticos no son efcientes debido a que los puntos de ebullición de los hidrocarburos involucrados son muy cercanos. Por tanto, esta separación se hace industrialmente por extracción líquido-líquido. Sin embargo existe un reto constante para disminuir los costos del proceso y reducir al mínimo los daños ambientales causados con los solventes tradicionales. Una alternativa que actualmente es objeto de intensos estudios es el uso de líquidos iónicos como solventes en procesos de extracción líquido-líquido, incluyendo la separación de hidrocarburos aromáticos y alifáticos (1, 2).
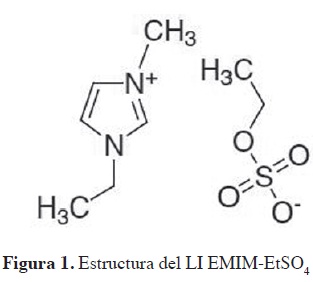
Los líquido iónicos (LI) son una familia de compuestos constituida por iones que tienen un punto de fusión inferior a 373,15 K (3, 4), pues están formados por iones asimétricos y voluminosos, los cuales presentan fuerzas atractivas más débiles que las sales iónicas convencionales, con un alto grado de asimetría que inhibe su cristalización. La estructura de los LI presenta un catión orgánico con un heteroátomo (N, P o S): imidazolio, piridinio, pirrolidinio, tetra alquil amonio, fosfonio y sulfonio asociado a un anión orgánico o inorgánico: alquil sulfato, haluro, nitrato, acetato, tetrafuoro-borato, hexafuorofosfato y otros (5). El interés por los LI como disolventes en diferentes procesos químicos se debe a su excelente estabilidad térmica, elevada polaridad, despreciable presión de vapor y a que permanecen inalterados cuando se mezclan con diferentes compuestos orgánicos (6). Sin embargo, la principal característica es que sus propiedades f-sicoquímicas pueden ajustarse mediante modifcaciones estructurales del catión o el anión. Es decir, los LI pueden convertirse potencialmente en solventes diseñados (7) y se proyectan como potenciales solventes verdes para remplazar los solventes orgánicos volátiles tradicionales en procesos de catálisis, síntesis orgánica, extracción líquido-líquido, electroquímica y química analítica (8-12).
Recientes estudios del equilibrio líquido-líquido (ELL) de sistemas ternarios alcano + aromático + LI han incluido alcanos desde hexano hasta nonano y un-decano en mezclas ternarias con una amplia variedad de LI a 298,15 K (13-22). En mezclas con EMIM-EtSO4 se han evaluado los ELL de ciclo alifático con tolueno, benceno, o-xileno, m-xileno y p-xileno a 298,15 K (23-27). Domínguez et al. (28) reportaron el ELL de (ciclo-hexano, metilciclohexano y ciclooctano) + tolueno + 1-butil-3-metilimidazolio metilsulfato a 298,15 K; Seoane et al. (29) determinaron el ELL de (heptano y ciclohexano) + tolueno + 4-metil-N--butilpyridinio bistrifuorometil sulfonil imida a 298,15 K; fnalmente, Corderi et al. (30) estudiaron el ELL del sistema (heptano y ciclohexano) + benceno + 1-etil-3-metilimidazolio bistrifuorometil sulfonil imida a 298,15 K. Los datos del ELL de sistemas ternarios alcano + aromático + LI se reportan en la mayoría de los casos a 298,15 K; pocos estudios se han realizado a temperaturas diferentes (17, 20, 22).
Los LI basados en el anión alquil-sulfato (R-SO4) han alcanzado en la última década un gran interés; se pueden sintetizar de forma efciente a un costo razonable, están libres de haluros, son estables térmicamente y tienen bajo punto de fusión (22). El grupo de investigación viene realizando el estudio sistemático de las propiedades fsicoquímicas del EMIM-EtSO4 en mezclas binarias (31) y en mezclas ternarias para evaluar la capacidad del LI como solvente para la extracción de aromáticos desde sus mezclas con hidrocarburos alifáticos. En el presente artículo se reportan datos experimentales del ELL de los sistemas hexano, heptano y ciclohexano + benceno + EMIM-EtSO4 a 308,15 K. La elección de los hidrocarburos en los sistemas se basa en la composición de la nafita C4 a C12 (32) y en las aplicaciones industriales del benceno. Desde los datos del ELL se determinó la selectividad y el coeficiente de distribución para comparar los sistemas estudiados y analizar el efecto de la naturaleza del alifático (hexano, heptano y ciclohexano) sobre el ELL a 308,15 K. La consistencia de las líneas de equilibrio en las mezclas ternarias se estudió con la ecuación de Othmer-Tobias, y la composición de las fases en equilibrio fue correlacionada con los modelos de coeficientes de actividad NRTL y Uni-quac. La Figura 1 muestra la estructura del LI EMIM-EtSO .
MATERIALES Y MÉTODOS
Materiales
Reactivos: hexano (99,0 %) de Merck, heptano (99,5 %) de Mallinckrodt Che-micals, ciclohexano (99,5 %) de Carlo Erba, benceno (99,8 %) de Carlo Erba y EMIM-EtSO4 (98,0 %) de Sigma Al-drich. El contenido de agua (ppm) en los reactivos se determinó por el método de Karl Fischer en un titroline KF, hexano 60 ppm, heptano 51 ppm, ciclohexano 11 ppm, benceno 85 ppm y EMIM-EtSO4 52 ppm. La densidad e índice de refracción de los componentes puros se midieron a 298,15 K con la metodología descrita en Martínez y Amado (31), y se comparan con valores de la literatura en la Tabla 1.
Determinación del equilibrio líquido-líquido
El ELL de los sistemas hexano(x1) + benceno(x2) + EMIM-EtSO4(x3), heptano(x1) + benceno(x2) + EMIM-EtSO4(x3) y ciclohexano(x1) + benceno(x2) + EMIM-EtSO4(x3) se determinó utilizando celdas de vidrio enchaquetadas (volumen interno 20 mL). Las mezclas se prepararon por peso en una balanza Ohaus con una precisión de 0,0001g. En el interior de la celda se coloca una barra magnética cubierta con tefón para realizar el proceso de agitación de la mezcla y así permitir un mayor contacto entre las fases. Se utilizó un tiempo de agitación de 6 h para asegurar una buena transferencia de masa entre las fases según la metodología propuesta por Alonso et al. (40). La temperatura se controla utilizando un termostato digital PolyScience con una precisión de ±0,01K que se conecta a la celda a través de una chaqueta de vidrio por la que circula agua. Una vez detenida la agitación, se deja el sistema en reposo durante 12 h para que la mezcla alcance el equilibrio a 308,15 K (40). La fase superior libre de LI se analizó por RMN-1H en un Bruker 400 para confirmar la no presencia de sal.
ANÁLISIS DE LAS MUESTRAS
La composición de sal en cada fase se estableció por análisis gravimétrico. Una cantidad medida de muestra líquida se colocó en un rotavapor hasta obtener el peso constante de la sal. RMN-1H se utilizó para descartar la presencia de los analitos en el LI. Un cromatógrafo de gases Hewlett-Packard (HP), serie 6890, equipado con detector FID se empleó para establecer la composición de hidrocarburos en las muestras libres de sal. Una columna de acero HP-FFAP (25 m x 0,2 mm) se usó para separar los componentes en las muestras. Temperatura inicial 343 K por 3 min, rampa de calentamiento de 10 o min1 y temperatura fnal 423 K constante por 1 min. La rata de fujo del gas de arrastre -helio- de 1 mL min-1. El método del estándar interno de cromatografía de gases se utilizó para analizar el contenido de los tres componentes.
RESULTADOS Y DISCUSIÓN
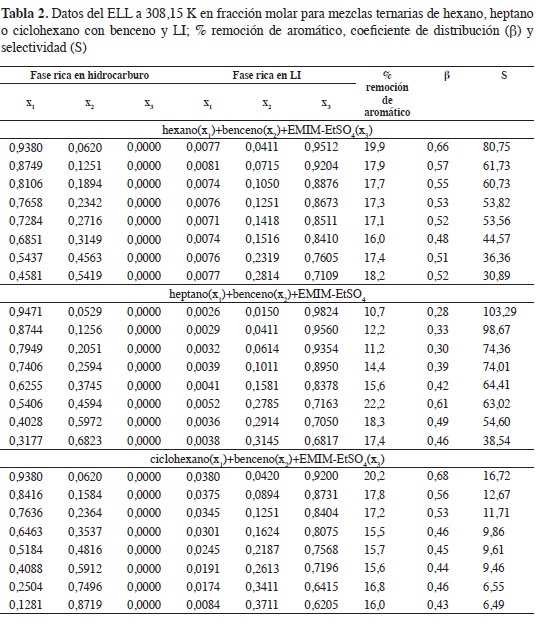
Los datos del ELL para las mezclas ternarias de hexano, heptano o ciclohexano con benceno y EMIM-EtSO4 a 308,15 K se resumen en la Tabla 2 junto con el coeficiente de distribución (β), la selectividad (S) y el porcentaje de remoción de aromático calculados con las ecuaciones 1, 2 y 3:
Donde XIS y XIIS son la fracción molar del benceno en las fases en equilibrio (I = fase rica en hidrocarburo y II = fase rica en LI).
Donde XIJ y XIIJ son la fracción molar del alifático (hexano, heptano o ciclohexano) en las fases en equilibrio.
Donde WLI y WH son la fracción en masa del benceno en las fase rica en LI e hidrocarburo, respectivamente.
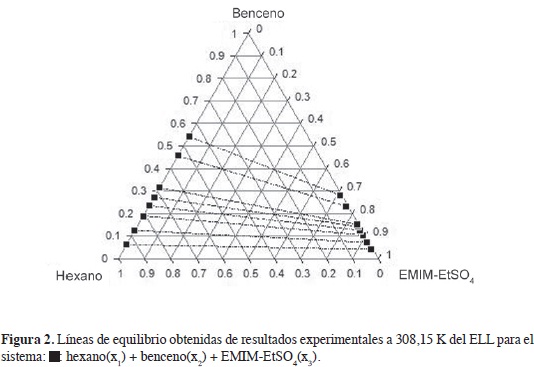
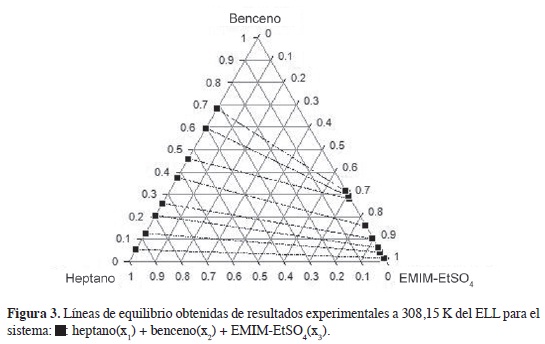
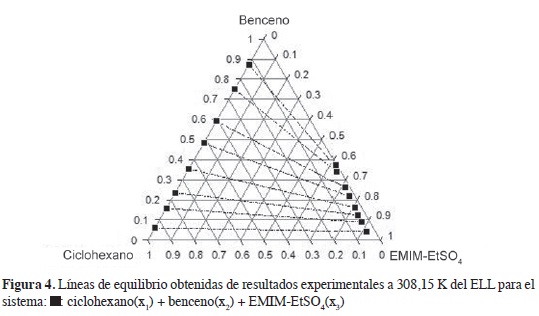
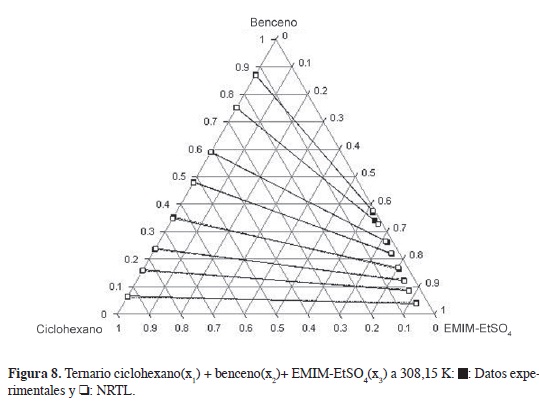
En las Figuras 2-4 se muestran los diagramas ternarios del ELL de las mezclas hexano, heptano y ciclohexano + benceno + EMIM-EtSO4; en los sistemas se observan líneas de equilibrio con tendencia a mezclas binarias; la fase superior es una mezcla de alifático + aromático, y la fase inferior rica en LI muestra composiciones apreciables del aromático y baja concentración del hidrocarburo alifático. La comparación de las Figuras 2 y 4 indican que la región de inmiscibilidad en las mezclas ternarias depende de la naturaleza del hidrocarburo alifático y se incrementa cuando el alifático de 6 carbonos cambia desde ciclohexano, en la Figura, 4 hasta el alifático lineal, Figura 2; las mezclas de ciclohexano con benceno en el ELL muestran una fase extracto rica en LI con mayor concentración del hidrocarburo alifático en comparación con las mezclas hexano-benceno y heptano-benceno; esto se refleja en selectividades (Tabla 2), menores cuando la extracción del aromático se realiza desde el cicloalcano.
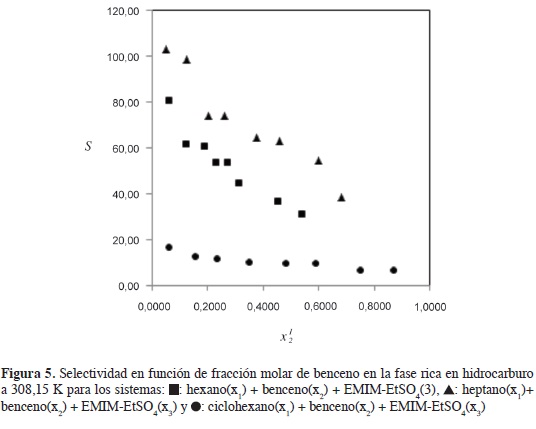
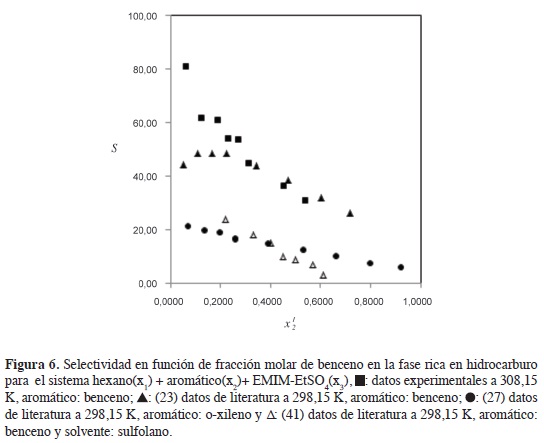
La Figura 5 muestra claramente cómo la selectividad del EMIM-EtSO4 varía en el siguiente orden: ciclohexano < hexano < heptano. La selectividad se incrementa con el número de carbonos en el alifático lineal desde C6 hasta C7; en la medida en que el hidrocarburo se hace más apolar, disminuye su solubilidad en el LI favoreciendo la selectividad del solvente hacia el benceno; la alta polaridad del anión R-SO4 explica la baja solubilidad de los alifáticos en el LI.
Valores superiores a la unidad en selectividad para los sistemas estudiados (Tabla 2) indican que el LI EMIM-EtSO4 se puede usar como solvente en procesos de extracción líquido-líquido para separar benceno desde sus mezclas con hidrocarburos alifáticos; las interacciones tipo it-Jt entre el soluto aromático y el catión de imidazolio del LI favorecen el proceso de extracción (20).
En los tres sistemas estudiados se reporta que la selectividad disminuye con el incremento de benceno en la fase rica en hidrocarburo (Figura 5); con el aumento del aromático, la distancia entre el benceno y los cationes del LI se hace más grande causando una disminución de las fuerzas de interacción y la selectividad (23). Los valores de coeficiente de distribución (Tabla 2) también deben considerarse en este análisis; valores inferiores a la unidad implican procesos más complejos y un mayor requerimiento de LI en la extracción del aromático. No obstante, esto no debe considerarse como una gran desventaja, teniendo en cuenta que el LI EMIM-EtSO4 puede ser recuperado y reutilizado; de acuerdo con González et al. (26), a pesar de que los LI son más costosos que los solventes tradicionales, la producción futura de cantidades más altas pueden favorecer la competitividad de los LI en procesos industriales.
La Tabla 2 también incluye el porcentaje de remoción de aromático (cantidad de benceno extraído en la fase rica en LI divido por la cantidad de benceno en las dos fases); estos valores están entre 10,7 % y 22,2 % en los sistemas estudiados.
La Figura 6 compara los valores de selectividad de sistemas hexano (x1) + aromático (x2) + EMIM-EtSO4(3) (x3) con valores de la literatura; en la extracción de benceno desde hexano con EMIM-EtSO4 se observa una disminución de la selectividad con la concentración de aromático en la fase rica en hidrocarburo en los datos experimentales a 308,15 K y en los datos de literatura (23) a 298,15 K. El uso del LI para extraer benceno desde hexano reporta valores más altos de selectividad en comparación con el sulfolano, que es el solvente tradicional para la extracción de aromáticos desde sus mezclas con alifáticos (2); esto indica que el hexano es más soluble en el sulfolano que en el LI EMIM-EtSO4, y que la región de inmiscibilidad es mayoren las mezcla ternarias hexano + benceno + EMIM-EtSO4 que en las mezclas ternarias hexano + benceno + sulfolano (23, 41). La selectividad del LI EMIM-EtSO4 hacia o-xileno es menor que la selectividad hacia el benceno (Figura 6); la presencia de los radicales metilo en el o-xileno disminuyen la solubilidad del aromático en el LI y desfavorecen la selectividad (23, 27).
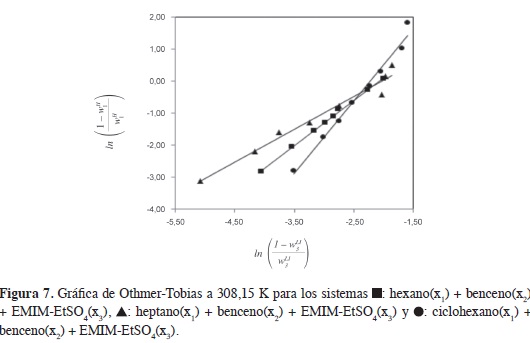
La composición de las fases en equilibrio en cada sistema ternario se ajusta con la ecuación de Othmer-Tobias (42):
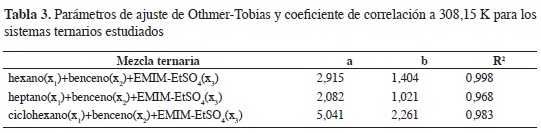
Donde wH1 es la fracción másica del alifá-tico en la fase rica en hidrocarburo; w^1, la fracción másica del LI en la fase rica en LI; a y b son los parámetros de ajuste. En la Tabla 3 se resumen los parámetros y el coeficiente de correlación del ajuste.
La linealidad de la ecuación de Othmer-Tobias indica el grado de consistencia de los datos experimentales (21); en los sistemas estudiados, la ecuación se ajusta adecuadamente a los datos obtenidos desde el ELL. La Figura 7 muestra las gráfcas de Othmer-Tobias para las mezclas ternarias a 308,15 K. Los parámetros de la ecuación de Othmer-Tobias aumentan desde heptano hasta ciclohexano; los datos experimentales indican que la disminución de la región de inmiscibilidad en las mezclas ternarias (Figuras 2-4), aumentan el valor del parámetro b, valores positivos en este parámetro indican un incremento de wH1 con el aumento de WLI3; esto se refleja en las líneas de unión de los diagramas ternarios que muestran una tendencia de las mezclas ternarias a separarse en dos fases, una rica en hidrocarburo y otra en LI. Valores superiores a la unidad en el parámetro b sugieren que en las líneas de unión de los diagramas ternarios WLI3 es mayor que wH1.
Correlación datos ELL
El modelo de actividad NRTL (non-ran-dom, two-liquid) se relaciona con la composición local, y es aplicable a sistemas parcialmente miscibles (43). La ecuación del modelo NRTL para coeficientes de actividad en un sistema multicomponente es:
Este modelo tiene tres parámetros ajustables para cada par binario (τij, τji y œij). Los parámetros τij y τji se relacionan con la energía de interacción entre las moléculas de tipo i y j; el parámetro œij está relacionado con la aleatoriedad de la mezcla.
La energía libre de Gibbs de exceso de Uniquac (Universal Quasi-Chemical) contiene una parte combinatoria gC, que toma en cuenta las diferencias en forma y tamaño molecular, y otra residual gR, que estima las interacciones moleculares (44):
La función gC contiene únicamente parámetros de componentes puros y gR incluye dos parámetros de interacción para cada par de moléculas.
Para un sistema multicomponente,
Donde
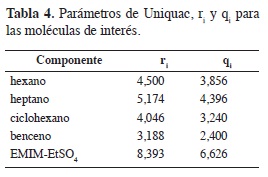
En estas ecuaciones, ri (un volumen molar relativo) y qi (un área superfcial molecular relativa) son parámetros de especies puras, respectivamente. Estos parámetros se han publicado previamente por Santiago et al. (45), y se muestran en la Tabla 4. Los parámetros tij están relacionados con la energía de interacción por pares a través de uij.
En el modelo NRTL, los parámetros œij se fijan para cada sistema; en ambos modelos (NRTL y Uniquac) se minimiza, con el algoritmo de Nelder y Mead (46), la función objetivo:
Donde se busca minimizar las diferencias entre la fracción molar calculada [x^ijk) y experimental (x¡jk) de cada componente en ambas fases. Para cada iteración de la minimización de los parámetros de los modelos es necesario resolver numéricamente el ELL. El error de los modelos se establece con la desviación cuadrática media:
Donde xexpijk es la fracción molar experimental del componente i en la fase j; en la línea de unión k, xcalijk corresponde al valor calculado por NRTL o Uniquac y n es el número de líneas de unión.
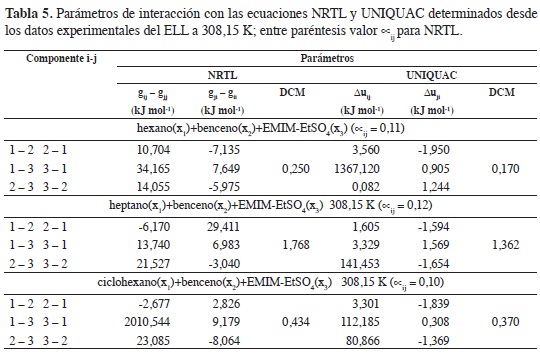
La Tabla 5 resume los parámetros de interacción binaria en los modelos NRTL y Uniquac; ambos modelos correlacionan adecuadamente los datos experimentales del ELL; Santiago et al. (45, 47), en una revisión bibliográfica de la aplicación de NRTL y Uniquac a sistemas ternarios con LI reporta valores de DCM para NRTL entre 0,06 y 3,25 en 184 líneas de equilibrio de 24 mezclas ternarias y valores de DCM para Uniquac entre 0,115 y 5,349 en 408 líneas de equilibrio de 50 mezclas ternarias.
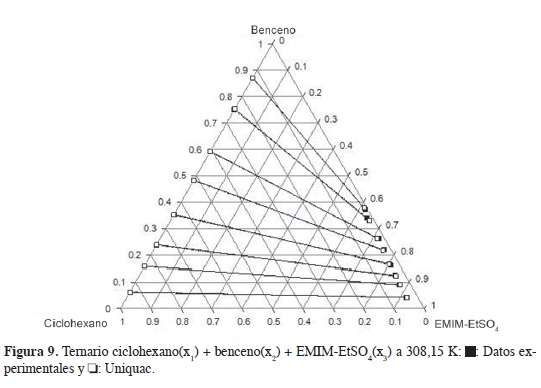
Las Figuras 8 y 9 muestran los datos experimentales y de correlación en la mezcla ternaria ciclohexano(x1) + benceno(x2) + EMIM-EtSO4(x3); se observan pequeñas diferencias entre los valores experimentales y las fracciones molares calculadas desde los modelos NRTL y Uniquac. Los valores de DCM reportados para estos modelos son 0,434 y 0,370, respectivamente, y se calculan con la ecuación 14, usando los datos de la Tablas 2 (composición experimental) y 6 (composición calculada con los modelos NRTL y Uniquac).
CONCLUSIONES
Se determinó experimentalmente a 308,15 K el ELL de las mezclas ternarias hexano(x1) + benceno(x2) + EMIM-EtSO4(x3), heptano(x1) + benceno(x2) + EMIM-EtSO4(x3) y ciclohexano(x1) + benceno(x2) + EMIM-EtSO4(x3). Selectividades y coeficientes de distribución se determinan desde los datos experimentales; los valores de selectividad son superiores a la unidad en los tres sistemas estudiados y aumentan en el orden ciclohexano < hexano < heptano.
La región de miscibilidad de los sistemas ternarios disminuye en la forma ciclohexano > hexano > heptano; el aumento de la longitud de cadena desde C6 hasta C7 disminuye la solubilidad; por otro lado, el cambio de alifático lineal C6 por ciclohexano tiene una infuencia positiva en la solubilidad.
La consistencia de los datos experimentales del ELL se verifcó con la linea-lidad de la ecuación de Othmer-Tobias; los modelos termodinámicos NRTL y Uniquac correlacionan adecuadamente el ELL de las mezclas ternarias. El LI EMIM-EtSO4 puede utilizarse como solvente para extraer benceno desde sus mezclas con hexano, heptano y ci-clohexano; los valores de selectividad -superiores a la unidad- favorecen el proceso de extracción, los valores de coeficiente de distribución son inferiores a la unidad y una extracción efciente va a requerir de una mayor cantidad de LI. Por esta razón, cuando se trabaja en el diseño de un proceso industrial, es necesario encontrar una relación efciente entre selectividad y coeficiente de distribución que permita obtener una gran cantidad del aromático utilizando la menor cantidad posible de LI; en estos procesos es importante considerar que los LI se pueden recuperar fácilmente.
AGRADECIMIENTOS
Los autores agradecen a la dirección de investigaciones de la Universidad de Pamplona (convocatoria interna 2007-2010) por la fnanciación del proyecto y a la escuela de Ingeniería Química, Universidad del Valle, en el desarrollo de los códigos de simulación.
REFERENCIAS BIBLIOGRÁFICAS
1. Letcher, T.; Redhi, G.; Radloff, S. Liquid-Liquid Equilibria of the Ternary Mixtures with Sulfolane at 303.15 K. J. Chem. Eng. Data. 1996. 41: 634-638. [ Links ]
2. Rappel, R.; de Góis, N.; Matte-di, S. Liquid–liquid equilibria data for systems containing aromatic + nonaromatic + sulfolane at 308.15 and 323.15 K. Fluid Phase Equilibr. 2002. 202: 263-276. [ Links ]
3. Earle, M.; Seddon, K. Ionic liquids. Green solvents for the future. Pure Appl. Chem. 2000. 72 (7): 1391-1398. [ Links ]
4. Olivier, H. Recent developments in the use of non-aqueous ionic liquids for two-phase catalysis. J. Mol. Ca-tal. A. 1999. 146: 285-289. [ Links ]
5. Olivier-Bourbigou, H.; Magna, L. Ionic liquids: perspectives for orga-nic and catalytic reactions. J. Mol. Catal. A. 2002. 182-183: 419-437. [ Links ]
6. Zhu, J.; Chen, J.; Li, C; Fei, W. Centrifugal extraction for separation of ethylbenzene and octane using 1-bu-tyl-3-methylimidazolium hexafuo-rophosphate ionic liquid as extractant. Sep. Purif. Technol. 2007. 56: 237-240. [ Links ]
7. Heintz, A. Recent developments in thermodynamics and thermophysics of non-aqueous mixtures containing ionic liquids. A review. J. Chem. Thermodyn. 2005. 37: 525-535. [ Links ]
8. Welton, T. Room-Temperature Io-nic Liquids. Solvents for Synthesis and Catalysis. Chem. Rev. 1999. 99: 2071-2083. [ Links ]
9. Alonso, L.; Arce, A.; Francisco, M.; Soto, A. Phase behaviour of 1 methyl-3-octylimidazolium bis[trifluoromethylsulfonyl]imide with thiophene and aliphatic hydro-carbons: The infuence of n-alkane chain length. Fluid Phase Equilibr. 2008. 263: 176-181. [ Links ]
10. Herbert, M.; Galindo, A.; Montilla, F. Catalytic epoxidation of cyclooc-tene using molybdenum(VI) compounds and urea-hydrogen peroxide in the ionic liquid [bmim]PF6. Catal. Commun. 2007. 8: 987-990. [ Links ]
11. Chen, P. The assessment of removing strontium and cesium cations from aqueous solutions based on the combined methods of ionic liquid extraction and electrodeposition. Electrochim. Acta. 2007. 52: 5484-5492. [ Links ]
12. Berthod, A.; Ruiz-Ángel, M.; Carda-Broch, S. Ionic liquids in separation techniques. J. Chromatogr. A. 2008. 1184: 6-18. [ Links ]
13. Selvan, M.; McKinley, D.; Du-bois, R.; Atwood, J. Liquid-Liquid Equilibria for Toluene + Heptane + 1-Ethyl-3-methylimidazolium Triio-dide and Toluene + Heptane + 1-Bu- tyl-3-methylimidazolium Triiodide. J. Chem. Eng. Data. 2000. 45 (5): 841-845. [ Links ]
14. Letcher, T.; Deenadayalu, N. Ternary liquid–liquid equilibria for mixtures of 1-methyl-3-octylimida-zolium chloride + benzene + an alkane at 298.2 K and 1 atm. J. Chem. Thermodyn. 2003. 35: 67–76. [ Links ]
15. Letcher, T.; Reddy, P. Ternary (li-quid–liquid) equilibria for mixtures of 1-hexyl-3-methylimidazolium (tetrafuoroborate or hexafuoro-phosphate) + benzene + an alkane at 298.2 K and P = 0.1 MPa. J. Chem. Thermodyn. 2005. 37: 415-421. [ Links ]
16. Deenadayalu, N.; Ngcongo, K.; Letcher, T.; Ramjugernath, D. Liquid-Liquid Equilibria for Ternary Mixtures (an Ionic Liquid + Benze-ne + Heptane or Hexadecane) at T = 298.2 K and Atmospheric Pressure. J. Chem. Eng. Data. 2006. 51(3): 988-991. [ Links ]
17. Meindersma, G.; Podt, A.; Haan, A. Ternary liquid–liquid equilibria for mixtures of toluene + n-heptane + an ionic liquid. Fluid Phase Equilibr. 2006. 247: 158-168. [ Links ]
18. Meindersma, G.; Podt, A.; Haan, A. Ternary liquid–liquid equilibria for mixtures of an aromatic + an aliphatic hydrocarbon + 4-methyl-n-butylpyridinium tetrafuoroborate, J. Chem. Eng. Data. 2006. 51: 1814-1819. [ Links ]
19. Maduro, R.; Aznar, M. Liquid–liquid equilibrium of ternary systems 1-bu-tyl-3-methylimidazolium hexafuo-rophosphate + aromatic + aliphatic. Fluid Phase Equilibr. 2008. 265: 129-138. [ Links ]
20. García, J.; Fernández, A.; Torrecilla, J.; Oliet, M.; Rodríguez, F. Liquid-liquid equilibria for {hexane + ben-zene + 1-ethyl-3-methylimidazolium ethylsulfate} at (298,2, 313,2 and 328,2) K. Fluid Phase Equilibr. 2009. 282: 117–120. [ Links ]
21. García, S.; Larriba, M.; García, J.; Torrecilla, J.; Rodríguez, F. (Liquid + liquid) equilibrium for the ter-nary systems {heptane+toluene+1-allyl-3-methylimidazolium bis (trifluoromethylsulfonyl)imide} and {heptane+toluene+1-methyl-3-propyl imidazolium bis(trifluoromethylsulfonyl)imide} ionic liquids. J. Chem. Thermodyn. 2011.43: 1641-1645. [ Links ]
22. García, S.; Larriba, M.; García, J.; Torrecilla, J.; Rodríguez, F. Alkil-sulfate-based ionic liquids in the liquid-liquid extraction of aromatic hydrocarbons. J. Chem. Thermodyn. 2012.45: 68-74. [ Links ]
23. González, E.; Calvar, N.; Gómez, E.; Domínguez, A. Separation of Ben-zene from Linear Alkanes (C6-C9) Using 1-Ethyl-3-Methylimidazo-lium Ethylsulfate at T= 298.15 K. J. Chem. Eng. Data. 2010. 55: 3422-3427. [ Links ]
24. González, E.; Calvar, N.; González, B.; Domínguez, A. Liquid Extraction of Benzene from Its Mixtures Using 1-Ethyl-3-methylimidazolium Ethylsulfate as a Solvent. J. Chem. Eng. Data. 2010. 55: 4931-4936. [ Links ]
25. González, E.; Calvar, N.; Domínguez, I.; Domínguez, A. Extraction of toluene from aliphatic compounds using an ionic liquid as solvent: In-fuence of the alkane on the (liquid + liquid) equilibrium. J. Chem. Thermodyn. 2011. 43: 562-568. [ Links ]
26. González, E.; Calvar, N.; Gómez, E.; Domínguez, A. Application of [EMim][ESO4] ionic liquid as sol-vent in the extraction of toluene from cycloalkanes: Study of liquid–liquid equilibria at T = 298.15 K. Fluid Phase Equilibr. 2011. 303: 174-179. [ Links ]
27. González, E.; González, B.; Calvar, N.; Domínguez, A. Study of [EMim] [ESO4] ionic liquid as solvent in the liquid-liquid extraction of xylenes from their mixtures with hexane. Fluid Phase Equilibr. 2011. 303: 227-232. [ Links ]
28. Domínguez, I.; Calvar, N.; Gómez, E. Domínguez, A. Separation of toluene from cyclic hydrocarbons using 1-butyl-3-methylimidazolium methylsulfate ionic liquid at T = 298.15 K and atmospheric pressure. J. Chem. Thermodyn. 2011. 43: 705-710. [ Links ]
29. Seoane, R.; Gómes, E.; González, E.; Domínguez, A. (Liquid + liquid) equilibria for the ternary mixtures (alkane + toluene + ionic liquid) at T=298.15 K: infuence of the anion on the phase equilibria. J. Chem. Thermodyn. 2012. 47: 402-407. [ Links ]
30. Corderi, S.; Calvar, N.; Gómez, E.; Domínguez, A. Capacity of ionics liquids (EMIM)(NTf2) and (EMPy) (NTf2) for extraction of toluene from mixtures with alkanes: Comparative study of the effect of the cation. Fluid Phase Equilibr. 2012. 315: 46-52. [ Links ]
31. Martínez, M.; Amado, E. Índices de refracción, densidades y propiedades derivadas de mezclas binarias de solventes hidroxílicos con líquidos iónicos (1-etil-3-metilimidazolio etil-sulfato y 1-metil-3-metilimidazolio metilsulfato) de 298,15 a 318,15 K. Revista Colombiana de Química. 2011. 40(2): 247-268. [ Links ]
32. Dike, K. V. Fundamentals of Petro-leum, 4th ed., University of Texas, Austin, 1997. [ Links ]
33. Rodríguez, H.; Brennecke, J. Tem-perature and Composition Dependence of the Density and Viscosity of Binary Mixtures of Water + Ionic Liquid. J. Chem. Eng. Data. 2006. 51: 2145-2155. [ Links ]
34. Arce, A.; Rodríguez, O.; Soto, A. A comparative study on solvents for separation of tert-amyl ethyl ether and ethanol mixtures. New experimental data for 1-ethyl-3-methyl imidazolium ethyl sulfate ionic li-quid. Chem. Eng. Sci. 2006. 61: 6929-6935. [ Links ]
35. Aminabhavi, T.; Patil, V. ; Aralaguppi, M.; Phayde, H. Density, Viscosity, and Refractive Index of the Binary Mixtures of Cyclohexane with Hexane, Heptane, Octane, Nonane, and Decane at (298.15, 303.15, and 308.15) K. J. Chem. Eng. Data. 1996. 41(3): 521-525. [ Links ]
36. Orge, B.; Rodríguez, A.; Canosa, J.; Marino, G.; Iglesias, M.; Tojo, J. Variation of Densities, Refractive Indices, and Speeds of Sound with Temperature of Methanol or Ethanol with Hexane, Heptane, and Octane. J. Chem. Eng. Data. 1999. 44(5): 1041-1047. [ Links ]
37. Calvar, N.; González, B.; Gómez, E.; Domínguez, A. Experimental densi-ties, refractive indices, and speeds of sound of 12 binary mixtures con-taining alkanes and aromatic compounds at T = 313.15 K. J. Chem. Thermodyn. 2009. 41: 939-944. [ Links ]
38. Moravkova, L.; Wagner, Z.; Linek, J. (p.Vm.T) measurements of (cy-clohexane + nonane) at temperatures from 298.15 K to 328.15 K and at pressures up to 40 MPa. J. Chem. Thermodyn. 2007. 39: 1637-1648. [ Links ]
39. Rodríguez, A.; Canosa, J.; Tojo, J. Physical Properties of the Ter-nary Mixture Dimethyl Carbonate + Methanol + Benzene and Its corresponding binaries at 298.15 K. J. Chem. Eng. Data. 1999. 44: 1298-1303. [ Links ]
40. Alonso, L.; Arce, A.; Francisco, M.; Soto, A. (Liquid + liquid) equilibria of [C8mim][NTf2] ionic liquid with a sulfur-component and hydrocar-bons. J. Chem. Thermodyn. 2008. 40: 265-270. [ Links ]
41. Chen, J.; Duan, L.; Mi, J.; Fei, Y. ; Li, C. Liquid-liquid equilibria of multi-component systems including n-hexane, n-octane, benzene, tolue-ne, xylene and sulfolane at 298.15 K and atmospheric pressure. Fluid Phase Equilibr. 2000. 173: 109-119. [ Links ]
42. Othmer, D.; Tobias, P. Tie line correlation. Ind. Eng. Chem. 1942. 34(6): 693-696. [ Links ]
43. Renon, H.; Prausnitz, J. Local Compositions in Thermodynamic Excess Functions for Liquid Mixtures. AI-ChE J. 1968. 14: 135-144. [ Links ]
44. Abrams, D.; Prausnitz, J. Statistical thermodynamics of liquid mixtures: a new expression for the excess Gibbs energy of partly or completely miscible substances, AIChE J. 1975. 21: 116-128. [ Links ]
45. Santiago, R.; Santos, G.; Aznar, M. Uniquac correlation of liquid–liquid equilibrium in systems involving ionic liquids: The DFT–PCM ap-proach. Fluid Phase Equilibr. 2009. 278: 54-61. [ Links ]
46. Nelder, J.; Mead, R. A Simplex Method for Function Minimization. Computer Journal. 1965. 7: 308-313. [ Links ]
47. Aznar, M. Correlation of (liquid+liquid) equilibrium of systems including ionic liquids. Braz. J. Chem. Eng. 2007. 24(1): 143-149. [ Links ]