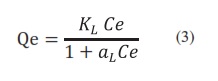Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.41 no.2 Bogotá May/Aug. 2012
REMOCIÓN DE CROMO HEXAVALENTE DE AGUAS CONTAMINADAS USANDO QUITOSANO OBTENIDO DE EXOESQUELETO DE CAMARÓN
REMOVAL OF HEXAVALENT CHROMIUM FROM CONTAMINATED WATER USING CHITOSAN OBTAINED FROM SHRIMP EXOSKELETON
REMOÇÃO DE CROMO HEXAVALENTE DE AGUAS CONTAMINADAS USANDO QUITOSANA OBTIDO DE EXOESQUELETO DE CAMARÃO
Yina Pájaro1, Fredyc Díaz2*
1 Químico Farmacéutico, M.Sc. (c). Facultad de Ciencias Farmacéuticas, Universidad de Cartagena. Cartagena, Colombia.
2 Químico Farmacéutico, M.Sc., Ph.D. Profesor titular. Facultad de Ciencias Farmacéuticas, Universidad de Cartagena. Laboratorio de Investigaciones Fitoquímicas y Farmacológicas (LIFFUC). Cartagena, Colombia.
* fredycdiazcastillo@yahoo.com
Recibido: 04/01/2012 – Aceptado: 16/07/2012
RESUMEN
El exoesqueleto de camarón desechado por la industria puede ser aprovechado para la obtención de quitina y quitosano con la utilización de reactivos comerciales de muy bajo costo. El quitosano es un biopolímero que tiene diversos usos, entre ellos, la remoción de metales pesados a partir de aguas residuales. En este estudio se utilizó quitosano para la remoción de cromo hexavalente a partir de muestras de aguas residuales del proceso de galvanizado (cromado) de una industria de Cartagena. La remoción de cromo se realizó por un proceso discontinuo, a un pH óptimo encontrado en este estudio de 2.0 y una temperatura de 26 °C. La cinética de adsorción fue estudiada mediante el uso de la isoterma de Langmuir, siendo la capacidad máxima de adsorción (Qmax) de 200 mg/g. La remoción de cromo hexavalente a partir de las muestras de aguas residuales fue del 99.98 %.
Palabras clave: quitina, quitosano, isoterma de Langmuir, cromo hexavalente.
ABSTRACT
The exoskeleton of shrimp discarded by the industry, can be used for the production of chitin and chitosan with the use of very low cost commercial reagents. Chitosan is a biopolymer that has many uses, including heavy metals removal from wastewater. In this study, chitosan was used to remove hexavalent chromium from wastewater samples from the galvanizing process (chrome) of an industry in the city of Cartagena. The chromium removal was performed by a batch process at an optimum pH found in this study of 2.0 and a temperature of 26 °C. The adsorption kinetics was studied by using the Langmuir isotherm, being the maximum adsorption capacity (Qmax.) of 200 mg/g. The removal of hexavalent chromium from wastewater samples was 99.98 %.
Key words: chitin, chitosan, Langmuir isotherm, hexavalent chromium.
RESUMO
O exoesqueleto de camarão desperdiçado pela indústria pode ser aproveitado para a obtenção de quitina e quitosana usando reagentes comerciais de baixo custo. A quitosana é um biopolimero que tem diversos usos como a remoção de metais pesados de aguas residuais. Neste estudo se usou quitosana para a remoção de cromo hexavalente de amostras de aguas residuais do processo de galvanizado (cromado) de uma indústria da cidade de Cartagena (Colômbia). A remoção do cromo se realizou através de um processo continuo em um pH de 2.0 como condição ótima encontrada durante a realização deste estudo e uma temperatura de 26 °C. A cinética de adsorção foi estudada através do uso da isoterma de Langmuir, sendo a capacidade máxima de adsorção (Qmax) de 200 mg/g. A remoção de cromo hexavalente a partir das amostras residuais foi de 99.98 %.
Palavras-chave: Quitina, quitosana, isoterma de Langmuir, cromo hexavalente.
INTRODUCCIÓN
La cría y comercialización de camarón en la costa Caribe colombiana constituye una actividad económica importante (1). A su vez la generación de residuos perecederos del exoesqueleto constituye un problema de contaminación ambiental. Una solución a este problema es el aprovechamiento del exoesqueleto de camarón como fuente de quitina, un biopolímero presente en el caparazón de muchos crustáceos. A partir de la quitina se obtiene quitosano, mediante un proceso químico de desacetilación. Ambos polímeros son recomendados como probables sustituyentes de los polímeros sintéticos, debido a que tienen excelentes propiedades como biocompatibilidad, biodegradabilidad y toxicidad nula (2-4). En la actualidad se están reemplazando los métodos convencionales para el tratamiento de aguas residuales (precipitación, oxidación, intercambio iónico, filtración) por sistemas que contienen biopolímeros adsorbentes (5). El quitosano posee grupos amino libres que permiten su interacción con cationes, aniones y compuestos tanto orgánicos como inorgánicos, dependiendo del pH del medio. Esta característica le confiere una utilidad potencial como biofiltro de aguas residuales, ayudando a resolver los problemas de contaminación (6, 7). Además de las propiedades quelantes, el quitosano es útil en medicina, en la industria de alimentos, cosmética y farmacéutica (8, 9).
Históricamente el cromo ha sido uno de los metales más ampliamente utilizados para el revestimiento de piezas metálicas, debido a su resistencia a la corrosión (10). Además, el cromo forma parte de curtientes, pigmentos y conservantes textiles, aleaciones, pinturas, antiincrustantes, catalizadores, agentes anticorrosivos, lodos de perforación, baterías de alta temperatura, fungicidas, conservantes de madera, recubrimientos metálicos y electrogalvanizados (11). El cromo es un metal de transición que puede existir en varios estados de oxidación, que van desde Cr (0) la forma metálica, hasta su forma hexavalente, Cr (VI). Tanto la forma trivalente (Cr [III]) como la hexavalente se consideran importantes desde el punto de vista ambiental, siendo el Cr (VI) mucho más toxico que el Cr (III). El Cr (VI) es considerado tóxico cuando se encuentra a concentraciones mayores a 0.05 mg/L en las aguas potables y se ha demostrado que posee propiedades mutagénicas y carcinogénicas (12). Por esta razón se seleccionó el Cr (VI) para este estudio de biosorción sobre quitosano, con el fin de remover este metal en aguas residuales provenientes de una industria artesanal de cromado. El uso extensivo de Cr (VI) en el acabado de metales y otras actividades industriales se ha traducido en contaminación de suelos y aguas subterráneas en Europa y América del Norte (10). La forma de cromo utilizada en la industria del galvanizado de metales es Cr (VI), lo cual supone un riesgo para la salud humana. De acuerdo con la Cámara Fedemetal de la Asociación Nacional de Industriales (ANDI), en Colombia para el 2008 se registraron aproximadamente unas catorce plantas de galvanizado con una capacidad anual aproximada de 80000 ton por año. Estas plantas de galvanizado poseen un control más o menos adecuado de sus aguas residuales (13). Sin embrago, en algunas regiones del país, como en Cartagena, se han encontrado pequeñas empresas artesanales dedicadas al proceso de cromado de metales, en las cuales no existe ningún control sobre las emisiones de los residuos que estas vierten al sistema de alcantarillado.
El término biosorción se utiliza para referirse a la captación de metales o especies metaloides que se lleva a cabo sobre un material de origen biológico (vivo o muerto), a través de mecanismos fisicoquímicos como la adsorción o el intercambio iónico (14). El proceso de biosorción involucra una fase sólida (sorbente) y una fase líquida (solvente, que es normalmente el agua) que contiene las especies disueltas que van a ser sorbidas (sorbato). Debido a la gran afinidad del sorbente por las especies del sorbato, este último es atraído hacia el sólido y enlazado por diferentes mecanismos. Este proceso continúa hasta que se establece un equilibrio entre el sorbato disuelto y el sorbato enlazado al sólido (a una concentración final o en el equilibrio). La afinidad del sorbente por el sorbato determina su distribución entre las fases sólida y líquida. La calidad del sorbente está dada por la cantidad del sorbato que puede atraer y retener en forma inmovilizada (14), lo cual se denomina como capacidad de adsorción o capacidad de captura del sorbente (Qe) (15). Se han desarrollado varios modelos para cuantificar la cantidad máxima de Cr (VI) que puede ser adsorbida sobre la superficie del adsorbente, en este caso quitosano, los cuales consisten en graficar la concentración de soluto [Cr (VI)] en la fase sólida Qe, en función de la concentración de Cr (VI) en la fase líquida o concentración en equilibrio Ce. Debido a que los datos son obtenidos a una misma temperatura, la gráfica se llama isoterma de adsorción (16).
Hasta donde se conoce, en Colombia son pocos los esfuerzos que se han hecho para el aprovechamiento del exoesqueleto de camarón, a pesar de que la quitina y el quitosano ofrecen un mercado potencial en usos, como coagulante, biomateriales, reactivos industriales, conservadores y estimulantes en plantas, biomedicina y agentes de liberación prolongada de fármacos. De allí que el principal objetivo de este trabajo, fue aprovechar el exoesqueleto de camarón desechado en la industria camaronera para la obtención de quitina y quitosano y el uso posterior de este último para la remoción de Cr (VI) proveniente de una muestra de agua residual de una empresa artesanal de galvanizado (cromado) en Cartagena.
MATERIALES Y MÉTODOS
Materiales y reactivos
Para la extracción de quitina y quitosano se usó hidróxido de sodio (NaOH, Merck, USA) y ácido clorhídrico (HCl, Merck, USA) grado analítico y ácido muriático (HCl, grado comercial) y soda caústica (NaOH, grado comercial). Para los estudios de remoción de cromo hexavalente se usaron los siguientes reactivos grado analítico: ácido sulfúrico (H2SO4, Merck, USA), dicromato de potasio (K2Cr2O7, 207802, ACS reagent, Sigma-Aldrich, Co., LLC, USA) y 1,5-difenilcarbazida (Merck). Los patrones utilizados para los espectros IR fueron: quitina (C7170 Sigma, Sigma- Aldrich Co., LLC, USA) y quitosano (C3646 Sigma, Sigma, Sigma-Aldrich Co., LLC, USA). Para la preparación de las diferentes soluciones se utilizó agua desionizada.
Preparación de quitina y quitosano T2
La extracción de quitina y la obtención de quitosano se realizó a partir del exoesqueleto de camarón crudo obtenido de una industria camaronera de Cartagena, Colombia, mediante el uso de protocolos previamente establecidos en la literatura, con ligeras modificaciones (6, 17). Diez kilogramos del material (humedad, 10.63 %; cenizas, 25.43 %; proteínas, 30.95 %) fueron sometidos a un proceso de limpieza manual, lavado y secado a temperatura ambiente por dos días y posteriormente triturados. Se calculó el porcentaje de exoesqueleto seco, a partir del material crudo. La quitina se obtuvo por desmineralización del exoesqueleto de camarón seco y molido, por tratamiento con ácido clorhídrico 1 M en proporción 1:10 (masa de material/volumen de solución ácida) y agitación constante a 26 °C durante 3 h. La mezcla se filtró, se lavó con abundante agua y se dejó secar a temperatura ambiente por 24 h. Posteriormente se realizó la desproteinización con hidróxido de sodio al 4 % p/v en proporción 1:10 (masa de material/volumen de solución ácida), agitación constante a 60 °C-70 °C durante 3 h. La quitina obtenida se lavó con abundante agua y se dejó secar a temperatura ambiente por 48 h; luego se pesó y se calculó el rendimiento con base en el peso de exoesqueleto seco y crudo. El quitosano se obtuvo por desacetilación de la quitina, por tratamiento de esta con NaOH al 50 %, bajo agitación por 6 h a una temperatura de 110 °C-120 °C. Una vez obtenido el quitosano, este se hizo pasar a través de tamices con diferentes números de malla, hasta obtener un tamaño de partícula final de 150 μm. Posteriormente, se calculó el rendimiento de quitosano con base en la cantidad de quitina y exoesqueleto de camarón seco usado para su extracción.
Caracterización fisicoquímica del agua residual de la industria de cromado
La determinación de cobre, níquel y zinc presentes en la muestra de agua residual de la industria de cromado se realizó utilizando un equipo de absorción atómica marca UNICAM solaar 969AA. Los límites de detección para estos metales se determinaron por medición de la absorción del blanco (entre 7-10 repeticiones) y son expresados como 3xDS en cada caso.
Caracterización mediante FTIR (Espectroscopia infrarroja con transformada de Fourier) de la quitina y el quitosano
La quitina y el quitosano fueron caracterizados mediante espectroscopia infrarroja, para lo cual se prepararon pastillas mezclando cada polímero con bromuro de potasio, utilizando un espectrofotómetro infrarrojo con transformada de Fourier (FT-IR 84005, marca Shimadzu). Los espectros de las muestras analizadas fueron comparados con aquellos obtenidos a partir de muestras comerciales de quitina y quitosano, marca Sigma Chemical Co. y con aquellos reportados previamente en la literatura (18). El grado de desacetilación del quitosano obtenido se realizó teniendo en cuenta la relación que existe entre la banda característica a 1320 cm-1 y la absorción de la banda tomada como referencia interna a 1421 cm-1, de acuerdo con lo establecido en la literatura (19) para el análisis por regresión lineal de tres muestras comerciales.
Estudios de biosorción
Determinación del pH óptimo para la remoción de Cr (VI)
Los experimentos se llevaron a cabo teniendo en cuenta protocolos previamente establecidos en la literatura, con pequeños ajustes (16, 20). Se evaluó la remoción de Cr (VI) a valores de pH entre 1 y 8. Brevemente, volúmenes de 50 ml de una solución a la concentración de 500 mg/L de Cr (VI), para cada pH evaluado, fueron ajustados a los valores de pH requerido a partir del pH de la solución inicial, usando H2SO4 0,5 M y NaOH 1 M. Se agregaron en cada recipiente 200 mg de quitosano y la mezcla se llevó a agitación constante por 3 h a 26 °C. La solución fue filtrada y se determinó la concentración de Cr (VI) no adsorbido en el filtrado. Se calculó el porcentaje de Cr (VI) removido para cada pH evaluado, basado en la diferencia de concentraciones de Cr (VI) en las soluciones acuosas antes y después de la adsorción. Cada ensayo fue realizado por triplicado en idénticas condiciones.
Isoterma de adsorción
Para la determinación de la isoterma de adsorción de cromo sobre quitosano se prepararon diferentes soluciones de concentraciones iniciales de Cr (VI): 25, 50, 100, 200, 300, 600 y 1200 mg/L. Cada solución se ajustó a pH 2.0 con H2SO4 0.5 M. A un volumen de 50 ml de cada solución por triplicado, se le agregaron 200 mg de quitosano y se dejó en agitación constante por 3 h a 26 °C. Las soluciones fueron filtradas y se midió la concentración final de Cr (VI) en el filtrado (Ce). Se calculó la capacidad de adsorción del quitosano para cada solución y para el análisis de la isoterma de adsorción se recurrió al modelo de Langmuir, el cual produce mejores resultados para la adsorción de cromo sobre varios adsorbentes, entre los que se encuentra el quitosano, cuando se compara con el uso de la ecuación de Freunlich (16, 20).
Remoción de Cr (VI) a partir de una solución preparada con K2Cr2O7 analítico, equivalente a 1200 mg/L en Cr (VI) y a partir de una solución residual de aguas de cromado diluida y estabilizada a 1200 mg/L de (VI)
Este ensayo se llevó a cabo en un proceso discontinuo. Un volumen de 50 ml de una solución de Cr (VI) de 1200 mg/L ajustada a pH 2.0 se mezcló con 200 mg de quitosano, en una primera etapa. La mezcla se mantuvo en agitación por 3 h, al final de las cuales se filtró y se le determinó la concentración de Cr (VI) al filtrado, al cual se le ajustó nuevamente el pH a 2.0 y se le agregaron 200 mg de quitosano, a las condiciones mencionadas anteriormente. El proceso se repitió seis veces hasta completar una cantidad de quitosano agregada de 1200 mg. De manera similar se procedió con una muestra de agua residual del proceso de cromado de una empresa artesanal de Cartagena, Colombia, la cual se dedica a procesos de galvanizado de metales. La muestra fue tomada del efluente de la empresa, con permiso de las autoridades de esta. Dicha muestra fue caracterizada midiendo los parámetros pH, concentración de Cr (VI) y de otros metales como cobre, zinc y níquel y diluida a la concentración requerida para este estudio.
Medida de la concentración de Cr (VI) en los ensayos realizados
La concentración de cromo hexavalente en cada ensayo fue medido por el método colorimétrico, consistente en la formación de un complejo color rojo violeta entre el Cr (VI) y el compuesto 1,5-difenilcarbazida en solución ácida (21). La intensidad del color es proporcional a la concentración de cromo y se midió en un espectrofotómetro UV-Vis 1700 Shimadzu, en la región visible a una longitud de onda de 540 nm.
RESULTADOS Y DISCUSIÓN
Preparación de quitina y quitosano
El rendimiento de exoesqueleto seco a partir 10 kg del material crudo obtenido de la industria camaronera fue del 7.08 %. Este bajo rendimiento fue debido probablemente, a que el material crudo tenía un alto contenido de masa muscular, incluyendo pleópodos y urópodos, además de camarones enteros, restos de guantes, agua en gran cantidad y otros desechos.
En la Tabla 1 se muestran los rendimientos de quitina y quitosano obtenidos con reactivos analíticos y comerciales, con base en el exoesqueleto de camarón crudo y seco; además se indican las cantidades de reactivos necesarias para cada extracción. No se observaron diferencias significativas en los rendimientos de quitina y quitosano cuando se comparó el uso de reactivos analíticos con reactivos de grado comercial, como soda caústica y ácido muriático. De acuerdo con los resultados obtenidos, se deduce que para la producción de 1 kg de quitosano, a partir de los reactivos comerciales usados en este estudio, se necesitarían aproximadamente 57 kg de material crudo (18 kg de quitosano/tonelada de material crudo). De igual forma para esta cantidad de material crudo se necesitarían 7.66 kg de soda cáustica y 8.5 L de ácido muriático. Teniendo en cuenta que 1 kg de hidróxido de sodio comercial (soda caústica) tiene un valor aproximado de US $ 2.2 y 1 L de ácido clorhídrico comercial (ácido muriático) de US $ 1.75 en el mercado colombiano, el costo de producir 1 kg de quitosano a partir de estos reactivos comerciales sería de aproximadamente US $ 32.11. El costo de producción del mismo kilogramo de quitosano a partir de reactivos grado analítico se calculó en aproximadamente US $ 459.7, al precio del mercado colombiano al momento de escribir el presente artículo.
Caracterización mediante FTIR (Espectroscopia infrarroja con transformada de Fourier) de la quitina y el quitosano
Los espectros FTIR de quitina y quitosano mostrados en la Figura 1 y Figura 2, permitieron establecer las diferencias estructurales entre los biopolímeros. La quitina posee un grupo N-acetilamina (amida) y el quitosano posee un grupo amino libre (producto de la desacetilación de la quitina). En el espectro de la quitina, la presencia de grupos N-acetilamida se muestra en las bandas de amida I a 1656 cm-1 y 1638.58 cm-1 y la banda de amida II a 1559.5 cm-1. Estas bandas se observan levemente en el espectro de quitosano, indicando su alto grado de desacetilación. En el espectro del quitosano la banda de alargamiento del grupo OH a 3500 cm-1 es más amplia, revelando que en este polímero existe mayor número de puentes de hidrógeno que en la quitina (6, 18). Los espectros de quitina y quitosano se compararon con los espectros infrarrojos de muestras comerciales. El grado de desacetilación (Gd) obtenido fue de 79.87 % y se calculó utilizando la ecuación 1, como se indicó en la metodología, teniendo en cuenta la relación entre las absorbancias de las bandas a 1320 cm-1 y 1420 cm-1.
Ensayos de remoción de cromo hexavalente
Determinación del pH óptimo
El parámetro más importante que influencia la adsorción es el pH del medio (11). La Figura 3 muestra la influencia del pH sobre la remoción de Cr (VI), a valores de pH entre 1 y 8. Se observa que el porcentaje de remoción de Cr (VI) incrementa de manera creciente cuando el pH de la solución disminuye, alcanzando un valor máximo a pH 2.0. Siguiendo el comportamiento observado se esperaría que a pH 1.0 la remoción de Cr (VI) fuera mayor que a pH 2.0, pero los resultados demuestran que la remoción es incluso menor que la obtenida a pH 3.0. El pH es un factor determinante para la especiación de los metales como el cromo y para la protonación del quitosano. El Cr (VI) puede coexistir en varias formas estables: Cr2O7 2-, HCr2O7 -, HCrO4 - y CrO4 2-, y la abundancia relativa de una especie en particular depende de la concentración de cromo y del pH de la solución (22, 23). A rango de pH 2-6, coexisten las especies HCrO4 - y CrO4 - y a pH menor de 2.0 se forma H2CrO4 (22). Por otra parte, el quitosano con sus grupos amino libres se protona a pH ácido quedando estos en la forma NH3+. Por tanto, de acuerdo con estudios previos, la máxima capacidad de adsorción de cromo a pH 2.0 se debe a la interacción electrostática de los oxianiones de cromo, HCrO4 - y CrO4 2-, con los grupos amino libres protonados del quitosano (22). La disminución de la adsorción de cromo a pH 1.0 se debe probablemente a la forma no ionizada del metal que se presenta por debajo de pH 2.0.
Isoterma de adsorción
El cálculo de la capacidad del quitosano para adsorber Cr (VI) en este estudio se basó en el balance de materia del sistema de adsorción, donde se asume que el Cr (VI) que desapareció de la solución debe estar en el quitosano; por tanto, la cantidad límite de Cr (VI) que desapareció de la solución puede ser calculada con la ecuación 2 (15):
Donde: Qe: capacidad de adsorción del quitosano, expresado generalmente en mg/g. Ci: concentración inicial de Cr (VI) en la solución (mg/L). Cf: concentración final de Cr (VI) en la solución (mg/L). V: volumen de solución utilizada (L). W: masa de quitosano utilizada (g).
Se han desarrollado varios modelos para cuantificar la cantidad máxima de Cr (VI) que puede ser adsorbida sobre la superficie del adsorbente, en este caso quitosano, los cuales consisten en graficar la concentración de soluto [Cr (VI)] en la fase sólida Qe, en función de la concentración de Cr (VI) en la fase líquida o concentración en equilibrio Ce. Debido a que los datos son obtenidos a una misma temperatura, la gráfica se llama isoterma de adsorción (16). Los modelos más conocidos son el de Langmuir y el de Freundlich. El modelo de Langmuir asume que las fuerzas intermoleculares disminuyen con la distancia, por tanto, predice que el sorbato, que en este estudio es Cr (VI), forma una monocapa sobre la superficie exterior del quitosano (sorbente) (15). Teóricamente el quitosano tendría una capacidad limitada para el Cr (VI), con lo que la adsorción alcanza un valor de saturación por encima del cual no es posible que haya más adsorción. La saturación se representa por la expresión (ecuación 3):
Donde: Qe: capacidad de adsorción (mg/g). Ce: concentración en equilibrio (mg/ dm3). KL: constante de Langmuir (dm3/g). aL: constantes de Langmuir (dm3/mg), relacionada con la afinidad a los sitios de unión.
Una gráfica de Ce/Qe en función de Ce produce una línea recta, si se cumple la ecuación 3, cuya pendiente es aL/ KL y el intersecto 1/KL. El valor de KL/aL corresponde a la capacidad de adsorción del sorbente (quitosano) por el sorbato, Cr (VI), y se expresa como Qe o Qmax. La expresión lineal de la ecuación de Langmuir es (ecuación 4):
Donde: Qe: capacidad de adsorción (mg/g). Ce: concentración en equilibrio (mg/ dm3). KL: constante de Langmuir (dm3/g). aL: constantes de Langmuir (dm3/mg), relacionada con la afinidad a los sitios de unión.
El estudio de la cinética de adsorción es útil en la evaluación de un adsorbente. La isoterma de adsorción permite observar cómo el soluto interactúa con el adsorbente y permite optimizar sus usos (20). La isoterma de adsorción obtenida en el presente estudio a pH 2 y 26 °C, para la adsorción de cromo sobre quitosano, se muestra en la Figura 4. La isoterma fue analizada bajo el modelo de Langmuir y los parámetros de esta se determinaron por regresión lineal, teniendo en cuenta el coeficiente de correlación lineal, el cual debe ser cercano a la unidad. De la ecuación de la recta obtenida se calculó un valor de Qmax = 200 mg/g. La capacidad de adsorción máxima de cromo sobre quitosano, Qmax, obtenida en este estudio es superior a las reportadas por Schmuhl (2001) (16) cuyo Qmax fue de 78 mg/g y por Baran (2006) (20), el cual reporta un Qmax de 153.85 mg/g (a pH 3). De acuerdo con lo anterior se asume que el quitosano utilizado en este estudio es estructuralmente homogéneo, donde todos los sitios para la adsorción del cromo son idénticos y energéticamente equivalentes (15). Nuestros resultados indican una alta capacidad de adsorción de Cr (VI) sobre el quitosano. La diferencia de estos valores con los reportados por otros autores puede ser debido al tamaño de partícula utilizado en los experimentos (150 μm), aunque no es posible asegurar esto completamente, ya que en las referencias consultadas no fue posible verificar el tamaño de partícula empleado por los autores en sus ensayos.
Remoción de Cr (VI) a partir de una solución preparada con K2Cr2O7 analítico, equivalente a 1200 mg/L en Cr (VI) y a partir de una solución residual de aguas de cromado diluida y estabilizada a 1200 mg/L de Cr (VI)
Los valores obtenidos de la caracterización del agua residual de la industria de cromado aparecen en la Tabla 2. Los porcentajes de remoción de Cr (VI) en un proceso discontinuo, a partir de una solución estándar de K2Cr2O7 a 1200 mg/L en Cr (VI) y a partir de agua residual de la industria de cromado, se encuentran en la Tabla 3. Los resultados de este estudio mostraron un alto porcentaje de remoción durante las primeras tres etapas. Cuando se alcanzó la tercera etapa se logró reducir considerablemente la concentración de cromo en las soluciones ensayadas, alcanzando un porcentaje de remoción mayor de 90 %. Al finalizar la última etapa, los porcentajes de remoción alcanzados fueron del 99.73 % y del 99.98 %, siendo las concentraciones finales de cromo de 3.23 mg/L y 0.18 mg/L en la solución estándar y en el agua residual, respectivamente. De acuerdo con los resultados obtenidos, los porcentajes de remoción en todas las etapas utilizando agua residual, superaron a los obtenidos en los ensayos de remoción de cromo en la muestra de agua estándar (Tabla 3), debido posiblemente a que la sustancia usada para el cromado es ácido crómico y no el dicromato de potasio, usado en la preparación de esta última solución en el presente estudio.
CONCLUSIONES
Es importante destacar que en este estudio se encontró que se puede producir quitosano a partir de los desechos industriales del camarón haciendo uso de reactivos comerciales de muy bajos costos, en reemplazo de los costosos reactivos analíticos, como una opción que sirva para estimular el manejo de los desechos industriales de este material orgánico por parte de la industria camaronera en la costa Caribe colombiana y en el país en general. De acuerdo con lo calculado, cuando se hace uso de reactivos analíticos el costo de producción de un kilogramo de quitosano es aproximadamente catorce veces más alto que cuando se hace uso de reactivos comerciales. Esto permite sugerir la implementación de estrategias que estimulen la creación de empresas de mediana capacidad que ayuden a la solución de dos graves problemas actuales en países como Colombia, como son la falta de empleos directos y la contaminación ambiental a partir de desperdicios industriales.
A pesar de que en este estudio la remoción de Cr (VI) a partir de agua residual no se pudo trabajar directamente debido a la alta concentración de este metal en ella, haciendo necesario una dilución de la muestra de aproximadamente quince veces de su concentración inicial, se observó que el quitosano obtenido del exoesqueleto del camarón desechado por la industria puede funcionar como un bioadsorbente adecuado para la remoción de Cr (VI) en este tipo de aguas. Las interferencias que se pudieron haber presentado debido a la presencia de otros metales como el cobre, el níquel y el zinc encontrados en la muestra inicial a concentraciones más bajas que el cromo, fueron eliminadas por el efecto de dilución utilizado. Sin embargo, queda todavía por resolver los efectos de matriz que se pudieron haber generado debido a la presencia de otros compuestos orgánicos e inorgánicos en la muestra y que son motivo de estudio en el laboratorio actualmente.
REFERENCIAS
1. Aguilera, M. Documentos de trabajo sobre economía regional: los cultivos de camarones en la costa Caribe colombiana. Centro de Investigaciones Económicas del Caribe Colombino. Banco de la República. Cartagena de Indias. 1998. pp. 19-38. [ Links ]
2. Parada, L.; Crespín, G.; Miranda, R.; Katime, I. Caracterización de quitosano por viscosimetría capilar y valoración potenciométrica. Rev. Iberoam. Polim. 2004. 5: 1-16. [ Links ]
3. Gamage, A.; Shahidi, F. Use of chitosan for the removal of metal ion contaminants and proteins from water. Food Chemistry. 2007. 104(3):989-996. [ Links ]
4. Pillai, C.; Paul, W.; Sharma, C.P. Chitin and chitosan polymers: Chemistry, solubility and fiber formation. Prog. Polym. Sci. 2009. 34:641-678. [ Links ]
5. Crini, G. Recent Developmments In Polysaccharide based materials used as adsorbents in wastewater treatment. Prog. Polym. Sci. 2005. 30: 38-70. [ Links ]
6. Fernandez, S. O. Physicochemical and functional properties of crawfish chitosan as affected by different processing protocols. Master of Science. Thesis, Louisiana State University. 2004. pp. 6-29. [ Links ]
7. Kurita, K. Controlled functionalization of the polysaccharide chitin. Prog. Polym. Sci. 2001. 26: 1921-1971. [ Links ]
8. Mura, P.; Zerrouk, N.; Mennini, N.; Maestrelli, F.; Chemtob, C. Development and characterization of naproxenchitosan solid systems with improved drug dissolution properties. Eur. J. Pharm. Sci. 2003. 19: 67-75. [ Links ]
9. Devlin, J. J.; Kircher, S.; Kozen,B. G.; Littlejohn, L. F.; Johnson,A. S. Comparison of chitoflex®, celoxâ¢, and quikclot ® in control of hemorrhage. J. Emerg. Med. 2011. 41(3): 237-245. [ Links ]
10. Moraetis, D.; Nikolaidis, N. P.; Karatzas, G. P.; Dokou, Z.; Kalogerakis, N.; Winkel, L. H. E.; Palaiogianni-Bellou, A. Origin and mobility of hexavalent chromium in North-Eastern Attica, Greece. Appl. Geochem. 2012. Article in Press. [ Links ]
11. Goyal, N.; Jain, S.C.; Banerjee,U.C. Comparative studies on the microbial adsorption of heavy metals. Adv. Environ. Res. 2003. 7:311-319. [ Links ]
12. Jacobs, J.A.; Testa, M.S. Overview of chromium (VI) in the environment: background and history. In: Guertin, J.; Jacobs, J. A.; Avakian,C. (Eds.). Chromium Handbook. Boca Raton, Florida. CRC Press. pp. 23-92. [ Links ]
13. Cámara Fedemetal de la ANDI. Colombia. 2008 Disponible en: www.andi.com.co/Archivos/file/ Fedemetal/CONGRESO_GALVANIZADO/Galvanizado_General_ en_Latinoam%C3%A9rica.pdf [ Links ]
14. Cañizares-Villanueva, R. Biosorción de metales pesados mediante el uso de biomasa microbiana. Rev. Latinoam. Microbiol. 2000. 42:131-143. [ Links ]
15. Wong, Y. C.; Szeto, Y. S; Cheung,W. H.; MacKay, G. Adsorption of acid dyes on chitosan-equilibrium isotherm analyses. Process Biochemistry. 2004. 39: 693-702. [ Links ]
16. Schmuhl, R.; Krieg, H. M.; Keizer,K. Adsorption of Cu(II) and Cr(VI) ions by chitosan: Kinetics and equilibrium studies. Water SA. 2001. 27(1): 1-7. [ Links ]
17. No, H. K.; Meyers, S. P. Preparation and Characterization of Chitin and Chitosan-A Review. J. Aquat. Food Prod. Technol. 1995. 4(2):27-52. [ Links ]
18. Rinaudo, M. Chitin and Chitosan: Properties and applications. Prog. Polym. Sci. 2006. 31: 603-632. [ Links ]
19. Brugnerotto, J.; Lizardi, J.; Goycoolea, F. M; Arguelles-Monal, W.; Desbrieres, J.; Rinaudo, M. An infrared investigation in relation with chitin and chitosan characterization. Polymer. 2001. 42: 3569-3580. [ Links ]
20. Baran, A.; Bicak, E.; Baysal, S. H.; Onal, S. Comparative studies on the adsorption of Cr(VI) ions on to various sorbents. Biores. Technol. 2006. 98(3): 661-665. [ Links ]
21. ASTM international. Standard test methods for chromium in water. D 1687-02. 2007: 1-7. [ Links ]
22. Boddu, V. M; Abburi, K.; Tal- bott, J. L.; Smith, E.D. Removal of Hexavalent Chromium from Wastewater Using a New Composite Chitosan Biosorbent. Environ. Sci. Technol. 2003. 37: 4449-4456. [ Links ]
23. Rich, R. L. Inorganic reactions in water. Springer. Ohio. 2007. pp. 113-151. [ Links ]