Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.41 no.2 Bogotá May/Aug. 2012
PREPARACIÓN DE CARBÓN ACTIVADO A PARTIR DE CÁSCARA DE NARANJA POR ACTIVACIÓN QUÍMICA. CARACTERIZACIÓN FÍSICA Y QUÍMICA
PREPARATION OF ACTIVATED CARBON FROM ORANGE PEEL BY CHEMICAL ACTIVATION PHYSICAL AND CHEMICAL CHARACTERIZATION
PREPARAÇÃO DE CARVÃO ATIVADO DE CASCA DE LARANJA POR ATIVAÇÃO QUÍMICA. CARACTERIZAÇÃO FÍSICA E QUÍMICA
Karen J. Peña H.1, Liliana Giraldo1,2Juan Carlos Moreno3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá, Colombia.
3 Departamento de Química, Facultad de Ciencias, Universidad de los Andes. Bogotá, Colombia.
Recibido: 28/04/2012 – Aceptado: 16/07/2012
RESUMEN
Se preparan carbones activados por pirólisis de cáscara de naranja, residuos lignocelulósicos, por activación química mediante impregnación con soluciones de ácido fosfórico a diferentes concentraciones (32 %, 36 %, 40 % y 48 % p/V), a una temperatura de 373 K y un tiempo de residencia de 3 h, presentando rendimientos alrededor del 36 %. La caracterización de la textura porosa de los carbones activados obtenidos se determina por adsorción física de N2 a 77 K. El análisis isotérmico muestra para los carbones materiales activados obtenidos áreas superficiales entre 940 y 1200 m2g-1 con características de materiales mesoporosos. El estudio mediante técnicas de equilibrio como las titulaciones tipo Boehm y la determinación del fósforo residual, así como técnicas espectroscópicas como el infrarrojo (IR) permiten observar cómo la variación en la concentración del agente activante muestra una influencia sobre la química superficial del material carbonoso a obtener.
Palabras clave: carbón activado, cáscara de naranja, adsorción física, área superficial.
ABSTRACT
Activated carbons are prepared by pyrolysis of orange peel, lignocellulosic wastes by chemical activation by impregnation with phosphoric acid at different concentrations (32 %, 36 %, 40 % and 48 % w/V), at a temperature of 373 K and a time residence of 3 h, showing about 36 % yield. The characterization of the porous texture of the activated carbons obtained is determined by physical adsorption of N2 at 77 K, the isothermal analysis sample to the activated carbons obtained surface areas between 940 and 1200 m2g-1 with characteristics of mesoporous materials. The study by equilibrium techniques such as: the titrations type Boehm and determination of residual phosphorus, and spectroscopic techniques such as infrared (IR) can observe how variation in the concentration of activating agent shows an influence on surface chemistry of the carbonaceous material to obtain.
Key words: Activated carbon, orange peel, physical adsorption, surface area.
RESUMO
Carbonos ativados foram preparados a partir da pirólise de casca de laranja, resíduos lignocelulósicos, por activação química mediante impregnação com soluções de ácido fosfórico em diferentes concentrações (32 %, 36 %, 40 % e 48 % p/V), a uma temperatura de 373 K e um tempo de residência de 3 h, mostrando cerca de 36 % de rendimento. A caracterização porosa textural dos carbonos ativados obtidos foi determinada por adsorção física de N2 a 77 K, e a análise isotérmica apresenta para os materiais obtidos, áreas superfíciais entre 940 e 1200 m2g-1 caracterizando materiais mesoporosos. A partir de estudos por meio de técnicas de equilíbrio, tais como titulações tipo Boehm e determinação de fósforo residual, e técnicas espectroscópicas tais como infravermelho (IR) puderamse observar como a variação na concentração de agente de ativação apresenta uma influência sobre a química superfícial do material carbonoso obtido.
Palavras-chave: Carvão ativado, casca de laranja, adsorção física, área da superfície.
INTRODUCCIÓN
La adsorción es un método interesante para la eliminación de compuestos orgánicos y metales de medios acuosos contaminantes, debido a la alta eficiencia y el fácil manejo de los materiales adsorbentes utilizados; por ello la atención industrial se ha enfocado en las últimas décadas en la síntesis y el desarrollo de carbonizados de bajo costo, pero con propiedades texturales adecuadas para usos ambientales.
El carbón activado es el adsorbente más versátil y comúnmente usado debido a su alta área superficial y volumen de poro, alta capacidad de adsorción, con cinética rápida, y relativamente fácil regeneración (1), se trata de un grupo de materiales preparados mediante reacción de un material carbonizado con gases oxidantes o mediante la carbonización de un material lignocelulósico impregnado con agentes químicos deshidratantes (2- 4). En el presente estudio el material lignocelulósico escogido para la obtención de carbón activado es la cáscara de naranja, debido a que Colombia tiene una actuación marginal como productor de cítricos en el mundo, esto causado por el aumento de las importaciones en forma acelerada y el decrecimiento de las exportaciones, manteniendo el sector en déficit comercial (5); por ello es importante sacar el máximo provecho no solo utilizando la proporción más significativa de la producción de cítricos que se destina a actividades de transformación, como los jugos y las mermeladas (6), sino aprovechar la cantidad considerable de residuos de la piel generados en la producción de carbón activado, un descontaminante de amplia gama.
Los carbones activados estructuralmente están formados por capas, dejando unos espacios que corresponden a los poros y que, consecuentemente, se considera que tienen forma de rendija (2). Según la International Union of Pure and Applied Chemistry, IUPAC, los poros se clasifican en tres grupos principales: microporos, con dimensiones inferiores a 2 nm; mesoporos, con dimensiones entre 2 nm y 50 nm; y macroporos con dimensiones superiores a los 50 nm (4).
Al igual que la porosidad de los carbones activados, la caracterización de la química superficial es importante debido a la influencia que esta tiene sobre las propiedades adsorbentes; dichas propiedades estarán limitadas por los grupos superficiales originados en el proceso de carbonización, los cuales se producen a partir de los radicales libres insaturados de la superficie del carbón que pueden quimisorber oxígeno.
La adsorción física de gases y vapores en sólidos es una de las técnicas más usadas para el estudio de la textura porosa de sólidos de todo tipo. La ecuación utilizada generalmente para calcular el área superficial específica es la propuesta por Brunauer-Emmet y Teller, mientras que la microporosidad se determina por la teoría de llenado de microporos propuesta por Dubinin, que se basa en la teoría del potencial de Polanyi.
En este trabajo se describe la preparación de carbones activados mediante la activación química de cáscara de naranja, usando como agente activante soluciones de H3PO4 de diferentes concentraciones entre 32 % y 48 %. La caracterización superficial de estos materiales se evalúa por adsorción física de gases, y los resultados que se encuentran en la adsorción se comparan con otras de las propiedades superficiales que presentan los sólidos porosos obtenidos.
MATERIALES Y MÉTODOS
Síntesis de carbón activado
Se seleccionan, se secan y trituran las cáscaras de naranja hasta lograr un diámetro de 2 mm, posteriormente se realiza la activación química con ácido fosfórico a 32 % (muestra denominada CAN- 32), 36 % (CAN-36), 40 % (CAN-40) y 48 % (CAN-48) a 373 K por 2 horas. Finalmente se carboniza en un horno horizontal Carbolite, en atmósfera inerte, a una velocidad de calentamiento de 3 K min-1 hasta una temperatura máxima de 723 K por un tiempo de 2 horas.
Caracterización
Determinación de isotermas de adsorción
La porosidad del material carbonoso se evalúa mediante la determinación de isotermas de adsorción de N2 a 77 K en un equipo convencional volumétrico, Autosorb 3B, Quantachrome.
Determinación de grupos funcionales
Método de Boehm
La caracterización de los grupos funcionales de superficie se realiza mediante titulación ácido-base por el método de Bohena, para determinar la acidez y la basicidad total del carbón activado (7).
Se pesa aproximadamente 1 g del sólido y se adiciona a un frasco de vidrio con 50 m de solución de hidróxido de sodio, NaOH, 0,1 M o con 50 mL solución de ácido clorhídrico, HCl, 0,1 M, según la determinación. Las soluciones se agitan mecánicamente y se mantienen a 298 K, durante 5 días. Alícuotas de 10 mL de las soluciones se titulan con la solución estándar de hidróxido de sodio o ácido clorhídrico según sea el caso; el pH de la solución se mide con un pH meter CG 840B Schott.
Espectroscopia infrarroja
Se prepara una dispersión al 1 % de la muestra finamente dividida con bromuro de potasio, también en polvo fino y bien seco; una vez la mezcla se homogeniza se comprime en un molde, hasta lograr una tableta transparente que se coloca en un soporte y se somete al examen en el espectrofotómetro en un equipo Nicolet Impact 410 FT-IR con una celda de reflectancia difusa.
Determinación de fósforo residual (8)
Preparación de reactivo vanadatomolibdato
-Solución A: se disuelven aproximadamente 40 g de molibdato de amonio (NH4)6Mo7O24 * 4H2O, en 300 mL de agua destilada en ebullició
-Solución B: se disuelven aproximadamente 2 g de metavanadato de amonio NH4VO3 en 300 mL de agua destilada en ebullición, se adicionan 460 mL de ácido perclórico HClO4 67 %.
Se mezclan la solución A y la solución B, llevando a un volumen de 2 L.
Tratamiento de la muestra
Se trituran aproximadamente 0,3 g de la muestra de carbón activado con 7,5 mL de ácido nítrico HNO3 en un balón Kjeldahl, llevando a ebullición por 40 min. Se enfría y se adicionan 5 mL de ácido clorhídrico HCl; vuelve a calentarse suavemente la solución hasta que desaparece el color cuidando de que no llegue a sequedad. Se toman 10 mL de la mezcla de digestión, se adicionan 20 mL del reactivo (vanadomolibdato) y se llevan a un volumen de 100 mL; se agita la solución y se deja en reposo a temperatura ambiente durante 10 min. La concentración de fósforo en las soluciones se determinó con un equipo espectrofotométrico UVVis Milton Roy Co. Spectronic Genesys SN a 353 nm.
RESULTADOS Y DISCUSIÓN
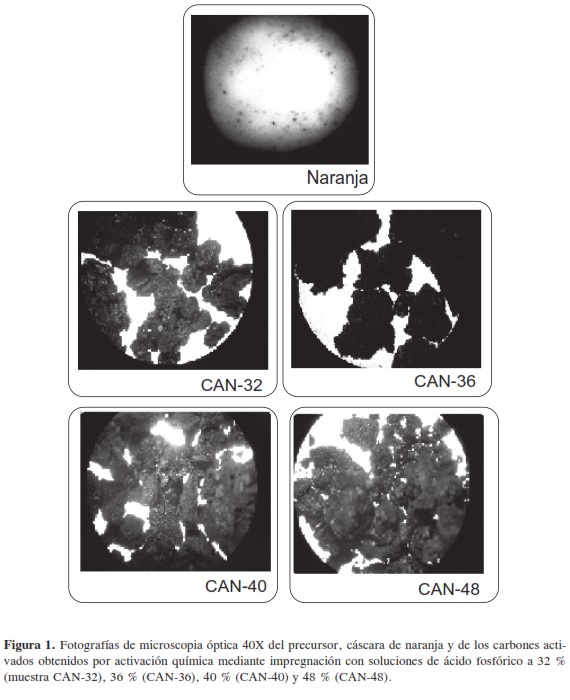
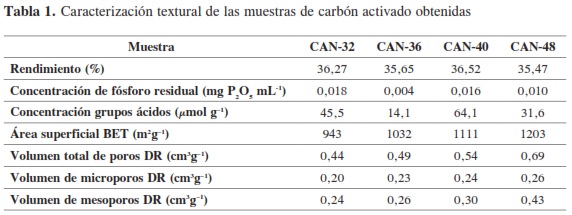
Al someter las cáscaras de naranja al tratamiento de activación se logra obtener los carbones activados que se presentan en la Figura 1, que muestra fotografías tomadas en un microscopio óptico Olympus CH-2 con un aumento de 40X. En la figura se presentan la cáscara de naranja, un trozo de aproximadamente 3 cm por 4 cm, y los carbones activados en partículas de alrededor de 2 mm, para las cuales se observa la rugosidad y macroporosidad que se desarrolla en el material lignocelulósico por acción del agente químico activante. Los carbones activados obtenidos en este trabajo son de tipo granular. Los rendimientos obtenidos se encuentran alrededor del 36 % y una concentración de fósforo residual alrededor de 0,01 mg P2O5 mL-1, que se presentan para cada carbón activado en la Tabla 1.
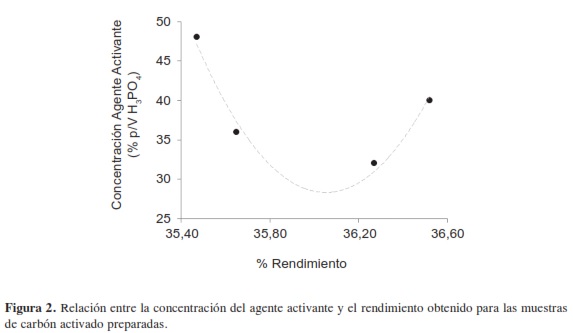
La correlación entre la concentración del agente activante y el rendimiento, que se presenta en la Figura 2, muestra que se consigue el porcentaje más alto de este último para solución con concentración del 40 % p/V H3PO4, y el menor porcentaje de rendimiento para la solución de mayor concentración del 48 % p/V H3PO4, distribución que puede estar asociada con el fósforo residual en los sólidos; en la figura se insinúa con una línea gris punteada dicha distribución.
Concentración Agente Activante
El porcentaje de rendimiento en los carbones activados varía entre 35,47 y 36,52, y se obtiene al relacionar el peso del material precursor y el peso del sólido poroso obtenido al final del proceso; como en la preparación de los carbones activados la condición experimental diferente es la concentración de la solución de H3PO4, entre 32 % y 48 %, se observan valores de porcentaje de rendimiento similares, con una diferencia del 1,05 % que se debe a la salida de compuestos volátiles de la estructura. Los valores obtenidos para el rendimiento son comparables con valores reportados en la literatura (2).
Las muestras obtenidas son caracterizadas por adsorción física de N2 en condiciones isotérmicas determinando así el área superficial (ver Tabla 1) mediante la aplicación modelo propuesto por Brunauer- Emmet y Teller, que se basa en la medida de sucesivos volúmenes de gas adsorbido sobre la superficie interna de los poros del sólido a la vez que se mide la presión del gas hasta lograr la saturación de la superficie (9). El volumen de microporos se calcula aplicando la teoría de llenado planteada por Dubinin, propuesta que está basada en la teoría del potencial de Polanyi, la cual supone la condensación del gas en los microporos en capas equipotenciales.
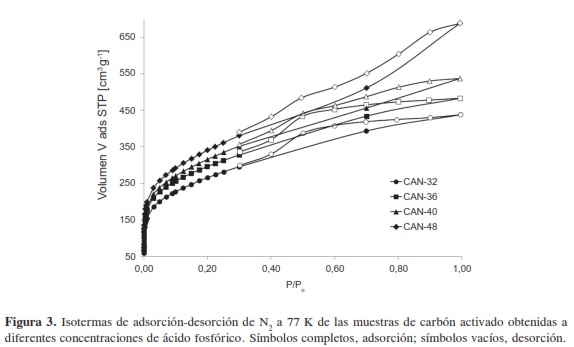
Las isotermas de adsorción de N2 a 77 K de los carbones activados obtenidos, se presentan en la Figura 3, con un comportamiento tipo IV según la clasificación IUPAC (10). Estas isotermas demuestran que el mecanismo de adsorción es distinto al de desorción, comportamiento evidenciado por la presencia de un ciclo de histéresis que muestra que al llegar a presiones medias se inicia un nuevo proceso de adsorción correspondiente a la condensación capilar en los mesoporos del material.
El ciclo de histéresis generado presenta una meseta a presiones relativamente altas. En la rama de adsorción se observa una pendiente cerca de la saturación que se va acrecentando entre una muestra y otra, lo que indica un aumento en la afinidad adsorbente-adsorbato correlacionada con el incremento de la concentración del agente activante. Los tipos de histéresis observados corresponden a un ciclo tipo H4, el cual suele asociarse a poros estrechos en forma de hendidura (10).
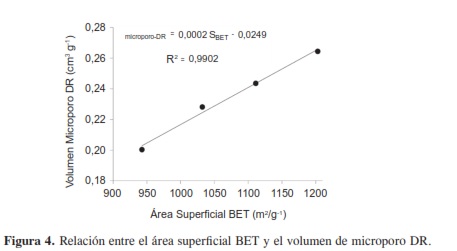
El mayor valor de área superficial obtenido pertenece a la muestra activada con la solución del 48 % p/V de H3PO4, siendo esta de 1203 m2g-1, mostrando paralelamente un mayor tamaño de microporo (0,26 cm3g-1) y mesoporo (0,43 cm3g-1); si se correlacionan el área superficial y el volumen de microporo de todas las muestras, se observa una tendencia lineal con un coeficiente de 0,9902 como se muestra en la Figura 4, indicando que el desarrollo de mayor área superficial exhibe mayor tamaño de microporos.
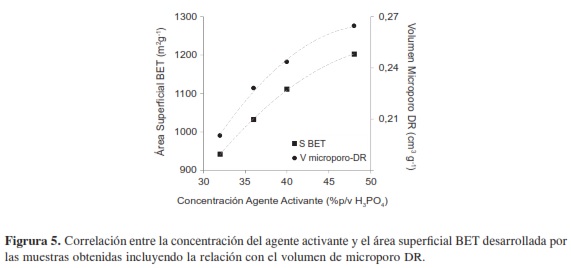
El aumento de la concentración de agente activante por tanto no solo desarrolla en las muestras una mayor área superficial, sino además una tendencia similar en cuanto al volumen de microporo, como se observa en la Figura 5. Este comportamiento se puede comparar con otros trabajos (11) en los que se muestra que al aumentar la cantidad de agente activante se aumentan los valores de las propiedades superficiales porque se presenta una mayor interacción con el precursor lignocelulósico, desarrollando una mayor porosidad.
La caracterización de los grupos ácidos superficiales de las muestras de carbón activado obtenido por el método de Boehm evidenció que la mayor cantidad de grupos ácidos desarrollados no necesariamente son pertenecientes a la muestra con el valor más alto de área superficial, lo que es interesante al comparar si el mecanismo de adsorción de diferentes compuestos contaminantes se ve favorecido termodinámicamente por las características ácidas de los grupos funcionales en la superficie o cinéticamente por el área específica de la muestra (12).
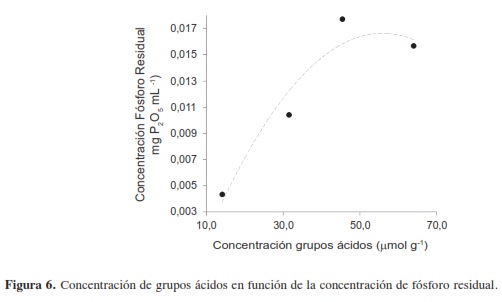
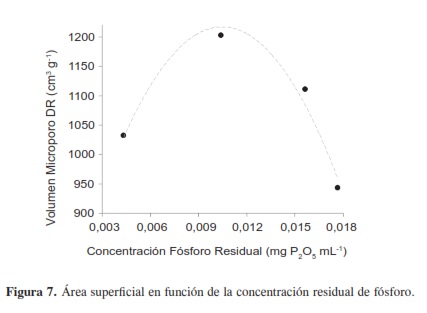
En la Figura 6 se puede observar que los grupos ácidos desarrollados en las diferentes muestras aumentan con la concentración de fósforo residual que, se asume, es procedente del agente activante; adicionalmente se observa que existe una concentración de fósforo residual en la cual se desarrolla una mayor área superficial (Figura 7).
La siguiente zona representa la tensión C-H, la cual aparece en el precursor pero no es muy representativa para las muestras obtenidas, posiblemente por el nuevo esqueleto carbonado formado. La banda en la zona (F) alrededor de 1800 cm-1 indica que los grupos funcionales detectados en la zona (B) del precursor son bandas propias de grupos metilos, y sus desdoblamientos de bandas de absorción de flexión simétrica indican la unión a más átomos de carbono (12).
Las banda alrededor de 2300 cm-1, zona (C), son propias de las vibraciones de tensión asimétrica de la molécula de CO2, no de gran interés en este estudio.La zona (D) en 1720 cm-1 representa el grupo > C = O propio de ácidos carboxílicos sustituidos, por ello se observa una ausencia en las muestras obtenidas contrario al precursor, esto debido a que a medida que aumenta la temperatura de calcinación los carboxilos presentes se disocian gradualmente; sin embargo, aquellos grupos > C = O pertenecientes a amidas poseen temperaturas de disociación mayores, por lo que es posible observar absorciones en la zona (E), que son vibraciones de banda I; no obstante dicha banda también se puede deber a grupos C = C de aromáticos.
La absorción alrededor de 1100 cm-1 es propia del estiramiento asimétrico del enlace C-O; esta banda posee una intensidad mayor comparada con las muestras preparadas, posiblemente proporcionada por la presencia de los polímeros de pectina (zona [G]).
El material precursor, además de lo mencionado, contiene una cantidad significativa de materia inorgánica, compuestos principalmente de calcio (15) que presentan absorción a 600 cm-1, zona (H), y que a temperaturas de pirólisis se descomponen, evidenciado en la desaparición de estas bandas en los respectivos espectros de las muestras. En esta zona no es muy apreciable la presencia del fósforo residual, puesto que el orden de concentración encontrado para este no supera el límite de detección del equipo.
CONCLUSIONES
Se prepararon carbones activados mediante la pirólisis de cáscara de naranja y activación química por impregnación con soluciones de ácido fosfórico a diferentes concentraciones, obteniendo un rendimiento máximo del 36,52 %, correspondiente a la muestra activada con la solución del 40 %, CAN-40. Las isotermas de N2 obtenidas a 77 K permiten conocer que estos carbones desarrollan áreas superficiales BET entre 940 y 1200 m2g-1, esta última desarrollada por la muestra CAN-48 y con características de mesoporosidad, con ciclos de histéresis tipo H4.
El incremento en la concentración de la solución de ácido fosfórico, agente activante, desarrolla en las muestras una mayor área superficial y una tendencia similar en cuanto al volumen de microporo; además de ello tiene una influencia sobre la química superficial del material carbonoso, presentando variaciones en la cantidad de grupos ácidos, los cuales fueron caracterizados por espectroscopia infrarroja y no solo afirman la acidez propia de los carbones activados preparados, si no también permiten observar los cambios que se llevaron a cabo por acción de la carbonización.
AGRADECIMIENTOS
Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia, y al Acta de Acuerdo entre los departamentos de Química de las dos universidades. Se agradece a la Dirección de Investigación Sede Bogotá (DIB) de la Universidad Nacional de Colombia, proyecto 15287.
REFERENCIAS
1. Tongpoothorn, W.; Sriuttha, M.; Homchan, P.; Chanthai, S.; Ruangviriyacha, C. Preparation of activated carbon derived from Jatropha curcas fruit shell by simple thermochemical activation and characterization of their physico-chemical properties. Chemical Engineering Research and Design. 2010. 89(3):335-340. [ Links ]
2. Rodríguez-Reinoso, F. El carbón activado como adsorbente universal. En: Sólidos porosos: preparación, caracterización y aplicaciones. Bogotá. Ediciones Uniandes. 2007. pp. 1-42. [ Links ]
3. Rodríguez Reinoso, F. Adsorción de amoniaco y aminas alifáticas en carbones activados en descontaminación ambiental mediante adsorbentes. En: Descontaminación ambiental mediante adsorbentes. Madrid. CYTED. 2005. pp. 145-164. [ Links ]
4. Rouquerol, F.; Rouquerol, J.; Sing, K. Adsorption by powders and porous solids, principles, methodology and applications. London. Academic Press. 1999. pp. 18-20. [ Links ]
5. Espinal, C. La cadena de cítricos en colombia una mirada global de su estructura y dinámica. Ministerio de Agricultura y Desarrollo Rural Observatorio Agrocadenas Colombia. 2005. Documento de Trabajo N. [ Links ]
6. Rosas, J. M.; Bedia, J.; Rodríguez-Mirasol, J.; Cordero, T. On the preparation and characterization of chars and activated carbons from orange skin. Fuel Processing Technology. 2010. 91(10): 1345-1354. [ Links ]
7. Rodríguez Reinoso, F.; Molina Sabio, M. Role of chemical activation in the development of carbon porosity. Colloids and Surfaces A: Physicochem. Eng. Aspects. 2004. 241: 15-25. [ Links ]
8. American Public Health Association; Water Works Association; Water Pollution Control Federation. Standard Methods for the Examination of Water and Wastewater. Washington, D.C. American Public Health Association. 1985. pp. 445-446. [ Links ]
9. Bansal Chand, R.; Goyal, M. Adsorption Isotherm Equations. Actived Carbon Adsorption. New York. Taylor y Francis. 2005. pp. 77-112. [ Links ]
10. Martín Martínez, J. M. Porosidad de carbones I. Distribuciones de tamaños de poros. Histéresis a baja presión. En: Adsorción física de gases y vapores por carbones. Alicante. Publicaciones Universidad de Alicante. 1990. pp. 1-109. [ Links ]
11. Molina-Sabio, M.; Almansa C.; Rodríguez-Reinoso, F. Phosphoric acid activated carbon discs for methane adsorption. Carbon. 2003. 41:2113-2119. [ Links ]
12. Rodríguez, P.; Giraldo, L.; Moreno, J. Nickel (II) Ion Adsorption onto Activated Carbon. Relationship Between Physicochemical Properties and Adsorption Capacity. Adsorption Science Technology. 2011. 29 6: 541-551. [ Links ]
13. Gálvez, H. Evaluación del comportamiento de la piedra caliza con diferente contenido de carbonato de magnesio (MgCO3) a través del proceso de calcinación a 850 °C y 640 mmHg en la obtención de cal viva mediante la determinación de la densidad aparente (ASTM 188-95). Ing. Qco. Tesis, Universidad de San Carlos de Guatemala. 2003. [ Links ]
14. Shin, S.; Jang, J.; Yoon, S.H.; Mochida, I. A study on the effect of heat treatment on functional groups heat treatment on functional groups of pitch based activated carbon fiber using FTIR. Carbon. 1997. 35:1739-1743. [ Links ]
15. Márquez-Montesinos, F.; Cordero, T.; Rodríguez-Mirasol, J.; Rodríguez-Mirasol J.; Rodriguez J.J. CO2 and steam gasification of a rgrapefruit skin char. Fuel. 2002. 81: 423-429. [ Links ]