Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.41 no.3 Bogotá Sept./Dec. 2012
Reducción de la biohidrogenación del ácido linoleico y alfa linolénico por la adición de diferentes proporciones de ácido eicosapentaenoico y docosahexaenoico
Reduction of the biohydrogenation of linoleic and alpha-linolenic acid by addition of different proportions of eicosapentaenoic acid and docosahexaenoic acid
Redução da bio-hidrogenação do ácido linoleico e alfa-linolênico pela adição de diferentes proporções de ácido eicosapentaenóico e docosahexaenóico
Julián A. Castillo1, Martha Olivera2, Martha L. Pabón1,Juan E. Carulla1,3
1Universidad Nacional de Colombia, Facultad de Medicina Veterinaria y de Zootecnia, Departamento de Producción Animal, Carrera 30 No. 45-03, Bogotá, D.C., Colombia.
2Universidad de Antioquia, Facultad de Ciencias Agrarias, Carrera 75 No. 65-87, Ciudadela Robledo, Medellín, Colombia.
Recibido: 31/10/12 - Aceptado: 13/12/12
RESUMEN
Se evaluó el efecto de la adición de ácido docosahexaenoicoe (DHA) y eicosapentaenocio (EPA) a una mezcla de ácido linoleico (ALi) y alfa-linolénico (ALn), sobre su biohidrogenación, en fluido ruminal in vitro. A 500 mg de kikuyo, se agregaron 18 µL de una mezcla de ALi:ALn (75:25) (Control) o una mezcla de 14,9 µL ALi:ALn (75:25) con 3,1 µL de una mezcla que contenía cuatro relaciones de DHA:EPA (100:0, 75:25, 25:75, 0:100). El kikuyo sin adición de ácidos grasos (AG) (Control negativo) o con adición de estos, fue incubado con fluido ruminal por triplicado, durante 0, 5 o 16 horas, en tubos de 50 mL. Los lípidos del material incubado fueron extraídos, metilados y analizados para AG por CG-FID. Las concentraciones relativas (g/100 g AG) de los AG incubados y los principales productos de la isomerización y biohidrogenación se compararon mediante un modelo completamente al azar, usando el PROC GLM de SAS. La concentración relativa de ALi y ALn disminuyó con el tiempo de incubación, pero no fue diferente entre tratamientos con EPA y DHA a las 16 horas. La adición de DHA y EPA puros o en mezclas disminuyó la concentración relativa de C18:0 (P < 0,01) e incrementó la de C18:1 trans-11 (ATV) (P < 0,01) y C18:2 trans-11, cis-15 (P < 0,01) (ALC), mientras que los cambios en la concentración relativa del C18:2 cis-9, trans-11 no fueron claros. Los resultados sugieren que la acción inhibitoria del EPA y DHA ocurre en los pasos finales de la biohidrogenación del ALi y del ALn.
Palabras clave: ácido linoleico conjugado, ácido trans-vaccénico, fluido ruminal, in vitro.
ABSTRACT
The effect of adding docosahexaenoic (DHA) and eicosapentaenoic acid (EPA) on the in vitro biohydrogenation of linoleic (ALi) and alpha-linolenic acid (ALn) using ruminal fluid was evaluated. To 500 mg of kikuyo, 18 µL of a mixture of ALi:ALn (75:25) (Control) or a mixture of 14,9 µL ALi:ALn (75:25) and 3,1 µL of a mixture containing four ratios of EPA:DHA (100:0, 75:25, 25:75, 0:100) were added. In 50 mL tubes, kikuyo without fatty acids (FA) (negative control) or with their addition was incubated with ruminal fluid by triplicate during 0, 5 or 16 hours. Lipids in the incubated material were extracted, methylated and fatty acids were quantified by GC-FID. Relative concentrations (g/100 g FA) of incubated fatty acids and their main isomerization and ruminal biohydrogenation products were compared by a completely randomized model using PROC GLM of SAS. The relative concentration of ALi and ALn decreased with incubation time but was not different between EPA and DHA treatments at 16 hours. Addition of EPA and DHA, pure or in mixtures, decreased the relative concentration of C18:0 and increased the relative concentration of C18:1 trans-11 (TVA) (P<0,01 ) and C18:2 trans-11, cis-15 (P<0,01), while changes in the relative concentration of C18:2 cis-9, trans-11 (CLA) were not clear. Our results suggest that EPA and DHA inhibit the final steps of ruminal biohydrogenation of ALi and ALn.
Key words: conjugated linoleic acid, trans-vaccenic acid, ruminal fluid, in vitro.
RESUMO
Foi avaliado o efeito da adição do ácido docosahexaenóico (DHA) e eicosapentaenóico (EPA) a uma mistura de ácido linoleico (ALi) e linolênico (ALn) sobre à sua biohidrogenação, em fluido ruminal in vitro. Foram adicionados, a 500 mg de kikuio, 18 µL de uma mistura de ALi:ALn (75:25) (Controle) ou uma mistura de 14,9 µL ALi:ALn (75:25) com 3,1 µL de quatro relações de EPA:DHA (100:0, 75:25, 25:75, 0:100). O kikuio sem adição de ácidos graxos (AG) (Controle negativo) ou com adição destes foi incubado com fluido ruminal por triplicata durante 0, 5 ou 16 horas, em tubos de 50 mL. Os lipídeos do material incubado foram extraídos, metilados e analisados para AG por CG-FID. As concentrações relativas (g/100 g AG) dos AG incubados e dos principais produtos da isomerizacão e biohidrogenação ruminal foram comparados por meio de um modelo completamente ao acaso, utilizando o PROC GLM do SAS. A concentração relativa de ALi e ALn diminuiu com o tempo de incubação, mas não foi diferente entre tratamentos com EPA e DHA às 16 horas. A adição de EPA e DHA puros ou em misturas diminuiu a concentração relativa de C18:0 e incremento ua presencia da C18:1 trans-11 (ATV) (P<0,01) e C18:2 trans-11, cis-15 (P<0,01), en quanto que a concentração relativa do C18:2 cis-9, trans-11 (ALC) a presentou um comportamento errático. Os resultados sugerem que a adição inibitória do EPA e DHA acontece nos estágios finais da biohidrogenação ruminal de ALi e ALn.
Palavras-chave: ácido linoleico conjugado, ácido trans-vaccênico, fluido ruminal, in vitro.
INTRODUCCIÓN
Los microorganismos ruminales hidrogenan e isomerizan los ácidos grasos poliinsaturados presentes en forrajes y alimentos de la dieta de los rumiantes (1, 2, 3). Los principales ácidos grasos poliinsaturados (AGPI) en los forrajes son el ácido linoleico (ALi, C18:2 cis-9,cis-12) y el ácido alfa-linolénico (ALn, C18:3 cis-9, cis-12, cis-15) (1, 2). Las principales rutas de reducción de estos ácidos se han estudiado ampliamente (1, 2). En el rumen, el ALi inicialmente se isomeriza a ácido linoleico conjugado (ALC, C18:2 cis-9, trans-11), que es biohidrogenado a ácido trans-vaccénico (ATV, C18:1 trans-11) y este se satura hasta ácido esteárico (C18:0). El ALn se convierte inicialmente en ácido octadecatrienoico (C18:3 cis-9, trans-11, cis-15) y es posteriormente transformado a ácido trans-11, cis-15 octadecadienoico (C18:2 trans-11, cis-15) que es reducido a ATV y finalmente a C18:0 (1).
La proporción de los intermediarios y los productos finales de la biohidrogenación (BH) del ALi y del ALn, determina hasta cierto punto el perfil de ácidos grasos en la leche y la carne de los rumiantes (4, 5, 6), por lo cual en los últimos años se ha hecho un gran esfuerzo en estudiar los factores que la determinan. Por ejemplo, el ATV condiciona en gran medida la concentración de ALC en la leche (7, 8, 9), compuesto bioactivo benéfico para la salud humana (7, 8).
Como lo muestran algunos trabajos en vacas (10, 11, 12) y en ovejas (13), la síntesis del ALC y ATV en el rumen puede ser afectada por la suplementación con aceites vegetales y aceites de pescado. Los aceites de pescado pueden incrementar hasta en un 300 % la concentración ATV en el rumen y por tanto, de ALC en la leche (14) y se sugiere que esto se debe principalmente a la disminución en la hidrogenación del ATV a C18:0, debido a la presencia del ácido cis-4, cis-7, cis-10, cis-13, cis-16, cis-19 docosahexaenoico (DHA) y del ácido cis-5, cis-8, cis-11, cis-14, cis-17 eicosapentaenoico (EPA) (por sus siglas en inglés) (15, 16, 17). Algunos autores sugieren que el DHA es más eficiente en inhibir la reducción del ATV a esteárico que el EPA (17, 18, 19), mientras otros reportan lo contrario (20).
Aunque existe un número amplio de trabajos en los cuales se ha evaluado el efecto de los aceites de pescado, EPA o DHA en combinación con aceites vegetales, sobre la concentración de ALC y ATV en la leche y el fluido ruminal (17, 21, 22), no se han realizado estudios que determinen el efecto de la adición de diferentes proporciones de EPA y DHA a una mezcla con una proporción mayor de ALi que de ALn. La proporción de intermediarios metabólicos de la BH del ALi y ALn podría contribuir a explicar el efecto del EPA y DHA sobre la BH en el rumen.
En el presente trabajo se evaluó el efecto de la combinación de diferentes relaciones de EPA:DHA y una relación de ALi:ALn de 75:25, sobre la proporción de los principales intermediarios y productos de la BH del ALi y ALn en fluido ruminal, en un sistema in vitro.
MATERIALES Y MÉTODOS
Todos los procedimientos fueron aprobados por el Comité de Bioética de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, sede Bogotá.
Tratamientos e incubación
Muestras de pasto kikuyo (Pennisetum clandestinum) de 60 días de rebrote se cosecharon mediante la metodología de Hand Plucking (23) en la finca El Recuerdo del municipio de Sopó (Cund.). Las muestras de forraje se secaron a 60 °C por 48 h en un horno de ventilación forzada, se molieron en un molino de cuchillas (Romer) con una criba de 1 mm, y posteriormente se tamizaron seleccionando partículas con un tamaño menor de 650 µm.
El fluido ruminal se obtuvo de un novillo Normando fistulado después de un ayuno de 12 horas. El fluido se filtró a través de cuatro capas de gasa y se colocó en un termo precalentado a 39 °C. Se transfirió a embudos de separación y se gaseó con CO2, recuperándose la fase intermedia. El fluido ruminal se mezcló con buffer McDougall (pH 6,9) (24) en proporción 1:4, se gaseó con CO2 y se mezcló con úrea (1g/L buffer), constituyendo el inóculo.
En tubos plásticos de 100 mL, se agregaron 500 mg de kikuyo seco y tamizado y 18 µL de mezclas ALi:ALn (75:25) (Control) o en combinación con diferentes proporciones de DHA:EPA (100:0, 75:25, 25:75, 0:100), a los cuales se les adicionó 50 mL de inóculo precalentado a 39°C, se gaseó con CO2, se sellaron con válvulas de Bunsen provistas de un orificio y se colocaron en un baño de maría a 39 °C (Blue Sland Illinois, USA) (25). Los tubos se agitaron manualmente cada 2 horas. Como control negativo, se incubó el forraje sin adición de ácidos grasos. Los tiempos de incubación para los tratamientos evaluados fueron de 0,5 o 16 horas (26, 27, 28). Cada serie de incubación estaba conformada por 18 tubos (6 tratamientos). Las corridas se realizaron por triplicado para cada tratamiento y tiempo de incubación (17, 19, 29). Luego de los tiempos señalados, las incubaciones se detuvieron agregando 500 µL de HgCl2 al 2 % y se colocaron los tubos en un baño de hielo (29). El contenido de los tubos fue congelado a -60 °C, liofilizado (CristAlpha 1-4 LO plus), y almacenado hasta su análisis.
Forraje
Se determinó proteína cruda (PC) (984,13), cenizas (Cen) (942,05), extracto etéreo (EE) (930,09) (30), fibra en detergente neutro (FDN) y fibra en detergente ácido (FDA) (31). La composición de ácidos grasos del forraje se estableció usando la técnica propuesta por Garcés y Mancha (32), con una modificación de Yamasaki et al.(33) (Tabla 1).
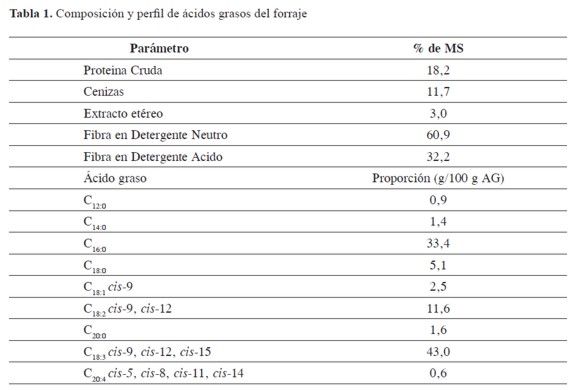
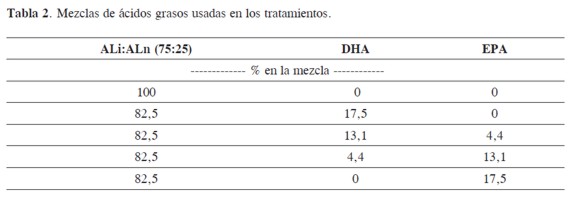
Para el experimento se usó ALi, ALn, EPA y DHA (90% de pureza, Nu-Check Prep Inc.) los cuales se mezclaron en proporciones diferentes, y se determinó su composición usando Meth-Prep® y análisis por CG-FID (Tabla 2).
COMPOSICIÓN DE ÁCIDOS GRASOS
La composición de ácidos grasos para el forraje y fluido ruminal liofilizado se determinó mediante la técnica propuesta por Garcés y Mancha (32), con una modificación de Yamasaki et al. (33): se pesaron 50 mg de forraje seco o fluido ruminal liofilizado, los cuales se transfirieron a tubos tapa rosca de 16 x 160 mm, agregándose 2148 µL de metanol, 990 µL de tolueno, 66 µL de ácido sulfúrico al 99,9 % y 1000 µL de dimetilsulfóxido (Merk®). A continuación se agregaron 2 mL de hexano (Merk®), se sellaron, y se introdujeron en un baño termostatado a 80 °C durante 2 horas. Posteriormente, se recuperó el hexano y se evaporó en corriente de nitrógeno. El residuo obtenido se redisolvió en 250 µL de diclorometano (Merk®) y se analizó por CG-FID.
La concentración de ácidos grasos del forraje, las mezclas de ácidos grasos y el fluido ruminal liofilizado se analizaron usando un cromatógrafo de gases Shimadzu GC-2014, equipado con un automuestreador AOC-20i y un detector de ionización en llama. En la separación de los esteres metílicos se usó una columna Restek 2560 (100 m x 0,25 mm d.i, 0,2 µm). Para la identificación de los ácidos grasos, se empleó una mezcla de ésteres metílicos (Nu-CheckPrep, Elysian, MN, No. GLC-603). El volumen de inyección fue de 1,0 µL, con una relación Split 30:1. Como gas de arrastre se usó He 5,0 a una velocidad de 1,12 mL/min. La temperatura del inyector y del detector fueron de 260 y 270 °C, respectivamente, y la del horno fue programada a un valor inicial de 140 °C por 5 minutos, la cual se incrementó a 4 °C/min durante 5 minutos más, hasta una temperatura de 220 °C, y se aumentó posteriormente a 2,0 °C/min durante 10 minutos, hasta una temperatura final de 240 °C.
Análisis estadístico
Para cada tiempo de incubación, las proporciones de ácidos grasos de 18 carbonos fueron comparadas entre los tratamientos evaluados mediante un modelo completamente al azar, usando el PROC GLM de SAS, versión 9.0 (34). La comparación de medias se realizó mediante una prueba de Tukey a una significancia del 5 %.
RESULTADOS Y DISCUSIÓN
Efecto de la adición de EPA y DHA sobre la cinética de biohidrogenación del ALi y ALn, y de sus intermediarios y productos
La adición de EPA y DHA aumentó la proporción de ALi y ALn en el fluido ruminal, independientemente del tiempo de incubación o del tratamiento (P < 0,01) (Tabla 3). Algunos autores han sugerido que el DHA y el EPA pueden inhibir los procesos de BH (17). Si esta inhibición se da en los primeros pasos de la BH, las proporciones de ALi y ALn en los tratamientos con DHA y EPA deberían ser mayores en aquellos tratamientos que contienen estos ácidos al aumentar los tiempos de incubación, lo cual no fue evidente en este ensayo. Por otro lado, las concentraciones de C18:0 fueron menores para los tratamientos con DHA y EPA comparado con aquel que solo contenía la mezcla ALi:ALn (75:25) y aquel que no contenía ácidos grasos (P <0,01) (Tabla 3). Esto implica que efectivamente estos dos ácidos inhiben la BH, pero que esta se da en los pasos intermedios de la ruta metabólica y no en el inicio. De los principales intermediarios de ALi y ALn, se observó que el ATV se acumulaba con el tiempo, con la adición de EPA y DHA, mientras que el efecto no era claro para el ALC. Por último, el C18:2 trans-11, cis-15 (intermediario en la BH del ALn) se acumulaba con la adición de EPA pero no de DHA. Los resultados anteriores sugerirían que la inhibición de la BH del ALi y el ALn por el EPA y el DHA ocurre principalmente en el paso de ATV a C18:0, aunque el EPA tendría también un efecto inhibitorio sobre la BH del C18:2 trans-11, cis-15. Estos resultados son similares a lo reportado por otros autores, que sugirieron que tanto el DHA como el EPA restringen su acción a la BH del ATV y del C18:2 trans-11, cis-15, con un impacto minoritario sobre la BH del ALC (21). Esto permitiría plantear que dicho efecto inhibitorio es minoritario para las bacterias del grupo A, siendo mayoritario sobre las del grupo B (responsables principalmente de la BH del ATV), lo cual se encuentra de acuerdo con varios trabajos (21, 35).
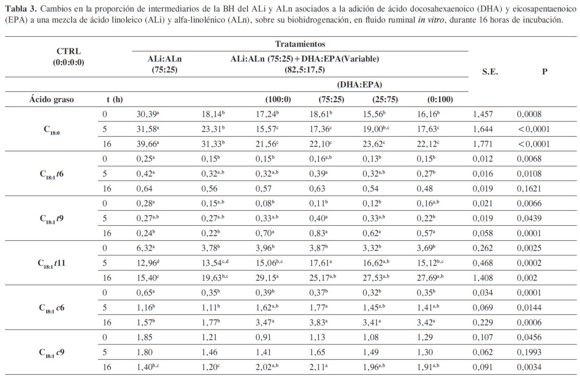
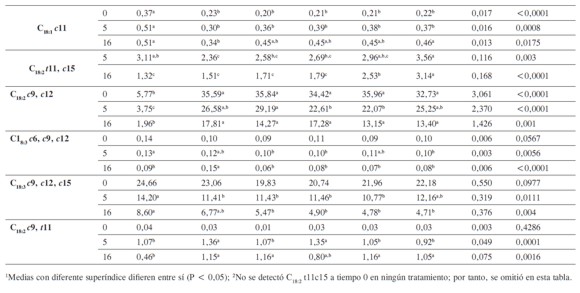
Algunos estudios han sugerido que la actividad inhibitoria del DHA y el EPA sobre la deshidrogenasa del ATV puede ser diferencial (20, 21). Esto implicaría que la respuesta a la adición de EPA y DHA fuera de carácter sinérgica o aditiva. Este trabajo no evidencia esto, a pesar de que a la hora 5 se presentó una mayor acumulación para T3, que contenía combinaciones de DHA: EPA (75:25). Sin embargo, se podría proponer que el sistema enzimático, principalmente responsable de la desaparición del C18:2 trans-11, cis-15, es diferente al del ATV.
Algunos intermediarios menores de la BH, como son el C18:1 trans-9, C18:1 cis-6 y el C18:1 cis-9, también se acumularon a medida que el tiempo de incubación aumentó para los tratamientos con EPA y DHA (Tabla 3). Esto sugiere que su BH depende de la misma enzima que biohidrogena el ATV y que es inhibida por EPA y DHA. Lo anterior se encuentra de acuerdo con lo propuesto por dos trabajos (12, 17), los cuales encontraron que la inclusión de EPA, DHA o aceite de pescado disminuyó la desaparición de C18:1 cis-9 y de otros C18:1 trans. Curiosamente en este estudio, aunque el C18:1 trans-6 y el C18:1 cis-11 presentaron acumulación en el tiempo (Tabla 3) esta no fue explicada por los tratamientos, sugiriendo un mecanismo o reductasa diferente para estos ácidos grasos en el último paso de la BH.
En los forrajes existen pequeñas concentraciones de C18:3 cis-6, cis-9, cis-12 (ácido gamma- linolénico). En este estudio, la adición de los ácidos grasos no tuvo un efecto claro sobre su desaparición a medida que el tiempo de incubación aumentó. Para los tratamientos con EPA y DHA se presento una disminución menor en sus proporciones, similar a la de aquel que no contenía ácidos grasos. Este no fue el caso para aquel que solo contenía ALi:ALn (75:25) donde a la hora 16, aparentemente se presentaron acumulaciones de este ácido, aspecto poco probable en las condiciones altamente reductoras del fluido ruminal.
Los resultados de este estudio muestran que la inclusión de EPA y DHA produce la inhibición del último paso de la BH del ALi y ALn, lo cual ya ha sido reportado por otros autores, con DHA, EPA y aceites de pescado (21, 22, 36).
Efecto de la combinación del EPA y del DHA, sobre su cinética de desaparición
Se encontró que a medida que la proporción de EPA en la mezcla incubada aumentaba, su desaparición en el tiempo era mayor (Tabla 4). Se estimó una desaparición del 25 % para el tratamiento con DHA: EPA (75:25), 45 % para aquel con relación 25:75 y 86 % para el que contenía una relación 0:100, a las 16 horas. Esto sugiere que el EPA lo metabolizan los microorganismos del rumen, pero su degradación depende de su concentración en el medio. Por otro lado, las proporciones de DHA se mantuvieron estables o aumentaron ligeramente (Tabla 4), lo cual sugiere que este compuesto no se metabolizó en las condiciones de degradación in vitro de este experimento. Otros autores han propuesto que el DHA se metaboliza en el rumen, pero que su degradación depende de su concentración. Algunos trabajos establecieron que a mayor concentración de DHA en el medio (100, 200, 300 y 400 mg/ mL de inóculo), disminuye su desaparición, como también la del EPA (21, 37). Estos hallazgos son aparentemente contrarios a los encontrados en este trabajo, donde con concentraciones menores (65 µg/mL) a las reportadas por ellos, no se presentó desaparición de DHA, y adicionalmente la desaparición del EPA aumentó al incrementar su concentración en el medio. Algunos autores han sugerido que el EPA y DHA no pueden ser metabolizados por los microorganismos del rumen (38). Lo observado en este trabajo estaría en concordancia con este postulado para el DHA pero no para el EPA. Se cree que estas discrepancias entre experimentos se deben a diferencias en las concentraciones utilizadas (39).
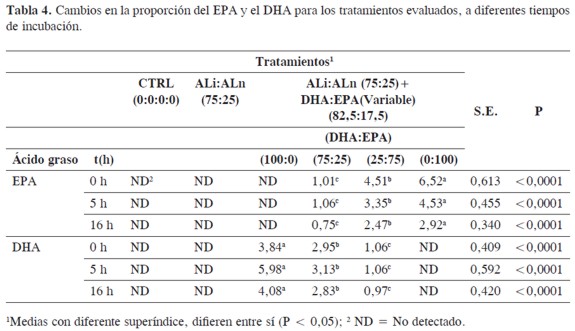
El uso de compuestos marcados podría ayudar a aclarar si realmente el rumen tiene capacidad para metabolizar estos compuestos. También es posible que las discrepancias entre estudios se expliquen por diferencias en la microflora ruminal de los animales donantes del fluido. El EPA y el DHA no son ácidos grasos comúnmente presentes en las dietas de los rumiantes, por lo cual es posible que en condiciones de dietas tradicionales no se desarrollen microorganismos capaces de metabolizar el EPA y el DHA. La capacidad de adaptarse a nuevas condiciones dietarías por los microorganismos del rumen ha sido ampliamente documentada, y se ha demostrado que cuando aparecen compuestos tóxicos (saponinas, oxalatos, mimosina, otros), las poblaciones ruminales pueden evolucionar o se modifican en el tiempo para degradarlos (40).
CONCLUSIONES
La adición de EPA y DHA no generó la acumulación de ALi y ALn con respecto al tratamiento que contenía solamente ALi y ALn. Esto sugiere que en las condiciones del experimento, el EPA y DHA no fueron inhibidores de la desaparición del ALi y del ALn.
La adición de EPA y DHA produjo la acumulación de ATV y disminuyó la proporción de C18:0 con respecto a aquellos tratamientos que no los contenían. Esto sugiere que el EPA y el DHA presentan un efecto inhibitorio en los pasos intermedios de la BH y no en el inicio.
Se encontró que el C18:2 trans-11, cis-15 se acumuló con la adición de EPA, pero no de DHA. Esto puede indicar que el sistema enzimático principalmente responsable de la desaparición del C18:2 trans-11, cis-15 es diferente al del ATV.
El C18:1 trans-9, C18:1 cis-6 y C18:1 cis-9 se acumularon a medida que se incrementó el tiempo de incubación, para los tratamientos con EPA y DHA, lo cual no sucedió para el C18:1 trans-6 y el C18:1 cis-11. Esto sugiere que los dos grupos de ácidos grasos podrían ser reducidos por mecanismos o reductasas diferentes.
A mayor proporción de EPA en la mezcla, su desaparición aumentó, lo cual no sucedió para el DHA. Esto indicaría que el EPA fue metabolizado por los microorganismos del rumen, lo cual dependió de su concentración en el medio. Por el contrario, el DHA no fue metabolizado en las condiciones in vitro de este experimento.
REFERENCIAS BIBLIOGRÁFICAS
1. Harfoot, C. G.; Hazlewood, G. P. Lipid metabolism in the rumen. En: P. N. Hobson y S. Stewart (Eds.). The Rumen Microbial Ecosystem. 1997. London, UK: Chapman and Hall, pp. 382-426. [ Links ]
2. Kemp, P.; Lander, D. J. Hydrogenation in vitro of α-linolenic acid to stearic acid by mixed cultures of pure strains of rumen bacteria. J Gen Microbiol. 1984. 130: 527- 533. [ Links ]
3. Maia, M. R.; Chaudhary, L. C.; Figueres, L.; Wallace, J. Metabolism of polyunsaturated fatty acids and their toxicity to the microflora of the rumen. Ant Van Lee. 2007. 91: 303-314. [ Links ]
4. Laverroux, S.; Glasser, F.; Gillet, M.; Joly, C.; Doreau, M. Isomerization of vaccenic acid to cis and trans C18:1 isomers during biohydrogenation by rumen microbe. Lipids. 2011. 46: 843-850. [ Links ]
5. Bauman, D. E.; Baumgard, L. H.; Corl, B. A.; Griinari, J. M. Biosynthesis of conjugated linoleic acids in ruminants. Proc Am Soc Anim Sci. 1999. Disponible en: http://www.asas.org/jas/symposia/proceedings/0937.pdf [ Links ]
6. Lock, A. L.; Bauman, D. E. Modifying milk fat composition of dairy cows to enhance fatty acids beneficial to human health. Lipids. 2004. 39: 1197-1206. [ Links ]
7. Griinari, J. M.; Bauman, D. E. Biosynthesis of conjugated linoleic acid and its incorporation into meat and milk in ruminants. En: G. J. Nelson (Eds.). Advanced in conjugated linoleic acids reseach. Vol. 1. 1999. Champaign (IL): AOCS Press. pp. 180-200. [ Links ]
8. Corl, B. A.; Baumgard, L. H.; Dwyer, D. A.; Griinari, J. M.; Phillips, B. S.; Bauman, D. E. The role of Δ 9desaturase in the production of cis 9, trans 11 CLA. J Nutr Biochem. 2001. 12: 622-630. [ Links ]
9. Kay, J. K.; Mackle, T. R.; Auldist, M. J.; Thomson, N. A.; Bauman, D. E. Endogenous Synthesis of cis-9, trans-11 Conjugated linoleic Acid in Dairy Cows Fed Fresh Pasture. J Dairy Sci. 2004. 87: 369-378. [ Links ]
10. Palmquist, D. L.; Griinari J. M. Milk fatty acid composition in response to reciprocal combinations of sunï¬ower and ï¬sh oils in the diet. Anim Feed Sci Tech. 2006. 131: 358-369. [ Links ]
11. Shingfield, K. J.; Ahvenjärvi, S.; Toivonen, V.; Arölä, A.; Nurmela, K. V. V.; Huhtanen, P.; Griinari, J. M. Effect of dietary ï¬sh oil on biohydrogenation of fatty acids and milk fatty acid content in cows. J Anim Sci. 2003. 77: 165-179. [ Links ]
12. Duckett, S. K.; Gillis, M. H. Effects of oil source and fish oil addition on ruminal biohydrogenation of fatty acids and conjugated linoleic acid formation in beef steers fed finishing diets. J Anim Sci. 2010. 88: 2684-2691. [ Links ]
13. Toral, P. G.; Frutos, P.; Hervas, G.; Gómez-Cortés, P.; Juarez, M.; de la Fuente, M. A. Changes in milk fatty acid profile and animal perfomance in response to fish oil supplementation alone or in combination with sunflower oil, in dairy ewes. J Dairy Sci 2010. 93: 1604-1615. [ Links ]
14. Chilliard, Y.; Ferlay, A.; Doreau, M. Review: Effect of different types of forages, animal fat or marine oils in cow´s diet on milk fat secretion and composition, especiallyconjugated linoleic acid (CLA) and polyunsaturated fatty acids. Livest Prod Sci 2001. 70: 31-48. [ Links ]
15. Givens, D. I.; Cottrill, B. R.; Davies, M.; Lee, P. A.; Mansbridge, R. J.; Moss , A. R. Sources of n-3 polyunsaturated fatty acids additional to fish oil for livestock diets: A review. Nutr. Abstr. Rev. B: Livest. Feeds Feed 2000. 70: 1-13. [ Links ]
16. Fievez, V.; Dohme, F.; Danneels, M.; Raes, K.; Demeyer, D. Fish oils as potent rumen methane inhibitors and associated effects on rumen fermentation in vitro and in vivo. Anim Feed Sci Tech. 2003. 104: 41-58. [ Links ]
17. Abughazaleh, A. A.; Jenkins, T. C. Disappearance of docosahexaenoic and eicosapentaenoic acids from cultures of mixed ruminal microorganisms. J Dairy Sci. 2004. 87: 645-651. [ Links ]
18. Boeckaert, C.; Vlaeminck, B, Mestdagh, J.; Fievez, V. In vitro examination of DHA-edible micro algae. 1. Effect of rumen lypolisis and biohydrogenation of linoleic and linolenic acid. Anim feed Sci Tech. 2007. 136: 63-79. [ Links ]
19. Abughazaleh, A. A.; Jacobson, B. N. The effect of pH and polyunsaturated C18 fatty acid source on the production of vaccenic acid and conjugated linoleic acids in ruminal cultures incubated with docosahexaenoic acid. Anim Feed Sci Tech. 2007. 136: 11-22. [ Links ]
20. Gulati, S. K.; McGrath, S.; Wynn, P. C.; Scott, T. W. Preliminary results on the relative incorporation of docosahexaenoic and eicosapentaenoic acids into cows milk from two types of rumen protected fish oil. Int Dairy J. 2003. 13: 339-343. [ Links ]
21. Chow, T. T.; Fievez, V.; Moloney, A. P.; Raes, K.; Demeyer, D.; De Smet, S. Effect of fish oil on in vitro rumen lipolysis, apparent biohydrogenation of linoleic and linolenic acid and accumulation of biohydrogenation intermediates. Anim Feed Sci Tech. 2004. 117: 1-12. [ Links ]
22. Hou, J.; Wang, F.; Ren, D. Effect of the supplementation of fish oil on the conjugated linoleic acid production, especially accumulation of trans-11 C18:1 and trans-10 C18:1 fatty acids: An in vitro rumen fermentation study. Small Ruminant Res. 2011. 99: 148-152. [ Links ]
23. Cook, C. W. Symposium on nutrition of forages and pastures: collecting forage samples representative of ingested material of grazing animals for nutritional studies. J Anim Sci. 1964. 23 (1): 265-270. [ Links ]
24. McDougall, E. I. Studies on Ruminant Saliva. 1. The composition and output of sheep's saliva. Biochem J. 1948. 43: 99-109. [ Links ]
25. Tilley, J. M. A.; Terry, R. A. A two-stage technique for the in vitro digestion of forage crops. J Br Crassl Soc. 1963. 18: 104-111. [ Links ]
26. Jouany, J. P.; Lassalas, B.; Doreau, M.; Glasser, F. Dynamic features of the rumen metabolism of linoleic acid, linolenic acid and linseed oil measured in vitro. Lipids. 2007. 42: 351-360. [ Links ]
27. Ribeiro, C. V. M.; Eastridge, L.; Firkins, J .L.; St-Pierre, N. R.; Palmquist, D. L. Kinetics of fatty acid biohydrogenation in vitro. J Dairy Sci. 2007. 90: 1405-1416. [ Links ]
28. Sterk, A.; Hovenier, R.; Vlaeminck, B.; van Vuuren, A. M.; Hendriks, W. H.; Dijkstra, J. Effects of chemically or technologically treated linseed products and docosahexaenoic acid addition to linseed oil on biohydrogenation of C18:3n-3 in vitro. J Dairy Sci. 2010. 93: 5286-5299. [ Links ]
29. Cortés, J. E.; Moreno, B.; Pabón, M. L.; ávila, P.; Kreuzer, M.; Hess, H. D.; Carulla, J. E. Effects of purified condensed tannins extracted from Calliandra, Flemingia and Leucaena on ruminal and postruminal degradation of soybean meal as estimated in vitro. Anim Feed Sci Tech. 2009. 151: 194-204. [ Links ]
30. AOAC 2006. Official Methods of Analysis of AOAC International. W. Hortwitz (Ed.). (18th Ed). Association of Official Analytical Chemists. [ Links ]
31. Van Soest, P. J.; Robertson, J. B.; Lewis, B. A. Methods for dietary fiber, detergent fiber and nonstarch polisaccharides in relation to animal nutrition. J Dairy Sci. 1991. 74: 3583-3597. [ Links ]
32. Garcés, R.; Mancha, M. One-step lipid extraction and fatty acid methyl esters preparation from fresh plant tissues. Anal biochem. 1993. 211: 139-143. [ Links ]
33. Yamasaki, M.; Kishihara, K.; Ikeda, I.; Sugano, M.; Yamada, K. A recommended esterification method for gas chromatographic measurement of conjugated linoleic acid. JAOCS. 1999. 76: 933-938. [ Links ]
34. Cochran, W. G.; Cox, G .M. Experimental Designs. Wiley and Sons (Ed.) Somerset, N.J. 1957, pp. 127- 131. [ Links ]
35. Boeckaert, C.; Mestdagh, J.; Vlaeminck, B.; Clayton, D.; Fievez, V. Micro-algae as potent rumen methane inhibitors and modifiers of rumen lypolisis and biohydrogenation of linoleic and linolenic acid. Int Congr Ser. 2006. 1293: 184-188. [ Links ]
36. Shingfield, K. J.; Lee, M. R.; Humphries, D. J.; Scollan, N. D.; Toivonen, V.; Reynolds, C. K.; Beever, D. E. Effect of incremental amounts of fish oil in the diet on ruminal lipid metabolism in growing steers. Br J Nutr. 2010. 104: 56-66. [ Links ]
37. Dohme, F.; Fievez, V.; Raes, K.; Demeyer, D.I. Increasing levels of two different fish oils lower ruminal biohydrogenation of eicosapentaenoic and docosahexaenoic acid in vitro. Anim Res. 2003. 52: 309- 320. [ Links ]
38. Ashes, J. R.; Siebert, B. D.; Gulati, S. K.; Cuthbertson, A. Z.; Scott, T. W. Incorporation of n-3 fatty acids of ï¬sh oil into tissue and serum lipids of ruminants. Lipids. 1992. 27: 629-631. [ Links ]
39. Gulati, S. K.; Ashes, J. R.; Scott, T. W. Hydrogenation of eicosapentaenoic and docosahexaenoic acids and their incorporation in to milk fat. Anim Feed Sci Tech. 1999. 79: 57-64. [ Links ]
40. Van Soest, P. J. Nutritional Ecology of the Ruminant (2nd. ed.). Cornell Univ. Press: Ithaca, NY. 1994. pp. 165-170. [ Links ]













