Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.42 no.1 Bogotá Jan./Apr. 2013
Composición molecular de ácidos húmicos evaluada mediante pirólisis – cromatografía de gases – espectrometría de masas e hidrólisis térmica asistida y metilación en suelos altoandinos de Colombia
Molecular composition of humic acids evaluated by pyrolysis – gas chromatography – mass spectrometry and thermally assisted hydrolysis and methylation in high Colombian Andean soils
Composição molecular de ácidos húmicos avaliada mediante pirólise – cromatografia de gases – massas e hidrólise térmica assistida e metilação, em solos altoandinos em Colômbia
Claudia X. Martínez1, Isabel Bravo1, Francisco J. Martin2
1Grupo de Agroquímica. Departamento de Química. Universidad del Cauca. Calle 5 No. 4-70, Popayán (Cauca, Colombia)
2 Departamento de Edafología y Química Agrícola, Universidad de Granada, Campus Fuentenueva s/n, 18071, Granada (Andalucía, España).
* Autores para correspondencia: cxmartinez@unicauca.edu.co, ibravo@unicauca.edu.co
Recibido: 23 de enero de 2013 • Aceptado: 8 de abril de 2013
Resumen
Se determinó la composición molecular de ácidos húmicos (AH), extraídos del horizonte 'A' de suelos altoandinos de Colombia dedicados a tres usos: bosque primario, cultivos y praderas. Los AH se obtuvieron mediante extracción secuencial de la materia orgánica humificada (MOH) con soluciones de tetraborato, pirofosfato e hidróxido de sodio (0,1N), y fueron purificados mediante diferentes procesos analíticos. Su composición molecular se determinó a través de Py-GC/MS y THMA. Los diferentes productos de la pirólisis se clasificaron atendiendo a la familia química a la que pertenecen; prevalecieron los ácidos grasos (FA) como el producto más abundante en los AH de todos los usos, mientras que los fenoles, esteroles, S-compuestos y terpenos se encontraron en menor abundancia. Se presentaron diferencias en los porcentajes de abundancia relativa de los grupos identificados, demostrando así que el cambio de uso de suelo influye en sus propiedades físicas, químicas y biológicas, por lo que se perciben diferentes grados de transformación que afectan la composición de los AH y su reactividad en el suelo.
Palabras claves: ácidos húmicos, suelos altoandinos, pirólisis – cromatografia de gases – espectrometría de masas, hidrólisis térmica asistida, metilación.
Abstract
It was determined the molecular composition of humic acids (HA) extracted from 'A' horizon in Colombian high Andean soils dedicated to three uses: primary forest, croplands and pastures. The AH were obtained by sequential extraction of humified organic matter (HOM) with tetraborate, pyrophosphate and sodium hydroxide (0.1N) solutions; HA were purified through various analytical processes. Its chemical composition was determined by Py-GC/MS and THMA. Different pyrolysis products were classified in response to the chemical family to which they belong, prevailed fatty acids (FA) as the most abundant in all AH, while phenols, sterols, terpenes and S-compounds were found in lower abundance. There were differences in the percentages of relative abundance of the identified groups, showing that the land use change influences the physical, chemical, and biological propertiers of soils that are perceived at different levels of transformation, affecting the HA composition and its reactivity in the soil.
Key Words: Humic acids, high Andean soils, pyrolysis – gas chromatography – mass spectrometry, thermally assisted hydrolysis, methylation.
Resumo
Foi determinada a composição molecular de ácidos húmicos (AH), extraídos do horizonte 'A' dos solos altoandinos, Colômbia, surgiro a três usos: floresta primária, cultivo e pastagem. Os AH se obtiveram através de extração sequencial da Matéria Orgânica Humificada (MOH) com soluções de tetraborato, pirofosfato e hidróxido de sódio (0,1N), e foram purificados por diversos processos analíticos. A sua composição química foi determinada por Py-GC/MS e THMA. Os diferentes produtos da pirolise foram classificados atendendo à família química à que pertencem, prevaleceram os ácidos gordurosos (FA) como o produto mais abundante em todos os AH, enquanto os fenóis, esteróis, S-compostos e terpenos foram encontrados em menor abundância. Surgiram diferenças nas percentagens da abundância relativa dos grupos identificados, mostrando que a mudança de uso de solo influencia nas propriedades físicas, químicas e biológicas do solo podendo ser perceptíveis diferentes graus de transformação, que afetam a composição dos AH e sua reatividade no solo.
Palavras-chave: ácidos húmicos, solos altoandinos, pirólise-cromatografia de gases- massas e hidrólise térmica assistida, metilação.
Introducción
Las sustancias húmicas (SH) cumplen un papel fundamental en la fertilidad y calidad del suelo, ejercen influencia en las propiedades físicas, químicas y biológicas del mismo. Son moléculas heterogéneas de peso molecular elevado, con diferentes tipos de grupos funcionales, producto de la transformación bioquímica de materiales orgánicos que han sufrido procesos de descomposición, síntesis microbial, reacciones de polimerización y condensación(1). Los microorganismos sintetizan una variedad de materiales incluyendo polisacáridos, proteínas, ácidos nucleicos, carotenoides, lípidos, etc., la mayoría de ellos fácilmente metabolizados por causa de muerte y autolisis y entran al ciclo del carbono, mientras los materiales refractarios escapan a la degradación y se acumulan en el suelo (2).
La estructura de las SH está influenciada por parámetros como el pH y la fuerza iónica, por lo que condiciones ambientales podrían influir en el tamaño y forma de las SH. Acorde a los principios de solubilidad en solventes acuosos las SH se clasifican en huminas, ácidos fúlvicos y ácidos húmicos (3,4), estos últimos de mayor peso molecular constituyen la fracción biológicamente más resistente, con una amplia gama de estructuras aromáticas condensadas, estructuras alifáticas y biopolimeros de carbono altamente funcionales, unidos por diferentes tipos de enlace, de hidrógeno, enlaces π, e interacciones hidrofóbicas que proporciona estabilidad a los suelos y evita la emisión de gases a la atmósfera favoreciendo el almacenamiento de carbono. Así mismo, los AH contribuyen a la retención de agua e influyenen procesos bioquímicos y ambientales, participan en la regulación de las interacciones de metales incluyendo procesos de adsorción/desorción y dependiendo de los parámetros geoquímicos pueden actuar como barreras geoquímicas, contribuir a la migración no retardada de metales (5). Retienen otros contaminantes de tipo orgánico e inorgánico afectando su movilidad, biodisponibilidad, degradación y fitotoxicidad en los suelos, tienen alta capacidad de intercambio catiónico y son fuente de macro y micronutrientes.(6).
La naturaleza y composición de las SH ha sido de gran interés para muchos científicos desde hace más de 200 años y se ha venido desarrollando la aplicación de técnicas analíticas, químicas y espectroscópicos, especialmente UV- Visible, RMN y IRTF (3,6-8). Sin embargo estos métodos no permiten establecer relaciones entre su composición química a nivel biomolecular y la vegetación de origen. Mientras otrosestudios han demostradoquela pirólisisanalíticay pirólisis combinada con metilación pueden proporcionar información valiosa para comprenderla estructura química demacromoléculas complejas, permitiendo llegar a comprender la complejidad real de los AH(9-15).
Los suelos Altoandinos contribuyen a la regulación de fuentes hídricas y al ciclo global del carbono, por su capacidad para estabilizar grandes cantidades de carbono orgánico durante miles de años, formando complejos estables con iones Al y Fe, alófanos y arcillas, sin embargo, están sufriendo procesos de expansión de la frontera agrícola que alteran sus propiedades y afectan la composición de las SH. Dada la importancia de estos suelos, este trabajo tuvo como propósito investigar la composición química de sus AH y evaluar el efecto del cambio de uso de suelo, determinando la contribución de los principales precursores de la macromolécula húmica, mediante Py-GC/MS y THM una técnica degradativa, de alta reproducibilidad capaz de romper enlaces tipo éster, éter y distintas uniones C-C.
Materiales y métodos
Descripción de la zona y suelos de estudio
La investigación se desarrolló en la microcuenca Santa Teresa, cuenca andina de alta montaña del rio Las Piedras, Colombia, localizada entre las coordenadas 2º 26' 17.73" N, 76º 24' 17.32" W, con clima frío húmedo (temperatura media anual de 10.4ºC y precipitaciones medias anuales entre 1050 a 1200 mm). Lossuelos pertenecen aecosistemas altoandinos en alturas comprendidas entre 2850-3238 msnm, clasificados como Andisoles, Typic (16).
Diseño experimental y muestreo
Las unidades experimentales se seleccionaron considerando el uso de suelo, con sistemas de bosque primario, cultivo de papa y pastura. Teniendo en cuenta el área total dedicada a cada uso y resultados previos de carbono orgánico se aplicó la fórmula de Pearson (17) para la delimitación del área de muestreo de suelos en secuestro de carbono, obteniéndose: 3 unidades experimentales (parcelas) para bosque primario, 2 para pasturas y 1 para cultivo de papa, dando como resultado un diseño experimental aleatorio estratificado con seis parcelas. Cada parcela se delimitó por una cuadrícula de 400 m2 tomando cada 5 m submuestras en el horizonte 'A', correspondiente a una profundidad de 20 cm en cultivo de papa y bosques primarios y a 10 cm en pastura, georreferenciadas usando GPS Garmin 60CS™. Los AH se obtuvieron a partir de las muestras compuestas formadas con 25 submuestras de cada parcela identificados como: AH-bosque I, AH-bosque II, AH-bosque III, AH-pastura II, AH-pastura III y AH-cultivo.
El tipo de vegetación predominante en los bosques es motilón (Freziera canescens) y en menor proporciónencenillo(Weinmannia tomentosa) y Quina(Cinchona pubescens). La variedad de pastos es kikuyo (Pennisetum clandestinum). Los bosques y pasturas tienen un tiempo de permanencia de aproximadamente 15 años. El suelo dedicado a cultivo de papa (solanum tuberosum) es reciente (un año). El área agrícola es poco tecnificada, con labranza conservacionista y gran parte de esta es de subsistencia. Las actividades pecuarias se realizan en pastos para ganadería extensiva con labranza cero.
Extracción y purificación de los ácidos húmicos
Para la extracción de las SH del suelo se utilizaron protocolos descritos por Mosquera et al.,(18,19). El fraccionamiento de MOS en materia orgánica humificada (MOH) y materia orgánica fresca (MOF) se realizó, mediante el método granulométrico de tamizaje en húmedo, disociando previamente en agua, por tratamiento mecánico los agregados normalmente estables del suelo. Así, se separó la fracción menor de 53µm correspondiente a la MOH utilizando un tamizador automático (Retsch As200®). Las fracciones AH, AF y huminas, se separaron mediante extracción secuencial de la MOH con soluciones básicas modificando la concentración de tetraborato, pirofosfato(0,1N) y la velocidad de centrifugación a 16.508 x g durante 20 minutos, usando una ultracentrífuga refrigerada Sorvall RC-5B®. Los AH se purificaron siguiendo el mismo protocolo y se liofilizaron en un equipo Labconco, modelo FreeZone 4.5® para su posterior caracterización (10).
Caracterización química de los ácidos húmicos mediante Py-GC/MS y THM
El análisis se llevó a cabo en un cromatógrafo de gases HP‐6869N® acoplado a un detector selectivo de masas HP‐5973 Network® (Hewlet Packard, Abondale, PA, USA). La temperatura del inyector fue de 250ºC. La pirolisis de la muestras se realizó a 600ºC durante 5 s. Se empleó un pirolizador precalibrado de espiral de Pt (CDS Pyroprobe®). Tanto la cámara de pirolisis como el inyector cromatográfico se mantuvieron a 250ºC. La separación cromatográfica fue realizada en una columna capilar de sílice fundida HP‐5MS (30 m x 250 mm x 0.25 mm nominal). Siguiendo las pautas establecidas por Buurman (9), las condiciones cromatográficas fueron las siguientes: temperatura inicial de 40ºC mantenida durante 1 min con una rampa de 7ºC/min hasta 300ºC durante 15 min. La inyección de las muestras se efectuó en modo Split con una relación 1:40. Como gas portador se utilizó He a una presión de 67,5 kPa en el inyector y con una velocidad de flujo constante de 1,5 ml/min.
Como técnica de ionización se utilizó el impacto electrónico y las condiciones de trabajo del espectrómetro de masas fueron las siguientes: temperatura de la fuente 230ºC, energía electrónica 70eV y velocidad de barrido del espectrómetro de masas de 0.5 s/scan en el intervalo m/z 20‐800. La THM combina la degradación de compuestos de alto peso molecular y la metilación de los productos obtenidos. A las muestras se adiciona una gota de solución de hidróxido de tetrametilamonio (TMAH) 25%, para introducir en el pirolizador. Se opera con un software Agilent Chemstation G1701CA MSD® para la integración de picos y evaluación de espectros de masas. Los espectros se adquirieron en modo monitorización de iones total. La identificación de los compuestos se llevó a cabo por comparación con los espectros de patrones de las espectrotecas Wiley y NIST, mediante la interpretación de las fragmentaciones másicas obtenidas para cada pico cromatográfico y según datos publicados en la bibliografía consultada (9,20). Se estimó la abundancia relativa de los componentes identificados en los AH, agrupando los diferentes compuestos según el grupo químico al que pertenecen (compuestos aromáticos, ácidos grasos, y demás) y calculando el porcentaje de su área cromatográfica con respecto al área total de todos los picos identificados.
Resultados y discusión
Pyrolysis-GC/MS y THM
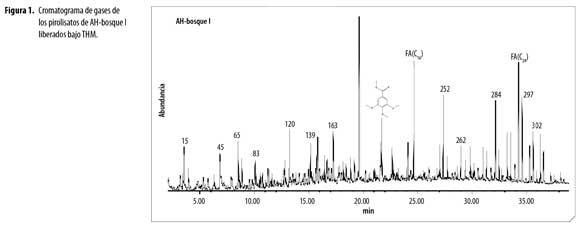
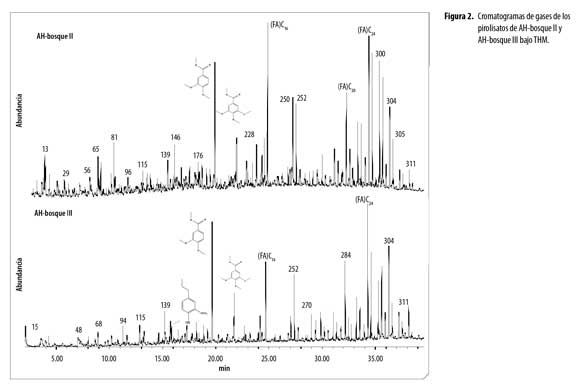
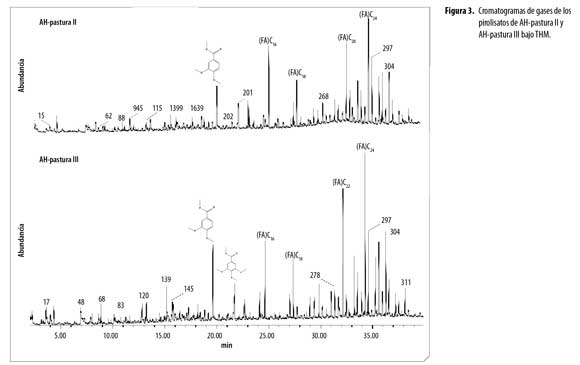
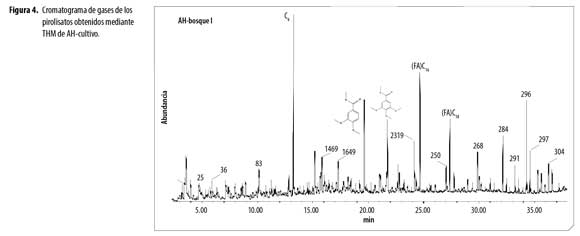
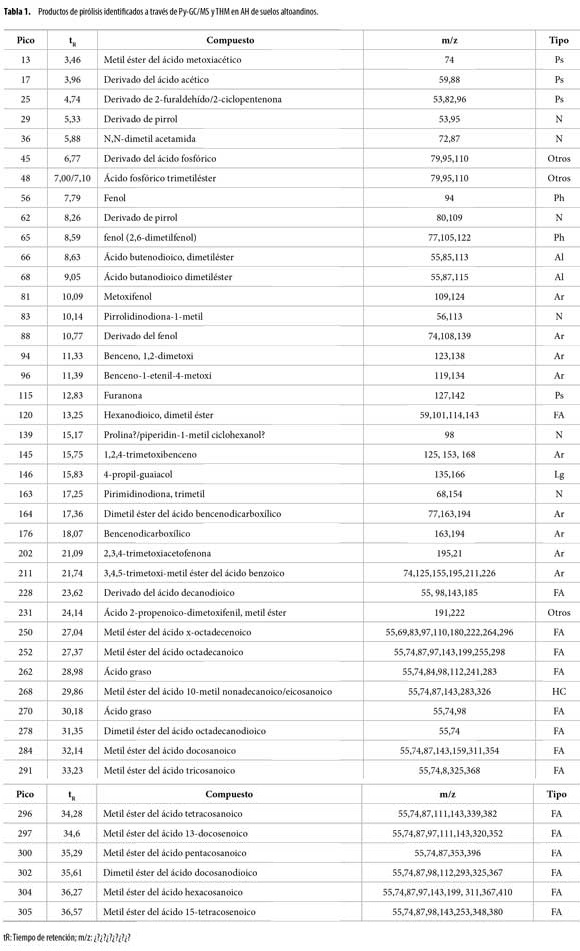
El análisis de ácidos húmicos por Py-GC/MS mediante hidrólisis térmicamente asistida y metilación, (THM) reveló en los cromatogramas de AH (Figura 1 a 4), la presencia de una variedad de productos liberados (pirolisatos), etiquetados connúmero. Los cromatogramas son comparables en compuestos identificados, con variaciones en intensidad de los picos.Se identificaron 252 compuestos algunos de los cuales se presentan en la tabla 1 y según la familia a la que pertenecen o precursor se agruparon en: compuestos aromáticos y poliaromáticos (Ar y PAr), ácidos grasos (FA), terpenos (Tr), esteroles (St), hidrocarburos (HC), hidrocarburos insaturados (HCins), otros hidrocarburos (Al), fenoles (Ph), compuestos derivados de polisacáridos (Ps), ligninas (Lg), compuestos de nitrógeno (N), compuestos de azufre (S) y derivados del ácido fosfórico.
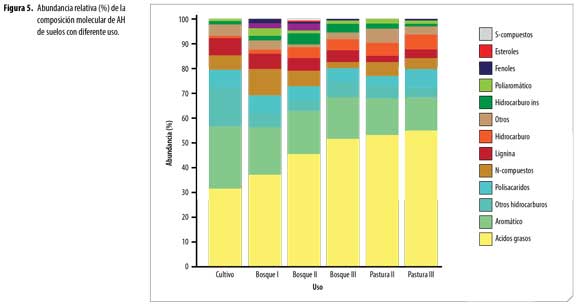
La distribución de abundancia relativa de los grupos de compuestos identificados en los AH,(figura 5), revela que la composición de los AH de los diferentes usos, está dominada por ácidos grasos (FA) y compuestos aromáticos. La abundancia de FA da indicios de la contribución microbial (basidiomycetes) en la formación de AH,porque estos FA son sintetizados por células microbiales en el proceso de neosíntesis y posteriormente por muerte y autolisis pasan a formar parte de los AH. La fuerte acidez y las bajas temperaturas en estos suelos favoreció la actividad de hongosy generó FA con poca ramificación. Polisacáridos como furanos, 2-furaldehyde y 5-methyl-furaldehyde, en los productos de pirolisis ratifican la presencia de biomasa fungal en los AH(4). Numerosos microorganismos telúricos, entre ellos Aspergillus y Penicillium, pueden haber contribuido al origen de los lípidos en los componentes alifáticos de la macromolécula húmica, importantes para la estabilidad estructural y flexibilidad conformacional de los AH (21). Lehtonen, Hanninen y Ketola (22) demuestran que macromoléculas biogénicas alifáticas de origen vegetal y polímeros microbianos alifáticos altamente resistentes se producen en huminas del suelo. Estos hallazgos apoyan fuertemente la sugerencia de que biolipidos, macromoléculas altamente alifáticas representen sustratos potenciales para producción intramolecular de n-alcano dentro de la estructura del AH.
Ácidos grasos: En todos los AH se encontró FA de C12–C29, dominados por FA de cadena par como el tetracosanoico (lignócerico) (C24:0) con mayor porcentaje de abundancia enAH de bosques y pasturas, el ácido hexadecanoico (palmítico) (C16:0) abundante en AH-cultivo. Además se identificaron el ácido 13-docosenoico (erúcico) (C22:1), ácido mono y dicarboxílico (C22), ácido pentacosanoico (C25:0) y ácido hexacosanoico (C26:0).Baja abundancia en ácidos grasos de cadenas impares y ramificadas puede ser por baja producción de propionato en el proceso de neosíntesis, lo que sugiere baja actividad bacteriana. La abundancia relativa de los FA fue superior en los AH-bosque III, AH-pastura II y AH-pastura III.
Aromáticos y Poliraromáticos. Seidentificaron fundamentalmente derivados del benceno, tolueno y fenol. El benceno generalmente se atribuye a polifenoles y el tolueno es un producto de pirolisis de otros fenoles o proteínas, sin embargo, ambos pueden derivar de carbón recalcitrante (9).En el AH-cultivo predomina el 3,4,5-trimetoxi metil ester del ácido benzoico siendo dos veces superior al de los otros AH, demostrando menor oxidación de grupos metoxilos en las cadenas laterales.Los AH de bosques presentan mayor abundancia relativa de compuestos aromáticos con respecto a los AH de pasturas, demostrando la influencia del cambio de uso en la formación de este tipo de compuestos. Los productos poliaromáticos identificados en las muestras de AH corresponden a densas estructuras aromáticas especialmente derivados del naftaleno.
Lignina. Se encontraron bajos contenidos (2-7%) de productos de pirolisis derivados de lignina, porque en estos suelos fuertemente ácidos predominan los hongos que utilizan este compuesto como fuente de energía, concordando con resultados marcadamente bajos de pirolisatos de andisoles encontrados por Naafs (4) quien sugiere que la lignina es degradada rápidamente en suelos volcánicos. ElAH-cultivo supera en abundancia de lignina a los AH de bosques, debido al material vegetal utilizado en la preparación del abono orgánico aplicado a esta parcela. Los AH de pasturas presentan los contenidos más bajos, ratificando que en suelos cubiertos de tejido leñoso hay más contenido de lignina. La distribución de patrones estuvo marcada por 4-propilguaiacol, metilguaiacol, 4-(1-propenil) guaiacol, 4-vinilguaiacol producto del ácido ferulico, siringoles como vinil-siringol y derivados del ácido siringico, prevaleciendo4-propilguaiacol en los AH de los diferentes usos de suelo. La disminución de siringoles respecto a guaiacoles confirma la posible demetilación y seguida dehidroxilación y/o demetoxilación de la lignina lo cual es una característica común en suelos (20).
N-compuestos. Enlos AH se identificaron compuestos de nitrógeno principalmente derivados del pirrol, piridina y algunos derivados del indol. Estos productos resultan de la contribución de aminoácidos presentes en polipeptidos y proteínas de los AH o en complejos proteína-quitina de las fuentes de AH. Los pirroles son productos de pirolisis de la prolina, hidroxiprolina y glutamina, las piridinas de aminoazúcares y alanina, los índoles de triptófano y nitrilos aromáticos de fenilalanina (20).En AH-cultivo predominan productos derivados del pirrol, de menor peso molecular que los encontrados en AH de los otros usos, porque aparecen a tiempos de retención (tR) más bajos, presentando mayor abundancia de 1-metil-pirrol, N,N-dimetilacetamida y metil propil succinimida, demostrando mayor grado de transformación estos AH por el efecto de la aplicación de abonos orgánicos maduros y el mejoramiento de las condiciones físicas y químicas del suelo que promueven una mayor actividad microbial. En los AH de bosques y pasturas los hay abundancia de prolina. Se identificó base nitrogenada pirimidinodiona en AH de pasturas y AH-bosque I, asociados a menor grado de transformación.
Hidrocarburos (alcanos/alquenos). Se determinó abundancia relativa de compuestos de cadena larga C11-C29 predominando los hidrocarburos saturados. Se resalta el menor contenido de hidrocarburos de cadena larga en AH-cultivo y mayor contenido en AH-bosque II y AH-bosque III. Las relaciones aromaticidad/alifaticidad de los AH-cultivo y AH-bosque I son superiores, confirmando que el AH de cultivo posee una estructura menos alifática y más transformada que los otros sistemas.
Polisacáridos. El contenido de polisacáridos es bajo (3,88-7,32%), tratándose en todos los casos de fragmentos muy pequeños porque su descomposición en el suelo, es un proceso rápido, la presencia en los AH se puede considerar de origen microbiano (23), indicando que una parte significativa de los polisacáridos es formada in situ de la mesofauna y biomasa microbial (20). Además es probable que exista estabilización de polisacáridos por los alófanos presentes en el suelo, como se detalla en un estudio realizado por Parfitt (24).
Fenol. El fenol es un indicador de la degradación de la MOS por su asociación con las proteínas, aunque la pirolisis de lignina y celulosa también genera fragmentos fenólicos (11). El contenido de fenoles en AH es muy bajo y no fue detectado en AH-bosque III, AH-pastura II y AH-pastura III.
Conclusión
La composición molecularevidencia que los AH de los diferentes usos presentan los mismos grupos de moléculas, con diferencias en los porcentajes de abundancia relativa y dominio de los grupos identificados. AH-cultivo, presentó inferior cantidad de FA, bajos contenidos de N-compuestos y superior abundancia de compuestos aromáticos, manifestando en estos suelos procesos de transformación in situ más avanzados por mejoramiento en sus condiciones físicas y químicas que redundan en superior calidad de los AH. Los AH de bosques presentaron mayor abundancia relativa de compuestos aromáticos con respecto a los AH de pasturas.
Agradecimientos
Los autores expresan sus agradecimientos a la VRI de la Universidad del Cauca y a la Universidad de Granada (España) por su apoyo económico a este trabajo enmarcado dentro de un proyecto de investigación. Al Instituto de Restauración del Patrimonio de la Universidad Politénica de Valencia (España) por el acompañamiento técnico.
Referencias
1. Stevenson, F.J. Humus Chemistry: Genesis, Composition and Reactions. 2nd ed. New York. Wiley Interscience.1994. [ Links ]
2. Piccolo, A. Humic Substances in Terrestrial Ecosystems Amsterdam, Elsevier Science B.V. 1996. [ Links ]
3. Ussiri, D.A.N.; Johnson, C.E. Characterization of organic matter in a northern hardwood forest soil by 13C NMR spectroscopy and chemical methods. Geoderma. 2003. 111: 123–149. [ Links ]
4. Naafs, D. F. W. What are humic substances? A molecular approach to the study of organic matter in acid soils. The Netherlands. Utrecht University. 2004. [ Links ]
5. Ghabbour, E.; Davies, G. Humic substances Nature,s Most Versatile Materials. New York. Taylor and Francis, Inc.pp 1-5. 2005. [ Links ]
6. Senesi, N.; Dorazio, V.; Ricca, G. Humic acids in the first generation of EUROSOILS. Geoderma. 2003. 116: 325-344. [ Links ]
7. Conte, P.; Piccolo, A.; Van lagen, B.; Buurman, P.; De Jager, P. A. Quantitative aspects of solid-state 13C-NMR spectra of humic substances from soils of volcanic systems. Geoderma. 1997. 80: 327-338. [ Links ]
8. Kang, S.; Amarasiriwardena, D.; Veneman, P.; Xing, B. Characterization of ten sequentially extracted humic acids and a humin from a soil in western massachusetts. Soil Sci. 2003. 168: 880-887. [ Links ]
9. Buurman, P.; Nierop, K.G.J.; Kaal, J.; Senesi, N.. Analytical pyrolysis and thermally assisted hydrolysis and methylation of EUROSOIL humic acid samples — A key to their source. Geoderma. 2009. 150: 10–22 [ Links ]
10. Nierop, K.; Van Langen, B.; Buurman, P. Composition of plant tissues and soil organic matter in the first stages of a vegetation succession. Geoderma. 2001. 100: 1-24. [ Links ]
11. Rodríguez, B.; España, M.; Cabrera de Bisbal, E. Propiedades químico-estructurales de la materia orgánica del suelo en un agro sistema de los llanos centrales venezolanos bajo diferentes prácticas de manejo. Interciencia. 2004. 29: 461-467. [ Links ]
12. De la rosa, J. M.; González, P. J. A.; González V. R.; Knicker, H.; López, C.E.; Manning, D. A. C.; González, V.F.J.. Use of pyrolysis/GC–MS combined with thermal analysis to monitor C and N changes in soil organic matter from a Mediterranean fire affected forest. Catena. 2008. 74: 293-303. [ Links ]
13. Knicker, H.; Gonzales, F.; Polvillo, O.; Gonzales, J.; Almendros, G.. Fire-induced transformation of C- and N- forms in different organic soil fractions from a Dystric Cambisol under a Mediterranean pine forest (Pinus pinaster). Soil Biol Biochem. 2005. 37: 701-718. [ Links ]
14. Spaccini, R.; Piccolo, A. Molecular characteristics of humic acids extracted from compost at increasing maturity stages. Soil Biol Biochem. 2009. 41: 1164-1172. [ Links ]
15. Vancampenhout, K.; Wouters, K.; De Vos, B.; Buurman, P.; Swennen, R.; Deckers, J. Differences in chemical composition of soil organic matter in natural ecosystems from different climatic regions – A pyrolysis–GC/MS study. Soil Biol Biochem. 2009. 41: 568-579. [ Links ]
16. IGAC. Estudio General de Suelos y Zonificación de Tierras Departamento del Cauca Escala 1:100.000. Bogotá. 2009. [ Links ]
17. Pearson, T.W.S.; Brown S. Sourcebook for Land use, land-use change and forestry project. International Winrock. 2005. Disponible en: http://www.winrock.org/ecosystems/files/winrock-biocarbon_fund_sourcebook-compressed.pdf. [Consultado el 9 de octubre de 2011] [ Links ].
18. Mosquera, C.; Bravo, I.; Hansen, E. Comportamiento Estructural de los ácidos húmicos obtenidos de un suelo Andisol del Departamento del Cauca. Revista Colombiana de Química. 2007. 36: 31-41. [ Links ]
19. Mosquera, C.; Bravo, I. Comportamiento de los ácidos húmicos en medio básico. Suelos Ecuatoriales. 2006.36: 36-42. [ Links ]
20. Nierop, K.; Ven Bergen, P.; Buurman, P.; Van Lagen, B. NaOH and Na4P2O7 extractable organic matter in two allophanic volcanic ash soils of the Azores Islands—a pyrolysis GC/MS study. Geoderma. 2005. 127: 36-51. [ Links ]
21. Carrillo, L. Actividad microbiana. En: Microbiología Agrícola. Salta: Universidad Nacional de Salta.pp.1-28. 2003. [ Links ]
22. Lehtonen, K.; Hänninen, K.; Ketola, M. Structurally bound lipids in peat humic acids. Org Geochem. 2001. 32: 33–43. [ Links ]
23. Fassbender, H.W.; Bornemisza, E. Química de suelos con énfasis en suelos de América Latina. 2ed. San Jóse,Costa Rica. IICA.1987. [ Links ]
24. Parfitt, R. L.; Yuan, G.; Theng, B. K. G. A 13C-NMR study of the interactions of soil organic matter with aluminium and allophane in podzols. Eur J Soil Sci. 1999. 50: 695-700. [ Links ]