Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.42 no.1 Bogotá Jan./Apr. 2013
Síntesis in situ de nanopartículas de plata sobre fibras de fique
In situ synthesis of silver nanoparticles on fique fibers
Síntese in situ de nanopartículas de prata em fibras de fique
Sergio A. Ovalle1, Cristian Blanco-Tirado1, Marianny Y. Combariza1,2
1 Universidad Industrial de Santander, Facultad de Ciencias, Escuela de Química, A.A. 678, Carrera 27 calle 9, Bucaramanga (Santander), Colombia.2 Autor para correspondencia: marianny@uis.edu.co
Recibido: 21 de enero de 2013 • Aceptado: 22 de abril de 2013
Resumen
Se realizó la síntesis de un material nanocompuesto mediante la deposiciónin situ de nanopartículas (NPs) de plata sobre fibras de Fique. La influencia de parámetros experimentales, como concentración del precursor, concentración del agente reductor y tiempos de inmersión de las fibras en la solución del precursor y del agente reductor, se evaluó en términos de recubrimiento, tamaño y dispersión del nanomaterial sobre la superficie. Los nanocompositos fueron caracterizados mediante espectroscopia de reflectancia difusa UV-Vis (RD), microscopía electrónica (FESEM) y difracción de rayos X (DRX). El control de los parámetros experimentales mencionados permitió obtener un material que exhibe recubrimiento uniforme y completo de NPs sobre la superficie y tamaños promedio de NPs de 40 nm.
Palabras Clave: nanopartículas de plata, fibras de fique, síntesis in situ, bionanocomposito.
Abstract
A nanocomposite material was synthesized by silver nanoparticles (NPs) in situ deposition on Fique fibers. The influence of experimental conditions such as precursor concentration, reducing agent concentration and immersion times of fibers in precursor and reducing agent solutions was evaluated in terms of nanomaterial coating, size and dispersion on the fibers surface. The nanocomposites were characterized by UV-Vis diffuse reflectance spectroscopy (DR), electron microscopy (FESEM) and X-ray diffraction (XRD). By carefully controlling experimental conditions we were able to produce a material with uniforme and complete coating of NPs on the surface of the fiber, and average sizes of 40 nm.
Keywords: Silver nanoparticles, fique fibers, in situ synthesis, bionanocomposite.
Resumo
Nanocompósito foi sintetizado através de deposição in situ de nanopartículas (NPs) de prata sobre as fibras de Fique. A influência dos parâmetrosexperimentais, tais como a concentração do sal metálico, a concentração do agente de redução e os tempos de imersão das fibras na solução do sal metálico e o agente de redução, foram avaliadas em termos do revestimento, tamanho e a dispersãona superfície do nanomaterial. Os nanocompósitosforam caracterizados por espectroscopia de refletância difusa no UV-Vis (RD), microscopia eletrônica (FESEM) e difração de raios X (XRD). O controle dos parâmetrosexperimentais mecionados originaram um material que exibe um revestimento uniforme e completo das NPs sobre a superfície das fibras e tamanhos médios de 40 nm.
Palavras-chave: nanopartículas de prata, fibras de fique, síntese in situ, bionanocomposito.
Introducción
El fique pertenece, junto con el sisal y el henequén, al grupo de fibras resistentes o 'duras'. Las fibras de fique se extraen de hojas de plantas de la especie Frucraea spp (Figura 1a). Este grupo de plantas tiene su origen en América Tropical, en especial en la región andina de Colombia y Venezuela, de donde se extendieron hacia la costa Oriental del Brasil y a las Antillas. Las fibras de fique se consideran como las fibras naturales colombianas por excelencia, ya que se han utilizado tradicionalmente para elaborar sogas, textiles y empaques. Los departamentos con mayor producción en el país son Cauca, Nariño, Santander, Antioquia y Boyacá; en estas regiones se cultivan varias especies, conocidas como tunosa común, uña de águila y bordón de oro (1).
En Colombia, el empleo de fibras de fique disminuye constantemente a favor del uso de fibras sintéticas que son más económicas; sin embargo, en la actualidad nuevas políticas ambientales a nivel mundial promueven el uso de materiales biodegradables que reduzcan la utilización de subproductos del petróleo como los polímeros sintéticos. En consecuencia, las fibras naturales son tema de actualidad y gran interés a todo nivel; industrialmente son atractivas debido a su bajo impacto ambiental, su biodegradabilidad y bajo costo, y sus interesantes propiedades aislantes (térmicas y acústicas) y mecánicas (flexibilidad y resistencia a la tensión) (2).
Los compositos son materiales hechos de dos o más elementos, en los que uno está en mayor proporción que los demás. En la búsqueda de soluciones para los problemas ambientales y de sostenibilidad, se han realizado grandes avances en el campo de la llamada 'tecnología verde' que han resultado en el desarrollo de materiales híbridos de alto rendimiento hechos a partir de fuentes naturales; un ejemplo son los biocompositos. En éstos, una de las fases constituyentes es un polímero natural, por lo que el uso de fibras naturales en estos materiales se ha incrementado debido a su relativo bajo costo, su habilidad para ser reciclados y el hecho de que pueden competir muy bien, en términos de funcionalidad, con las fibras sintéticas. Dentro del grupo de los biocompositos se destacan los nanocompositos, en los que una de las fases tiene dimensiones en el rango nanométrico. Estos materiales se destacan por sus excelentes propiedades térmicas, mecánicas y aislantes, aún con un contenido muy bajo de la fase nano. La unión de nano y biocompositos lleva el desarrollo de un nuevo material llamado bionanocomposito, que se caracteriza por ser amigable con el medio ambiente y poseer óptimas propiedades térmicas, mecánicas y aislantes (3-5).
Las nanopartículas (NPs), que corresponden a la fase de rango nanométrico de los bionanocompositos, se definen como clusters de átomos en un rango de tamaño entre 1 y 100 nm. Estos materiales son de gran interés debido a sus propiedades únicas, cuando se comparan con el bulk de coloración, reactividad química, absorción de radiación, elevada relación área/volumen y en algunas –como las nanopartículas de plata (Ag NPs)–, comprobada actividad antimicrobial. La mayoría de reportes en la literatura referencian la síntesis de nanopartículas en fase acuosa, que requiere emplear agentes estabilizantes y encapsulantes para prevenir la agregación (6-9).
Las fibras naturales de celulosa son atractivas como matrices para la síntesis in situ de nanopartículas por dos razones: 1) la superficie de las fibras posee una porosidad innata que facilita la adherencia o deposición de las nanopartículas, y 2) su estructura nanoporosa, con alta densidad de oxígeno, funciona como un nanoreactor para su formación y estabilización. La síntesis in situ permite obtener una fibra con recubrimiento uniforme en la que las nanopartículas se encuentran ancladas y estabilizadas firmemente con la matriz celulósica sin necesidad de recurrir a 'monocapas' que eviten la agregación del nanomaterial (10-13).
La utilización de las fibras duras para la síntesis de bionanocompositos tiene obvias ventajas que dependen del uso final que se quiera dar al material. La síntesis de nuevos materiales funcionales que combinen las ventajas de una matriz celulósica polimérica biodegradable, económica y con alta resistencia mecánica, con la actividad de las Ag NPs es un área de investigación muy activa en la actualidad. Aunque la síntesis in situ de Ag NPs sobre fibras naturales blandas como el algodón, la seda y la lana es un proceso relativamente sencillo, previamente reportado en la literatura (14-16), existen muy pocos reportes sobre esta síntesis utilizando como matriz fibras celulósicas duras como el fique. Los bionanocompositos a base de fibras duras pueden perfectamente ser usados bajo condiciones extremas de temperatura, humedad y presión, sin que se afecte su funcionalidad, a diferencia de los bionanocompositos hechos de fibras blandas, cuyos usos se limitan a la industria textil debido a su resistencia mecánica y química inferior (12, 13).
Materiales y métodos
Reactivos
El nitrato de plata (AgNO3) con grado analítico se adquirió de Carlo Erba® (Milan, Italia); el borohidruro de sodio (NaBH4) con grado analítico provino de Merck® (Darmstad, Alemania). Los reactivos se usaron sin ningún tratamiento, tal y como fueron recibidos del proveedor. Para la preparación de las soluciones siempre se usó agua desionizada con una resistividad eléctrica<18.2 MΩ.
Pretratamiento de las fibras de fique
Las fibras de fique fueron suministradas por la Asociación de Fiqueros de Santander (Asedefique). Las fibras crudas, tal y como se recibieron del proveedor, se limpiaron y cepillaron con un cepillo metálico para eliminar restos de material vegetal y otras impurezas. A continuación, se sometieron a limpieza asistida por ultrasonido utilizando un baño ultrasónico Bransonics® (40 kHz, 130 W) dentro del cual se sumergieron en agua durante 120 minutos a 40 °C. Finalmente se secaron en un horno a 60 °C durante la noche.
Síntesis de nanopartículas de plata
El procedimiento de síntesis consistió en disponer las fibras de fique limpias en soluciones de la sal precursora (AgNO3) durante tiempos variables y bajo la influencia de ondas de ultrasonido. A continuación, las fibras se lavaron abundantemente con agua desionizada y se dispusieron en una solución acuosa de borohidruro de sodio (NaBH4) bajo concentración y tiempo variables y en condiciones ultrasónicas. Finalmente se secaron a 60 °C durante la noche.
Las variaciones de los parámetros experimentales durante la síntesis se resumen en la Tabla 1. Se inició con la variación de los tiempos de inmersión en las soluciones precursora y reductora, por lo que las condiciones óptimas obtenidas de estos procedimientos fueron las usadas en los demás experimentos. Al final, se presentan los resultados obtenidos al realizar la síntesis de las NPs de Ag usando las condiciones más favorables obtenidas en cada paso.
Caracterización del bionanocomposito sintetizado
Espectroscopia de Reflectancia Difusa - ultravioleta-visible
Los bionanocompositos de fibras de fique y Ag NPs se caracterizaron mediante espectroscopia de reflectancia difusa - ultravioleta-visible (RD UV-Vis) utilizando un espectrofotómetro UV-Vis Shimadzu® 2401 PC, equipado con lámpara de deuterio y halógeno. Los espectros de reflectancia (%R) se adquirieron realizando un barrido espectral desde 200 a 800 nm con una velocidad de escaneo media y slit de 5.0 nm. Para todas las mediciones se utilizaron fibras de fique limpias como blanco. El software Origin® (Northampton, MA, EUA) se utilizó para establecer los parámetros característicos de las bandas de reflectancia en el espectro UV-Vis: porcentaje de reflectancia (%R), longitud de onda de mínima de reflectancia, ancho de la banda a la altura media y corrimiento del mínimo.
Microscopía electrónica de barrido de emisión de campo
El análisis de las fibras limpias se realizó con un microscopio electrónico de barrido de emisión de campo (FESEM) marca Quanta® FEG 650 FEI a 10 kV dotado con un detector de campo amplio (Large Field Detector, LFD). El análisis elemental, a 10 kV, se realizó con un aditamento de espectroscopia de rayos X por energía dispersiva (EDX). El análisis de los bionanocompositos se hizo en un equipo LEO 1550 Fesem a 5 kV, con un detector de lente. El análisis elemental, a 20 kV, se realizó con un aditamento de espectroscopia de rayos X por energía dispersiva (EDX).
Difracción de Rayos X
El analisis de las muestras se realizo en un difractometro de rayos-X marca BRUKER® modelo D8 Discover con Geometria DaVinci usando radiacion Cu-Kα (λ = 1.5406 Å) a 40 kV y 30 mA. Las muestras fueron cortadas y montadas en un portamuestra de polimetilmetacrilato (PMMA) mediante la tecnica de llenado frontal.
Resultados y discusión
Pretratamiento de las fibras de fique
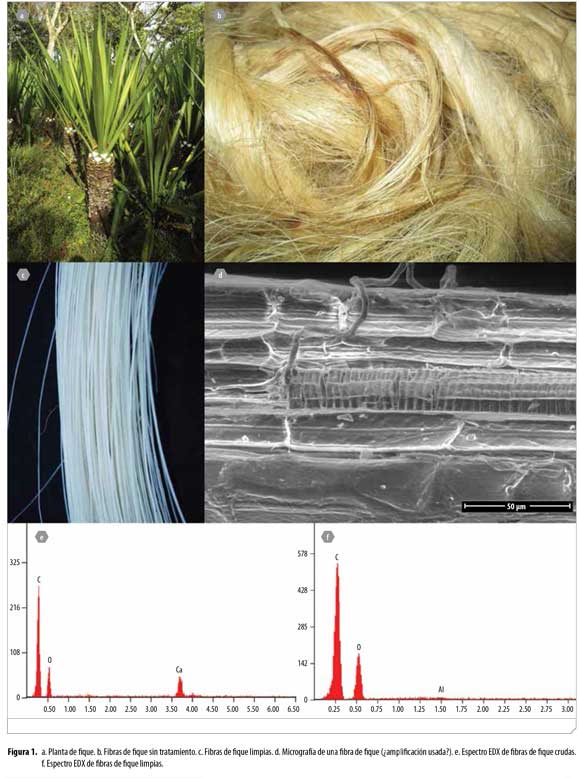
En términos generales el proceso de beneficio de la planta de fique (Figura 1a) está conformado por las siguientes actividades: corte, desespinado y desfibrado de las hojas, seguido por el lavado, secado, peinado y empacado de las fibras. El material resultante de este proceso se considera como fibra cruda con alto contenido de impurezas, como pigmentos vegetales y residuos sólidos orgánicos e inorgánicos que posteriormente deben eliminarse mediante procesos de refinación de la fibra, dependiendo de su uso final. En nuestro caso, las fibras crudas (Figura 1b) se sometieron inicialmente a un cepillado manual para eliminar impurezas, seguido por una limpieza asistida por radiación ultrasónica para eliminar el carbonato de calcio y la lignina. Este proceso permite obtener una fibra limpia con una coloración un poco más clara que la de las fibras crudas (Figura 1c). En la Figura 1d se observa, además, una micrografía SEM, en la que se aprecia la morfología superficial de la fibra de fique. Las fibras de fique son estructuras complejas compuestas por microfibras paralelas unidas por lignina y hemicelulosa (17,18). Adicionalmente dentro de su estructura presentan microfibras helicoidales, dispuestas a lo largo de la fibra principal, responsables de las excelentes propiedades mecánicas de la fibra.
La eliminación del carbonato de calcio, luego de la limpieza mediante irradiación ultrasónica, pudo comprobarse en los espectros de EDX mostrados en las Figuras 1e y 1f, que corresponden a las fibras antes y después de la limpieza, respectivamente. En el espectro de la Figura 1e se observa la presencia de señales relativas a la presencia de carbono y oxígeno en la celulosa, junto con la señal del calcio. Luego de la limpieza (Figura 1f), se elimina la señal del calcio. Adicionalmente aparece una señal con muy baja intensidad de aluminio, posiblemente debida a la superficie sobre la que se secaron las fibras.
Síntesis de nanopartículas de plata
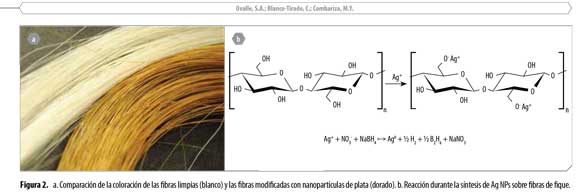
La luz interactúa con las nanopartículas de metales nobles causando que los electrones de la banda de conducción oscilen a frecuencias específicas, como respuesta al campo magnético alternante, lo cual resulta en colores brillantes y llamativos. Esta propiedad, conocida como LSPR (Localized Surface Plasmon Resonance), depende significativamente de la forma, tamaño, composición, entorno y espacio entre partículas. Aunque se pueden obtener espectros UV-Vis para todos los metales, sólo los metales nobles (plata, oro, platino, paladio, cobre) presentan resonancia plasmónica superficial localizada en la región visible, lo que les confiere colores intensos característicos. Cuando las NPs no son esféricas (cilindros, prismas, discos, etc.) existen dos bandas de resonancia plasmónica, que se relacionan con los ejes transversal y longitudinal de las mismas y generan diferentes coloraciones como verde, azul o rojo (19). Cuando se realiza síntesis en solución de NPs es relativamente sencillo modificar su geometría, por lo que pueden conseguirse gran variedad de colores en fase acuosa. Sin embargo, esto no ocurre al depositar las NPs sobre soportes sólidos, como en el caso de la síntesis in situ usando como matriz fibras de fique. Consecuentemente, en todos nuestros experimentos la síntesis de NPs de plata sobre las fibras de fique siempre estuvo caracterizada por la aparición de una coloración dorada en la fibra, típica de las presencia de Ag NPs esféricas (10), tal como se observa en la Figura 2a.
Existen ventajas inherentes a la estructura de la celulosa y sus propiedades fisicoquímicas que la hacen una matriz adecuada para la deposición in situ de nanomateriales. La celulosa posee una carga parcial negativa debido a su alta densidad de oxígeno que facilita la interacción electrostática con iones de metales de transición electropositivos como la plata. Esta interacción ocurre en la etapa de inmersión de las fibras en la solución del precursor durante el proceso de síntesis in situ. Una vez depositados los iones Ag+ sobre la superficie de la fibra se procede a realizar su reducción con NaBH4, momento en el que inicia la formación de las Ag NPs
La formación de NPs tiene lugar en tres pasos fundamentales: nucleación, crecimiento y estabilización. La nucleación inicia una vez se agrega el NaBH4 que actúa como agente reductor para convertir los iones de plata, unidos electrostáticamente a la superficie de las fibras de fique, en plata metálica. Los átomos de plata neutros comienzan a agregarse y la nanoestructura crece sobre la superficie donde inicialmente se formaron los núcleos hasta alcanzar un volumen estable que depende de las condiciones de síntesis. Finalmente, la estructura porosa de la celulosa estabiliza las NPs de plata mediante un efecto similar al denominado 'efecto éter corona', gracias a la alta densidad de átomos de oxígeno que rodean la nanopartícula. La reacción general se observa en la Figura 2b (11, 20-22). Esta estabilización ha sido observada y reportada previamente por nuestro grupo, en biocompositos de nanopartículas de óxidos de metales de transición y fibras de fique (13).
La espectroscopia de reflectancia difusa UV-Vis se utilizó para determinar las condiciones óptimas de síntesis. Las Ag NPs son de forma esférica, tanto en solución como soportadas, y presentan bandas de absorción características en la región entre 400 y 480 nm. Estas señales se deben a fenómenos de resonancia plasmónica superficial que tienen su origen en la excitación colectiva de electrones libres en las NPs. Durante la síntesis de NPs sobre la superficie de las fibras de fique para la formación de bionanocompositos, se busca que las NPs sean del menor tamaño posible, que la distribución de tamaños sea uniforme y que las NPs se encuentren bien distribuidas sobre la superficie de las fibras sin formar agregados. Los tamaños pequeños son deseables debido a que en las NPs de menor tamaño hay mayor cantidad de átomos en su superficie, lo que aumenta la reactividad del material. Por otra parte, la mayor cantidad de NPs sobre la superficie de las fibras incrementa también el área superficial disponible para reacciones o para interacciones de quimisorción específicas. A partir de los análisis de reflectancia difusa (RD) es posible obtener información cualitativa sobre el tamaño, distribución y cantidad del nanomaterial sobre la superficie de la fibra. Por ejemplo, es posible correlacionar el tamaño de las NPs con la longitud de onda de mínima reflectancia (máxima absorción) en el espectro de RD, pues a menor tamaño de NPs hay un corrimiento del mínimo de reflectancia a menores longitudes de onda (23). Por otro lado, el porcentaje de reflectancia difusa se relaciona con la cantidad de NPs presentes en la superficie de la fibra, ya que un menor porcentaje de reflectancia indica una mayor cantidad de NPs sobre la superficie de las fibras. Adicionalmente, se puede inferir una idea aproximada de la distribución de tamaños del nanomaterial a partir del ancho de la banda de reflectancia: a menor ancho del pico a la altura media, se esperan tamaños uniformes en las NPs depositadas (24-26).
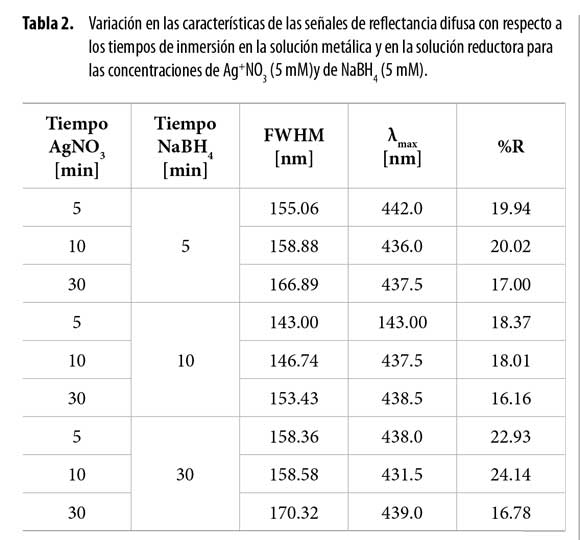
En la Tabla 2 se presentan los resultados obtenidos para determinar el tiempo óptimo de permanencia de las fibras de fique en la solución metálica y en la solución reductora bajo condiciones ultrasónicas. Debido a que no hubo variaciones significativas en la longitud de onda de máxima absorción (λmax), se tomó en cuenta únicamente el porcentaje de reflectancia (%R). Así, puede notarse que el menor porcentaje de reflectancia en todos los casos se observa al mantener las fibras en la solución metálica durante 30 minutos (17.00, 16.16 y 16.78%). Al tomar en cuenta la variación del tiempo de inmersión en la solución reductora en la Tabla 2, se observa que el menor porcentaje de reflectancia se dio al disponer las fibras en la solución reductora durante 10 minutos (18.37, 18.01 y 16.16%), con lo que se concluyó que estos eran los tiempos adecuados de síntesis. En cuanto al ancho del pico a la altura media (FWHM), se observa que al dejar las fibras durante 10 minutos en la solución reductora, la distribución de tamaños del nanomaterial es menor comparada a los demás tiempos de acuerdo con los valores de FWHM registrados para estas condiciones (143.00, 146.74, 153.43 nm), lo que apoya la conclusión de que 10 minutos es el mejor tiempo para realizar la reducción.
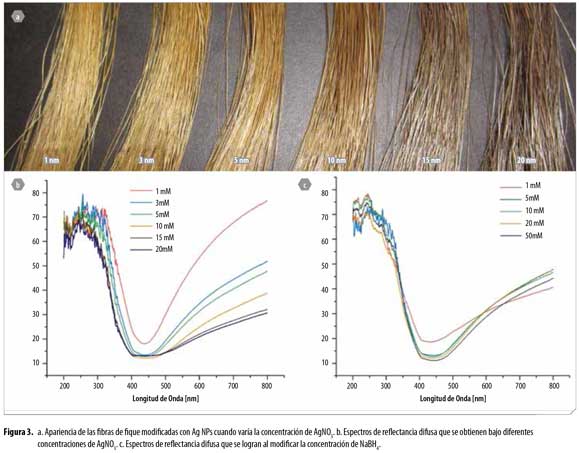
Una vez seleccionados los tiempos de inmersión en la solución precursora y de reducción en la solución de NaBH4, se determinó el efecto de la concentración del precursor sobre las características del recubrimiento de Ag NPs sobre la superficie de las fibras de fique. La Figura 3a, muestra que al variar la concentración de la solución de nitrato de plata se presentaun cambio en la coloración de las fibras de fique modificadas: a mayor concentración de precursor se observa una coloración más oscura en la fibra. En este procedimiento la concentración de NaBH4 se mantuvo en 5 mM y se usaron los tiempos de impregnación determinados en la sección inicial, 30 minutos en la solución de nitrato de plata y 10 minutos en la solución reductora, todo bajo condiciones ultrasónicas.El análisis RD (Figura 3b) permite observar que cuando la síntesis in situ se realiza utilizando una concentración del precursor de 3 mM, se registra un porcentaje de reflectancia bajo, un menor ancho de banda y menor longitud de onda de máxima absorción. Estas caracerísticas del espectro de reflectancia indican la formación de gran cantidad de NPs muy pequeñas, bien dispersas y de tamaños uniformes. Se observa un comportamiento similar en las curvas de reflectancia en las concentraciones de 1 a 10 mM, pero a partir de 15 mM la curva empieza a comportarse diferente, indicando que el material depositado está en forma de agregados o cristales micrométricos.
La tendencia general es que a mayor concentración del precursor, menor porcentaje de reflectancia (mayor cantidad de NPs), pero, al tomar en cuenta las longitudes de onda de máxima absorción, se observó que eran 438.5, 437, 437.5 y 441.5 nm para las concentraciones de 1, 3, 5 y 10 mM respectivamente. Así, puede observarse que al utilizar la concentración de 3 mM no sólo se está formando una cantidad similar de NPs a la obtenida con las concentraciones de 5 y 10 mM, sino que además se están formando nanopartículas de menor tamaño.
El siguiente parámetro optimizado fue la concentración del agente reductor bajo condiciones ultrasónicas, manteniendo la concentración del AgNO3 en 5 mM y los tiempos de inmersión en las soluciones precursora y de NaBH4 en 30 y 10 minutos, respectivamente. En este caso, la coloración de las fibras no cambió significativamente. Es posible concluir, a partir de los análisis de RD (Figura 3c), que la concentracion óptima del agente reductor es 20 mM. Si bien al aumentar la concentración del agente reductor disminuye el porcentaje de reflectancia, también es evidente el corrimiento en el máximo de absorbancia (437.5, 439.5, 436 y 443.5 nm para las concentraciones de 5, 10, 20 y 50 mM respectivamente), lo que indica que a la concentración de 20 mM de NaBH4 se estaban generando las NPs más pequeñas. El ancho del pico a la altura media no fue un factor muy influyente en este caso pues, como se observa, todas las curvas presentaron un valor muy similar.Teniendo en cuenta las condiciones de síntesis descritas anteriormente (concentración de AgNO3 de 3 mM, concentración de NaBH4 de 20 mM, 30 minutos de inmersión en AgNO3 y 10 minutos de inmersión en NaBH4, todo bajo condiciones ultrasónicas), se realizó la síntesis del bionanocomposito y se procedió a su caracterización por RD, FESEM, y DRX. Para la muestra sintetizada bajo condiciones óptimas se determinó, en el espectro de RD (no mostrado aquí), una longitud de onda de máxima absorción de 436.5 nm, con R% de 13.35 y FWHM de 151 nm.
Por su parte, la distribución y características morfológicas del recubrimiento de Ag NPs sobre fibras de fique, en condiciones óptimas de síntesis, fueron estudiadas mediante microscopía Fesem y análisis EDX, como se observa en la Figura 4. El análisis Fesem permite establecer que, bajo las condiciones de síntesis seleccionadas, es posible obtener una distribución uniforme de Ag NPs sobre la superficie de la fibra de fique sin el desarrollo de aglomerados (Figura 4a). Adicionalmente, las NPs depositadas sobre la fibra tienen geometría esférica con diámetros alrededor de 40 nm. En la Figura 4b se reporta el espectro EDX del biocomposito en el cual se observan las señales de carbono y óxigeno, propias de la matriz celulósica de las fibras de fique, junto con señales de plata debidas a la presencia del nanometerial depositado sobre la superficie de las fibras.
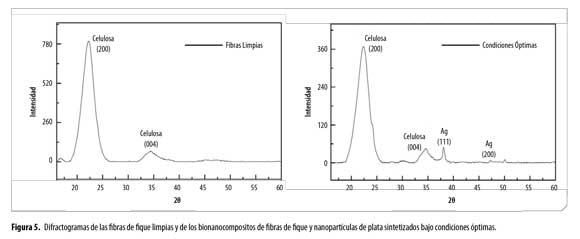
Finalmente, los análisis DRX de las fibras limpias y las fibras modificadas con nanopartículas de plata usando condiciones óptimas se muestran en la Figura 5. En el difractograma de las fibras limpias se observan señales características de la estructura cristalina de la celulosa tipo I, típica de las fibras celulósicas vegetales, en 2θ = 22.26 (2 0 0) y 34.39 (0 0 4). Por otra parte, en el difractograma del bionanocomposito se observan señales correspondientes a la plata en una estructura cristalina cúbica centrada en las caras (27-29) en 2θ = 38.08 (1 1 1) y 47.30 (2 0 0). Adicionalmente, también se observan las señales de la celulosa tipo I, indicando que la modificación superficial con Ag NPs no alteró la estructura de la matriz celulósica.
Conclusiones
Las fibras de fique funcionan como una matriz efectiva para la síntesis in situ de nanopartículas de plata debido a la alta densidad electrónica de la celulosa; esta cualidad permite la adsorción de cationes de plata y su estabilización en la superficie de la fibra una vez ocurre el proceso de reducción. Aunque el aumento en la concentración de la sal precursora afecta directamente la cantidad de material depositado sobre las fibras, también influye positivamente en su tamaño y distribución. El incremento en la concentración del agente reductor durante la síntesis in situ de Ag NPs resulta en un aumento de la absorción de radiaciónelectromagnética (mayor cantidad de material depositado sobre las fibras) con un corrimiento a mayores longitudes de onda (NPs de mayor tamaño). Los análisis efectuados mediante Fesem y DRX permitieron corroborar la presencia de nanopartículas de plata sobre la superficie de las fibras de fique.
El bionanocomposito desarrollado a partir de fibras de fique y NPs de plata hace posible su uso potencial en la elaboración de material filtrante con propiedades antibacteriales, como ya se ha comprobado en estudios hechos en nuestro grupo de investigación, que será tema de una próxima publicación.
Referencias
1. Guía ambiental del subsector fiquero. Ministerio de Ambiente, Vivienda y Desarrollo Territorial. Ministerio de Agricultura y Desarrollo Rural. Departamento Nacional de Planeación. Segunda Edición, Bogotá D.C.2006. [ Links ]
2. Mohanty, A. K.; Misra, M.; Drzal, L. T.; Selke, S. E.; Harte, B. R.; Hinrichsen, G. Natural Fibers, Biopolymers and Biocomposites: An Introduction. Natural Fibers, Biopolymers and Biocomposites. United States of America, Taylor & Francis Group, CRC Press. 2005.1-37. [ Links ]
3. Oksman, K.; Mathew, A. P.; Bondeson, D.; Kvien, I. Manufacturing process of cellulose whiskers/polylactic acid nanocomposites. Composites Science and Technology. 2006.66: 2776-2784. [ Links ]
4. Faruk, O.; Bledzki, A. K.; Fink, H. P.; Sain, M. Biocomposites reinforced with natural fibers: 2000-2010. Progress in Polymer Science.2012.37: 1552- 1596. [ Links ]
5. John, M. J.; Thomas, S. Biofibres and biocomposites. Carbohydrate Polymers. 2008.71: 343-364. [ Links ]
6. Martínez-Castañón, G. A.; Niño-Martínez, N.; Martínez-Gutierrez, F.; Martínez-Mendoza, J. R.; Ruiz, Facundo. Synthesis and antibacterial activity of silver nanoparticles with different sizes. Journal of Nanoparticle Research. 2008.10: 1343-1348. [ Links ]
7. Ruparelia, J. P.; Chatterjee, A. K.; Duttagupta, S. P.; Mukherji, S. Strain specificity in antimicrobial activity of silver and copper nanoparticles. Acta Biomaterialia. 2008.4: 707-716. [ Links ]
8. Fernández, A.; Picouet, P.; Lloret, E. Cellulose-silver nanoparticle hybrid materials to control spoilage-related microflora in absorbent pads located in trays of fresh-cut melon. International Journal of Food Microbiology. 2010.142: 222-228. [ Links ]
9. Vainio, U.; Pirkkalainen, K.; Kisko, K.; Goerigk, G.; Kotelnikova, N. E.; Serimaa, R. Copper and copper oxide nanoparticles in a cellulose support studied using anomalous small-angle X-ray scattering. The European Physical Journal D. 2007.42: 93-101. [ Links ]
10. Tan, Y.; Dai, X.; Li, Y.; Zhu, D. Preparation of gold, platinum, palladium and silver nanoparticles by the reduction of their salts with a weak reductant-potassium bitartrate. Journal of Materials Chemistry. 2003.13: 1069-1075. [ Links ]
11. Patakfalvi, R.; Oszkó, A.; Dékány, I. Synthesis and characterization of silver nanoparticle/kaolinite composites. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2003.220: 45-54. [ Links ]
12. Castellanos, L. J.; Blanco, C.; Hinestroza, J. P.; Combariza, M. Y. In-situ synthesis of gold nanoparticles using fique natural fibers as template. Cellulose. 2012.19: 1933-1943. [ Links ]
13. Chacón, M. L.; Blanco, C. Combariza, M. Y. Green biocomposite of nanostructured MnO2 and Fique fibers for efficient dye degradation. Green Chemistry, In Press.Green Chem., DOI:10.1039/C3GC40911B. [ Links ]
14. Chen, C. Y.; Chiang, C. L. Preparation of cotton fibers with antibacterial silver nanoparticles. Materials Letters. 2008.62: 3607-3609. [ Links ]
15. Abbasi, A. R.; Morsali, A. Formation of silver iodide nanoparticles on silk fiber by means of ultrasonic irradiation. Ultrasonics Sonochemistry. 2010.17: 704-710. [ Links ]
16. Ki, H. Y.; Kim, J. H.; Kwon, S. C.; Jeong, S. H. A study on multifunctional wool textiles treated with nano-sized silver. Journal of Materials Science. 2007.42: 8020-8024. [ Links ]
17. Lerouxel, O.; Cavalier, D. M.; Liepman, A. H.; Keegstra, K. Biosynthesis of plant cell wall polysaccharides — a complex process. Current Opinion in Plant Biology. 2006.9:621-630. [ Links ]
18. Delmer, D. P.; Amor, Y. Cellulose Biosynthesis. The Plant Cell. 1995.7: 987-1000, [ Links ]
19. Tang, B.; Wang, J.; Xu, S.; Afrin, T.; Xu, W.; Sunb, L.; Wangb, X. Application of anisotropic silver nanoparticles: Multifunctionalization of wool fabric. Journal of Colloid and Interface Science. 2011.356: 513-518. [ Links ]
20. Bjorge, D.; Daels, N.; De Vrieze, S.; Dejans, P.; Van Camp, T.; Audenaert, W.; Hogie, J.; Westbroek, P.; De Clerck, K.; Van Hulle, S. W. H. Performance assessment of electrospun nanofibers for filter applications. Desalination. 2009.249: 942-948. [ Links ]
21. Travan, A.; Pelillo, C.; Donati, I.; Marsich, E.; Benincasa, M.; Scarpa, T.; Semeraro, S.; Turco, G.; Gennaro, R.; Paoletti, S. Non-cytotoxic Silver Nanoparticle-Polysaccharide Nanocomposites with Antimicrobial Activity. Biomacromolecules. 2009.10: 1429-1435. [ Links ]
22. Jin, R.; Cao, Y.; Mirkin, C. A.; Kelly, K. L.; Schatz, G. C.; Zheng, J. G. Photoinduced Conversion of Silver Nanospheres to Nanoprisms. Science. 2001.294: 1901-1903. [ Links ]
23. Brittain, H. G. UV/VIS Reflectance Spectroscopy. En: Spectroscopy of Pharmaceutical Solids. Brittain, H. G., New Jersey: Taylor & Francis Group. 2006. 121-149. [ Links ]
24. Sharma, V. K.; Yngard, R. A.; Lin, Y. Silver nanoparticles: Green synthesis and their antimicrobial activities. Advances in Colloid and Interface Science. 2009.145: 83-96. [ Links ]
25. Jain, P.; Pradeep, T. Potential of Silver Nanoparticle-Coated Polyurethane Foam As an Antibacterial Water Filter. Biotechnology and Bioengineering. 2005.90: 59-63. [ Links ]
26. An, Jing; Wang, De-Song; Yuan, Xiao-Yan. Synthesis of Stable Silver Nanoparticles with Antimicrobial Activities in Room-temperature Ionic Liquids. Chemical Research in Chinese Universities. 2009.25: 421-425. [ Links ]
27. Bankar, A; Joshi, B.; Kumara, A. R.; Zinjarde, S. Banana peel extract mediated novel route for the synthesis of silver nanoparticles. Colloids and Surfaces A: Physicochem. Eng. Aspects.2010.368: 58-63. [ Links ]
28. Shaligram, N. S.; Bule, M.; Bhambure, R.; Singhal, R. S.; Singh, S. K.; Szakacs, G.; Pandey, A. Biosynthesis of silver nanoparticles using aqueous extract from the compactin producing fungal strain. Process Biochemistry.2009.44: 939-943. [ Links ]
29. Kora, A. J.; Sashidharb, R. B.; Arunachalam, J. Gum kondagogu (Cochlospermum gossypium): A template for the green synthesis and stabilization of silver nanoparticles with antibacterial application. Carbohydrate Polymers.2010.82: 670-679. [ Links ]
30. Mandal, A.; Chakrabarty, D. Isolation of nanocellulose from waste sugarcane bagasse (SCB) and its characterization. Carbohydrate Polymers.2011.86: 1291- 1299. [ Links ]
31. Sèbe, G.; Ham-Pichavant, F.; Ibarboure, E.; Chantal Koffi, A. L.; Tingaut, P. Supramolecular Structure Characterization of Cellulose II Nanowhiskers Produced by Acid Hydrolysis of Cellulose I Substrates. Biomacromolecules. 2012.13: 570-578. [ Links ]