Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Química
versão impressa ISSN 0120-2804
Rev.Colomb.Quim. vol.42 no.1 Bogotá jan./abr. 2013
Oxidación catalítica de tolueno y 2-propanol sobre óxidos mixtos de Mn y Co obtenidos por coprecipitación
Catalytic oxidation of toluene and 2-propanol over Mn and Co mixed oxides obtained by coprecipitation method
A oxidação catalítica de tolueno e 2-propanol em óxidos mistos de Mn e de Co, obtidos por coprecipitação
María H. Castaño1, Rafael Molina1, Sonia Moreno1*
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Crr. 30 No. 45-03, Bogotá DC, Colombia.
Grupo de investigación Estado Sólido y Catálisis Ambiental (Esca).
* Autor para correspondencia: smorenog@unal.edu.co
Recibido: 21 de enero de 2013 • Aceptado: 29 de abril de 2013
Resumen
Óxidos mixtos de manganeso y cobalto, con relaciones molares M2++Mg2+ /M3+=3 y M2+/ Mg2+=1, fueron preparados por el método de coprecipitación. Los sólidos fueron caracterizados mediante las técnicas de difracción de rayos X (XRD), temperatura programada de reducción (TPR-H2) y adsorción de N2 en área superficial; éstos fueron empleados para la oxidación catalítica de una mezcla de dos compuestos orgánicos representativos de COVs: el tolueno y el 2-propanol. El óxido mixto de manganeso logró el 100% de oxidación de la mezcla de COVs, mientras que el óxido mixto de cobalto no alcanzó una oxidación total.
El catalizador Mn-Mg-Al presentó las menores temperaturas de oxidación de tolueno y 2-propanol en la mezcla, haciéndolo el catalizador más eficiente. El desempeño catalítico superior de dicho óxido se asocia principalmente con su mejor comportamiento redox, comparado con el del óxido de cobalto. Con el fin de evaluar el efecto de la composición del reactivo, se estudió la oxidación catalítica individual de tolueno y 2-propanol sobre el óxido mixto de manganeso. El catalizador fue activo en la oxidación de los dos COVs individuales, pero el tolueno fue el compuesto más difícil de oxidar. Dicho catalizador mostró 100% de conversión del tolueno hacia CO2, mientras que el 2-propanol produjo primero acetona, la cual posteriormente fue oxidada hasta CO2. Las temperaturas de oxidación de los componentes en la mezcla de COVs fueron superiores que en la conversión individual de tolueno y 2-propanol. Este resultado sugiere un posible efecto inhibitorio en la oxidación de 2-propanol cuando se tienen mezclas de los COVs.
Palabras clave: coprecipitación, óxido mixto, compuestos orgánicos volátiles, COVs.
Abstract
Manganese and cobalt mixed oxides with M2++Mg2+/M3+=3 y M2+/Mg2+=1 ratios were obtained by the coprecipitation method. The solids were characterized using X-ray diffraction (XRD), temperature-programmed reduction (H2-TPR), N2 adsorption and in the catalytic oxidation of two VOCs: toluene and 2-propanol. Manganese mixed oxide reached 100% conversion of the mixture of VOCs while cobalt mixed oxide did not achieve a complete oxidation. The catalyst Mn-Mg-Al showed the lowest temperature oxidation of toluene and 2-propanol in the mixture. The highest performance of the oxide catalyst Mn-Mg-Al is associated with the better redox potential in the manganese catalyst.
Manganese mixed oxide was active in the oxidation of the single VOCs, where the scale of difficulty to oxidize the different organic compounds evaluated was: 2-propanol < toluene. The mixed oxide showed 100% conversion to CO2 in the oxidation of toluene, while the 2-propanol was first oxidized to acetone. It suggests that there is an inhibitory effect on the oxidation of 2-propanol in the mixture of VOCs.
Keywords: Coprecipitation, mixed oxides, volatile organic compounds, VOCs.
Resumo
Óxidos mistos de cobalto e manganês com relações M2++Mg2+/M3+=3 y M2+/ Mg2+=1 foram preparados pelo método de coprecipitação. Os sólidos foram caracterizados pelas técnicas de difração de raios-X (XRD), temperatura programada de redução (TPR-H2), área superficial adsorção do N2 e na oxidação catalítica de dois compostos orgânicos representativos (COVs): tolueno e 2-propanol. O catalisador Mn-Mg- Al apresentou as menores temperaturas de oxidação da mistura, fazendo-lo o catalisador mais eficiente. O desempenho catalítico superior do óxido Mn-Mg-Al está associado principalmente a seu melhor desempenho redox em comparação com o óxido de cobalto. Mn-Mg-Al catalisador foi ativo na oxidação dos dois individuais COVs, sendo o tolueno o composto mais difícil de oxidar seguido do 2-propanol. Óxidos mistos de manganês mostro 100% de conversão até CO2 para tolueno, enquanto que o 2-propanol produz em primeiro lugar acetona, que posteriormente é oxidada a CO2.
Temperaturas de oxidação dos componentes da mistura de compostos orgânicos voláteis é maior do que a única conversão de tolueno e 2-propanol. Este resultado sugeriu um possível efeito inibitório sobre a oxidação de 2-propanol ao ter misturas de COV.
Palavras-chave:coprecipitação, óxidos mistos, compostos orgánicos volatiles, COVs.
Introducción
Los compuestos orgánicos volátiles (COVs) son aquellos compuestos que a la temperatura de 293.15 K presentan una presión de vapor de 0.01kPa o superior, o una volatilidad equivalente a las condiciones particulares de uso (1). De acuerdo con la EPA (Environmental Protection Agency de los EUA) los COVs se definen como compuestos de carbono que tienen una alta actividad fotoquímica (capacidad de reaccionar con los óxidos de nitrógeno y otros contaminantes atmosféricos en presencia de la luz solar para formar oxidantes fotoquímicos); de tal definición se excluyen el carbono, el monóxido de carbono, el dióxido de carbono y los compuestos con enlaces metal-carbono (2).
Debido a los efectos adversos ocasionados por los COVs, existen acuerdos internacionales y nacionales que regulan y previenen la emisión de estos compuestos contaminantes a la atmósfera y al medio ambiente. Por ejemplo, en Colombia existe la Resolución 610 de 2010 que establece la normatividad de calidad del aire con el fin de garantizar un ambiente sano y minimizar los riesgos sobre la salud humana causados por la concentración de contaminantes en el aire. Así, para el tolueno el nivel máximo permitido es de 260 μg/m3 por una semana, mientras que para el benceno es de 5 μg/m3 por un tiempo de exposición de un año (3).Con el fin de cumplir las regulaciones establecidas para emisiones de COvs, y teniendo en cuenta el impacto negativo que ejercen estas sustancias, es necesario implementar tecnologías que permitan su eficiente destrucción a un costo energético y económico razonable.
Entre los sistemas más empleados para la eliminación de COVs se encuentran la oxidación térmica y la oxidación catalítica.
La oxidación térmica se lleva a cabo en un rango de temperaturas entre 700 y 1000°C, lo que puede producir niveles altos de óxidos de nitrógeno (NOx) provenientes del nitrógeno presente en el aire, lo que requeriría de un tratamiento posterior de la corriente. Por su parte, la oxidación catalítica disminuye las temperaturas de oxidación hasta 300-500°C y, en consecuencia, generan menor cantidad de NOx (4, 5, 6). En la mayoría de los casos, la oxidación catalítica parece ser la tecnología óptima para reducir drásticamente las emisiones de COVs. Sin embargo, la formulación catalítica encuentra algunas limitaciones en la gran variedad de moléculas de COVs y la naturaleza complicada de las mezclas de COVs, lo que mantiene el interés en la búsqueda de nuevos materiales catalíticos que logren una mayor eficiencia en la eliminación de estos compuestos contaminantes.
Los óxidos mixtos se encuentran dentro de los catalizadores más empleados para la oxidación de COVs. Uno de los métodos más interesantes para obtenerlos es el empleo de hidrotalcitas (HTs) como precursores. Los óxidos obtenidos por el tratamiento térmico de las HTs presentan propiedades únicas como alta área superficial, buena estabilidad térmica, interdispersión homogénea entre los elementos y propiedades básicas, las cuales son características útiles en las reacciones de oxidación (7, 8).
Las emisiones industriales generalmente contienen mezclas de COVs. Se ha reportado que la oxidación de un COV en una mezcla difiere de su oxidación simple debido a la interacción de diferentes especies con el catalizador, razón por la cual es difícil predecir el comportamiento del catalizador y de los COVs en una mezcla.
En la búsqueda de catalizadores útiles para la oxidación de una amplia gama de COVs, en este trabajo se evaluaron óxidos de manganeso y cobalto obtenidos por coprecipitación para la oxidación de una mezcla de tolueno y 2-propanol, lo que, según nuestro conocimiento, aún no ha sido reportado con este tipo de catalizadores.
Materiales y métodos
Síntesis de los óxidos Mn-Mg-Al y Co-Mg-Al
Se adicionaron gota a gota nitratos de Mg2+, Al3+, Mn2+/ Co2+ a una solución 0.2 M de K2CO3 con agitación constante y manteniendo el pH entre 9.5 y 10.5 (mediante adición de una solución 1M de NaOH) y relaciones M2+ + Mg2+ / M3+= 3 y M2+ / Mg2+ =1 (donde M = Mn o Co). El precipitado que se obtuvo fue envejecido durante 18 h sin agitación. Posteriormente, el sólido se lavó y secó a 60ºC en aire por 18 h y se calcinó a 500ºC por 16 h para obtener el respectivo óxido mixto identificado como CPMn1.0 o CPCo1.0
Caracterización de los óxidos M-Mg-Al
Los catalizadores se caracterizaron por difracción de rayos X (DRX), reducción a temperatura programada (TPR-H2), área superficial BET, para luego emplearlos en la oxidación catalítica de una mezcla de dos COVs,: el tolueno y el 2-propanol.
Los patrones de difracción de rayos X fueron tomados con un difractómetro Shimadzu Lab- xrd- 6000 equipado con un ánodo de cobre. Los análisis de reducción a temperatura programada (TPR-H2) fueron realizados en un Chembet 3000 Quantachrome equipado con un detector de conductividad térmica. En la determinación del área superficial (BET) se empleó un sortómetro Asap 2020 MICROMERITICS.
Los sólidos fueron evaluados en la oxidación catalítica de una mezcla de 250 ppm de tolueno y 250 ppm de isopropanol, empleando un caudal de 500 ml/min y 0.200g de catalizador (tamizado <250 μm). La conversión fue obtenida a través de la desaparición del COV y la producción de agua y CO2, otro producto de la reacción, mediante el análisis por espectroscopia de masas (MASS SPECTROMETER BALZERS OMNISTAR).
Resultados y discusión
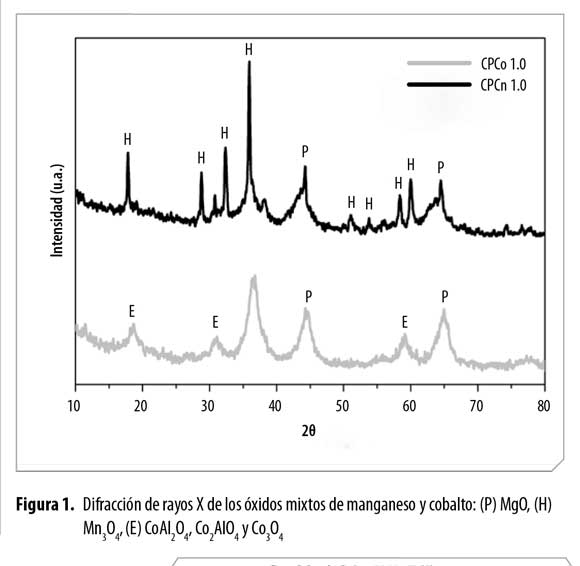
La Figura 1 presenta los patrones de difracción de los óxidos de manganeso y cobalto preparados mediante coprecipitación. El perfil de CPMn 1.0 exhibe las señales propias de la fase periclasa MgO, (JCPDS N°. 045-0946) y hausmanita Mn3O4, (JCPDS N°. 024-0734) junto con las fases espinela del tipo Mn2MgO4 y Mn2AlO4, (JCPDS N°. 023-0392 y JCPDS N°. 029-0881). Para el caso de CPCo 1.0 no se observó la formación de los óxidos CoO y Co2O3. Sin embargo, los iones Co3+/2+ pueden encontrarse en estructuras espinela del tipo CoAl2O4, Co2AlO4 y Co3O4 (JCPDS N°. 044-0160; JCPDS N°. 030-0814; JCPDS N°. 042-1467) cuyas señales se superponen sin que puedan diferenciarse. La señal a 19º2θ podría indicar que Co3+/2+ o Co3O4 se encuentra incorporado dentro la fase espinela Mg-Al (9).
La cristalinidad de los sólidos puede relacionarse con los periodos de envejecimiento que se emplean en esta metodología (18h) los cuales favorecen el crecimiento de cristal y la segregación de fases.
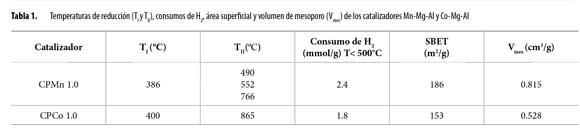
En la Tabla 1 se resumen los resultados de la caracterización de los óxidos mixtos de manganeso y cobalto. El estudio de TPR-H2 para CPMn 1.0 reveló un perfil bastante complejo en razón a los múltiples estados de oxidación del manganeso y a los diferentes ambientes químicos en los que se puede encontrar. El perfil se caracteriza por tener dos regiones de reducción a bajas y altas temperaturas localizadas en los rangos entre 150°C-400°C y 400°-800°C, respectivamente. Las señales en el rango de bajas temperaturas puede ser explicada por la reducción de MnO2/Mn2O3 hasta Mn3O4, mientras que las correspondientes a temperaturas mayores, se asignan a la reducción de Mn3O4 hasta MnO, y a la reducción de especies oxídicas del manganeso que se encuentran dentro de la solución sólida. Estos resultados evidencian que el óxido mixto presenta especies de manganeso con diferente estado de oxidación (10, 11) (las temperaturas máximas de reducción se indican en la Tabla 1).
Así mismo, en los perfiles de reducción de CPCo1.0 se presentan dos señales: a bajas y altas temperaturas. La señal I, a bajas temperaturas (Tabla 1), se atribuye a la reducción de Co3O4 hasta Co metálico. La señal II, a altas temperaturas, se explica por la reducción de especies Co-Al que se encuentran dentro de la solución sólida (12).
De acuerdo con los resultados obtenidos mediante TPR-H2, el sólido que posee mejor comportamiento redox es el CPMn 1.0 quien presenta el mayor consumo de hidrógeno bajo las condiciones de reacción (<500°C). Este consumo de hidrógeno superior refleja una mejor movilidad electrónica y movilidad de oxígeno en el sólido CPMn1.0 lo que probablemente lo convierte en un catalizador más eficiente si se tiene en cuenta que en los óxido mixtos, la oxidación de COVs se lleva a cabo a través de un mecanismo redox conocido como Mars van Krevelen (13).
El análisis textural mostró isotermas tipo II (Iupac) para los dos óxidos que son características de materiales no porosos (14). El área de estos sólidos se deriva de la formación de poros resultantes de la destrucción de los espacios laminares de la hidrotalcita después de la calcinación (pérdida de agua y carbonatos) (15).
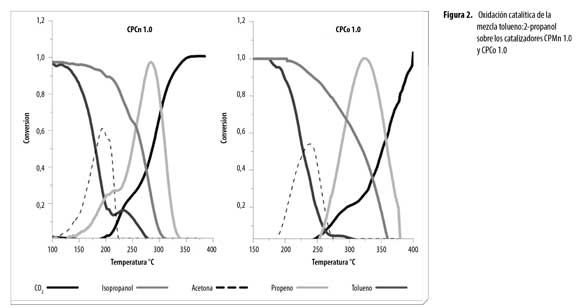
La Figura 2 presenta las curvas de conversión para la mezcla 2-propanol:tolueno sobre CPMn 1.0 y CPCo 1.0. Se observa que la presencia de tolueno inhibe la oxidación de 2-propanol en ambos óxidos. La temperatura de oxidación total a CO2 del 2-propanol sólo es alcanzada cuando todo el tolueno se ha oxidado, lo que hace evidente que la temperatura de conversión total está determinada por la molécula más difícil de oxidar que, en este caso, es el tolueno.
Adicionalmente, se observó la formación de propeno como otro subproducto, el cual desfavorece la oxidación del 2-propanol por requerir temperaturas más elevadas para lograr la oxidación total de propeno hasta CO2. En el caso del sólido CPCo 1.0 sólo se logró conversión total a CO2 a temperaturas elevadas (∼400°C), lo que muestra el fuerte efecto inhibitorio de la mezcla de COVs sobre este catalizador.
Con el fin de conocer el efecto que tiene el empleo de la mezcla de COVs sobre las temperaturas de conversión de los componentes, se evaluó la actividad catalítica del mejor catalizador (CPMn 1.0) en la oxidación individual de tolueno y 2-propanol.Estos resultados son consistentes con los reportes de literaturaen donde la acetonase reporta como producto intermediario en la combustión de 2-propanol.
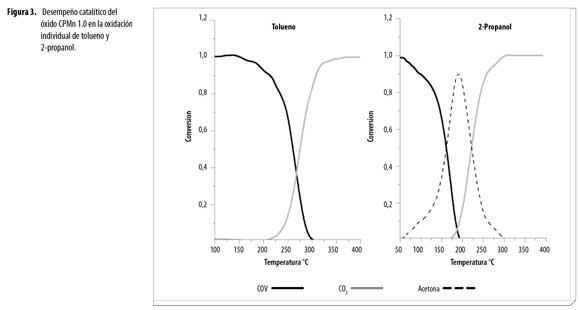
En la Figura 3 se presenta el desempeño catalítico de CPMn1.0 en la oxidación individual de los dos COVs. Se evidencia que la reacción del 2-propanol produce acetona en primer lugar, que posteriormente se oxida hasta CO2. De acuerdo a la literatura, la acetona es el primer producto de la oxidación y es intermediario en la combustión de 2-propanol (16). La formación máxima de acetona se lleva a cabo a bajas temperaturas (∼190°C) y luego se oxida completa y rápidamente hasta CO2 a 290°C.
De otro lado, la oxidación completa de tolueno se lleva a cabo a temperaturas más altas (310°C), con agua y CO2 como únicos productos de la oxidación. Estos resultados muestran que el óxido de Mn-Mg-Al sintetizado por coprecipitación presenta un excelente desempeño catalítico y, por tanto, es un material promisorio en la oxidación de diferentes COVs.
Las temperaturas en donde se alcanza el 50% y 90% de conversión (T50 y T90, respectivamente) del tolueno y el 2-propanol individual y en la mezcla, se muestran en la Tabla 2. Los resultados revelan que la presencia de tolueno en la mezcla retrasa la oxidación del 2-propanol aumentando las temperaturas de oxidación, en comparación con la oxidación individual del mismo. Este comportamiento también se reporta en la literatura en la oxidación catalítica de otras mezclas, en donde la temperatura de conversión está gobernada principalmente por la molécula más difícil de oxidar (17, 6).
De acuerdo con los resultados de caracterización y actividad catalítica, el catalizador CPMn 1.0 presenta el mejor comportamiento catalítico debido a una mayor área superficial y al mayor consumo de hidrógeno bajo condiciones de reacción, los cuales superan los valores obtenidos para el óxido mixto de cobalto. Sin embargo, son las propiedades redox las que definen principalmente el comportamiento catalítico, debido al mecanismo de óxido-reducción que gobierna la oxidación de COVs. En tal sentido, los óxidos de manganeso son conocidos por su capacidad para formar óxidos en diferentes estados de oxidación permitiendo su participación como un agente oxidante o como agente reductor y actuando en ambos casos, como un componente activo de un sistema redox (13). El mayor consumo de hidrógeno a temperaturas menores de 500°C, evidencia una mayor movilidad electrónica y movilidad de oxígeno en el sólido CPMn 1.0, convirtiéndolo en el catalizador de oxidación más eficiente.
Conclusiones
El óxido de manganeso presentó las mejores propiedades texturales, redox y, por tanto, el mejor desempeño catalítico en la oxidación de una mezcla de COVs. Por su parte, el comportamiento de los COVs individuales difiere del comportamiento catalítico frente a las mezclas. Sin embargo, el óxido mixto Mn-Mg-Al resultó un catalizador activo y selectivo en la oxidación catalítica individual de tolueno y 2-propanol, así como en la mezcla de los mismos, lo que muestra su potencial para ser empleado en la oxidación catalítica de una amplia gama de COVs
Agradecimientos
Los autores agradecen al proyecto DIB-UN código Hermes 14785 por la financiación parcial de este trabajo y al profesor Mario Montes de la Universidad del País Vasco (España), por su apoyo en la realización de los ensayos catalíticos.
Referencias
1. Directiva 1999/13/CE del consejo del 11 de marzo de 1999 relativa a las limitaciones de las emisiones de compuestos organicos volátiles debido al uso de disolventes orgánicos en determinadas actividades e instalaciones.Diario oficial de las comunidades europeas. [ Links ]
2. Environmetal protection agency. Disponible en: http://www.epa.gov/iaq/voc2.html. [Consultado el 7 de noviembre de 2011] [ Links ].
3. Ministerio de ambiente, vivienda y desarrollo territorial. Disponible en: http://www.alcaldiabogota.gov.co/sisjur/normas/Norma1.jsp?i=39330#3. [Consultado el 22 de junio de 2013] [ Links ].
4. F. Wyrwalski, J.F. Lamonier, S. Siffert, A. Aboukaïs. Additional effects of cobalt precursor and zirconia support modifications for the design of efficient VOC oxidation catalysts. Appl. Catal. B: Environmental, 2007. 70 (1-4): 393-399. [ Links ]
5. Everaert, K. and J. Baeyens, Catalytic combustion of volatile organic compounds.J. Hazard. Mater., 2004. 109(1-3): 113-139. [ Links ]
6. F.N. Aguero, B.P. Barbero, L. Gambaro, L.E. Cadús. Catalytic combustion of volatile organic compounds in binary mixtures over MnOx/Al2O3 catalyst. Appl. Catal. B: Environmental, 2009. 91(1-2): 108-112. [ Links ]
7. Vaccari, A. Preparation and catalytic properties of cationic and anionic clays Catal. Today. 1998. 41, 53-71. [ Links ]
8. K.S. Chang, H. Song, Y.-S. Park, J.-W. Woo.Analysis of N2O decomposition over fixed bed mixed metal oxide catalysts made from hydrotalcite-type precursorsAppl. Catal. A: General. 2004.273, 223. [ Links ]
9. He, H. Berntsen, E. Ochoa-Fernández, J. Walmsley, E. Blekkan, D. Chen Co–Ni CatalystsDerived from Hydrotalcite-Like Materials for Hydrogen Production by Ethanol Steam Reforming.Top. Catal. 2009. 52(3): 206-217. [ Links ]
10. J.Q. Torres, J.-M. Giraudon, J.-F. Lamonier. Formaldehyde total oxidation over mesoporous MnOx catalysts. Catal. Today. 2011. 176 : 277-280. [ Links ]
11. D.A. Aguilera, A. Perez, R. Molina, S. Moreno. Cu–Mn and Co–Mn catalysts synthesized from hydrotalcites and their use in the oxidation of VOCsAppl. Catal., B.2011.104:144-150. [ Links ]
12. A. Pérez, J.-F. Lamonier, J.-M. Giraudon, R. Molina, S. Moreno. Catalytic activity of Co-Mg mixed oxides in the VOC oxidation: Effects of ultrasonic assisted in the synthesis.Catal. Today. 2011. 176(1) : 286-291 [ Links ]
13. J.L.G. Fierro, metal oxides. ed., CRC Press: New York. (2006). [ Links ]
14. Gregg, S.J., Sing, K.S.W., Adsorption, surface area and porosity. 1982, London: Academic Press. [ Links ]
15. Daza, C.E., S. Moreno, and R. Molina.Ce-incorporation in mixed oxides obtained by the self-combustion method for the preparation of high performance catalysts for the CO2 reforming of methane. Catal. Commun. 2010. 12(3): 173-179. [ Links ]
16. Scirè S., Minicò S, Crisafulli C., Satriano C., Pistone. Catalytic combustion of volatile organic compounds on gold/cerium oxide catalystsAppl. Catal., B. 2003. 40 :43–49. [ Links ]
17. V.P. Santos, M.F.R. Pereira, J.J.M. Órfão, J.L. Figueiredo.Mixture effects during the oxidation of toluene, ethyl acetate and ethanol over a cryptomelane catalyst. J. Hazard. Mater. 2011. 185:1236-1240. [ Links ]