Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.42 no.1 Bogotá Jan./Apr. 2013
Síntesis y caracterización de bentonita modificada con especies de TiO2 y Fe-TiO2 obtenidas del mineral ilmenita
Synthesis and characterization of modified-bentonite with TiO2 and Fe-TiO2 species obtained from ilmenite
Síntese e caracterização de bentonita modificada com espécies de TiO2 e Fe-TiO2 obtidas do mineral ilmenita
Juan A. Torres1, José G. Carriazo1* , Nancy R. Sanabria1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Crr. 30 No. 45-03, Bogotá DC, Colombia.Grupo de investigación Estado Sólido y Catálisis Ambiental (Esca).
* Autor para correspondencia: jcarriazog@unal.edu.co
Recibido: 23 de enero de 2013 • Aceptado: 15 de abril de 2013
Resumen
Se sintetizó una serie de sólidosnanoestructurados obtenidos de laintercalación de nanopartículas de TiO2y Fe-TiO2 en los espacios interlaminaresde un mineral de arcilla esmectítico. Losnuevos materiales se prepararon mediantela modificación simultánea de dos mineralesnaturales: bentonita e ilmenita. Los materialesobtenidos se caracterizaron por fluorescenciade rayos X (FRX), espectroscopia infrarroja(IR), difracción de rayos X (DRX),microscopia electrónica de barrido (SEM)y sortometría de nitrógeno. Los resultadosdel análisis químico (FRX) confirmaronclaramente la incorporación de titanio y dehierro en los materiales sintetizados. Losanálisis por DRX, SEM y sortometría denitrógeno verificaron la modificación delmineral de arcilla por incorporación deespecies de dióxido de titanio y la generaciónde estructuras mesoporosas delaminadas oexfoliadas con incremento en los valores deárea superficial y porosidad controlada.
Palabras clave: ilmenita, dióxido detitanio, bentonita, mineral de arcilla, arcilla delaminada.
Abstract
A set of nanostructured porous solids was synthesized by intercalation of TiO2 and Fe- TiO2 into the interlayer sites of a smectite clay mineral. The new materials were prepared through simultaneous modification of two natural minerals: bentonite and ilmenite. Synthesized materials were characterized by X-ray fluorescence (XRF), infrared spectroscopy (IR), X-ray powder diffraction (XRD), scanning electron microscopy (SEM) and N2-adsorption technique. Results of chemical analysis (XRF) clearly confirmed the incorporation of titanium and iron in the synthesized materials. Modification of clay mineral by incorporation of titanium dioxide species was verified by XRD, SEM and N2- adsorption analyses, showing the formation of mesoporous delaminated structures with increased surface areas and controlled porosity.
Key words: Ilmenite, titanium dioxide, bentonite, clay mineral, delaminated clay.
Resumo
Uma serie de sólidos nanoestruturadosforam sintetizados, obtidos pela intercalaçãode nanopartículas de TiO2 e Fe-TiO2 nosespaços interlaminares de um mineralde argila esmectítica. Os novos materiaisforam preparados mediante a modificaçãosimultânea de dois minerais naturais:uma bentonita e uma ilmenita. Osmateriais obtidos foram caracterizadospor fluorescência de raios X (FRX),espectroscopia infra-vermelho (IR), difraçãode raios X (DRX), microscopia eletrônica devarredura (SEM) e sortometria de nitrogênio.Os resultados da análise química (FRX)confirmaram claramente a incorporação detitânio e de ferro nos materiais sintetizados.A análise por DRX, SEM e sortometriade nitrogênio verificaram a modificaçãodo mineral de argila por incorporação deespécies de dióxido de titânio, demonstrandoa geração de estruturas mesoporosasdelaminadas ou esfoliadas com incrementonos valores de área superficial e porosidade controlada.
Palavras-chave: ilmenita, dióxido detitânio, bentonita, mineral de argila, argila delaminada.
Introducción
El dióxido de titanio es un semiconductor con band-gap de 3,0 a 3,2eV y se encuentra presente en la naturaleza en tres tipos de estructuraspolimórficas comunes: anatasa, rutilo y broquita (1). Este material hatenido gran importancia debido a sus numerosas aplicaciones entre lasque se destacan sus usos como pigmento y como material fotosensible(2). También exhibe algunas propiedades químicas y eléctricas quepueden ser utilizadas en diferentes aplicaciones tecnológicas y de ingeniería;entre ellas se destaca su uso en membranas cerámicas, celdassolares, baterías a base de litio y sensores de humedad (1, 2). El dióxido de titanio, en su forma predominante de anatasa, presenta excelentespropiedades catalíticas y fotocatalíticas para la degradación de contaminantesen el aire y medio acuoso, lo cual es muy atractivo para la soluciónde problemas ambientales. El interés por la utilización del TiO2como fotocatalizador radica en que permite alcanzar la degradaciónde una amplia variedad de contaminantes orgánicos bajo condicionesde reacción suaves, es bastante estable ante la corrosión química y fotoquímica,es de bajo costo y relativamente inerte (3, 4).
Sin embargo, aunque el dióxido de titanio es un material promisoriocomo fotocatalizador para la degradación de contaminantes orgánicos,para optimizar su desempeño catalítico es preciso modificaralgunos aspectos fundamentales: 1) presenta baja eficiencia cuánticadebido a la recombinación de pares electrón-hueco (5); 2) sólo es activobajo radiación UV (λ < 390 nm) (6), la cual constituye menos del5% de la energía solar que llega a la Tierra (3) e impide usar el enormepotencial de la fotocatálisis solar (5); y, 3) el proceso que se lleva a cabopara la reacción fotocatalítica, por lo general involucra la utilizaciónde TiO2 en suspensión, lo que dificulta la remoción de las partículasfinas al final del proceso y lo hace más costoso (7, 8). Recientementese ha encontrado que las partículas finas de TiO2 remanentes en aguasresiduales son capaces de penetrar las células de algunos microorganismosabatiendo algunas formas de vida y causando desequilibrio enciertos ecosistemas (9). Por ello, se requiere el desarrollo de la síntesisde TiO2 sobre un soporte adecuado que permita una dispersiónapropiada de los sitios activos y facilite la remoción del catalizador delmedio de reacción (10).
Para elegir un buen soporte catalítico ha de tenerse en cuenta queéste debe ser capaz de formar un enlace fuerte con el TiO2 y que dichaunión no debe sacrificar su actividad; asimismo el soporte debe ofreceruna alta área superficial, porosidad adecuada y facilitar la adsorciónde las moléculas contaminantes (8). Por lo anterior, se proponeel empleo de minerales de arcilla como soporte para el TiO2, dado queson materiales abundantes, con alta capacidad de adsorción, bajo costoy fácil modificación a escala molecular (10, 11).
Los minerales de arcilla son aluminosilicatos laminares resultantesde la asociación de entidades tetraédricas de silicatos y capas octaédricasde óxido de aluminio hidratado, con posibles sustitucionesisomórficas, tanto en la capa octaédrica, como en la capa tetraédrica(12, 13). Los minerales de arcilla clasificados como 2:1 (esmectitas omontmorillonitas) se caracterizan por sus propiedades fisicoquímicasde expansión en medios húmedos y por su capacidad de intercambiocatiónico, atributos que facilitan su modificación molecular mediantela intercalación de especies polihidroxocatiónicas de gran tamaño enlos espacios interlaminares, para generar finalmente sólidos micro ymesoporosos útiles en catálisis heterogénea.
En Colombia se han localizado fuentes o yacimientos de arcillas,con alto contenido de esmectita y elevada capacidad de explotación,a lo largo de la cordillera central, en los departamentos del Valle delCauca, Tolima y Caldas (14, 15). En el Valle del Cauca (municipiode Tuluá), la empresa Bentonitas de Colombia (Bentocol) explota ycomercializa a gran escala un material esmectítico con propiedadesimportantes cuyas características fisicoquímicas ya han sido valoradasen trabajos anteriores (12), mostrando enormes potencialidades en elproceso de intercalación para la preparación de sólidos microporosos.
Por otro lado, múltiples publicaciones indican que el dopaje deTiO2 con metales de transición permite obtener estructuras con valores de band gap en la región del espectro visible con un aumento en laeficiencia cuántica, señalando a la especie Fe3+ como la más significativa(16-18). Trabajos recientes muestran la posibilidad exitosa de intercalaciónde nanopartículas de Fe-TiO2 (TiO2 dopado con Fe3+) en losespacios interlaminares de una bentonita de origen colombiano (bentonitadel Valle del Cauca), con actividad catalítica en la reacción deoxidación total de fenol en medio acuoso diluido, empleando nivelesmuy bajos de irradiación UV (10).
Para lograr la síntesis de Fe-TiO2 seutilizan como precursores tetracloruro de titanio (TiCl4) o alcóxidosde titanio y sales de hierro. Los dos primeros son reactivos costosos yquímicamente difíciles de manejar, limitando sus aplicaciones en losprocesos de síntesis a gran escala. En consecuencia, es deseable haceruso de precursores mucho más económicos, abundantes y de manejosimple, por lo que se sugiere la utilización del mineral llamado ilmenita,material proveniente de rocas ígneas cuyo componente principal estitanato de hierro, FeTiO3 (19). Colombia cuenta con buenas reservasde ilmenita, cuya pureza es variable dependiendo de la zona de origen(20, 21). El mineral ilmenita, que de hecho es una de las principalesfuentes naturales de dióxido de titanio a nivel mundial (19, 22), puedeaportar no sólo el titanio sino también el hierro necesario para la síntesisde las especies de TiO2 dopado con Fe3+, gracias a su composiciónquímica. En este sentido, el presente trabajo se enfoca en la preparaciónde materiales laminares mesoporosos conformados con especiesde TiO2 o Fe-TiO2 incorporadas en los espacios interlaminares de unmineral de arcilla, a partir de dos minerales de origen colombiano:bentonita e ilmenita.
Los resultados de la presente investigación permiten avanzar en eldiseño de nuevos materiales de porosidad controlada y potencialmenteactivos como catalizadores de reacciones fotoasistidas. En una segundaetapa, los sólidos serán evaluados catalíticamente en reaccionesde oxidación de contaminantes orgánicos en medio acuoso.
Materiales y métodos
Materiales de partida
Se emplearon dos minerales colombianos, un mineral ilmenita suministradopor el Servicio Geologico Colombiano (antes Ingeominas),proveniente de Puerto Colombia, departamento del Atlantico, y unmineral de arcilla proveniente del Valle del Cauca, comercializado porla empresa Bentocol (Bentonitas de Colombia). La arcilla se sometioa separacion por tamano de particulas y la fraccion menor a 2 ƒÊm fuecolectada y sometida a un proceso de homoionizacion con sodio, paraposteriormente emplearla en la preparacion de los nuevos materiales.Se utilizo hierro en polvo (J.T. Baker), acido sulfurico (Merck, 98%) ycloruro de sodio (Merck, 99,5%).
Síntesis de los sólidos
La síntesis de los sólidos se llevó a cabo mediante la extracción de Fe3+ yTi4+ haciendo algunas variaciones al proceso del sulfato, para lo cual serealizaron ensayos usando una masa constante de ilmenita de 50,0 g yun volumen de 70,0 mL de ácido sulfúrico a diferentes concentraciones(20%, 50%, 80%). De igual forma, se varió la temperatura de reaccióncon tres valores diferentes, 50, 70 y 110 ºC. El tiempo del proceso deextracción fue de una hora y para cada muestra se realizaron tres extracciones.La reacción involucrada produce oxisulfato de titanio y sulfatode hierro como subproductos (23) y se expresa así:
FeTiO3 + 2H2SO4 → TiOSO4 + FeSO4 + 2H2O
El ion férrico se redujo a ion ferroso por la adición en exceso dehierro en polvo; luego, la solución resultante se llevó a una temperaturade 10ºC para, posteriormente, retirar el sulfato de hierro en formade cristales de sulfato ferroso heptahidratado Fe2SO4.7H2O. Los residuossólidos se retiraron por decantación/filtración y la solución remanente(solución intercalante) contiene las especies polihidroxicatiónicasde titanio, [TiO2(OH)4]n, o de hierro-titanio, [FexTi(1-x)O2(OH)4]n.
Esta solución fue adicionada lentamente (gota a gota, 0,5 mL/minuto),bajo agitación vigorosa, a una suspensión 2% de arcilla en agua(preparada 24 horas antes). La mezcla resultante se dejó en agitacióndurante 24 horas.
Los sólidos obtenidos se separaron por centrifugación y se lavaronvarias veces con agua destilada hasta alcanzar una conductividad aproximadaa la del agua de partida. Finalmente, los sólidos se secaron a60ºC y posteriormente se calcinaron a 400ºC por 2 horas en atmosferaestática (10). Los materiales obtenidos se denotan de acuerdo a las condicionesde extracción de las especies de Ti-Fe; por ejemplo, S50-70 yS50-110 son los sólidos preparados empleando una solución de ácidosulfúrico al 50% y temperaturas de 70 ó 110ºC, respectivamente.
Caracterización de los sólidos
Previamente a los analisis, las muestras se tamizaron en malla 100ASTM. El analisis quimico de los dos minerales de partida y de los solidossintetizados se realizo por fluorescencia de rayos X (FRX) usandoun espectrometro Magix Pro® PW-2440 Philips equipado con un tubode rodio y una potencia maxima de 4kW. Los perfiles de difraccion derayos X fueron tomados en un equipo Shimadzu Lab-X XRDR D-6000con anodo de Cu (radiacion Kα, λ = 1,5406 Å). Los difractogramas setomaron a temperatura ambiente mediante la tecnica de polvos, contamano de paso de 0,02 °2θ y tiempo de paso 10 s. Los espectros deinfrarrojo fueron tomados en un equipo Nicolet Thermo Scientifici® S10, haciendo pastillas con KBr (2 mg de muestra en 200 mg de KBr).Las microscopias electronicas de barrido (SEM) fueron tomadas en unmicroscopio FEI Quanta® 200, capturando 4 micrografias en diferentessitios sobre la superficie de cada solido con sus correspondientes espectrosde energia dispersiva de rayos X (EDX).
Las propiedades texturales de los sólidos se determinaron mediante isotermas de adsorción de nitrógeno, tomadas a 77 K usando un equipo Micromeritics ASAP® 2020 en el intervalo de presiones relativas (P/P0) de 1x10-5 a 0,99. Las muestras se desgasificaron previamente a 350 ºC por 4 horas. Para determinar las áreas superficiales se empleó el modelo BET en el intervalo de presiones relativas 0,05≤P/P0≤0,35. Los volúmenes y áreas de microporos se determinaron por medio de curvas t y los volúmenes totales de poro se calcularon empleando el método de Gurvitsch (35).
Resultados y discusión
Análisis químico
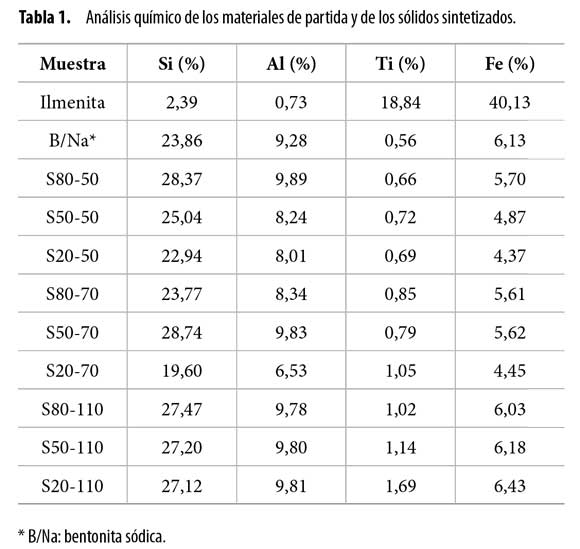
En la Tabla 1 se muestra la composición química de los minerales departida y de los sólidos sintetizados. La ilmenita de partida presentaun alto contenido de titanio (18,84%) y de hierro (40,13%), frente a loscontenidos de silicio (2,39%) y de aluminio (0,73%) correspondientes aimpurezas (óxidos) dentro del material. El análisis químico de la arcillamuestra una composición típica de esmectita (12). A partir del análisiselemental se observa la incorporación efectiva de titanio en los sólidossintetizados, comparados con la matriz original (mineral de arcilla). Elaumento en la temperatura de extracción de las especies intercalantescondujo a una incorporación mayor de titanio en los sólidos modificados.El mayor porcentaje de incorporación de titanio se observó en lossólidos sintetizados a 110ºC. Además, el análisis de hierro indica que laincorporación de este elemento en la mayoría de los sólidos sintetizadosse incrementa ligeramente con el aumento de la temperatura de extracción.La incorporación conjunta de hierro y titanio está relacionada conla formación de especies Fe-TiO2 (10). Por otra parte, aunque a temperaturas menores a 110ºC no se aprecia una influencia muy marcada dela variación de la concentración de ácido sulfúrico empleado en el proceso,sí se presenta una ligera disminución de los contenidos de titanioen la medida en que se emplean concentraciones mayores de ácido. Unatendencia menos rigurosa se presenta en la variación de los contenidos de hierro incorporado; no obstante, a 110ºC la incorporación de hierromuestra una tendencia similar a la de titanio, lo que también puede estarrelacionado con la incorporación de especies Fe-TiO2 en la arcilla.
Difracción de rayos X
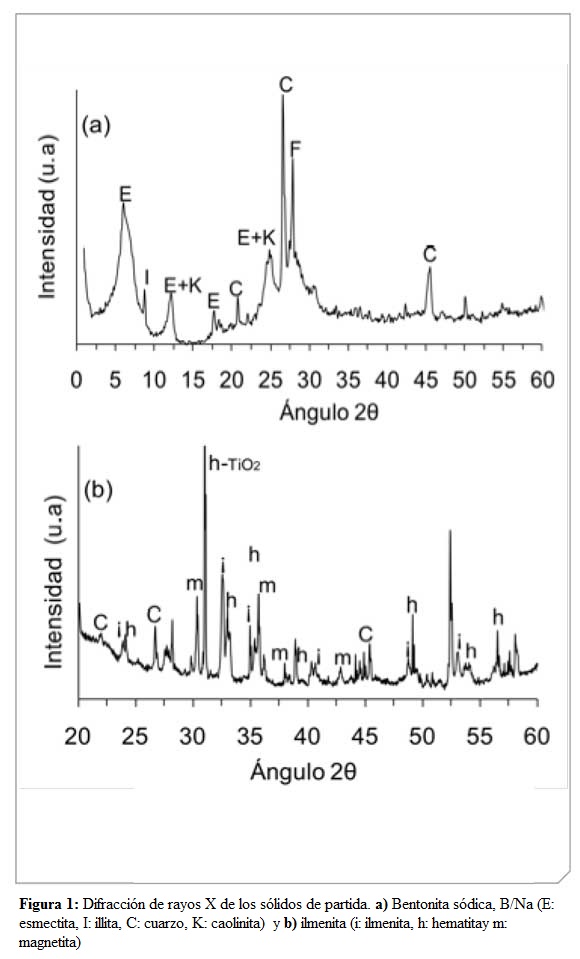
El perfil de difracción de rayos X de la arcilla (Figura 1a) permite identificarlas señales típicas de esmectita ubicadas en ángulos 2θ= 6.00,12.11, 18.13 y 24.37, con espaciados interlaminares (Figura 1b) correspondientesa 14.70 Å, 7.30 Å, 4.89 Å y 3.65 Å, respectivamente (12). Elmineral esmectita es el principal constituyente de la bentonita. De igualforma, se pueden observar otras señales que confirman la presencia deimpurezas como cuarzo (2θ = 20.79, 26.56 y 45.79), illita y feldespato(2θ = 8.79 y 27.95, respectivamente) (12). La Figura 1b muestra el difractogramadel mineral ilmenita, donde se pueden observar las señalescaracterísticas para el titanato de hierro (2θ = 32,47; 35,24; 48,70; 23,79;40,27 y 53,93) (24). Además, aparecen señales propias de óxidos de hierrocomo la hematita (α-Fe2O3) (25, 26) y la magnetita (Fe3O4) (27). Laseñal a ángulo 2θ igual a 31.0 se atribuye a la especie mixta Fe2O3 – TiO2(28), en este caso la señal con mayor intensidad.
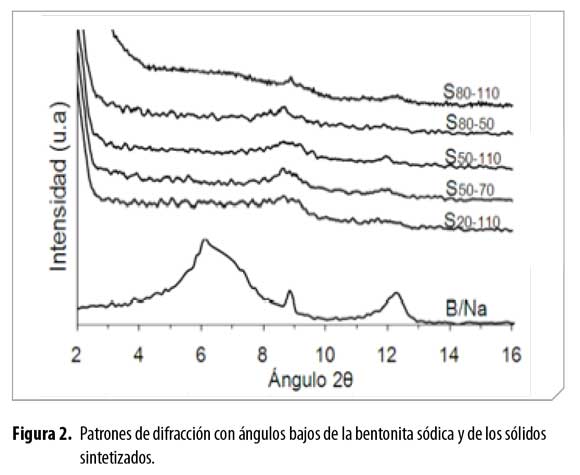
De otro lado, en la Figura 2 se muestran los perfiles de difracciónde los sólidos modificados, en los cuales desaparece la señal típica de laesmectita, d001 = 14,70 Å, indicando que el mineral de arcilla sufrió unamodificación a causa de las especies intercalantes. Al desaparecer la señal d001 se pierde el orden estructural de largo alcance o de apilamientode las láminas, lo que verifica la delaminación del mineral arcilloso. Las señales correspondientes a las especies de hierro y de óxido de titaniono se logran observar en los perfiles de difracción de los sólidos debidoa que constituyen especies amorfas o porque se encuentran presentes enpequeñassub cantidades y no son detectadas por dicha técnica.
Espectroscopia infrarroja con transformada de Fourier (IRTF)
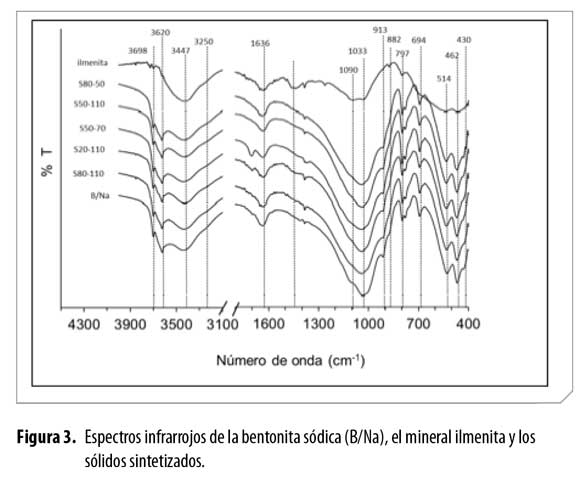
Los espectros infrarrojos del material de partida y de los sólidos sintetizadosse presentan en la Figura 3 y muestran las dos zonas en las que seobservaron señales. La primera zona, correspondiente a las vibracionesentre 3750 y 3100 cm-1, es la región característica de estiramientos delenlace O-H. La señal a 3698 cm-1 pertenece al estiramiento del enlaceO-H estructural en la red de caolinita (29, 30), lo que confirma lapresencia de este mineral como impureza. Las trazas de caolinita en labentonita de partida también fueron observadas por difracción de rayos X. Alrededor de 3620 cm-1 se presenta el estiramiento de enlaces O-H ensitios Al2OH estructurales de esmectitas dioctaédricas (29-31), es decir,de esmectitas o montmorillonitas ricas en aluminio. La banda alrededorde 3447 cm-1 se atribuye al estiramiento del enlace O-H en moléculas deagua adsorbidas, las cuales forman puentes de hidrógeno entre sí y conla superficie del sólido proporcionando un ensanchamiento de la bandamencionada. La banda que intenta emerger en 3250 cm-1 ocurre por vibracionesde sobretono de las flexiones del agua que aparecen en 1636cm-1 (30, 31). La segunda zona corresponde al intervalo entre 1750 cm-1y 400 cm-1, en la cual se aprecia la banda (1636 cm-1) característica de lasdeformaciones del enlace O-H del agua adsorbida. La serie de bandas a1090, 797 y 778 cm-1 se atribuyen a las vibraciones derivadas del estiramientodel enlace Si-O en la estructura del cuarzo. La señal a 1033 cm-1,ancha e intensa en la arcilla y en los sólidos modificados, corresponde avibraciones de estiramientos del enlace Si-O en la estructura del mineralde arcilla. Esta misma señal, así como las asignadas a cuarzo, presentanpoca intensidad en la ilmenita, lo que sugiere la contaminación deeste mineral con material silícico (arenas) en la ilmenita de partida. Ladeformación del enlace AlAlOH en la estructura del mineral de arcillaaparece en 913 cm-1. A 882 cm-1 se encuentra la vibración correspondientea la deformación AlFeOH producto de las sustituciones isomórficasde Fe en la capa octaédrica del mineral arcilloso en estudio (12,29). Las vibraciones de deformación de los enlaces Si-O-Si y Al-O-Si seobservan a 462 y 514 cm-1, respectivamente (29).
El espectro infrarrojo del mineral ilmenita (Figura 3) presenta unabanda ancha en el intervalo comprendido entre 450–650 cm-1, correspondientea vibraciones características de enlaces Ti-O-Ti (32, 33). Eneste mismo intervalo se espera la aparición de vibraciones correspondientesal enlace Fe-O de los óxidos de hierro (hematita y magnetita),previamente detectados por DRX, lo que hace complejo el análisis precisode esta zona. En el intervalo de 1033 a 1090 cm-1 se presenta unabanda ancha debido a la presencia de cuarzo y donde posiblemente seencuentre solapada la señal atribuida a la flexión de los enlaces Ti-O-Fe(1050 cm-1) (34). Debido a quelas señales características del dióxido detitanio son ocultadas por las señales del soporte (mineral de arcilla), nose observan grandes cambios en los espectros infrarrojos de los sólidos sintetizados.
Microscopía electrónica de barrido (SEM)
La Figura 4 muestra el cambio en la morfología de la arcilla despuésde sufrir los procesos de modificación por las especies intercalantes. La micrografía correspondiente a la arcilla sódica (Figura 4a) muestraagregados de granos con superficie relativamente lisa, mientras que lasimágenes correspondientes a los sólidos modificados revelan un cambiomorfológico importante que pone en evidencia la formación de granoscon superficies altamente erosionadas (Figuras 4b a 4e). La morfologíade los sólidos modificados se relaciona con la exfoliación o delaminacióndel mineral, que impide el apilamiento ordenado de las láminas y la conformación de estructuras ordenadas a largo alcance, como lo confirmó el análisis por difracción de rayos X.
Propiedades texturales
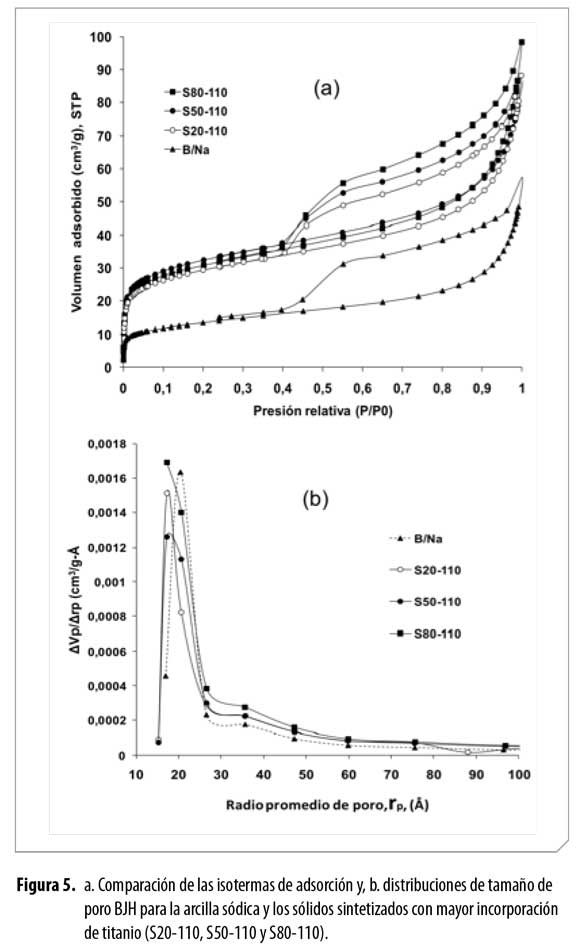
Las isotermas de adsorción de nitrógeno de la arcilla sódica y de lossólidos modificados con mayor incorporación de titanio se muestranen la Figura 5a. Las isotermas presentan mayores volúmenes de adsorción de nitrógeno en los sólidos sintetizados que en la arcilla de partida,poniendo en evidencia el incremento en la porosidad de los materialescomo consecuencia de la modificación con especies de titanio. La formade todas las isotermas permite clasificarlas como tipo II, según la clasificaciónde la IUPAC (35), y es típica de sólidos con macro y mesoporos.Adicionalmente, la rama de desorción de las isotermas forma histéresistipo H3, que se atribuye a poros en forma de rendijas con tamaños nouniformes (35).
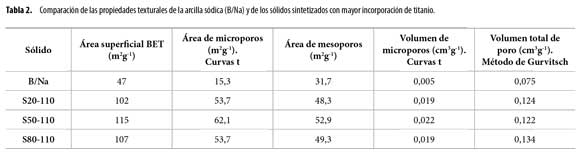
En la Tabla 2 se muestran los diferentes parámetros texturales delos sólidos sintetizados, observándose que efectivamente los sólidosmodificados presentan mayor área superficial que la arcilla de partida.Asimismo, el volumen de poro de los sólidos modificados, calculadosegún el método de Gurvitsch (35), es mayor en todos los casos que elcorrespondiente a la arcilla sin modificar. Las curvas de distribución detamaño de poro, construidas por el método BJH (Figura 5b), exhibenun aumento de la fracción de mesoporos en el intervalo de 25 a 80 Å,como consecuencia de la modificación de los sólidos. Esto concuerdacon la modificación estructural (delaminación de la arcilla) verificadapor difracción de rayos X y confirma nuevamente la alteración de laspropiedades texturales del mineral arcilloso hacia la conformación favorablede estructuras mesoporosas.
Conclusiones
Los resultados obtenidos en el presente trabajo permiten concluir quela bentonita fue modificada exitosamente con especies TiO2 y Fe-TiO2extraídas del mineral ilmenita. Los resultados de análisis químico sugierenla modificación efectiva de los materiales mediante incorporaciónde especies de hierro y de titanio. Los análisis por difracción de rayos Xy microscopía electrónica de barrido (SEM) confirman la delaminaciónde los materiales como consecuencia de la incorporación exitosa de nanopartículasde TiO2 y Fe-TiO2.
La síntesis de materiales nanoestructurados con especies de dióxidode titanio intercalado en el mineral de arcilla permitió mejorar los parámetrostexturales del material de partida, aumentando el área superficialy generando porosidad controlada en los sólidos, propiedades importantespara el uso de los nuevos materiales en catálisis heterogénea.
Finalmente, la ruta de síntesis propuesta en el presente trabajo mostróser útil para la obtención de materiales delaminados con especiesde TiO2 a partir del empleo de dos minerales naturales como materiaprima.
Agradecimientos
Los autores agradecen a la Universidad Nacional de Colombia (sedeBogotá) y a Colciencias por el apoyo logístico y financiero a través delprograma Jóvenes Investigadores e Innovadores "Virginia Gutiérrez dePineda". Este trabajo se desarrolló en el Laboratorio de Diseño y Reactividadde Estructuras Sólidas (Lab-DRES) del Departamento de Químicade la Universidad Nacional de Colombia.
Referencias
1. Asiah, M.N.; Mamat, M.H.; Khusaimi, Z.; Achoi, M.F.; Abdullah, S.; Rusop, M. Thermal stability and phase transformation of TiO2 nanowires at various temperatures. Microelectron. Eng. 2013. In Press. [ Links ]
2. Keswani, R.K.; Ghodke, H.; Sarkar, D.; Khilar, K.C.; Srinivasa, R.S. Room temperature synthesis of titanium dioxide nanoparticles of different phases in water in oil micro-emulsion. Colloids Surf., A: Physicochem. Eng. Aspects. 2010. 369 (1-3): 75-81. [ Links ]
3. Zhou, M.; Yu, J.; Cheng, B. Effects of Fe-doping on the photocatalytic activity of mesoporous TiO2 powders prepared by an ultrasonic method. J. Hazard. Mater. B. 2006. 137 (3): 1838-1847. [ Links ]
4. Wongkalasin, P.; Chavadej, S.; Sreethawong, T. Photocatalytic degradation of mixed azo dyes in aqueous wastewater using mesoporous-assembled TiO2 nanocrystal synthesized by a modified sol-gel process. Colloids Surf., A: Physicochem. Eng. Aspects. 2011. 384 (1-3): 519-528. [ Links ]
5. Rauf, M.A.; Meetani, M.A.; Hisaindee, S. An overview on the photocatalytic degradation of azo dyes in the presence of TiO2 doped with selective transition metals. Desalination. 2011. 276 (1-3): 13-27. [ Links ]
6. Zhu, J.; Zheng, W.; He, B.; Zhang, J.; Anpo, M. Characterization of Fe-TiO2 photocatalysts synthesized by hydrothermal method and their photocatalytic reactivity for photodegradation of XRG dye diluted in water. J. Mol. Catal. A: Chem. 2004. 216 (1): 35-43. [ Links ]
7. Damardji, B.; Khalaf, H.; Duclaux, L.; David, B. Preparation of TiO2-pillared montmorillonite as photocatalyst: Part II Photocatalytic degradation of a textile azo dye. Appl.Clay Sci. 2009. 45 (1-2): 98-104. [ Links ]
8. Shan, A.Y.; Ghazi, T.I.M.; Rashid, S.A. Immobilisation of titanium dioxide onto supporting materials in heterogeneous photocatalysis: A review. Appl. Catal., A: Gen. 2010, 389 (1-2): 1-8. [ Links ]
9. Lovern, S.B.; Klaper, R. Daphnia magna mortality when exposed to titanium dioxide and fullerene (C60) nanoparticles. Environ. Toxicol. Chem.. 2006. 25 (4): 1132-1137. [ Links ]
10. Carriazo, J.G.; Moreno-Forero, M.; Molina, R.A.; Moreno, S. Incorporation of titanium and titanium-iron species inside a smectite-type mineral for photocatalysis. Appl. Clay Sci. 2010. 50 (3): 401-408. [ Links ]
11. Kameshima, Y.; Tamura, Y.; Nakajima, A.; Okada, K. Preparation and properties of TiO2/montmorillonite composites. Appl. Clay Sci. 2009. 45 (1-2): 20-23. [ Links ]
12. Carriazo, J.; Molina, R.; Moreno, S. Caracterización estructural y textural de una bentonita colombiana. Rev. Colomb. Quím. 2007. 36 (2): 213-225. [ Links ]
13. Carriazo, J.G.; Saavedra, M.J.; Molina, M.-F. XRD study on the intercalation-pillaring of a 2:1 clay mineral with aluminum polyoxocationic species. Rev. Mex. Ing. Quím.. 2009. 8 (3): 299-305. [ Links ]
14. Camacho, J.A.; Celada, C.M. Definición de zonas potenciales para esmectitas en los departamentos del Valle del Cauca, Tolima y Caldas. Bogotá. Ingeominas. 2004. [ Links ]
15. Laguna, O.H. Efecto del contenido esmectítico en procesos de pilarización de minerales arcillosos provenientes de la cordillera central de Colombia. Tesis de Maestría, Departamento de Química, Universidad Nacional de Colombia, Bogotá. 2007. [ Links ]
16. Choi, W.; Termin, A.; Hoffmann, M.R. The role of metal ion dopants in quantum-sized TiO2: correlation between photoreactivity and charge carrier recombination dynamics. J. Phys. Chem. 1994. 98 (51): 13669-13679. [ Links ]
17. Zhang, X.; Zhou, M.; Lei, L. Co-deposition of photocatalytic Fe doped TiO2 coatings by MOCVD. Catal. Commun. 2006. 7 (7): 427-431. [ Links ]
18. Adán, C.; Bahamonde, A.; Fernández-García, M.; Martínez-Arias, A. Structure and activity of nanosized iron-doped anatase TiO2 catalysts for phenol photocatalytic degradation. Appl. Catal., B. 2007. 72 (1-2): 11-17. [ Links ]
19. Wilson, N. C.; Muscat, J.; Mkhonto, D.; Ngoepe, P. E.; Harrison, N. M. Structure and properties of ilmenite from first principles. Phys. Rev. B. 2005. 71 (7): 075202, 1-9. [ Links ]
20. Mutis, V. Cátalogo de los yacimientos, prospecto y manifestaciones minerales de Colombia. Bogotá., Ingeominas: pp 285, 287. 1983. [ Links ]
21. González, L. Análisis financiero para mineralizaciones de ilmenita en la Sierra Nevada de Santa Marta. Bol. Geológico. 2000. 38(1-3): 1-82. [ Links ]
22. Lin, C.; Liang, B.; Wang, H.Y. Preparation of synthetic rutile by hydrochloric acid leaching of mechanically activated Panzhihuailmenite. Hydrometallurgy. 2008. 91 (1-4): 121-129. [ Links ]
23. Chernet, T. Effect of mineralogy and texture in the TiO2 pigment production process of the Tellnes ilmenite concentrate. Miner, Petrol. 1999. 67 (1-2): 21-32. [ Links ]
24. Anthony, J.W.; Bideaux, R. A.; Bladh, K.W.; Nichols, M.C. Handbook of Mineralogy. Chantilly, VA 20151-1110, USA. Mineralogical Society of America, Version 1. 2001-2205. Disponible en: http://www.handbookofmineralogy.org/pdfs/ilmenite.pdf. [ Links ] [Consultado el 31 de mayo de 2013]
25. Hassanjani-Roshan, A.; Vaezi, M.R.; Shokuhfar, A.; Rajabali, Z. Synthesis of iron oxide nanoparticles via sonochemical method and their characterization. Particuology. 2011. 9 (1): 95-99. [ Links ]
26. Peng, D.; Beysen, S.; Li, Q.; Sun, Y.; Yang, L. Hydrothermal synthesis of monodisperse α-Fe2O3 hexagonal platelets. Particuology. 2010. 8 (4): 386-389. [ Links ]
27. Giri, S.K.; Das, N.N.; Pradhan, G.C. Synthesis and characterization of magnetite nanoparticles using waste iron ore tailings for adsorptive removal of dyes from aqueous solution. Colloids Surf., A: Physicochem. Eng. Aspects. 2011. 389 (1-3): 43-49. [ Links ]
28. Smith, Y.R.; Raj, K.J.A.;Subramanian, V.; Viswanathan, B. Sulfated Fe2O3-TiO2 synthesized from ilmenite ore: A visible light active photocatalyst. Colloids Surf., A: Physicochem. Eng. Aspects. 2010. 367 (1-3): 140-147. [ Links ]
29. Madejová, J.; Komadel, P. Baseline studies of the clay minerals society source clays: Infrared methods. Clays Clay Miner. 2001.49 (5): 410-432. [ Links ]
30. Madejová, J. FTIR techniques in clay mineral studies. Vib. Spectrosc. 2003. 31 (1): 1-10. [ Links ]
31. Yang, X.; Zhu, H.; Liu, J.; Gao, X.; Martens, W.N.; Frost, R.L.; Shen, Y.; Yaun, Z. A mesoporous structure for efficient photocatalysts: Anatase nanocrystals attached to leached clay layers. Microporous Mesoporous Mater. 2008.112 (1-3): 32-44. [ Links ]
32. Navío, J.A.; Colón, G.; Macías, M.; Real, C.; Litte, M.I. Iron-doped titania semiconductor powders prepared by a sol-gel method. Part I: synthesis and characterization. Appl. Catal., A: Gen. 1999. 177 (1): 111-120. [ Links ]
33. Manova, E.; Aranda, P.; Martín-Luengo, M.A.; Letaïef, S.; Ruiz-Hitzky, E. New titania-clay nanostructured porous materials. Microporous Mesoporous Mater. 2010.131 (1-3): 252-260. [ Links ]
34. Ghorai, T.K.; Chakraborty, M.; Pramanik, P. Photocatalytic performance of nano-photocatalyst from TiO2 and Fe2O3 by mechanochemical synthesis. J. Alloys Compd. 2011.509 (32): 8158-8164. [ Links ]
35. Leofanti, G.; Padovan, M.; Tozzola, G.; Venturelli, B. Surface area and pore texture of catalysts. Catal. Today. 1998. 41 (1-3): 207-219. [ Links ]