Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.42 no.2 Bogotá May/Aug. 2013
Producción y purificación de anticuerpos aviares (IgYs) a partir de cuerpos de inclusión de una proteína recombinante central en el metabolismo del NAD+
Production and purification of avian antibodies (IgYs) from inclusion bodies of a recombinant protein central in NAD+ metabolisim
Produção e purificação de anticorpos aviários (IgYs) empregando os corpos de inclusão de uma proteína recombinante importante para o metabolismo do NAD+
Paula A. Moreno-González1,2, Gonzalo J. Diaz1, María H. Ramírez-Hernández1,2,3
1 Universidad Nacional de Colombia, sede Bogotá, Calle 44 # 45-67 Bogotá D.C., Código Postal 111321 - Colombia
2 Facultad de Ciencias, Departamento de Química, Laboratorio de Investigaciones Básicas en Bioquímica (LIBBIQ). Bogotá D.C., Colombia
3 mhramirezh@unal.edu.co
Recibido: Abril 17 de 2013 Aceptado: julio 30 de 2013
Resumen
El uso de gallinas para la producción de anticuerpos policlonales, reduce la intervención animal, obteniendo además una gran cantidad de anticuerpos. Las aves presentan mayor distancia filogenética entre sus antígenos y los de mamíferos ofreciendo altos porcentajes de anticuerpos específicos. La producción de anticuerpos requiere antígenos en cantidades considerables, por ello es creciente el uso de proteínas recombinantes para tales fines. No obstante, la obtención de proteínas en sistemas heterólogos conduce frecuentemente a la precipitación en agregados insolubles de limitada utilidad (cuerpos de inclusión).
Este trabajo presenta una metodología para la producción de anticuerpos policlonales (IgYs) empleando cuerpos de inclusión (CI) como antígeno. Los CI purificados e inoculados corresponden a la Nicotinamida / Nicotinato Mononucleotido Adenililtranferasa (His-GiNMNAT) de Giardia intestinalis expresada en Escherichia coli. La purificación del antígeno se llevó a cabo mediante solubilización y renaturalización. Los anticuerpos se purificaron de la yema de huevo de gallinas imunizadas mediante dilución en agua, seguida de precipitación con sulfato de amonio al 60% y afinidad tiofilica. Los anticuerpos fueron evaluados mediante inmunoblot empleando la proteína His-GiNMNAT. De una yema de huevo se obtuvieron 14,4 mg de IgYs, con alta pureza y con un reconocimiento de hasta 15ng de His-GiNMNAT. Se mejoró la especificidad de los IgYs mediante una purificación adicional por afinidad al antígeno, lo cual permitiría su empleo para el reconocimiento de la proteína del parásito.
Palabras clave: Anticuerpos, IgYs, Cuerpos de Inclusión (CI), Giardia intestinalis, NAD+, NMNAT.
Abstract
In contrast with other animal models, the use of hens for polyclonal antibodies production not only reduces animal intervention, but also increases the quantity of the obtained immunoglobulins. The phylogenetic distance between birds and mammals, leads to more specific avian antibodies than their mammalian counterparts.
Since a large amount of antigen is required for avian antibody production, the use of recombinant proteins for this procedure has been growing faster over the last years. Nevertheless, recombinant protein production through heterologous systems, frequently leads to the formation of insoluble and useless aggregates (inclusion bodies, IC). This article presents a strategy to produce avian polyclonal antibodies (IgYs) from IC.
In order to obtain the antigen, the Giardia intestinalis nicotinamide mononucleotide adenylyltransferase recombinant protein (His-GiNMNAT) was expressed in Escherichia coli. The His-GiNMNAT protein was purified through IC solubilization and re-folding. The purified protein was use to immunize hens. The antibodies were purified from egg yolk by water dilution, followed by ammonium sulfate precipitation and thiophilic affinity chromatography.
Specificity of the purified antibodies was tested against the His-GiNMNAT protein through Western blot essays. In terms of yield, 14.4 mg of highly pure IgYs were obtained from one egg yolk; these antibodies were able to detect 15 ng of antigen. IgYs specificity was improved by means of antigen affinity purification, allowing its implementation for endogenous detection of GiNMNAT protein in G. intestinalis.
Key words: Antibodies, IgYs, Inclusion bodies, Giardia intestinalis, NAD+, NMNAT.
Resumo
A utilização de galinhas para a produção de anticorpos policlonais, diminui a intervenção sobre o animal e permite a geração de grandes quantidades de anticorpos. As aves têm maior distância filogenética entre os seus antígenos em comparação com os mamíferos, oferecendo altos porcentagens de anticorpos específicos. A produção de anticorpos requerem quantidades consideráveis de antigénio, por conseguinte, é comum a utilização de proteínas recombinantes para esta finalidade. No entanto, a produção de proteínas em sistemas heterólogos muitas vezes leva à precipitação em agregados insolúveis de utilidade limitada (corpos de inclusão).
Este trabalho apresenta uma metodologia para a produção de anticorpos policlonais, utilizando proteína recombinante a partir de corpos de inclusão. O antígeno utilizado foi a proteína Nicotinamida / Nicotinato Mononucleótido Adenililtranferasa de Giardia intestinalis gerada em Escherichia coli (His-GiNMNAT). A purificação do antigénio foi feita por solubilização e renaturalização. Os anticorpos foram purificados a partir da gema de ovo de galinhas imunizadas pelo método de diluição em água, seguido de precipitação com sulfato de amónio (60%) e afinidade tiofilica. Os anticorpos foram avaliados por imunoblot utilizando a proteína His-GiNMNAT. De uma gema de ovo foram obtidos 14,4 mg de IgYs com pureza elevada. Estes anticorpos podem reconhecer até 15 ng de His-GiNMNAT. A especificidade dos IgYs foi reforçada por outra purificação por afinidade pelo antigénio. Isto irá permitir a sua utilização para o reconhecimento da proteína do parasita.
Palavras-Chave: Anticorpos, IgYs, Corpos de inclusão (CI), Giardia intestinalis, NAD+, NMNAT.
Introducción
Los protozoos del género Giardia son considerados modelos biológicos de gran interés en razón a sus posición evolutiva basal, metabolismo reducido y simplicidad estructural. Son parásitos de mamíferos que constituyen un problema de salud médica y veterinaria nivel mundial. (1) Giardia intestinalis, es un eucariota ancestral con vías metabólicas simplificadas, similares a las procariotas, muchas de las cuales permanecen por ser dilucidadas.
El Dinucleotido de Nicotinamida y Adenina (NAD+) en sus diversas formas (NAD+, NADH, NADP+, NADPH+) tiene un rol fundamental como cofactor de óxido-reductasas, tanto en reacciones catabólicas como en procesos anabólicos (2-4). Adicionalmente, en la última década, se ha acumulado evidencia sobre el papel del NAD+ como sustrato para la modificación covalente de proteínas y la generación de movilizadores de calcio (3,5,6).
Teniendo en cuenta la multifuncionalidad del NAD+, muchos procesos celulares son regulados mediante las rutas de síntesis y consumo de esta molécula, siendo la síntesis indispensable para la viabilidad celular. (7,8). En organismos como Giardia el estudio de este tipo de vías centrales es un punto clave para evaluar la divergencia de la maquinaria celular ya que al estudiar el metabolismo energético en organismos basales, se puede tener una mejor comprensión de estos procesos en organismos más complejos (9)
El transcriptoma de Giardia intestinalis reporta dos secuencias candidatas para la Nicotinamida / Nicotinato Mononucleótido Adenililtransferasa (GiNMNAT) enzima central en la síntesis del NAD+, ya que constituye el punto de convergencia entre las vías de síntesis conocidas para esta molécula. (10) En trabajos realizados previamente, ambas secuencias fueron evaluadas en sistemas heterólogos mediante el uso de proteínas recombinantes, obteniéndose la primera evidencia de la expresión a nivel proteico de ambas isoenzimas, ensayos adicionales han permitido confirmar ambos candidatos como enzimas activas in vitro. (11–13).
La producción de proteínas recombinantes, conduce frecuentemente a la formación de cuerpos de inclusión, agregados insolubles, compuestos casi exclusivamente por proteína recombinante en diferentes estados de plegamiento (14). Los cuerpos de inclusión son considerados un efecto no deseado en ensayos funcionales debido a la perdida de la estructura nativa; algunas veces las proteínas, pueden ser recuperadas a través de solubilización en agentes denaturantes, seguida de renaturalización. A pesar de la perdida de la estructura tridimensional, la estructura primaria no es alterada y esto permite su empleo como un excelente antígeno para el desarrollo de anticuerpos.
Para continuar con el estudio de las NMNAT en Giardia, en el presente trabajo se realizó la producción de anticuerpos policlonales contra una de las isoenzimas de Giardia intestinalis empleando modelos aviares. Los anticuerpos policlonales constituyen herramientas de gran interés en la investigación científica; por tanto, hoy en día se hace más exigente no solo su calidad sino también la metodología empleada para su producción. Tanto en la sangre como en la yema de huevo de las aves se acumula una inmunoglobulina G homóloga, conocida como IgY. Estas inmunoglobulinas son transferidas desde el sistema circulatorio de la gallina a través del oolema hacia el ovocito en desarrollo en el folículo ovárico. Se producen entre 70 y 100 mg de IgY de acuerdo al tamaño del huevo, siendo éstos una fuente abundante de anticuerpos policlonales que pueden ser adquiridos sin involucrar la muerte del animal, a partir de huevos obtenidos de gallinas inmunizadas. (15–20) En este trabajo se presenta la obtención, purificación y caracterización de anticuerpos IgY contra una de las isoenzimas GiNMNAT obtenida a partir de cuerpos de inclusión.
Materials and methods
Obtención del antígeno: La proteína recombinante His-GiNMNAT se obtuvo a partir del clon de expresión BL21 (DE3) – transformado con el vector pET100D-TOPO/ginmnat; un pre-inoculo de las células crecieron a 37 °C durante toda la noche en medio Luria Bertani (AMRESCO®) suplementado con 100 µg/ml de ampicilina (Genfar®). Posteriormente se realizó una dilución 1/100 de pre-inoculo en medio Luria Bertani (AMRESCO®) y se llevó a cabo la inducción a la OD600 ≈ 0,6 empleando Isopropil-tio-glactopiranósido (IPTG) (Fermentas®) a una concentración final de 1mM, de acuerdo a condiciones experimentales estandarizadas previamente. (11-12, 15) Las células fueron colectadas por centrifugación a 6000 rpm durante 10 min; los lisados se obtuvieron mediante el tratamiento de las células con lisozima (1 µg/ml) y la maceración de los mismas con nitrógeno líquido. La separación de fracciones proteicas solubles e insolubles (cuerpos de inclusión (CI)) se llevó a cabo mediante centrifugación a 12000 rpm 30 min de los lisados celulares obtenidos.
La purificación de la proteína se realizó mediante homogenización de la fracción insoluble en solución de lavado 1 (2 M urea, 100 mM Tris/HCl pH 7, 5 mM EDTA, 5 mM DTT, 2% (P/V) Tritón X-100) y posterior centrifugación a 12000 rpm durante 30 minutos (min) a 4°C. Para retirar el exceso de urea y detergente, el precipitado resultante se homogenizó en una solución de lavado 2 (100 mM Tris/HCl pH 7, 5 mM EDTA, 5 mM DTT). El precipitado obtenido se homogenizó en buffer de re-suspensión (8 M hidrocloruro de guanidina, 50 mM Tris/HCl pH 7, 5 mM EDTA, 5 mM DTT) y se centrifugó a 14000 rpm durante 1 hora (h) a 4 °C; de allí se separaron las fracciones solubilizadas de las insolubles. (16) Las fracciones solubilizadas se sometieron a proceso de diálisis. Las muestras obtenidas durante el proceso de purificación se analizaron mediante SDS-PAGE.
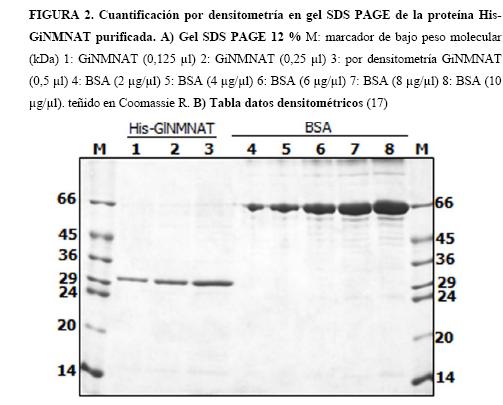
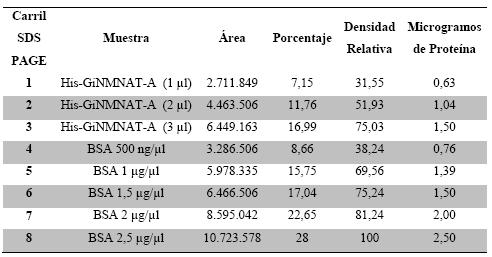
Cuantificación de proteínas: Se determinó la cantidad de proteína antigénica total mediante un método semi-cuantitativo (densitometría en gel). Se tomaron diferentes volúmenes (5, 10 y 15 µl) de la proteína antígeno (His-GiNMNAT) y se prepararon para SDS PAGE 12%. La tinción de las bandas obtenidas se realizó con azul de Coomassie 0,1% R-250. Los valores de área e intensidad de las bandas de interés en el gel obtenido se midieron en el densitómetro de análisis molecular (BioRad) empleando IMAGEJ (17) Software. Estos valores fueron interpolados de la curva estándar realizada con 0,5, 2 y 4 µg de BSA (Suero de Albumina Bovina, Sigma. Mo, USA).
Las anticuerpos aviares (IgY) se sometieron a cuantificación de proteína total por el método de Bradford, empleando como patrón para la curva de calibración espectrofotométrica BSA en diferentes concentraciones.
Producción de anticuerpos policlonales
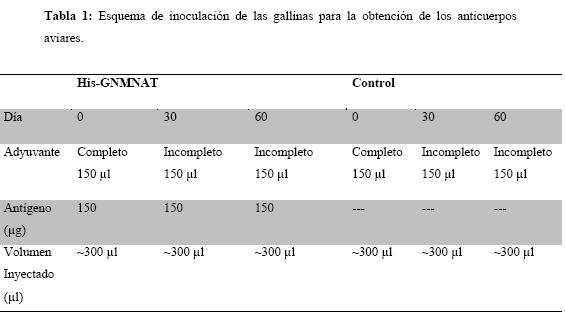
Esquema de inmunización aviar y recolección de huevos: Se emplearon gallinas Babcock Brown de 19 semanas de edad (tres por tratamiento) [Tabla 1]. Se realizaron inoculaciones intramusculares con: antígeno His-GiNMNAT y Control sin antígeno. [Tabla (1)] Se recogieron 72 huevos para cada gallina. Adicionalmente, para analizar los IgY plasmáticos, al cabo de un mes de inoculación se tomaron muestras de sangre de las aves.
Purificación de los anticuerpos obtenidos: (i) Deslipidación de las yemas de los huevos recolectados: Se empleó el método descrito por Akita y Nakai (18); se extrajo la yema retirando la clara y se solubilizó en 9 volúmenes de agua destilada, se equilibró el pH de la solución en 5,0. Se sometió la solución a 16 h de agitación a 4 °C y se centrifugó a 8000 x g durante 30 minutos a 4°C. El sobrenadante se conservó a -80 °C. 2 ml del sobrenadante sometieron a precipitación con sulfato de amonio (60%). El precipitado se solubilizó en 2 ml de PBS para ser sometido posteriormente a análisis de ELISA y determinar las yemas con mayor contenido de IgYs.
(ii) Cromatografía tiofílica: a partir de los huevos que contenían la mayor cantidad de IgY, se realizó la purificación de los mismos mediante métodos de afinidad. (1) Se adicionaron 87 mg de sulfato de sodio por cada ml de solución a la muestra. Se dializó a 4°C toda la noche, se centrifugó dos veces a 10000 x g durante 30 min, se filtró tres veces utilizando membranas de 0.45 μm. Se utilizó el kit Pierce® Thiophilic Adsorbent, equilibrando la columna con 24 ml de buffer de unión (sulfato de potasio 0,5 M, fosfato de sodio 50 mM, azida de sodio 0,05% pH 8.0). A continuación se aplicó la muestra y se recogieron fracciones de 2 ml monitorizadas a 280 nm, eliminando las proteínas no unidas mediante lavados con el buffer de unión. Las inmunoglobulinas se eluyerón, utilizando 24 ml de buffer de elución (fosfato de sodio 50 mM, azida de sodio 0,05% pH 8,0).
Las fracciones obtenidas mediante ELISA y las IgYs eluidas se almacenan con glicerol 10% (V/V) a 4 °C. 20 El procedimiento completo de purificación de IgY se visualiza mediante SDS-PAGE al 12%.
(iii) Obtención de IgYs a partir de sangre de gallina. La sangre obtenida de la vena alar de las aves experimentales fue incubada a 37 °C 30 min y posteriormente centrifugada. El suero resultante fue suplementado con glicerol al 10 % (v/v). Las muestras se conservaron a -20 °C para posteriores ensayos.
(iv) Purificación de anticuerpos IgY-αGiNMNAT por afinidad al antígeno. 1mg de la proteína recombinante antigénica, fue cargada en SDS-PAGE al 12 % y transferida a una membrana de nitrocelulosa, la banda correspondiente a la His-GiNMNAT (31 kDa.) fue evidenciada mediante tinción con solución de Ponceau S. (Sigma) y fue cortada y pre tratada con una solución de glicina 100 mM pH 2,5 por 10 min. Posteriormente fue lavada 5 min con 100 µl de amortiguador tris salino (TBS) (50mM de Tris, 150mM NaCl), luego las membranas fueron bloqueadas con TBS suplementando leche descremada al 5 %, durante 1h a temperatura ambiente y lavadas con TBS tres veces. Posteriormente las membranas fueron sumergidas en una alícuota de 100 µl del anticuerpo puro durante 18 horas a 4 °C en agitación. El anticuerpo IgY-αGiNMNAT purificado se eluyó al incubar la membrana con 100 µl de una solución de Glicina 100 mM pH 2,5 durante dos minutos. Seguidamente el anticuerpo eluido se neutralizó de la solución adicionando 10 µl de Tris HCl 2M pH 8,5. La elución es repetida 3 veces y se obtuvo un volumen final de 300 µl llegando a una concentración final de Tris HCL 150 mM. Los anticuerpos IgY-αGiNMNAT puros y eluidos se cuantificaron mediante un ensayo de Bradford. (15)
Ensayo por inmunoabsorción ligado a enzimas (ELISA): se realizaron ELISAs indirectos de acuerdo a procedimientos estándar (20,21). Se emplearon placas de 96 pozos activadas con 10 ng de la proteína recombinante His-GiNMNAT, las IgYs a evaluar fueron empleados en dilución 1:100 en PBS; como anticuerpo secundario se empleó IgG de burro anti IgY acoplado a peroxidasa (dilución 1:100000 Sigma Aldrich), utilizando como sustrato o-fenildiamina dihidrocloridrato (OPD) (Thermo Scientific) a una concentración de 0,4 mg/ml. Luego de 30 minutos de reacción las placas se midieron a una OD: 490 nm, para evidenciar la reacción colorimétrica producida por el sustrato OPD.
Inmunodetección mediante Inmunoblot: con el objeto de evaluar los anticuerpos obtenidos, se realizaron ensayos de reconocimiento sobre proteína recombinante en membranas de nitrocelulosa (Thermo Scientific). Para ello en geles discontinuos SDS-PAGE 12 %, se sembraron diferentes concentraciones del antígeno, seguido del proceso de electrotransferencia y bloqueo de inespecificidades con TBS leche descremada al 5 %. El reconocimiento se llevó a cabo mediante imunodetección empleando las IgYs obtenidos como anticuerpo primario y como anticuerpo secundario IgG de burro anti IgY (Sigma) mediante el sistema de revelado de peroxidasa de rábano con los sustratos cloronaftol y peróxido al 4 % según lo reportado (1).
Resultados y discusión
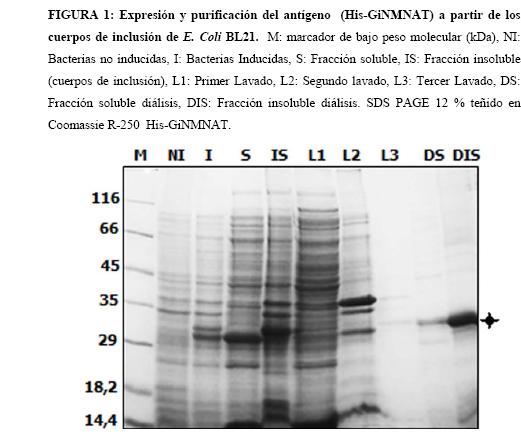
Como primer paso para la generación de anticuerpos policlonales es indispensable tener una gran cantidad de antígeno con un alto grado de pureza. En trabajos previos, se determinó que la mayor cantidad de proteína recombinante His-GiNMNAT expresada en Escherichia coli (E. coli), se acumula en los cuerpos de inclusión. (12,13) Obtener proteínas en forma de cuerpos de inclusión es desventajoso para el estudio biológico de las mismas, sin embargo estos resultan bastante útiles para la obtención de altas cantidades de proteína, uno de los requisitos que deben tener los antígenos a ser inoculados para la producción de anticuerpos en cualquier sistema, (14) por lo que se escogió esta fracción como fuente del antígeno.
La purificación de la proteína se llevó a cabo en tres pasos básicos: lavado, solubilización y renaturalización (13, 15). El curso de la purificación, se puede visualizar mediante SDS PAGE (Figura 1). Se obtuvo una purificación parcial de la proteína (Figura 1 DIS), la cual en su mayoría se encuentra en la fracción insoluble de la purificación, teniendo en cuenta lo anterior se cuantifico a través de densitometría en gel como se describió previamente, obteniéndose 1,26 mg de His-GiNMNAT a una concentración 630 ng/µl (Figura 2).
Los anticuerpos IgY de las gallinas son transferidos desde el suero durante la maduración de la yema en el oviducto por un mecanismo similar a la transferencia placentaria que ocurre en mamíferos y se almacenan allí en grandes proporciones como un mecanismo de protección al embrión. (14,16) Ya que es posible mantener IgY activos en la yema de huevo por varios meses si se sigue una inmunización periódica, (24) se recolectaron la mayor cantidad de huevos posibles durante dos meses.
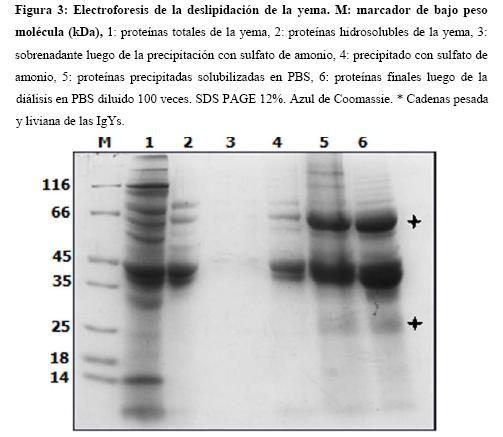
La yema de huevo se compone fundamentalmente de gránulos formados por fosfovitinas y lipoproteínas, dispersas en una fracción soluble que contiene livetinas y LDL. (23-25) Inicialmente la separación por solubilidad, mediante dilución en agua de la yema a un pH 5, facilitó la aglomeración de los gránulos lipídicos insolubles (deslipidación) (25), favoreciendo su posterior separación de las proteínas del plasma, entre ellas las livetinas (de 45 kDa dentro de las cuales se encuentran las IgYs) mediante centrifugación o filtración (26), permitiendo la aparición de sobrenadantes traslúcidos. Ya que las IgYs son proteínas solubles, es posible recurrir a la precipitación por salting out; en este caso la adición de sulfato de amonio a una saturación del 60 % ha mostrado ser óptima para la separación de las globulinas, favoreciendo un alto porcentaje de recuperación ≈ 89 %. (Figura 3) (4,16).
El proceso de purificación por dilución en agua para uno de los huevos purificados, es seguido mediante SDS-PAGE (Figura 3). Al ajustar el pH y centrifugar la yema es posible visualizar las livetinas (Figura 3 carril 2), en los carriles 4 y 5 se observa el pellet de proteínas luego de la precipitación con sulfato de amonio, donde se evidencia la presencia de diversas globinas, la eficiencia de la precipitación es clara al verificar la ausencia de proteínas en la fracción soluble resultante del tratamiento con sulfato de amonio (carril 3). También se observa la desaparición de otras proteínas, junto con la concentración de las IgYs conforme se lleva a cabo la purificación. En el carril 6 es de resaltar la presencia de dos bandas de 30 y 65 kDa, que corresponden a los pesos moleculares esperados para las cadenas liviana y pesada de las inmunoglobulinas IgYs reportados previamente. Es posible evidenciar también, dentro del perfil electroforético otras proteínas. La banda de 45 kDa presumiblemente represente a las ß-livetinas (proteínas similares a γ-livetinas, compuestas principalmente de IgYs), que por su peso se cree que pertenezcan a un grupo más específico, el de las α-2-glicoproteínas (24). Por su parte la banda de 38 kDa se atribuye a la fracción de α-fosvitinas (16,24).
Los extractos obtenidos de las yemas colectadas después del proceso de deslipidación se evaluaron mediante ELISA con el objeto de identificar los huevos con mayor producción de anticuerpos (Figura 4). La figura 4 resume los resultados del ensayo de ELISA de los huevos colectados y procesados de ambos tratamientos (con y sin antígeno). A pesar de la irregularidad de la respuesta inmune, es posible visualizar picos de mayor concentración de IgYs posteriores a las inoculaciones. La ausencia de una tendencia regular en los datos, no es inesperada ya que el metabolismo de las aves se ve influenciado por condiciones fisiológicas y ambientales que no es posible controlar, lo cual conlleva a oscilaciones en la producción de inmunoglobulinas en los diferentes momentos evaluados (22-27).
La respuesta inmune primaria al antígeno, se caracteriza por producir anticuerpos de baja afinidad, tras lo cual se generan células de memoria T y B. (26-28). Gracias a la generación de procesos de memoria en el sistema inmune, en los refuerzos la presencia de una nueva estimulación antigénica genera una respuesta inmunológica más rápida, lo cual explica en parte el perfil obtenido. (29) En la figura 4 se pueden evidenciar picos de alta concentración de IgY; en este trabajo se escogió el huevo identificado con el número 30 para llevar a cabo la purificación total posterior a la solubilización. La figura 4 también permite visualizar que la reacción de reconocimiento de las proteínas solubles obtenidas de la gallina inoculada (negro) es específica por el antígeno ya que está ausente en la gallina control inoculada solamente con adyuvante (gris).
Luego de determinar los picos de mayor producción de anticuerpos, se procedió a la purificación total de las IgY mediante cromatografía de afinidad tiofilica (Figura 5). Para ello, la fracción soluble del huevo 30 fue elegida por su elevado contenido de IgYs. La columna está constituida por esferas de agarosa químicamente unidas a 2- mercaptoetanol a su vez unidas a grupos divinilsulfona activados, que presentan una elevada afinidad por las inmunoglobulinas en presencia de sales liotrópicas. (14,19) Algunos autores, (14,16) describen el mecanismo de acción como la interacción entre el grupo tiol del 2-mercaptoetanol con regiones aromáticas de la proteína, principalmente residuos de triptófano y fenilalanina. No obstante, otros reportes refutan esta teoría y consideran que el mecanismo de acción está aún por determinarse. (14,19)
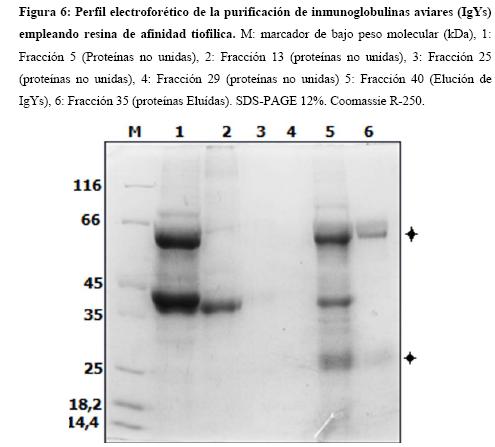
La Figura 5 muestra el perfil cromatográfico de la purificación por columna de afinidad tiofílica. En las primeras fracciones se eluyen proteínas que no presentan interacción con la resina, luego de eliminarlas se procede a la elución, donde se da un efecto inmediato de disociación de las uniones específicas de las proteínas con la resina y un consecuente aumento en la lectura a 280 nm (Figura 5). El pico más alto corresponde a la fracción obtenida en el momento de la aplicación del buffer de elución (Figura 5 Fracción 40), la cual al ser visualizada mediante SDS PAGE (Figura 6 carril 5) muestra el patrón electroforético característico de las IgY (Bandas de 30 y 65 kDa), por lo que se logra una adecuada purificación de IgYs mediante esta metodología.
La fracción 40 es empleada para los experimentos posteriores como el anticuerpo IgY de huevo. Para determinar la cantidad de proteína IgY presente, una alícuota se cuantificó mediante el método de Bradford como se describe en la metodología. Se obtuvo una concentración de 7,2 µg/µl, que equivale, a un total de 14,4 mg de IgY para el huevo 30. Esta cantidad se encuentra dentro de rango obtenido para IgY purificadas por dilución en agua y cromatografía tiofílica para otros antígenos (16), tanto como para otros anticuerpos IgY purificados por esta metodología (30). Del total de IgYs obtenidas, se espera que entre un 2 a un 10 % correspondan a IgY especificas contra el antígeno inoculado (25). Por lo que la metodología empleada para la purificación fue efectiva en la obtención de una gran cantidad de proteína IgY. La purificación de IgY puede llevarse a cabo mediante diversas metodologías, no obstante para garantizar la eficiencia de un método deben ser tenidos en cuenta tres factores determinantes: cantidad, pureza y actividad biológica de las inmunoglobulinas, además de los costos que involucre el proceso. (16) El procedimiento utilizado en el presente trabajo se puede considerar como un método muy eficiente de obtención de anticuerpos a partir de la yema de huevo, considerando la relación costo beneficio.
Evaluación del título del IgY sobre proteína recombinante.
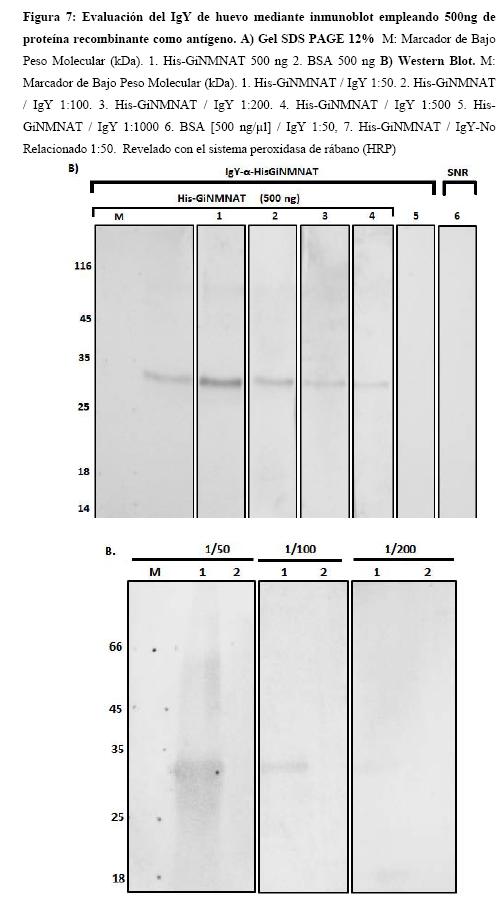
Para caracterizar el anticuerpo purificado, se realizó la determinación del título mediante un ensayo de inmunoblot en el cual se emplea como antígeno la proteína recombinante His-GiNMNAT (500 ng), purificada previamente desde los cuerpos de inclusión. La proteína para estos ensayos corresponde a la misma empleada para la inmunización de las gallinas. La Figura 7 muestra los resultados del inmunoblot al usar diferentes títulos del anticuerpo obtenido de huevo IgY-α-GiNMNAT (1:1000 – 7,22 ng/µl, 1:500 - 14,44 ng/µl, 1:200 - 36,10 ng/µl, 1:100 - 72,20 ng/µl y 1:50 - 144,40 ng/µl). Se evidencia reconocimiento de la proteína recombinante de 31 kDa desde 1:1000. También es clara la ausencia de reconocimiento de otras proteínas como BSA que estaban presentes en las mismas cantidades y fueron tratadas con los mismos títulos, tanto como la ausencia de reconocimiento de las IgYs purificadas de las gallinas no inoculadas con el antígeno His-GiNMNAT empleando los mismos títulos.
Los títulos escogidos se probaron de acuerdo a ensayos estandarizados previamente para otros anticuerpos aviares obtenidos y purificados. (16) Los títulos reportados para IgY varían de acuerdo a la cantidad de antígeno, al método de purificación utilizado, y a la cantidad de inoculaciones realizadas, por lo que no es posible comparar directamente el título obtenido con los reportados. (16) Sin embargo, el título del anticuerpo obtenido concuerda con el registrado para antígenos similares de parásitos como Leishmania spp. (16).
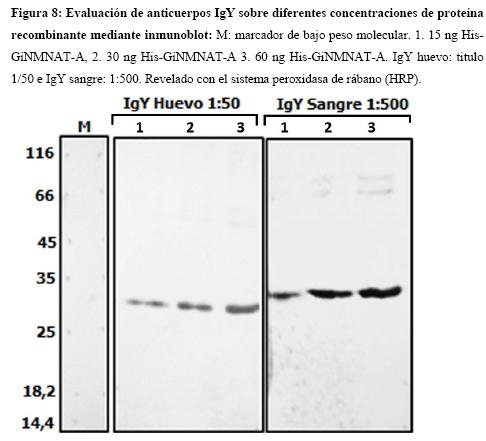
Las NMNAT son enzimas de baja expresión en algunos organismos y/o tejidos celulares, (3) por lo que es importante estandarizar el reconocimiento de cantidades muy bajas de proteína recombinante. Se realizó un ensayo de inmunoblot sobre diferentes cantidades de His-GiNMNAT para la determinar la cantidad mínima capaz de ser reconocida por los anticuerpos obtenidos. Los resultados de este experimento se muestran en la Figura 8.
En adición se muestra la detección de la proteína recombinante con una señal fuerte, incluso sobre cantidades tan reducidas como 15 ng. Se reconocen también algunas inespecificidades de mayor peso molecular, estas corresponden a impurezas del antígeno, que contiene cantidades bajas de otras proteínas de E. coli presentes en los cuerpos de inclusión, es de esperar que se produzcan anticuerpos contra estas proteínas contaminantes y por ende una detección de las mismas empleando concentraciones elevadas de anticuerpos como en este ensayo.
De manera paralela para tener una fuente adicional de IgYs, se decidió tomar una muestra de sangre de 5 ml de la gallina de la cual se obtuvieron los huevos, un mes después de la segunda inoculación. Se evaluó el título del suero obtenido de forma similar a las IgYs de huevo sobre proteína recombinante (resultados no mostrados), obteniéndose un título de (1:500) para la detección de cantidades tan bajas como 15n g de proteína recombinante (Figura 8). Los IgYs obtenidos del suero son igualmente eficientes en el reconocimiento de la proteína recombinante, constituyendo una fuente adicional de anticuerpo. Las IgYs de séricas no requieren una purificación posterior pero su disponibilidad es limitada debido a que se presentan en un volumen menor y su extracción involucra un proceso invasivo en el animal. Contrario a lo observado en la obtención de IgYs de huevo.
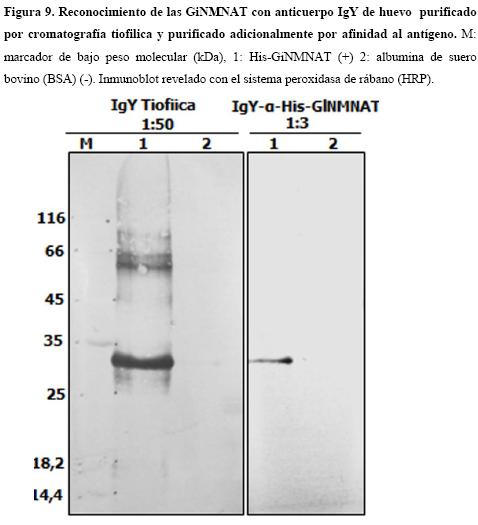
El anticuerpo IgY-αGiNMNAT purificado mediante afinidad desde membranas de nitrocelulosa
Dado que el anticuerpo IgY al ser empleado en altas concentraciones, detecta además de la proteína His-GiNMNAT de 31 kDa una banda de alto peso molecular (≈ 66 kDa), aprovechando la gran cantidad de anticuerpo IgY de huevo disponible, se abordó una estrategia adicional de purificación por afinidad al antígeno, previamente transferido e inmovilizado sobre membranas de nitrocelulosa como se describe en la metodología. Los anticuerpos así purificados, fueron empleados para el reconocimiento de la proteína recombinante por inmunoblot. La Figura 9 muestra la eficiencia del proceso de purificación en la eliminación de reconocimiento de proteínas inespecíficas de alto peso molecular en comparación con el anticuerpo inicial previamente purificado por afinidad tiofilica en título (1/50). Mediante el anterior proceso de purificación se logró la obtención de un anticuerpo IgY-αGiNMNAT de alta especificidad por la proteína recombinante His-GiNMNAT.
En este manuscrito se describe una técnica para la obtención y purificación de IgYs a partir yemas de huevo cuya utilidad es extensa, ya que permite la obtención grandes cantidades de anticuerpos que pueden ser empleados para estudios diversos. El hecho de que las aves se encuentren filogenéticamente más distantes de los mamíferos hace esta metodología ideal para la obtención de anticuerpos contra antígenos de mamíferos sin lugar a reacciones cruzadas y con una alta especificidad. Además de evitar reacciones indeseadas con el sistema complemento u otros componentes del sistema inmune. (16) teniendo en cuenta lo anterior para el caso particular de Giardia intestinalis patógeno frecuente de mamíferos como conejos o ratones, sus antígenos no constituyen buenos inmunogénos para la obtención de anticuerpos en estos modelos. Por lo que es ventajoso para el estudio de la GiNMNAT-A emplear modelos aviares para la obtención de anticuerpos específicos
La NMNAT esta presente en todos los organismos vivos conocidos hasta el momento, ya que cataliza el paso clave de la síntesis del NAD+ (2). La obtención de anticuerpos IgYs-αHis-GiNMNAT-A descrita en este articulo permitirá desarrollar estudios funcionales y celulares detallados en Giardia intestinalis. Adicionalmente, los anticuerpos desarrollados evidencian detección de proteínas NMNAT recombinantes obtenidas y purificadas de otros protozoarios, pero no de alguna proveniente de mamíferos (resultados no mostrados), demostrando que la herramienta inmunológica obtenida constituye una estrategia eficiente para el desarrollo de estudios acerca de la síntesis del NAD+ en parásitos protozoos.
Conclusión
Los cuerpos de inclusión obtenidos de la sobreexpresión de proteínas recombinantes como His-GiNMNAT en sistemas heterólogos como E. coli, son herramientas útiles para la obtención de anticuerpos policlonales. Ya que pueden ser empleados como antígenos eficientes para una alta producción de anticuerpos, aprovechando un subproducto de la sobreexpresión de proteínas.
Se implementó y estandarizó un método para la producción y purificación de grandes cantidades de anticuerpos policlonales aviares (IgYs) a partir de la yema de huevo empleando cuerpos de inclusión como antígeno. Se obtuvieron IgYs tanto de yema de huevo como de plasma sanguíneo de las gallinas inoculadas capaces de reconocer la proteína recombinante His-GiNMNAT. Adicionalmente se empleó un método para mejorar la especificidad del anticuerpo mediante una segunda purificación por afinidad al antígeno inmovilizado en membranas de nitrocelulosa, con la cual se obtuvo un reconocimiento específico de la proteína recombinante de 31 kDa.
Agradeciminetos
Agradecemos a la Universidad Nacional de Colombia, especialmente al proyecto de estudiante auxiliar 17807/2063.
Bibliografía
1. Morrison, G.; McArthur, G.; Gillin, F.; Aley, S.; Adam, R.; Olsen, G.; Sogin, M. Genomic minimalism in the early diverging intestinal parasite Giardia lamblia. Science. 2007. 317 (5846), 1921-6. [ Links ]
2. Berger, F.; Ramirez-Hernández, M.; Ziegler, M. The new life of a centenarian: signalling functions of NAD(P). Trends Biochem. Sci. 2004; 29(3):111-8. [ Links ]
3. Chiarugi, A.; Dölle, C.; Felici, R.; Ziegler, M. The NAD metabolome--a key determinant of cancer cell biology. Nat. Rev. Cancer. 2012;12(11):741-52. [ Links ]
4. Lau, C. Functional Characterisation of Three Human Nicotinamide Mononucleotide Adenylyltransferases. Dissertation for the degree philosophiae doctor.University of Bergen. 2008. Disponible.: https://bora.uib.no/bitstream/handle/1956/3283/Ph._Thesis_CorinnaLau.pdf?sequence=1 [consultado el 10 de diciembre de 2011] [ Links ]
5. Neme, R.; Ramírez-Hernández, M.; Aproximación Bioinformática y Bioquímica al Metabolismo del Dinucleótido de Nicotinamida (NAD+) en Leishmania braziliensis. SINAB- Univ. Nac. Colomb. 2008: (12) 1-31. [ Links ]
6. Jayaram, H.; Kusumanchi, P.; Yalowitz, J. NMNAT expression and its relation to NAD metabolism. Curr. Med. Chem. 2011;18 (13):1962-72. [ Links ]
7. Garavaglia, S.; D'Angelo, I.; Emanuelli, M.; Carnevali, F.; Pierella, F.; Magni, G.; Rizzi, M. Structure of human NMN adenylyltransferase. A key nuclear enzyme for NAD homeostasis. J. Biol. Chem., 2002, 277, 8524-8530. [ Links ]
8. Lee, H. Physiologycal Functions of Cyclic ADP-Ribose and NAADP as Calcium Messengers. 2001. Annu. Rev. Pharmacol. Toxicol. 2001. 41:317-45. [ Links ]
9. Koch-Nolte, F.; Fischer, S.; Haaga, F.; Ziegler, M. Compartmentation of NAD+-dependent signalling. FEBS Lett. 2011; 585 (11):1651-6. [ Links ]
10. Manning, G.; Reiner, D.; Lauwaet, T.; Dacre, M.; Smith, A.; Zhai, Y.; Svard, S.; Gillin, F. The minimal kinome of Giardia lamblia illuminates early kinase evolution and unique parasite biology. Genome Biol. 2011; 12 (7):66-72. [ Links ]
11. Denu, J. Vitamins and aging: pathways to NAD+ synthesis. Cell. 2007; 129 (3):453-4. [ Links ]
12. Buitrago, J.; Ramírez-Hernández M. Aproximación al estudio del metabolismo del dinucleótido de nicotinamida adenina en Giardia lambía. SINAB- Univ. Nac. Colomb. 2007. (12):1-21. [ Links ]
13. Ramírez-Vargas, E.; Ramírez-Hernández, M. Evaluación del candidato a de la proteína NMNAT mediante herramientas bioquímicas. SINAB- Univ. Nac. Colomb. 2010. [ Links ]
14. Bustos-Parra, V.; Ramírez-Hernández, M. Evaluación del candidato B de la proteína NMNAT de Giardia lamblia mediante herramientas bioinformáticas y bioquímicas. SINAB- Univ. Nac. Colomb. 2010. (12):1-21. [ Links ]
15. Singh, S., & Amulya K., 2005. "Solubilization and Refolding of Bacterial Inclusion Body Proteins." Journal of Bioscience and Bioengineering 99 (4): 303-10. [ Links ]
16. Contreras, L., & Ramírez-Hernández, M. H. Aproximación al Metabolismo del Dinucleótido de Nicotinamida y Adenina (NAD+) en Leishmania. Rev. Asoc. Col. Cienc. (Col.) 2010. 22, 97-108. [ Links ]
17. Pinto, J.; Barco, M.; Afanador, M.C.; Merchán, A.M.; Montañez, M.F.; Andrade, F.; Torres, O. Obtención de anticuerpos policlonales IgY antiparvovirus canino a partir de yema de huevo de gallina. Universitas Scientiarum 2005; 10 (1):37-43. [ Links ]
18. Quantification of protein bands using densitometry http://www.med.umn.edu/starrlab/prod/groups/med/@pub/@med/@starrlab/documents/content/med_content_370494.html [consultado el 4 de mayo de 2013] [ Links ]
19. Akita, M. & Nakay, E. Immunoglobulins from Egg Yolk: Isolation and Purification. J. Food Sci. 1992; 57(3):8058-70. [ Links ]
20. Barroso, P.; Murcia, H.; Vega, N.; Pérez, G. Obtención y purificación de IgY dirigidas contra la lectina de Salvia bogotensis. Biomédica 2005; 4:496-510. [ Links ]
21. García, D.; Nicholls, R.; Arévalo, A.; Torres O.; Duque, S. Obtención, purificación y caracterización de anticuerpos policlonales IgY desarrollados en gallina, dirigidos contra aislamientos colombianos de Giardia duodenalis. Biomédica 2005; 25:451-63. [ Links ]
22. Sánchez-Lancheros, D.; Ramírez-Hernández M. Desarrollo de una herramienta inmunológica para el estudio de la Nicotinamida Mononucleotido AdenililTransferasa (NMNAT) en Leishmania braziliensis. SINAB- Univ. Nac. Colomb. 2011; 26.345-350. [ Links ]
23. Fang L. Antibody Purification from Inmunoblotting. 2011. Disponible: http://www.bio-protocol.org/wenzhang.aspx?id=133. [Consultado el 18 de abril de 2013] [ Links ]
24. Rica, F. Métodos Inmunológicos. 2007. Disponible. http://medicina.ens.uabc.mx/manuales_laboratorio/L1M-N3-004.pdf. [Consultado el 06 de junio de 2013] [ Links ]
25. Huopalahti, R.; López-Fandiño, R.; Anton, M.; Schade, R. Bioactive Egg Compounds. Eds. Springer. 2007; 5:293-389. [ Links ]
26. Harlow, E. & Lane D. Lab. Antibodies A Laboratory Manual. Cold Spring Harb. 1988 2:726 -856. [ Links ]
27. Levy, J.; Ibrahim, A.; Shirai, T.; Otha, K.; Nagasawa, R.; Yoshida, H.; Estesii, J.; Gardenerii, M. Dietary fat affects immune response, production of antiviral factors, and immune complex disease in NZB/NZW mice. Proc. Natl. Acad. Sci. U. S. A. 1982; 79:1974-8. [ Links ]
28. Paul, W.; Mcheyzer-williams, M.; Barthold, Stephen.; Bowen, R.; Hedrick, Ronald.; Knowles, Donald.; Lairmore, Michael.; Parrish, Colin.; Saif, Linda.; Swayne D. Maclachlan, N. Fenner's veterinary virology. Elsevier. 2010; 4:43-51. [ Links ]
29. Paul, W.; Mcheyzer-williams, M. Fundamental Immunology. 5th edition. Lippincott Williams & Wilkins Publishers 2003; 5:157:204. [ Links ]
30. Kaser, Matthew R. Howard GC. Making and Using Antibodies- A Practical Handbook. Crc press. Taylor & Francis group. 2006; 2:385:395. [ Links ]
31. Reyes-Montaño, E.; Lareo, L.; Pérez, G. Production and purification of IgY antibodies as a novel tool to purify the NR1 subunit of nmda receptor. Rev. Colomb. Quím. 2012; 41(1):31-45. [ Links ]