Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.42 no.3 Bogotá Sep./Dec. 2013
DETERMINACIÓN DE COMPUESTOS CIANOGÉNICOS AMIGDALINA Y PRUNASINA EN SEMILLAS DE ALMENDRAS (PRUNUS DULCIS L) UTILIZANDO CROMATOGRAFÍA LIQUIDA DE ALTA RESOLUCIÓN
DETERMINATION OF CYANOGENIC COMPOUND AMYGDALIN AND PRUNASIN IN ALMOND KERNELS (PRUNUS DULCIS L) BY USING LIQUID CHROMATOGRAPHY
DETERMINAÇÃO DE COMPOSTOS CIANOGÊNICOS AMIGDALINA E PRUNASINA EM SEMENTES E AMÊNDOA (PRUNUS DULCIS MILLER) CROMATOGRAFIA LÍQUIDA DE ALTA RESOLUÇÃO
Guillermo Arrazola P1, Nuria Grané2, María L. Martin2, Federico Dicenta3
1 Departamento Ingeniería de Alimentos. Facultad de Ingeniería. Km 3 Vía Cereté. Colombia. E.mail. guillermo.arrazola@ua.es
2Departamento Química Analítica. Universidad Alicante. España.
3CEBAS- CSIC. Mejora Genética. Murcia. España
Resumen
El objetivo del presente trabajo fue aplicar un técnica para determinar y cuantificar por separado los compuestos cianogénicos que pueden estar presentes en la semilla de almendra madura (Prunus dulcis). Entre los métodos encontrados, se seleccionó la cromatografía de líquidos de alta resolución (HPLC), que permite la cuantificación de los glucósidos cianogénicos amigdalina y prunasina por separado, adecuando diferentes procedimientos de extracción como el tamaño de partículas que influye en el proceso de liofilización, donde a menor superficie mayor área de contacto para la sublimación. Se ensayaron muestras sin grasa y con grasa, utilizando los resultados con muestras con grasa, dados los resultados obtenidos. Se utilizó metanol 100% como extractante de los glucósidos cianogénicos, resultando una concentración de amigdalina máxima a partir un tiempo de extracción de 12 horas y como fase móvil acetonitrilo/agua (20:80), se obtiene amigdalina, con una concentración de 9,8 mg/100g de muestra seca. Los cromatogramas obtenidos presentan tiempo de retención (Tr), Amigdalina: 3,4 y Prunasina, 5,7, dos picos con excelente resolución, por lo tanto las condiciones anteriores se pueden utilizar para la identificación y cuantificación de amigdalina y prunasina.
Palabras Clave. Cianógenos, almendras dulces, amigdalina y prunasina.
Abstract
The aim of this study was to apply a technique to identify and quantify separately also cyanogenic compounds that may be present in the mature seed almond (Prunus dulcis). Among the methods selected the chromatography of liquids of high resolution (HPLC), that permit the quantification of the glycosides for the separation process of Freeze Dry where there is less surface there is more contact to sublimation without fat samples, looking at the obtain results and supported by other investigations, the use of 100 % methanol extract as a mobile phase acetonitrile-water (80:20) the results obtained of the glycosides cyanogenics resulting in a concentration of maximum amygdalin from the time of extraction of twelve hours, amygdalin is obtained, with a concentration of 9,8 mg / 100 g of dry sample. The chromatograms obtained a time of retention (Tr), amygdalin 3,4 and prunasin 5,7 two peaks with excellent resolution, to the above conditions can be used for analysis by HPLC, identification and quantification of amygdalin and prunasina.
Key words. Cyanogens, sweet almond, amygdalin and prunasin.
Resumo
Neste trabalho, a técnica é aplicada para determinar e também para quantificar separadamente compostos cianogénicos que podem estar presentes na semente madura amêndoa (Prunus dulcis). Métodos encontrados é seleccionado de cromatografia líquida de alta eficiência (HPLC), que permite a quantificação dos glicosídeos separar adaptar diferentes técnicas de extracção, tais como o tamanho de partícula influencia o processo de liofilização, onde a área de superfície maior menor sublimação contacto com desengradas amostras de gordura e usando os resultados com amostras desengorduradas, Tendo em vista os resultados obtidos, e suportados por outras pesquisas metanol a 100 % foi usado como o agente de extracção e como fase móvel acetonitrilo/água (80:20) de glicósidos cianogénicos, resultando numa concentração elevada de amigdalina a partir de um tempo de extracção de 12 horas. Amigdalina é obtido, com uma concentração de 9,8 mg / 100 g de amostra seca. Os cromatogramas apresentados tempo de retenção (Tr), Amygdalin: 3,4 e prunasina 5,7 dois picos com excelente resolução, com as condições acima podem ser utilizados para a análise por HPLC. identificação e quantificação de amigdalina e prunasina.
Palavras-chave. Cyanogens, amêndoa doce, amigdalina e prunasina.
Introducción
Los glucósidos cianogénicos son el producto del metabolismo secundario en la síntesis de compuestos propios de las plantas que se componen de una aglicona tipo α-hidroxinitrilo y de un azúcar, principalmente D-glucosa (1). La distribución de los glucósidos cianogénicos (GC) en el reino vegetal es relativamente grande, el número es por lo menos 2500 cultivares, donde una gran cantidad pertenecen a las familias Fabaceae, Rosaceae, Linaceae, Compositae y otros. Los glucósidos cianogénicos son un grupo conocido y se presentan en las especies del género Prunus, es decir, almendros, damascos, durazneros, nectarinos, cerezos, entre otros (2, 3). La característica de producir ácido cianhídrico por la hidrólisis de los compuestos cianogénicos de algunos vegetales entre ellos los citados anteriormente, depende tanto de la biosíntesis de los glucósidos cianogénicos y de la existencia (o ausencia) de sus enzimas de degradación (2, 3). Los glucósidos cianogénicos contienen un monosacárido o un disacárido y un hidroxinitrilo aromático. Esto último es el caso de la amigdalina. Tal como ocurre en otras síntesis de compuestos como los glucosinolatos, inicialmente se forma una aldoxima a partir de un aminoácido que a continuación es transformada en un nitrilo, seguido de un hidroxinitrilo. Finalmente, se obtiene el glucósido cianogénico mediante diferentes etapas, muchas de ellas aún desconocidas (3, 4). A partir de los compuestos cianogénicos, la generación de ácido cianhídrico es un proceso de dos etapas que implica una deglicosilación y una división de la molécula (regulada por β-glucosidasa y α-hidroxinitrilasa). Teniendo en cuenta que la compartimentación a nivel de los tejidos de los glucósidos cianogénicos y sus enzimas impide a gran escala la hidrólisis en el tejido vegetal intacto, donde cultivares del genero Prunus, tienen la capacidad de acumular amigdalina, cianógeno que está relacionado con el amargor y producción de ácido cianhídrico (5-11). El compuesto inicialmente puede ser prunasina o amigdalina, pero una vez el tejido que contiene este es degradado, empieza la acción de enzimas propias como es las β-glucosidasas con la liberación de glucosa, benzaldehído y ácido cianhídrico (2-12). Este sistema de dos componentes, cada uno de ellos químicamente inerte, le proporciona a la planta una defensa química contra los herbívoros, insectos y patógenos, garantizando posiblemente la supervivencia de la especie o también sirve como reservas de energía (13). Para el caso de los almendros pueden presentarse almendras dulces, ligeramente amargas y almendras amargas (4) (28).
La cianogénesis está muy extendida en las plantas, pero relativamente pocos compuestos cianogénicos se han aislado y caracterizado (14). Dos plantas tropicales, ampliamente cultivadas, maracuyá, Passiflora edulis Sims (Passifloraceae) y papaya, Carica papaya L. (Caricaceae), han sido previamente examinadas en búsqueda de compuestos cianogénicos, pero siguen existiendo dudas sobre la presencia e identidad de estos compuestos. En la Yuca (Manihot esculenta), se ha identificado por el método del picrato el cianógeno (27).
Algunos compuestos cianogénicos son aparentemente derivados o tienen como precursores los aminoácidos, valina y la isoleucina, el caso de los miembros de la Passifloraceae (15), además parecen ser derivados a partir de fenilalanina (16-17). Otras familias generan compuestos cianogénicos, taxipilina y prunasina, Lauraceae y Sapindaceae, (18), ahora industrialmente muchas frutas tropicales por ejemplo, una especie pasiflora edulis, tiene una importancia económica considerable y se cultiva para aprovechar la fruta fresca y zumo (19). No obstante, las hojas, tallos y frutos inmaduros de esta especie contienen compuestos cianogénicos, a veces en altas concentraciones.
Para el análisis y determinación de compuestos cianogénicos en vegetales, existen algunas técnicas instrumentales como la cromatografía líquida de alta resolución (HPLC). Sin embargo, en este análisis, las interferencias debidas a los compuestos en la matriz, tales como los pigmentos, flavonoides, taninos y otros compuestos, hacen que a estas técnicas deban adaptarse metodologías verificables y reproducibles, además de purificación de las muestras a analizar (2). Encontrar técnicas que sirvan para identificar estos compuestos es de gran importancia para la industria alimentaria como el caso de almendras (amargor), y genéticamente, por que actúan como mecanismo de defensa ante insectos y como fuente de energía (2).
El objetivo de esta investigación fue implementar y desarrollar la técnica analítica de determinación y cuantificación de glucósidos cianogénicos (amigdalina y prunasina) en el fruto de la almendra (Prunus dulcis), mediante cromatografía líquida de alta resolución (HPLC).
Materiales y métodos
Toma, acondicionamiento y conservación de la muestra.
Las almendras analizadas proceden de árboles cultivados en la finca experimental "Tres Caminos" del CEBAS-CSIC en Murcia, España. Se recolectaron del árbol en plena maduración cuando el mesocarpo se encontraba completamente abierto. Cada muestra está constituida por 100 unidades de almendras que se tomaron aleatoriamente. Las almendras fueron desprovistas del mesocarpo e introducidas en bolsas de malla, debidamente etiquetadas. Posteriormente, las muestras se llevaron al laboratorio del Departamento de Química Analítica de la Universidad de Alicante para su análisis. Una vez en el laboratorio, las almendras se descascararon manualmente con un martillo, teniendo especial cuidado de no dañar la semilla, y se prepararon para su conservación, sin eliminación del tegumento, pues ayuda en su conservación. Se estudió el efecto de la preparación de la muestra sobre la determinación analítica: eliminación o no de la grasa de la almendra, tamaño de partículas en la muestra, troceado antes o después de la liofilización, teniendo en cuenta que pueda o no influir en los resultados cromatograficos.
En el presente trabajo las muestras se conservaron liofilizadas, con el fin de garantizar que las características fisicoquímicas y organolépticas no se alteraran de forma significativa. Las muestras previamente colocadas en unos viales de vidrio se introdujeron en un liofilizador Telstar 2000, a una presión de 4x10-2 mbar y una temperatura entre -79 ºC y -82 ºC.
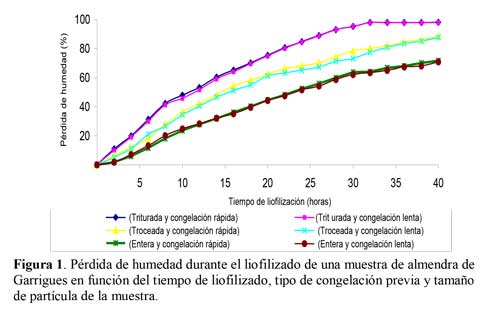
Con objeto de mejorar las condiciones de liofilización se controlaron diferentes parámetros: tamaño de partícula de la muestra, tipo de congelación previa, tiempo de liofilización. Respecto al tamaño de partícula se ensayaron tres tratamientos, muestras finamente trituradas (con un tamaño de grano menor a 1 mm), almendras partidas o troceadas en trozos irregulares de diferentes tamaños inferiores a 5 mm y almendras enteras. La trituración de las muestras se realizó en un molino Marca IKA® A 11 BASIC, con una velocidad de giro de 3500 r.p.m. El tiempo de trituración fue inferior a 30 segundos, con el fin de no calentar la muestra y evitar el apelmazamiento que podría producir el alto contenido de aceite de almendras. Para que la muestra se calentara lo mínimo durante la trituración, las almendras se mantuvieron refrigeradas con anterioridad. Respecto al tipo de congelación previa a la liofilización se utilizaron dos procedimientos: Congelación lenta, en un congelador a -18 ºC/ 24 horas, congelación rápida, con nitrógeno líquido a -178 ºC/ 30 segundos. En cuanto al tiempo de liofilización, se ensayaron diferentes tiempos de liofilización entre 2 y 40 horas, utilizando muestras trituradas, troceadas y enteras, y con congelación rápida y lenta (Figura 1).
Preparación de la muestra para su análisis.
Se tomaron 10 muestras de 100 mg cada una. Para la extracción de grasa de las almendras, se utilizó un Equipo Soxhlet Selecta FS-6 digital de 6 (seis) lugares, algodón, cartuchos de extracción de celulosa (Whatman) de 26 mm de diámetro x 60 mm de alto y éter de petróleo grado HPLC. Las muestras estuvieron en reflujo durante 30 minutos, para después, utilizando un rota evaporador se recuperaba el aceite de la almendra y el éter utilizado por aparte (26).
Extracción de los glucósidos cianogénicos.
Se realizó el proceso de extracción de glucósidos cianogénicos de la semilla de almendra, estudiando los efectos de diferentes sistemas extractantes como son: agua, metanol 100%, metanol: agua (80:20). Metanol: agua (50:50), acetonitrilo: agua (20:80) y extracción Soxhlet con metanol 100%, hasta 24 horas, por triplicado. La extracción de los glucósidos cianogénicos se realiza con la muestra S3088, de sabor ligeramente amargo, que tiene un contenido de 9,8 mg de cianuro/100g de muestra seca. (Ensayos previos). La extracción de compuestos cianogénicos se realizó a una temperatura de 30 ºC, en un baño con agitación (Memmert®) entre 30 minutos y 20 horas, excepto en el caso de la extracción con Soxhlet que se llevó a cabo a 80 ºC durante 2 horas. La extracción con agua se efectúa de la siguiente manera: a la muestra se le añaden 10 mL de agua a 40°C y se deja en un baño con agitación a 30ºC, con los extractos obtenidos se analizan de forma más detallada los sistemas extractantes metanol 100% y metanol:agua (80:20), para evaluar también la influencia del tiempo de extracción para ambos casos. Las experiencias realizadas consistieron en someter a extracción con ambos disolventes, 5 mg de una misma muestra durante tiempos diferentes, (2, 8, 16 y 24/ h), con objeto de determinar el tiempo de extracción, para determinar la concentración del cianógeno utilizando HPLC. Así mismo, se ha aprovechado la misma experiencia para comprobar la estabilidad en el tiempo de los extractos obtenidos con el sistema extractante, mantenidos a 4 ºC. Todo lo anterior con el fin de garantizar la mejor extracción de los compuestos cianogénicos presentes, lo cual se comprueba mediante la determinación y cuantificación de los compuestos cianogénicos presentes en los extractos obtenidos utilizando HPLC.
Determinación de los glucósidos cianogénicos por HPLC.
Se pesa de forma exacta aproximadamente 0,2 g de almendra si esta es amarga, y 0,4 g si la almendra es dulce o ligeramente amarga. Se introduce en un tubo de centrífuga junto con 5 mL de metanol de grado HPLC, se tapa y se deja durante 12 y 30 horas en baño con agitación a 30ºC. Se centrifuga durante 5 minutos a 3000 rpm, se deja reposar tratando de no mezclar nuevamente el sedimento formado. El sobrenadante se filtra utilizando una jeringa a través de un disco Millipore de Nylon de 0,45µm. Cuando la muestra obtenida es de almendras dulces o ligeramente amargas se inyecta el extracto filtrado directamente, pero en el caso de las amargas dependiendo de la concentración del analito en la muestra se tiene que diluir 1:5, 1:10 o incluso 1:20.
Las condiciones cromatográficas. Se utilizó un cromatógrafo líquido de alta eficiencia marca Waters Modelo 600 controller, entrega de solventes con gradiente cuaternario modelo 600E, Inyector manual Rheodine 7125, Detector de Arreglo de Diodos Waters modelo 996, a 218 nm, columna (Symmetry C18, Waters, 250 x 4.6 mm, 5 mm), además una pre columna C18, software millenium 2008.Otras condiciones cromatograficas son: volumen de inyección 20 µL, Flujo del eluyente 1.3 mL/min, composición del eluyente: Acetonitrilo: agua (20:80) isocrática, tiempo de elución: 10 minutos. El sistema de detección elegido fue el fotométrico, ajustando la longitud de onda de absorción a 218 nm, longitud de onda que se encuentra cerca del máximo de absorción del compuesto analizado, con la ventaja de presentar menor absorción del eluyente. Respecto a la determinación cuantitativa, se prepararon patrones de amigdalina en el intervalo de concentración adecuado, obteniendo dos curvas de calibración. Una de ellas con concentración de amigdalina entre 1x10-6 y 2x10-4 M, se empleó para determinar la amigdalina en muestras dulces y ligeramente amargas. La otra, con valores de amigdalina entre 1,2x10-4 y 1,3x10-3 M, se utilizó para la determinación de amigdalina en muestras amargas. Además, se realizó una curva de calibrado similar para la prunasina con concentraciones entre 1,5x10-6 y 2,1x10-5 M. Las curvas de calibración se han obtenido a partir de patrones de amigdalina y prunasina (Sigma®), disueltos en metanol. Se aplicó el método de calibración con patrones externos para la determinación cuantitativa y un detector "diode array" para la evaluación de la pureza de los picos cromatográficos teniendo la recta de calibrado de ecuación y=bx+a, el LOD se calculó:
Limite detección, XLOD= 3Sa/b
Sa la desviación estándar de la ordenada y b la pendiente. Para el límite de cuantificación:
XLOQ = 10Sa/b.
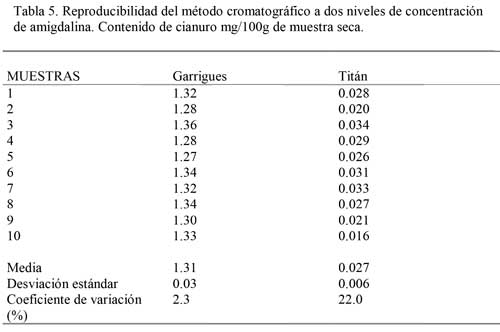
La reproducibilidad del método cromatográfico se estudió a dos niveles de concentración de cianuro (equivalente a amigdalina) utilizando 10 diez muestras de la variedad Garrigues (ligeramente amarga) con 1,31 mg de cianuro/ 100g de muestra seca, y de la variedad Titán (dulce), con 0,03 mg de cianuro/ 100g de muestra seca (Tabla 5) (4). La reproducibilidad del método puede estimarse sobre la base de resultados obtenidos. Se utilizó la norma cubana de especificación técnica NC-TS 367:20003, basada en el procedimiento No. 5 del Comité Nórdico de Análisis de Alimentos (NMKL) (24).
Resultados y discusión
Con el fin de conservar las propiedades fisicoquímicas y organolépticas, las muestras se liofilizaron, para lo cual se tuvo en cuenta el tamaño de partículas. En la Figura 1 se observa cómo el tamaño de partícula de la muestra influye en la extracción final de agua durante el proceso de liofilización, obteniéndose el mayor rendimiento en las muestras trituradas. Con la muestras de almendras trituradas y congelación rápida, se obtuvo una pérdida del 88% de humedad en 32 horas y finalmente con las almendras enteras y congelación rápida, 62% de pérdida de humedad. Dada la mayor rapidez y seguridad de la congelación con nitrógeno líquido, se utilizó con el fin de evitar que las muestras ya congeladas aumenten su temperatura al introducirlas en el liofilizador. Hay que indicar que el procedimiento de liofilización que se acaba de exponer, con muestra triturada y congelada de forma rápida, es aplicable solamente en el caso de que se trabaje con almendra madura, ya que en otro estado de madurez el porcentaje de agua es muy alto.
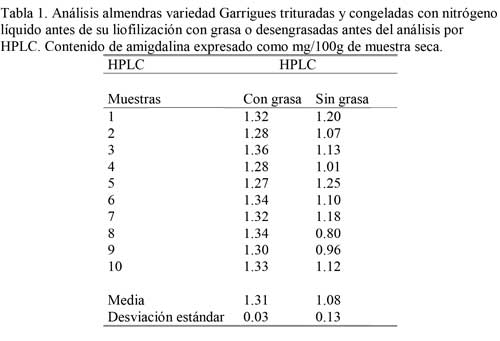
En el análisis mediante HPLC, el aceite o grasa como componentes de las muestras, pueden interferir teóricamente en los resultados, afectando la resolución de los cromatogramas, presentándose picos irregulares, por lo cual previamente se realizaron ensayos de muestras con grasa y muestras sin grasa. Los promedios de los resultados obtenidos con muestra desengrasada se refieren a muestra entera, es decir, teniendo en cuenta el porcentaje de grasa extraído previamente (50%). De los resultados presentados en la Tabla 1, se observa que existen valores diferentes para el contenido de amigdalina así: 1,31 para muestras con grasa y desengrasada 1,08 mg/ 100g muestra seca, siendo los resultados obtenidos con muestras desengrasada alrededor de un 17% más bajos y mucho menos precisos.
De estos resultados se deduce que se debe producir una pérdida de amigdalina en el desengrasado. Por otro lado, tampoco se consigue una mejora sustancial del cromatograma en el caso de que se lleve a cabo el desengrasado a una muestra con contenido bajo en amigdalina, por lo que en este trabajo se optó por analizar las muestras sin desengrasar previamente (2).
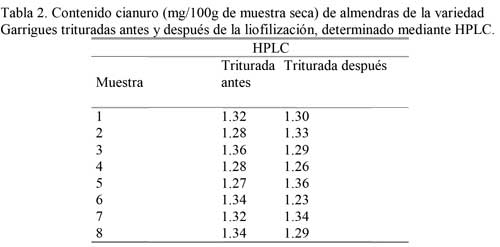
En cuanto a la trituración o no de la muestra, el tamaño de partícula afecta de modo significativo al rendimiento y al tiempo de liofilización. Además, ensayos preliminares cualitativos mostraron que con la muestra triturada, se obtienen mejores resultados analíticos, resolución de cromatogramas y una mejor extracción de los glucósidos cianogénicos en metanol para su posterior determinación por cromatografía, así como también una mejor hidrólisis de amigdalina. Los resultados sobre el posible efecto de la trituración de las almendras antes de la liofilización, sobre la determinación de los glucósidos cianogénicos por HPLC se presentan en la Tabla 2. Teniendo en cuenta que la almendra tiene un alto grado de contenido graso, si no se conserva adecuadamente tiende a oxidarse, es así como hay dos tipos de enranciamiento, uno oxidativo, en cuyo caso se forman aldehídos o cetonas por la adición de oxígeno molecular y otro hidrolítico, mediante el cual se forman ácidos grasos libres por la hidrólisis que presentan los glicéridos. Estas características se conservan mediante la liofilización, que es un procedimiento ampliamente utilizado para la conservación de muestras. Los promedios obtenidos indican que las concentraciones de amigdalina y cianuro obtenidas, fueron semejantes con independencia de haber triturado la muestra antes o después de la liofilización.
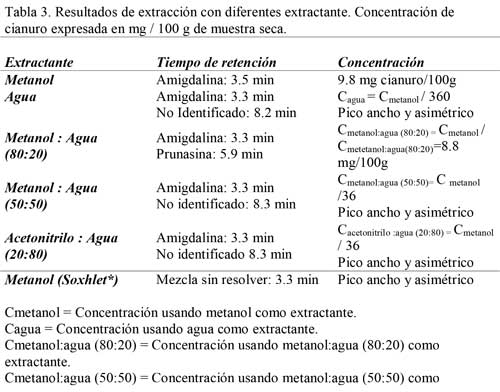
Determinación de glucósidos cianogénicos por HPLC. Los extractos obtenidos después de 12 horas de tratamiento a 30 ºC±2 con los distintos sistemas extractantes utilizados, se analizaron por HPLC, obteniéndose resultados muy variados. Se observó que la extracción con agua no resultó efectiva, ya que proporcionó un rendimiento muy bajo independiente del tiempo de extracción. Así mismo, la extracción con acetonitrilo: agua (20:80) también fue deficiente y la extracción con Soxhlet produjo un pico cromatográfico deforme, lo que parece indicar que coeluyen otros componentes que también se han extraído junto con la amigdalina. Merece especial atención el resultado obtenido con metanol: agua en diferentes proporciones (Tabla 3).
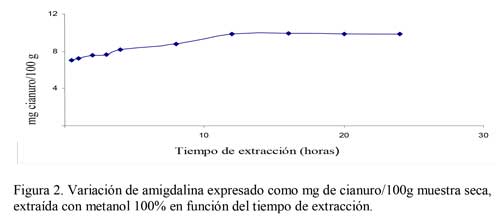
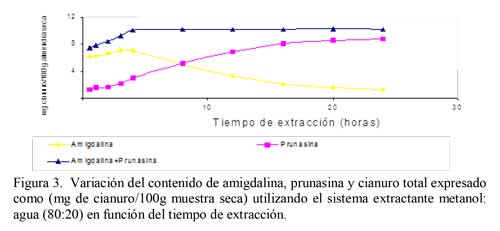
De todos los extractante utilizados, el metanol 100% proporciona un pico cromatográfico a 3,5 minutos que corresponde a amigdalina, con una concentración de 9,8 mg/ 100g de muestra seca, utilizando como eluyente acetonitrilo: agua (20:80). Además aparece un pico a 5,9 minutos que se corresponde al tiempo de retención de la prunasina, con una concentración de 8,8 mg/ 100g muestra seca. Este es el mejor y resultado obtenido, teniendo en cuenta las características de los patrones utilizados, en lo que son características de los picos y los tiempos de retención. Si la mezcla es metanol:agua (50:50), el pico correspondiente a amigdalina ha disminuido en 36 veces su concentración, no aparece ningún pico al tiempo de retención de la prunasina y sin embargo aparece un pico ensanchado y deforme a un tiempo de retención de 8,3 minutos. Todo ello indica que la presencia de agua en el extractante hace que la amigdalina extraída vaya degradándose paulatinamente a prunasina, y si la proporción de agua es suficientemente alta, la degradación continúa probablemente hasta cianhídrina o incluso benzaldehído. La suma de amigdalina y prunasina extraída con metanol:agua (80:20) coincide prácticamente con la concentración de amigdalina extraída con metanol 100% durante 16 horas de extracción (Figuras 2, 3) según (10). Por otra parte, extrayendo con metanol 100% en muestras de almendras amargas procedentes de los primeros meses de su desarrollo, se ha comprobado que se extrae amigdalina y prunasina, por lo tanto el metanol 100% es capaz de extraer ambos glucósidos si estos están presentes en la muestra (2). En la Tabla 3 se relacionan los resultados obtenidos mediante los diferentes extractante utilizados. Por ello, se puede afirmar que en almendra madura el único glucósido cianogénico es la amigdalina, en contra de lo publicado por (20), que encontró prunasina.
Probablemente, este resultado fue consecuencia de la degradación de la amigdalina a prunasina, debido al sistema de extracción utilizado en dicho trabajo (2). A la vista de los resultados obtenidos, lo mejor es utilizar metanol 100% como extractante de los glucósidos cianogénicos. Se observa que el extractante metanol puro proporcionó una concentración de amigdalina máxima a partir de un tiempo de extracción de 12 horas (Figura 2). Con la mezcla metanol:agua (80:20) se obtuvo un rendimiento máximo de extracción a tan solo 4 horas, si se considera la suma de amigdalina y prunasina (Figura 3). Por lo tanto, esta también podría ser una alternativa válida, pero con el inconveniente de que existe una transformación de amigdalina en prunasina, y por lo tanto solo sería aplicable si lo que interesa es el contenido total de cianuro, pero nunca para cuantificar amigdalina y prunasina por separado. Actualmente se vienen realizando análisis para otros compuestos cianogénicos para la determinación cualitativa y cuantitativa, por ejemplo la linamarina (21).
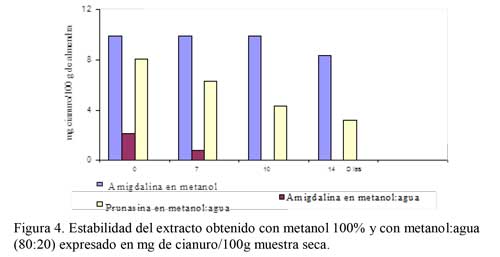
Igualmente, se presta especial atención a la determinación en matrices complejas, por ejemplo, en productos alimenticios procesados de Manihot esculenta Cranz. En papaya (Carica papaya), fruta tropical de mucho consumo en fresco, (22) determinó compuestos cianogénicos en concentraciones de 300-500 mg/ 100g. muestra seca y glucosinolatos. Los resultados sobre la estabilidad del extracto obtenido con metanol 100% se presentan en la Figura 4. Se observa que el extracto obtenido en metanol puro es más estable, manteniéndose durante 10 días a 4 ºC, mientras que el obtenido en la mezcla metanol:agua (80:20) se va degradando, prosiguiendo la transformación de amigdalina en prunasina e incluso llegando con el tiempo a la hidrólisis de la prunasina (11). Por todo lo anteriormente expuesto, se optó por trabajar con metanol 100% como agente extractante, dejando en contacto la muestra triturada, congelada con nitrógeno líquido, liofilizada y sin desengrasar durante 16 horas con agitación y a una temperatura de 30ºC±2, con objeto de asegurar que el rendimiento de la extracción fuera elevado y reproducible. El extracto obtenido en estas condiciones es estable durante 14 días mantenido a 4 ºC. En cuanto al rendimiento de la extracción, en la Tabla 4 puede observarse que la primera extracción proporcionó un porcentaje elevado y reproducible de extracción. Por ello, se optó por trabajar con el primer extracto, considerando una recuperación del 91,2 % en el proceso de extracción.
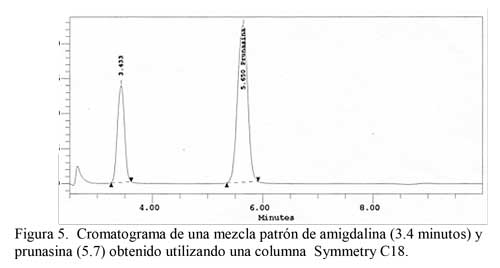
Condiciones cromatográficas. La columna Symmetry C18 utilizada en este estudio proporcionó resultados satisfactorios tanto para los patrones como para las muestras reales, aportando resultados de mayor calidad sobre todo para muestras con concentraciones altas de glucósidos cianogénicos y reproducibilidad. Para muestras dulces, con concentración de amigdalina cercana al límite de detección, se observa la aparición de interferencias debido a sustancias extraídas que eluyen a tiempos de retención cercanos. Con la columna Symmetry C18, el eluyente más adecuado fue el acetonitrilo:agua (20:80) que proporciona tiempos de retención de 3,4 minutos para amigdalina y 5,7 minutos para prunasina.
Para el análisis de almendras maduras, donde sólo hay amigdalina, la columna utilizada es la Symmetry C18, con la que se consigue determinar la amigdalina en un tiempo más corto. Además, proporciona una buena separación de los dos glucósidos (amigdalina y prunasina) presentes en la almendra durante su desarrollo, en menos de 10 minutos, trabajando a una velocidad de flujo de 1,3 mL/min. Además, permite que ambos componentes eluyan puros, separados de otros componentes del extracto metanólico, pureza que ha sido contrastada mediante la utilización de un detector fotométrico "diode array". Tan solo cuando la concentración de amigdalina está cercana al límite de detección, debido a la escala de trabajo, en el cromatograma se observa una impureza junto al pico correspondiente a amigdalina, que hace que haya que ajustar la integración según los parámetros de pureza de pico del detector "diode array". En la Figura 5 se muestra un cromatograma tipo obtenido a partir de una mezcla patrón de amigdalina y prunasina. Como se observa el tiempo de retención para la amigdalina y prunasina es de 3,4 y 5,7, respectivamente.
Determinación cuantitativa. Las rectas de calibrado obtenidas son las siguientes:
Muestras dulces y ligeramente amargas (amigdalina) Y= ax + b
Y = 8.050 x 109 + 5.513.104 [Ec. 1]
Muestras amargas (amigdalina): Y = 6.573 x 109 + 5.125.104 [Ec. 2]
Amargas y ligeramente (prunasina) Y = 8.751 x 109 + 2.593.104 [Ec. 3]
A partir de estas rectas de calibrado se calculó el límite de detección para amigdalina y prunasina:
Límite de detección de la amigdalina: 0,387 mg / 100g de muestra seca, cuando se trabaja con 0,4 g de muestra y se utiliza un volumen de extracción de 5 ml de metanol.
Límite de detección de la prunasina: 0,136 mg / 100g muestra seca, con las mismas condiciones de extracción que para amigdalina.
De acuerdo con las definiciones de la ISO y la IUPAC, el Límite de Detección (LDD) es un parámetro del método analítico definido a priori, porque se fija antes de que se realice la medida. El LDD es esencialmente diferente a la decisión sobre si se detecta un analito o no, puesto que dicha decisión se toma una vez se conoce el resultado de la medida. En otras palabras: a posteriori (25). La Tabla 5 presenta la reproducibilidad del método a los dos niveles de concentración estudiados, tomando 10 muestras (1 mg) y analizándolas inmediatamente. Se observa que el coeficiente de variación toma valores de 2,3% para la variedad Garrigues, y de 22% para la Titán.
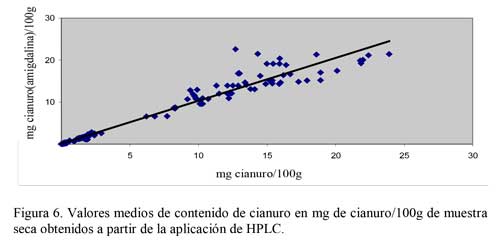
Desde el punto de vista práctico, el método de HPLC utilizado es más sencillo en cuanto a la preparación previa de la muestra, y requiere menor destreza y tiempo de análisis (sobre todo si se dispone de un inyector automático). Además, presenta la ventaja adicional de permitir la identificación y cuantificación de los compuestos cianogénicos (amigdalina o prunasina) presente en la muestra (Figura 6). Berenguer et al (23) ha realizado ensayos para determinación de compuestos cianogénicos utilizando otro tipo de columna diferente a Symmetry C18.
Conclusiones
El acondicionamiento y preparación de las muestras más adecuado para la determinación analítica de los compuestos cianogénicos, se presentó en almendras con tegumento, sin desengrasar, trituradas, congeladas con nitrógeno líquido y liofilizadas durante 32 horas. Para el análisis por HPLC, la extracción de los compuestos cianogénicos de la almendra debe realizarse con metanol 100% durante 16 horas, a 30±2 °C y con agitación. El extracto obtenido con metanol es estable durante 7 días.
Las condiciones cromatograficas seleccionadas han sido: Columna Symmetry C18, eluyente acetonitrilo:agua (20:80), caudal 1.3 mL/min y detector fotométrico a 218 nm. El coeficiente de variación obtenido en cromatografía, como medida de la reproducibilidad del método, fue del 2,3% a niveles de concentración 100 veces por encima del límite de detección y del 22% en niveles de concentración cercanos al límite de detección. El límite de detección para amigdalina es de 0,387 mg/ 100g y para prunasina de 0,136 mg/ 100g. La técnica cromatográfica HPLC permite identificar y cuantificar los glucósidos cianogénicos presentes en la muestra Amigdalina y Prunasina de forma independiente y con excelente resultados. El tiempo de retención para la amigdalina y prunasina es de 3,4 y 5,7, respectivamente.
Referencias Bibliográficas
1.Rimington C. The occurrence of cyanogenic glucoside in South African species of Acacia II. Determination of the chemical constitution of Acaciapetalin and its isolation Acacia stolonifera Burch. Onderstepoort. J. Vet Res. 1935. 5: 445-456 [ Links ]
2. Arrázola, G. Tesis Doctoral. Determinación de compuestos cianogénicos en semillas de almendras (Prunus dulcis L). Incidencia en la mejora genética. Universidad de alicante. 2002. 132 p. [ Links ]
3. János, Vetter. Plant cyanogenic glycosides. Toxicon. 2000. 38: 11-36. [ Links ]
4. Arrázola, G.; Sánchez R.; Dicenta, D.; Grané, N. Content of the cyanogenic glucoside amygdalin in almond seeds related to the bitterness genotype. Agronomía Colombiana 2012. 30(2), 260-265. [ Links ]
5. McCarty, CD.; Leslie, JW.; Frost, HB. Bitterness of kernels of almond x peach hybrids and their parents. Proc. Amer. Soc. Hort. Sci. 1995. 59: 254-258. [ Links ]
6. Conn EE. 1980. Cyanogenic compound Ann. Rev. Plant Physiology. 1980. 31: 433-451. [ Links ]
7. Frehner, M.; Scalet, M.; Conn, EE. Pattern of the Cyanide-Potential in Developing Fruits. Plant. Physiol. 1990. 94: 28-34. [ Links ]
8. Swain, E.; Poulton, JE. Utilization of Amygdalin during Seedling Development of Prunus serotina. Plant Physiology. 1994. 106: 437-445. [ Links ]
9. Poulton JE.; Li, CP. Tissue level compartmentation of (R)-amigdalin and amygdalin hydrolase prevents large-scale cyanogenesis in undamaged Prunus seeds. Plant Physiology 1994. 104: 29-35. [ Links ]
10. Dicenta, F.; Birger, L.; M¸ller, L.; J¸rgensen, K. 2012. Prunasin Hydrolases during Fruit Development in Sweet and Bitter Almonds. Plant Physiology. 2012. 3: 111-119. [ Links ]
11. Raquel Sanchez, R; J¸rgensen, K; Olsen, K; Dicenta, F, Lindberg M¸ller. Bitterness in Almonds. Plant Physiology, 2008. 146: 1040-1052. [ Links ]
12. Morant, A.V.; J¸rgensen, K.; Jørgensen, C.; Paquette, S.M.; Sánchez-Pérez, R.; Møller, B.L.; Bak, S. β-Glucosidases as detonators of plant chemical defense. Phytochemistry, 2000. 69: 1795-1813. [ Links ]
13. Jones DA. Why are so many food plants cyanogenic. Phytochemistry. 1998. 47: 115-162. [ Links ]
14. Lechtenberg, M.; Nahrstedt, A. Cyanogenic glycosides. In: Ikan, R. (Ed.) Naturally Occurring Glycosides. Wiley, Chichester, p. 147-191. 1999. [ Links ]
15. Olafsdottir, E.; Cornett, C.;Jaroszewski, J. Cyclopentenoid cyanohydrin glycosides with unusual sugar residues. Acta Chemica Scandinavica 1989b. 43: 51-55. [ Links ]
16. Spencer, K.; Seigler, D. Cyanogenesis of Passiflora edulis. Journal of Agricultural and Food Chemistry. 1983. 31: 794-796. [ Links ]
17. Chassagne, D.; Crouzet, J.; Bayonove, C.; Baumes, R. Identification and quantification of passion fruit cyanogenic glycosides. Journal of Agricultural and Food Chemistry. 1996. 44: 3817-3820. [ Links ]
18. Miller, R.; Tuck, K. Reports on the distribution of aromatic cyanogenic glycosides in Australian tropical rainforest tree species of the Lauraceae and Sapindaceae. Phytochemistry. 2013. 92: 146-152. [ Links ]
19. Rehm, S.; Espig, G. Die Kulturpflanzen der Tropen und Subtropen. Eugen Ulmer Verlag, Stuttgart. 1976. 6: 112-118. [ Links ]
20. Usai, M.; D'hallewin, G. Cyanogenic glucosides contained in different organs of bitter and sweet almond. Agriculture. Rapport 14081 FR. Amélioration génétique de deux espèces de fruits secs méditerranéens: l'amandier et le pistachier, Proceedings of the VIII GREMPA Meeting, Nîmes (France) 1992. 26-27 June, pp. 233-236. [ Links ]
21. Brimer, L.; Nout, MJR.; Tunçel, G. ß-Glycosidase (amygdalase and linamarase) from Endomyces fibuliger, Appl Microbiol Biotechnol. 1998. 49: 182-188. [ Links ]
22. Williams, D.; Pun, S.; Chaliha, M.; Scheelings, P.; O'Hare, T. An unusual combination in papaya (Carica papaya): The good (glucosinolates) and the bad (cyanogenic glycosides). Journal of Food Composition and Analysis. 2013. 29: 82-86. [ Links ]
23. Berenguer, V.; Giner RM.; Grané, N.; Arrázola, G. Chromatographic determination of cyanoglycosides prunasin and amygdalin in plant extracts using a porous graphitic carbon column. J. Agric Food Chem. 2002. 20: 50(24). 6960-3. [ Links ]
24. Procedimiento No. 5. Versión en español, 2005 del Comité Nórdico de Análisis de Alimentos (NMKL). Estimación y Expresión de la Incertidumbre de la Medición en Análisis Químico. 2003. [ Links ]
25. IUPAC. International Union of Pure and Applied Chemistry. 67. 1699-1723. 1995 [ Links ]
26. Extracciones con Soxhlet. Carlos Eduardo Núñez. cenunez.com.ar. p. 1-5. 2008. Disponible: http://www.cenunez.com.ar/archivos/39-traccinconequiposoxhlet.pdf 2014. [ Links ]
27. Rezaul Haque, M.; Howard Bradbury, J. Total cyanide determination of plants and foods using the picrate and acid hydrolysis methods. Food Chemistry 77 2002. 107-114. [ Links ]
28. Arrázola, G.; Grane, N.; Dicenta, F. Importancia de los glucósidos cianogénicos en el sabor de frutos de almendros (Prunus dulcis Miller) y su incidencia en la agroindustria. Revista Colombiana de Ciencias Hortícolas 2014 - Vol. 8 - No. 1 - pp. 57-66. [ Links ]