Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.42 no.3 Bogotá Sep./Dec. 2013
Estudio experimental y teórico de polígonos supramoleculares de ni, pd y pt, autoensamblados con 4,4'-bipiridina
Estudo experimental e teórico de polígonos supramoleculares de ni, pd y pt, automontados con 4,4'-bipiridina
Experimental and theoretical studies of ni, pd and pt supramolecular polygons, self-assembled with 4,4'-bipyridine
Paulo C. Torres P.1, Félix Moncada 2,3, Álvaro Duarte Ruíz 1.
1Línea de Investigación en Nuevos Materiales, 2Química Cuántica y Computacional.3Programa de Química pctorresp@unal.edu.co
1,2Departamento de Química, Universidad Nacional de Colombia, Sede Bogotá, Carrera 30 No. 45-03, Bogotá, Colombia. aduarter@unal.edu.co.
3Universidad de la Amazonia, Calle 17 No. 3F, Florencia, Colombia. fsmoncadaa@unal.edu.co
Resumen
Los polígonos y poliedros supramoleculares presentan diversas y novedosas aplicaciones como nanoreactores, en química de inclusión, nanosensores moleculares, entre otras. En este trabajo se presenta la síntesis, caracterización y comparación de polígonos supramoleculares autoensamblados entre complejos de tipo [M(dppe)(TOF)2], con centros metálicos de un mismo grupo (M = Ni, Pd y Pt) y la molécula orgánica 4,4'-bipiridina. Los análisis realizados por Uv-vis, FT-IR, Raman, 1H-, 31P-, 1H COSY- y 19F- RMN, demostraron que el complejo que contiene níquel formó únicamente un cuadrado, mientras que los complejos que contienen paladio y platino presentaron un equilibrio triángulo-cuadrado. Además se realizaron cálculos PM6 para los complejos supramoleculares, considerando sistemas catíonicos y neutros, tanto en fase gaseosa como en disolución. Los resultados muestran que para los tres metales, sin importar el medio, se ve favorecida energéticamente la formación de cuadrados en comparación con la formación de triángulos. Además, se observa que los centros de Ni favorecen más la formación de cuadrados, mientras que los centros de Pd la favorecen menos. Las tendencias teóricas se encuentran en concordancia con los resultados experimentales.
Palabras clave: polígono supramolecular, estudios semiempíricos PM6, autoensamblaje, complejos de Ni, Pd y Pt.
Resumo
Os poligonos e poliedros supramoleculares apresentam diversas e novas aplicacoes como nanoreatores, em quimica de inclusao, nanosensores moleculares, entre outras. Neste trabalho apresenta-se a sintese, caracterizacao e comparacao de polígonos supramoleculares automontados entre complexos de tipo [M(dppe)(TOF)2], com centros metalicos de um mesmo grupo (M = Ni, Pd y Pt) e a molecula organica 4,4'-bipiridina. Os analises realizados por Uv-vis, FT-IR, Raman, 1H-, 31P-, 1H COSY- y 19F- RMN, demonstraram que o complexo que contem niquel formou unicamente um quadrado, enquanto que os complexos que contem paladio e platino apresentaram um equilibrio triangulo-quadrado. Adicionalmente, realizaram-se calculos PM6 para os complexos supramoleculares, considerando sistemas cationicos e neutros, tanto em fase gasosa como em dissolucao. Os resultados mostram que para os tres metais, sem importar o meio, vesse favorecida energeticamente a formacao de quadrados em comparacao com a formacao de triangulos. Finalmente, foi observado que os centros de Ni favorecem mais a formacao de quadrados, enquanto que os centros de Pd sao menos favorecidos. As tendencias teoricas mostraram concordancia com os resultados experimentais.
Palavras-chave: supramolecular poligono, PM6 estudos semi-empiricos, auto-montagem, complexos de Ni, Pd e Pt.
Abstract
Supramolecular polygons and polyhedral have many novel applications such as nanoreactors, molecular nanosensors, Host-guest chemistry, among others. In this work is presented the synthesis, characterization and comparison of supramolecular polygons selfassembled between complexes of type [M(dppe)(TOF)2], which have metal centers in the same group (M = Ni, Pd and Pt) and the organic molecule 4,4'-bipyridine. Analyses by UV -Vis, FT-IR, Raman, 1H-, 31P -, 1H COSY- and 19F- NMR, showed that the nickel-containing complex only formed a square, while the palladium- and platinum-containing complexes formed a triangle-square equilibrium.
In addition, PM6 calculations for the supramolecular complexes, considering cationic and neutral systems in the gas phase and in solution, were performed. These results reveal that for the three metals, regardless of the environment, the formation of squares is energetically favored over the formation of triangles. Furthermore, it is observed that the Ni centers favor more the formation of squares, whereas the Pt centers favor it less. These theoretical trends are in good agreement with the experimental results.
Keywords: supramolecular polygon, PM6 semiempirical studies, self-assembly Ni, Pd and Pt complexes.
Introducción
La construcción de arreglos moleculares, basada en el reconocimiento entre unidades moleculares complementarias, ha permitido obtener una amplia variedad de polígonos y poliedros supramoleculares. En la síntesis de estas estructuras, los metales de transición más utilizados han sido el Paladio (II) y el Platino (II) (1-2). Sin embargo, se han encontrado reportes en los cuales se han empleado otros metales tales como: Cromo (3), Plata (4), Molibdeno (5) y Rodio (6), entre otros. De igual manera, a la fecha únicamente se han encontrado reportes de dos cuadrados supramoleculares (7-8) y de dos cubos (9-10), sintetizados a partir de complejos de Níquel (II) con diferentes ligantes conectores. La construcción de cuadrados moleculares a partir de centros metálicos de Pd (II) y Pt (II), los cuales han sido desarrollados principalmente por Fujita y Stang (1, 2, 12), ha despertado el interés científico por las amplias propiedades y aplicaciones químicas encontradascomo nanoreactores, sensores moleculares, química de inclusión, síntesis de nano partículas, nano catálisis y reconocimiento molecular (13-14). Por consiguiente, en el futuro se planean realizar estudios electroquímicos a los poligonos obtenidos, con el fin de ampliar la información acerca de posibles aplicaciones que puedan tener estas estructuras.
Algunas consideraciones importantes a tener en cuenta que permiten direccionar el proceso de auto-ensamblaje de estos polígonos supramoleculares son: los enlaces débiles, la favorabilidad entálpica, la viabilidad termodinámica, la concentración, el solvente, la labilidad del enlace metal-nitrógeno, el ángulo y la fuerza del ligando quelante, la naturaleza del ión metálico, la temperatura, la cinética del proceso, y el ángulo de apertura (15). Con base en estas variables, en muchos ensamblajes metalo-supramoleculares se presentan equilibrios entre dos o más especies, debido a que no hay una clara preferencia por una de ellas desde un punto de vista termodinámico. Algunos de los autores que han estudiado estos equilibrios son Ferrer (15), Würthner (16) y Cotton (17), quienes han reportado la formación de especies altamente simétricas en equilibrio (triángulo-cuadrado).
El interés principal de esta investigación es contribuir al desarrollo y comprensión de la química supramolecular y las arquitecturas moleculares, construidas mediante el autoensamblaje de complejos metálicos de un mismo grupo; desarrollando por primera vez algunos polígonos supramoleculares (cuadrados y triángulos), a partir de diferentes complejos de coordinación del tipo: [M(dppe)(TOF)2] (M: Ni [2], Pd [3] y Pt [4], (TOF: trifluorometanosulfonato, dppe: difenilfosfino etano)) junto con el ligante orgánico lineal 4,4'-bipiridina[1] (18-19), los cuales actúan como vértices y aristas, en la formación (autoensamblaje) de estas especies supramoleculares. De igual manera, debido al carácter de buen grupo saliente que posee el ion trifluorometanosulfonato (triflato), y gracias a su baja nucleofílicidad y gran tamaño, actúa como contraión estabilizando estas arquitecturas supramoleculares.
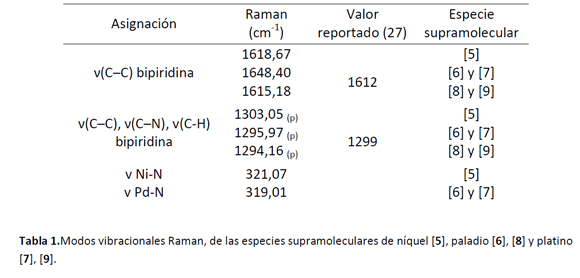
Las especies macrocíclicas supramoleculares obtenidas, fueron caracterizadas por diferentes técnicas espectroscópicas (Uv-vis, FT-IR, Raman, 1H-, 31P-, 19F- y COSY-RMN); cabe resaltar que los análisis realizados mediante espectroscopía Raman y los cálculos teóricos semi-empíricos PM6, se constituyen en los primeros estudios realizados a polígonos supramoleculares que poseen centros metálicos de un mismo grupo: níquel [5], paladio [6], [7] y platino [8], [9], autoensamblados con 4,4'-bipiridina [1].
Finalmente, según los análisis realizados se pudo determinar que las especies supramoleculares obtenidas para el caso de los complejos del Pd, un equilibrio con una relación de formación del 72 % para el cuadrado y 28 % triángulo, mientras para las especies de platino la formación corresponde a un 74 % triángulo y a un 26 % de cuadrado. Finalmente en el autoensamblaje del complejo de níquel, se obtuvo un 100 % de especie cuadrada. De igual manera, los cálculos teóricos soportan cual es la especie predominante para cada metal.
Materiales y métodos
Sección Experimental
Equipos: Raman: Los espectros Raman, fueron tomados en el equipo Raman Spectroscope Thermo Scientific DXR 780 nm Laser.
Espectroscopia RMN: 1H, 31P y COSY, fueron tomados en el equipo Bruker avance ultrashield (400 y 162 MHz).
Modelamiento molecular: Los cálculos semiempíricos PM6 fueron realizados con el programa MOPAC2012, con el fin de estudiar la estructura y estabilidad relativa de los complejos [5-9]. Por tal razón se optimizó la geometría de las especies catíonicas [M(dppe)(4,4'-bipy)]36+ y [M(dppe)(4,4'-bipy)]48+ y neutras [M(dppe)(4,4'-bipy)]4(TOF)8] y [M(dppe)(4,4'-bipy)]3(TOF)6]. En estos cálculos se impuso el grupo de simetría C4 para los complejos cuadrados y el grupo C3 para los triangulares. La convergencia en la geometría se alcanzó cuando la norma del gradiente era menor a 0.1 Kcal/mol. Además, se realizaron cálculos de punto sencillo COSMO/PM6, usando las geometrías optimizadas para determinar la entalpía de solvatación en los compuestos neutros.
Síntesis: Todas las síntesis fueron realizadas utilizando reactivos sin ningún tipo de tratamiento previo, grado analítico. En cuanto a la caracterización de los complejos [M(dppe)(TOF)2] (M: Ni [2], Pd [3] y Pt [4] y TOF: trifluorometanosulfonato, dppe: difenilfosfino etano), fueron llevadas a cabo según reportes previos.
Resultados
La síntesis del complejo [2] se realizó según lo reportado por Torres et al (20) y por Fallis et al (21). La síntesis del complejo [3] se realizó según reportes publicados por Posada (19) y Fallis (21). De igual manera, el complejo [4] fue obtenido con base en reportes de Fallis (21). El autoensamblaje de las especies supramoleculares se realizó según procedimientos similares reportados por Stang et al (22). Todos los autoensamblajes fueron realizados utilizando como solvente cloroformo [cuadrado 5] y diclorometano [especies 6-10], mezclando el complejo [M(dppe)(TOF)2](M: Ni [2], Pd [3], Pt [4].) y 4,4'-bipiridina [1], en cantidades estequiométricas 1:1 (22) (figura 1).
Cuadrado Supramolecular [5]: A 1,98*10-4 moles (150 mg) del complejo [2] disueltos en 100 ml de CHCl3, fueron adicionadas 1,98*10-4 moles (31 mg) de 4,4'-bipiridina [1], disueltos en 50 ml de CHCl3. La reacción se realizó en un balón de tres bocas bajo atmosfera de nitrógeno, con agitación magnética permanente y a temperatura ambiente por 3 semanas. Inicialmente, la solución del complejo [2], presentó un color amarillo intenso, el cual no varió al agregar la solución de 4,4'-bipiridina [1], por lo cual se protegió de la luz y se dejó reaccionar. Al transcurrir dos semanas de reacción, la solución presentó un color amarillo ocre bastante oscuro, esta solución no varió, fue estable al dejar la mezcla reaccionar por una semana más. Por consiguiente, se detuvo la reacción y se retiró el exceso de solvente en el rotavapor a 35 ºC y 350 mbar, obteniéndose un polvo color verde oscuro, al cual fue necesario realizarle lavados sucesivos con éter, para retirar la 4,4'-bipiridina sin reaccionar. Finalmente fue secado en alto vacío por 4h, obteniéndose un rendimiento del 76 %. Uv-vis (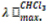 : nm): 277,00 (TC L-M), 288,00 (TC L-M), 310,00 (π π*), 335,00 (π π*). FT-IR cercano (
: nm): 277,00 (TC L-M), 288,00 (TC L-M), 310,00 (π π*), 335,00 (π π*). FT-IR cercano (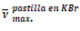 : cm-1): 3058,98 (ν CH), 1835,03 (ν CC), 2924,99 (ν CH2), 2850.99 (ν CH2), 1606,17 (ν CN), 1437,02 (ν CN), 810,82 (ν CN), 1258,33 (ν SO), 1150,08 (ν SO), 1100,12 (ν CF), 1029,20 (ν CF), 636,38 (ν SO). Raman (cm-1): 1618,67 (ν C-C bipiridina), 1303,05 (ν C-C), (ν C-N), (v C-H), 321,07 (v Ni-N). RMN 1H (400 MHz, acetona d6, δ): 8,60 (d, 16 H, J= 6,03 Hz), 7,10 - 7,70 (m, 96 H, C6H5), 3,99 (d, J= 4,80 Hz, 16 H, -CH2-CH2-). RMN 31P (acetona d6, 162 MHz, H3PO4 85%, δ): 30,57 (s, P-dppe). RMN 19F (acetona d6, 282 MHz, (C2HF3O2), δ): -78,87 (s, -SO3CF3). COSY 1H-1H: Especie cuadrada (d: 8,60 α 4,4'-bipridina con d: 7,70 protones grupo fenilo dppe.) (18).
: cm-1): 3058,98 (ν CH), 1835,03 (ν CC), 2924,99 (ν CH2), 2850.99 (ν CH2), 1606,17 (ν CN), 1437,02 (ν CN), 810,82 (ν CN), 1258,33 (ν SO), 1150,08 (ν SO), 1100,12 (ν CF), 1029,20 (ν CF), 636,38 (ν SO). Raman (cm-1): 1618,67 (ν C-C bipiridina), 1303,05 (ν C-C), (ν C-N), (v C-H), 321,07 (v Ni-N). RMN 1H (400 MHz, acetona d6, δ): 8,60 (d, 16 H, J= 6,03 Hz), 7,10 - 7,70 (m, 96 H, C6H5), 3,99 (d, J= 4,80 Hz, 16 H, -CH2-CH2-). RMN 31P (acetona d6, 162 MHz, H3PO4 85%, δ): 30,57 (s, P-dppe). RMN 19F (acetona d6, 282 MHz, (C2HF3O2), δ): -78,87 (s, -SO3CF3). COSY 1H-1H: Especie cuadrada (d: 8,60 α 4,4'-bipridina con d: 7,70 protones grupo fenilo dppe.) (18).
Especies supramoleculares [6] y [7]: A 9,96*10-5 moles (0.080 g) del complejo [3] disueltos en 12 ml de CH2Cl2, se adicionaron 9,96*10-5 moles (0,016 g) de 4,4'-bipiridina (C10H8N2) [1] disueltos en 10 ml de CH2Cl2. La reacción se realizó en un balón de tres bocas bajo atmosfera de nitrógeno, con agitación magnética permanente y a temperatura ambiente por 3 h. La solución inicial del complejo [3] presentó un color amarillo, la cual se tornó incolora al agregar la 4,4'-bipiridina [1]. La solución resultante fue disminuida hasta aproximadamente 5 ml en el rotavapor, luego se adicionaron 10 ml de éter etílico, formándose un precipitado blanco que corresponde a las especies en equilibrio. Este precipitado fue filtrado y purificado, a través de lavados sucesivos con éter y secado en alto vacío por 4 h. De esta manera se obtuvo un total de 0,075 g, el cual es un polvo fino de color blanco (Rendimiento 88%). Uv-vis (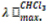 : nm): 270,00 (TC L-M), 324,01 (π π*). FT-IR cercano (
: nm): 270,00 (TC L-M), 324,01 (π π*). FT-IR cercano (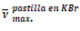 : cm-1): 3095,14 (ν CH), 2924,10 (ν CH), 2853,66 (ν CH), 1716,17 (ν C-C), 1610,14 (ν C-N), 1437,78 (ν C-N), 1258,99 (ν SO), 1158,37 (ν SO), 1104,49 (ν C-F), 1029,65 (ν C-F), 818,78 (ν C-N), 637,74 (ν SO). Raman (cm-1): 1648,40 (ν C-C bipiridina), 1295,97 (ν C-C), (ν C-N), (v C H), 319,01 (v Ni-N). RMN 1H (400 MHz, acetona-d6, δ): 3,40 (d, 16 H, -CH2-CH2-), 7,98-7,48 (m, 96 H, -C6H5), 8,80 (d, J: 4,77 Hz, 16 H, Hα 4,4'-bipiridina cuadrado) y 8,65 (d, J= 4,97 Hz, Hα 4,4'-bipiridina triángulo). RMN 31P (acetona-d6, 162 MHz, H3PO4 85%, δ): 66,60 (s, P-dppe, Cuadrado Supramolecular) y 68,20 (s, P-dppe, triángulo Supramolecular). RMN 19F (acetona-d6, 282 MHz, fluorobenceno (C6H5F), δ): -77,68 (s, -SO3CF3 coordinado). COSY 1H-1H: Especie cuadrada (d:8,80 α 4,4'-bipridina con d: 7,98-7,48 protones grupo fenilo dppe.), Especie triangular (d:8,65 α 4,4'-bipridina con d: 7,98 - 7,48 protones grupo fenilo dppe.) (18).
: cm-1): 3095,14 (ν CH), 2924,10 (ν CH), 2853,66 (ν CH), 1716,17 (ν C-C), 1610,14 (ν C-N), 1437,78 (ν C-N), 1258,99 (ν SO), 1158,37 (ν SO), 1104,49 (ν C-F), 1029,65 (ν C-F), 818,78 (ν C-N), 637,74 (ν SO). Raman (cm-1): 1648,40 (ν C-C bipiridina), 1295,97 (ν C-C), (ν C-N), (v C H), 319,01 (v Ni-N). RMN 1H (400 MHz, acetona-d6, δ): 3,40 (d, 16 H, -CH2-CH2-), 7,98-7,48 (m, 96 H, -C6H5), 8,80 (d, J: 4,77 Hz, 16 H, Hα 4,4'-bipiridina cuadrado) y 8,65 (d, J= 4,97 Hz, Hα 4,4'-bipiridina triángulo). RMN 31P (acetona-d6, 162 MHz, H3PO4 85%, δ): 66,60 (s, P-dppe, Cuadrado Supramolecular) y 68,20 (s, P-dppe, triángulo Supramolecular). RMN 19F (acetona-d6, 282 MHz, fluorobenceno (C6H5F), δ): -77,68 (s, -SO3CF3 coordinado). COSY 1H-1H: Especie cuadrada (d:8,80 α 4,4'-bipridina con d: 7,98-7,48 protones grupo fenilo dppe.), Especie triangular (d:8,65 α 4,4'-bipridina con d: 7,98 - 7,48 protones grupo fenilo dppe.) (18).
Especies supramoleculares [8] y [9]: A 8,96 * 10-5 moles (0,080 g) de [6], disueltos en 10 ml de CH2Cl2, fueron adicionadas 1,12 *10-4 moles (0,017 g) de 4,4'-bipiridina [1], disueltos en 10 ml de CH2Cl2. La reacción se llevó a cabo en un balón de 100 ml, protegido de la luz y bajo agitación magnética permanente durante 6 d. Al inicio la reacción se tornó translucida, durante las primeras 72 horas no se observó cambioalguno en cuanto a la apariencia de la mezcla de reacción, por lo cual se dejó reaccionar hasta observar algún tipo de cambio. Pasadas las siguientes 72 horas, la mezcla de reacción tomó un color verde claro, el cual permaneció constante. Luego fue extraído todo el solvente con ayuda del rotavapor a presión reducida, obteniéndose un polvo fino de color verde claro brillante. Finalmente este precipitado, fue secado en alto vacío por 4 h y pesado, obteniéndose 0,304 g (rendimiento 79 %). Uv-vis ( 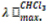 : nm): 279,00 (TC L-M), 283,00 (TC L-M), 287,00 (π π*). FT-IR cercano (
: nm): 279,00 (TC L-M), 283,00 (TC L-M), 287,00 (π π*). FT-IR cercano ( 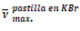 : cm-1): 3054,46 (νCH), 2921,23 (νCH), 2850,97 (νCH), 1972,73 (νCC), 1614,41 (νCN), 1436,61 (νCN), 1259,71 (νSO), 1153,41 (νSO), 1105,68 (νCF), 1029,34 (νCF), 812,02 (νCN), 636,68 (νSO). Raman (cm-1): 1615,18 (ν C-C bipiridina), 1294,16 (ν C-C), (ν C-N), (v C H). RMN 1H (400 MHz, acetona-d6, δ): 2,85 (d, 16 H, J= 4,57 Hz, -CH2-CH2-), 7,10-7,86 (m, 96 H, -C6H5), 8,87 (8 H, Hα 4,4'-bipiridina, triángulo) y 8,67 (8 H, Hα 4,4'-bipiridina, cuadrado). RMN 31P (acetona-d6, 162 MHz, H3PO4 85%, δ): 35,67 (s, P-dppe, Cuadrado Supramolecular, JPt-P: 3254,29 Hz) y 37,37 (s, P-dppe, triángulo Supramolecular, JPt-P: 3245,23 Hz). RMN 19F (acetona-d6, 282 MHz, fluorobenceno (C6H5F), δ): -79,56 (s, -SO3CF3 coordinado). COSY 1H-1H: Especie triangular (d: 8,87 α 4,4'-bipridina con d: 7,10 - 7,86 protones grupo fenilo dppe), Especie cuadrada (d:8,67 α 4,4'-bipridina con d: 7,10 - 7,86 protones grupo fenilo dppe.) (18).
: cm-1): 3054,46 (νCH), 2921,23 (νCH), 2850,97 (νCH), 1972,73 (νCC), 1614,41 (νCN), 1436,61 (νCN), 1259,71 (νSO), 1153,41 (νSO), 1105,68 (νCF), 1029,34 (νCF), 812,02 (νCN), 636,68 (νSO). Raman (cm-1): 1615,18 (ν C-C bipiridina), 1294,16 (ν C-C), (ν C-N), (v C H). RMN 1H (400 MHz, acetona-d6, δ): 2,85 (d, 16 H, J= 4,57 Hz, -CH2-CH2-), 7,10-7,86 (m, 96 H, -C6H5), 8,87 (8 H, Hα 4,4'-bipiridina, triángulo) y 8,67 (8 H, Hα 4,4'-bipiridina, cuadrado). RMN 31P (acetona-d6, 162 MHz, H3PO4 85%, δ): 35,67 (s, P-dppe, Cuadrado Supramolecular, JPt-P: 3254,29 Hz) y 37,37 (s, P-dppe, triángulo Supramolecular, JPt-P: 3245,23 Hz). RMN 19F (acetona-d6, 282 MHz, fluorobenceno (C6H5F), δ): -79,56 (s, -SO3CF3 coordinado). COSY 1H-1H: Especie triangular (d: 8,87 α 4,4'-bipridina con d: 7,10 - 7,86 protones grupo fenilo dppe), Especie cuadrada (d:8,67 α 4,4'-bipridina con d: 7,10 - 7,86 protones grupo fenilo dppe.) (18).
Discusión de resultados
Con relación a los estudios de UV-Vis realizados a los complejos de interés [2-4] y a los macrociclos [5-9], se presentan las bandas correspondientes a transferencias de carga ligante-metal (TC L-M) en las zonas de alta energía del espectro; mientras las transiciones de tipo (π π*) para estos mismos complejos, se presentan en zonas de menor energía. Aunque los espectros obtenidos para estas estructuras son similares, la posición de las bandas correspondientes a las transiciones electrónicas, entre los metales y el dppe coordinado en los complejos presentan pequeñas variaciones, estas dependen del centro metálico; es decir, según la teoría de campo cristalino para complejos de tipo cuadrado planares (d8), señala que la transición electrónica entre orbitales dxy a dx2-y2 para los metales en cuestión, es energéticamente: Pt (II)>Pd (II)>Ni (II). De igual manera, al unirse en disolución una fosfina terciaria (PR3) bidentada con el metal, esta se comporta como un ligante donor σ y aceptor π, lo cual es evidenciado por las transferencias electrónicas, encontradas en los espectros de UV-Vis (18).
De igual manera, al comparar los resultados encontrados en los espectros de FT-IR, para los complejos de interés y los macrociclos, se obtienen pequeñas diferencias en las señales asignadas para los diversos modos vibracionales, lo cual es indicio de la forma en que los modos vibracionales, producidos en el ligando dppe, se presentan de la misma manera al encontrarse coordinando al níquel (II), al paladio (II) y al platino (II). Mientras la presencia del enlace del anión triflato en los complejos metálicos, lleva a que la energía necesaria para promover una transición vibracional, sea superior en la medida que el tamaño del metal sea mayor, por lo que se presentan bandas con números de onda mayores o energéticamente superiores (para mayor información ver referencias 18-20).
Sin embargo, en los espectros de FT-IR obtenidos, no es posible observar la naturaleza del metal, debido a que las vibraciones ocasionadas por las interacciones ligante-metal, se observan en zonas del espectro inferiores a 500 cm-1, se realizó una estudio Raman como técnica complementaria.
Espectroscopia 1H y 31P RMN:
En los espectros 1H RMN de los polígonos obtenidos se presenta un doblete atribuido al desplazamiento químico de los protones alifáticos de los grupos etilén del dppe, coordinados a átomos de fósforo en las estructuras de los polígonos supramoleculares: ([5]:3,99 ppm, d, J= 4,80 Hz, 16 H, -CH2-CH2-, [6-7]: 3,40 ppm, d, 16 H, -CH2-CH2- y [8-9]: 2,85 ppm, d, 16 H, J= 4,57 Hz, -CH2-CH2-). De igual manera, se presentan las señales generadas por el desplazamiento químico de los protones aromáticos de los grupos fenilo y de los protones β de la 4,4'-bipiridina [1], estas últimas señales se encuentran solapadas por los protones aromáticos de los grupos fenilo, lo cual es confirmado por el valor de las integrales: ([5]: 8,60 ppm, d, 16 H, J= 6,03 Hz. 7,10-7,70 ppm, m, 96 H, C6H5. [6-7]: 7,98-7,48 ppm, m, 96 H, -C6H5. 8,80 ppm, d, J= 4,77 Hz, 16 H, Hα 4,4'-bipiridina cuadrado y 8,65 ppm, d, J= 4,97 Hz, Hα 4,4'-bipiridina triángulo. [8-9]: 7,10-7,86 ppm, m, 96 H, -C6H5. 8,87 ppm, 8 H, Hα 4,4'-bipiridina, triángulo y 8,67 ppm, 8 H, Hα 4,4'-bipiridina cuadrado).
Al comparar los desplazamientos de este grupo de señales con relación a los desplazamientos químicos de las señales de los complejos precursores, se presentan corrimientos hacia campo alto, debido a la interacción de [1] a los centros metálicos durante el proceso de autoensamblaje.Las señales correspondientes a los protones α de la 4,4'- bipiridina coordinada en la estructura, se presenta como un doblete, y posee un desplazamiento hacia campo bajo con relación al valor de la señal reportada para los protones α de la 4,4'-bipiridina libre (23). Para el caso de las especies en equilibrio [6-9], se presentan dos señales diferenciadas para los protones α de [1], los cuales se encuentran coordinados al centro metálico en otra especie altamente simétrica, la cual se encuentra en equilibrio y es generada durante el proceso de autoensamblaje (24).
En cuanto a los espectros de RMN31P (figura 2) para la especie [5] (30,57 ppm, s, P-dppe), se presenta la aparición de una única señal que corresponde a átomos de fósforo, presentes en la estructura del dppe coordinado al centro metálico de níquel. Mientras que para las especies de paladio [6-7] (66,60 ppm, s, P-dppe Cuadrado Supramolecular y 68,20 ppm, s, P-dppe triángulo Supramolecular) y platino [8-9] (35,67 ppm, s, P-dppe Cuadrado Supramolecular, JPt-P: 3254,29 Hz y 37,37 ppm, s, P-dppe triángulo Supramolecular, JPt-P: 3245,23 Hz), se muestran dos señales que corresponden a átomos de fósforo, presentes en la estructura del dppe coordinado en dos entornos químicos diferentes. Estas señales presentan dos desplazamientos químicos diferentes, lo cual indica la presencia de estos átomos en dos especies distintas. La señal que presenta un desplazamiento mayor hacia campo alto en estos espectros, corresponde a átomos de fósforo coordinados al centro metálico en la estructura de los triángulos [7] y [9] debido a la variación en los ángulos de enlace de coordinación N-Pd-P, en la conformación del triángulo.
Por último, otro indicador que evidencia la formación de las especies [8], [9] en equilibrio, es el acoplamiento diferenciado 195Pt-P, que se presenta para cada una de las especies formadas (J: 3245,23 Hz para [8] y J: 3254,29 Hz para [9]).
De igual manera, con el fin de estudiar el desplazamiento del equilibrio generado, se realizó la reacción de autoensamblaje de las especies [6] y [8] y la toma del espectro de 1H RMN a -20º C, encontrándose una pequeña variación entre el porcentaje de formación de las dos especies en equilibrio (25 % especie triangular y 75 % especie cuadrada), en comparación con los resultados obtenidos a partir de la síntesis realizada a temperatura ambiente, evidencia que podría soportar la teoría acerca de la coexistencia de las especies en equilibrio y no en mezcla (mayor información ver referencia 20)
Espectroscopia COSY RMN.
El análisis de Correlación Homonuclear COSY 1H-1H de los polígonos obtenidos, se realizó con el fin de verificar la existencia de acoplamientos diferenciales, para las señales atribuidas a los protones α de la 4,4'-bipiridina (18).
En los espectros se presentan los acoplamientos del cuadrado de níquel y de los polígonos en equilibrio, lo cual se confirmó gracias a las correlaciones correspondientes al acoplamiento entre las señales de los protones α, localizados en los fragmentos piridinos de la 4,4'-bipridina coordinada al níquel, que acoplan entre ellos y con los protones del grupo fenilo del dppe. Mientras para las especies de platino y paladio, se observan dos acoplamientos diferentes entre la señal de los protones α de la 4,4'-bipiridina con la señal de los protones del grupo fenilo del dppe, debido a la formación de una segunda estructura simétrica. Lo anterior permitió descartar la coexistencia de otra especie en equilibrio con el cuadrado para el caso del níquel, ya que no se presentó otro tipo de acoplamiento diferenciado. En la figura 3 se ilustra el COSY de las especies supramoleculares de platino [8-9], en el cual se presentan las correlaciones de estos polígonos.
Espectroscopía Raman.
El análisis por espectroscopía Raman, se constituye en el primer estudio realizado para arreglos supramoleculares [5-9], construidos a partir de complejos metálicos de níquel [2], paladio [3] y platino [4] con dppe y autoensamblados con 4,4-'bipiridina [1], donde a la fecha no se ha encontrado ningún reporte. Con relación a las bandas presentadas para los modos de vibración de los complejos precursores reportadas por Franklin et al (25), las bandas de estos complejos en las especies supramoleculares (los cuales actúan como vértices), presentan desplazamientos muy similares luego del proceso de coordinación. En la tabla 1 se presentan los desplazamientos correspondientes a las tres bandas diferenciales a, b, c, que se presentan en estos complejos luego del proceso de coordinación de la 4,4-'bipiridina [1] a los centros metálicos (autoensamblaje). Estas bandas se encuentran en concordancia según los datos reportados en diferentes estudios de Raman, realizados a la molécula de la 4,4'-bipiridina coordinada en diferentes complejos (26-27).
Cálculos computacionales semiempíricos
Las geometrías optimizadas del triángulo y del cuadrado catíonico de Ni se muestran en las Figuras 4a y 4b, en las cuales se observa que los centros metálicos de ambas especies son cuadrado planares, mientras que las uniones del cuadrado son lineales y las del triángulo se encuentran arqueadas. Los ángulos de enlace N-Ni-N son ligeramente mayores en el cuadrado (98.4°) que en el triángulo (94.6°). Esta tendencia también se presenta en los estudios realizados por Ferrer para especies supramoleculares de Pd y Pt (15). Las geometrías optimizadas para los compuestos de Pd y Pt presentan resultados análogos.
Por otra parte, en presencia de un disolvente poco polar, es poco probable que estas especies supramoleculares se encuentren en forma catíonica debido a la alta carga que presentan. Por lo tanto se realizaron optimizaciones de los complejos supramoleculares neutros. Las Figuras 4c y 4d presentan la posición de los contraiones en los complejos [Ni(dppe)(4,4'-bipy)]3(TOF)6 y [Ni(dppe)(4,4'-bipy)]4(TOF)8. Estas figuras muestran que los contraiones se ubican en caras opuestas del centro metálico en forma asimétrica, en el cual las distancias entre el centro metálico de Ni y el átomo de O más próximo, son 3,7 Å para el cuadrado y 3,6 Å para el triángulo.
Además, los ángulos de los enlaces N-Ni-N son similares a los ángulos para las especies catíonicas (95.4° cuadrado y 92.9° triángulo). A partir de estos resultados podemos concluir que los aniones TOF no se encuentran dentro de la esfera de coordinación del centro metálico.
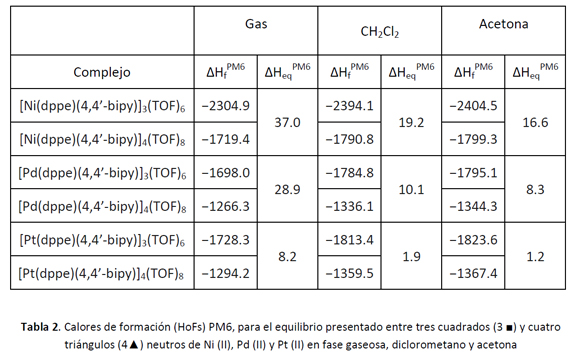
Con el fin de comparar la estabilidad de las especies macrocíclicas, se calculó la entalpía para el equilibrio de interconversión, ∆Heq (28), entre el cuadrado y el triángulo:
3 [M(dppe)(4,4'-bipy)]4(TOF)8 ↔ 4 [M(dppe)(4,4'-bipy)]3(TOF)6 M=Ni,Pd,Pt,
A partir de los calores de formación calculados ∆Hf a nivel PM6:
∆Heq= 4∆Hf (triángulo) - 3∆Hf (cuadrado)
Los valores de ∆Hf y ∆Heq, para la molécula libre (fase gaseosa) y en solución de CH2Cl2 y acetona, se muestran en la tabla 2. Los valores de ∆Heq para los complejos de Pd en solución 10.1 Kcal/mol y 8.3 Kcal/mol en CH2Cl2 y en acetona respectivamente, se encuentran bastante cerca del valor de 8.4 Kcal/mol reportado por Schalley (29) para complejos similares de Pd en DMF.
Los resultados presentados revelan que tanto en fase gaseosa como en solución, ∆Heq es positivo, lo que implica que los cuadrados supramoleculares se ven favorecidos energéticamente sobre los triángulos, debido a la tensión generada en las estructuras triangulares por la distorsión de la geometría de la 4-4' bipiridina. Además se observa que ∆Heq (Ni) > ∆Heq (Pd) > ∆Heq (Pt), sin importar el medio. A partir de estos resultados teóricos se puede concluir que los centros de Ni favorecen más la formación de cuadrados, mientras que los centros de Pt se favorecen más la formación de triángulos.
Conclusiones
Se realizó por primera vez la construcción de las especies supramoleculares [5-9], utilizando como bloque de construcción complejos metálicos, del tipo [M(dppe)(TOF)2] con níquel [2], paladio [3] y platino [4], obtenidas por procesos de auto-ensamblaje con 4,4'-bipiridina [1], mediante la sustitución nucleofílica de los aniones triflato de forma espontánea, lo cual demuestra la favorabilidad termodinámica del autoensamblaje.
Se determinó mediante el análisis de RMN 1H, 31P, COSY 1H-1H, cálculos semi empíricos y de acuerdo a la simetría y posición de las señales encontradas en el proceso de auto-ensamblaje, la presencia de estructuras supramoleculares, siendo el cuadrado la estructura formada más probable para la especie de níquel [5]. Además, se presentó un equilibrio cuadrado-triángulo para las especies de paladio [6-7] y triángulo-cuadrado [8-9] para el caso del platino.
Las especies macrocíclicas de paladio [6] y [7], y las especies de platino [8] y [9] coexisten debido a la reversibilidad estructural del proceso de auto-ensamblaje. La comparación entre la proporción de las señales encontradas en los espectros de RMN 1H y RMN 31P, permitió encontrar que la proporción de formación de la especie supramolecular [6] es del 72 % y de la especie [7] corresponde al 28 %. Mientras la proporción para las especies de platino, corresponden a un 74 % para [8] y a un 26 % para [9]. Para el níquel se encontró un porcentaje de formación del 100% para el cuadrado [5].
Agradecimientos.
Los autores agradecen a la Universidad Nacional de Colombia. Al profesor Cesar Sierra del grupo de investigación en Macromoléculas (UNAL), al profesor Elíseo Avella del laboratorio de RMN (UNAL), al profesor Luis Enrique Cuca del grupo de investigación en Fitoquímica (UNAL). Un agradecimiento especial a Oscar Morales de Purdue University y al Doctor Makoto Fujita profesor de la Universidad de Tokio, por sus valiosos comentarios.
Bibliografía.
1. Stang, P. J.; Chakrabarty, R.; Mukherjee, P. S. Supramolecular Coordination: Self-Assembly of Finite Two- and Three-Dimensional Ensembles.Chem. Rev. 2011, 111, 6810-6918. [ Links ]
2. Cook, T. R.; Zheng, Y. R.; Stang, P. J. Metal-Organic Frameworks and self-assembled supramolecular coordination complexes: comparing and contrasting the design, synthesis and functionality of Metal-Organic Materials.Chem. Rev. 2013, 113, 734-777. [ Links ]
3. Stricklen, P.; Volcko, E.; Verkade, J. Novel homo and heterometallic coordination macrocycles. J. Am. Chem. Soc. 1983, 105, 2494. [ Links ]
4. Albrecht, M. Dicatechol ligands: novel building-blocks for metallo-supramolecular chemistry. Chem. Soc. Rev. 1998, 27, 281-288. [ Links ]
5. Hinton, H.A.; Chen, H.; Hamor, T.A.; Jones, C. J.; McQuilan, F.S.; Tolley, M.S. Mono-, Bi-, and Trinuclear Metallocyclophanes Formed in Reactions between [Mo(NO){HB(3,5-Me2C3HN2)3}I2] and Xylenedithiols. The X-ray Crystal Structures of [Mo(NO){HB(3,5-Me2C3HN2)3}{1,4-(SCH2)2C6H4}n] (n = 2, 3). Inorg. Chem. 1998, 37, 2933-2942. [ Links ]
6. Farrell, J. R.; Eisenberg, A. H.; Mirkin, C. A.; Guzei, I. A.; Liable-Sand, L. M.; Incarvito, C. D.; Rheingold, A. L.; Stern, C. L. Templated Formation of Binuclear Macrocycles via Hemilabile Ligands. Organometallics. 1999, 18, 4856-4868. [ Links ]
7. Ekkehardt, H. F.; Radloff, C.; Pape, T.; Hepp, A. A nickel(II)-cornered molecular rectangle with biscarbene and 4,4′-bipyridine bridging groups. Organometallics. 2008, 27, 6408-6410. [ Links ]
8. Byabartta, P.; Laguna, M. Gold(I)-nickel(II)-4,4´-bipy-phosphine complexes: synthesis and multinuclear NMR study. J. Chin. Chem. Soc. 2007, 54, 1277-1286. [ Links ]
9. Hong, M.; Zhao, Y.; Su, W.; Cao, R.; Fujita, M.; Zhou Z.; Chan, A. A Nanometer-Sized Metallosupramolecular Cube with Oh Symmetry. J. Am. Chem. Soc. 2000, 122, 4819-4820. [ Links ]
10. Liu, Y.; Kravtsov, V.; Walsh, R. D.; Poddar, P.; Srikanthc, H.; Eddaoudi, M. Directed assembly of metal-organic cubes from deliberately predesigned molecular building blocks. Chem. Commun. 2004, 2806 - 2807. [ Links ]
11. Fujita, M.; Yazaki, J.; Ogura, K. Preparation of a macrocyclic polynuclear complex, [(en) Pd(4,4'-bpy)]4(NO3)8, which recognizes an organic molecule in aqueous media. J. Am. Chem. Soc. 1990, 112, 5645-5647. [ Links ]
12. Stang, P. J.; Cao, D. Transition metal based cationic molecular boxes. Self-Assembly of macrocyclic Platinum (II) and Palladium (II) tetranuclear complexes. J. Am. Chem. Soc. 1994, 116, 4981-4982. [ Links ]
13. Würthner, F.; Saha-Möller, C. Metallosupramolecular squares: from structure to function. Chem. Soc. Rev. 2004, 33, 133-146. [ Links ]
14. Kuppler, R.; Timmons, D.; Fang, Q. Potential applications of metal-organic frameworks. Coord. Chem. Rev. 2009, 3042-3066. [ Links ]
15. Ferrer, M.; Mounir, M.; Rossell, O.; Ruiz, E.; Maestro, M.; Equilibria between Metallosupramolecular Squares and triangles with the new rigid linker 1,4-bis(4-pyridyl) tetrafluorobenzene, experimental and theoretical study of the structural dependence of NMR data. Inorg. Chem. 2003, 42, 5890-5896. [ Links ]
16. Sautter, A.; Schmid, D.; Jung, G.; Würthner, F. A triangle-square equilibrium of metallosupramolecular assemblies based on Pd(II) and Pt (II) corners and diazadibenzoperylene bridging ligands. J. Am. Chem. Soc. 2001, 123, 5424-5430. [ Links ]
17. Cotton, F.; Murillo, C.; Yu, R. Dynamic equilibrium between cyclic oligomers. Thermodynamic and structural characterization of a square and a triangle. Dalton Trans. 2006, 12, 3900-3905. [ Links ]
18. Torres, P. Síntesis y caracterización de poligonos supramoleculares a partir de complejos de niquel paladio y platino. Universidad Nacional de Colombia, sede Bogotá, 2014. [ Links ]
19. Posada, J.; Duarte, A.; Avella, E.; Echegoyen, L. Síntesis y caracterización de un cuadrado supramolecular a partir del auto-ensamblaje del complejo 1,2-bis(difenilfosfino)etano bis(trifluorometanosulfonato)paladio (II) y 4,4´-bipiridina. Rev. Col. Quím. 2011, 40, 293-304. [ Links ]
20. Torres, P.; Cano, C.; Duarte, A. Autoensamblaje de un cuadrado supramolecular a partir del complejo Ni(dppe)(tof)2 con 4,4'-bipiridina. Rev. Col. Quím. 2014, Aceptado 42, 2. [ Links ]
21. Fallis, S.; Anderson, G. K.; Rath, N. P. Nucleophilic attack on or displacement of coordinated 1,5-Cyclooctadiene. Structures of [Pt{ζ:η2-C8H12(PPh3)}(dppe)][ClO4]2 and [Pt(dppe)(H2O)2][SO3CF3]2. Organometall. 1991, 10, 3180-3184. [ Links ]
22. Stang, P.J.; Cao, D.; Sato, S.; Arif, A. Self-Assembly of cationic, tetranuclear, Pt (II) and Pd (II) macrocyclic squares. X-ray crystal structure of [Pt2+(dppp)(4,4'-bipyridyl)2-OSO2CF3]4. J. Am. Chem. Soc. 1995, 117, 6213-6283. [ Links ]
23. Kuroboshi, M.; Waki, Y.; Tanaka, H. Palladium - catalyzed tetrakis (dimethylamino) ethylene promoted reductive coupling of aryl halides. J. Org. Chem. 2003, 10, 3938-3942 [ Links ]
24. P. J. Stang, B. Olenyuk, Self-Assembly, symmetry and molecular architecture: Coordination as the motif in the rational design of supramolecular metallocyclic polygons and polyhedra. Acc. Chem. Res. 1997, 20, 502-518. [ Links ]
25. Franklin, A.; Ramakrishnan, V.; Murugesan, R. Infrared and laser Raman studies of [Ni(II)(dppe)Cl2] and [Co(III)(dppe)2Cl2]PF6(dppe=1,2-bis(diphenylphosphino)ethane). Spect. Acta Part A. 2002, 58, 1703-1712 [ Links ]
26. Zhuang, Z.; Chenga, J.; Wanga, X.; Zhaoa, B.; Hana, X.; Luob, Y. Surface-enhanced Raman spectroscopy and density functional theory study on 4,4´-bipyridine molecule. Spectrochimica Acta Part A. 2007, 67, 509-516. [ Links ]
27. Creighton, J. A.; Álvarez, M. S.; Weitz, D. A.; Garoff, S.; Kim, M. W. Surface-enhanced Raman scattering by molecules adsorbed on aqueous copper colloids. J. Phys. Chem. 1983, 87,4793-4799. [ Links ]
28. James, J.; Stewart, P. Optimization of parameters for semiempirical methods V: Modification of NDDO approximations and application to 70 elements. J Mol Model. 2007, 13, 1173-1213. [ Links ]
29. Weilandt, T.; Troff, R.; Saxell, H.; Rissanen, K.; Schalley, C. Metallo-Supramolecular Self-Assembly: the Case of Triangle-Square Equilibria. Inorg. Chem. 2008, 47, 7588-7598. [ Links ]