Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.43 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/rev.colomb.quim.v43n1.50542
DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v43n1.50542
Lignanos diarildimetilbutanos y otros constituyentes aislados de nectandra turbacensis (kunth) nees (lauraceae)
Diaryldimethylbutane lignans and other constituents isolated from nectandra turbacensis (kunth) nees (lauraceae)
Lignanas diaryldimethylbutane e outros constituintes isolado de nectandra turbacensis (kunth) nees (lauraceae)
Víctor Macías-Villamizar1,§, Luís Cuca-Suárez1
1Laboratorio de Productos Naturales Vegetales, Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. A.A. 14490, Bogotá, D.C., Colombia.; §Estudiante de Doctorado y Profesor Universidad del Madalena. Tel. +57 1 3165000; ext. 14476-14453
Correo electrónico de contacto: lecucas@unal.edu.co, vemaciasv@unal.edu.co.
Recibido: 5 diciembre 2013. Aceptado: 17 febrero 2014
Resumen
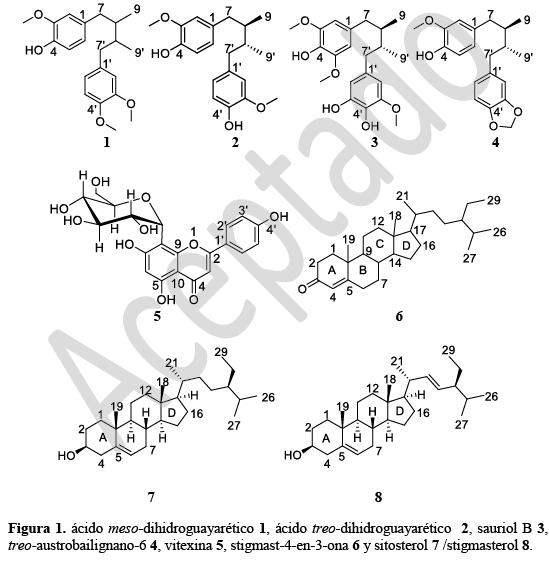
Ocho compuestos conocidos fueron aislados del extracto etanólico de corteza de Nectandra turbacensis (Kunth) Nees (Lauraceae). Éstos fueron identificados como ácido meso-dihidroguayarético 1, ácido treo-dihidroguayarético 2, sauriol B 3, y treo-austrobailignano-6 4; vitexina (8-C-β-D-glucopiranosil-5,7,4'-trihidroxiflavona) 5; estigmast-4-en-3-ona 6 y la mezcla sitosterol 7 / estigmasterol 8. Las estructuras de los compuestos fueron elucidadas por métodos espectroscópicos, que incluyeron técnicas de RMN en 1D y 2D, CG/EM y por comparación de los datos espectroscópicos, reportados en la literatura, de compuestos relacionados. Este es el primer reporte de la presencia de este tipo de compuestos en la especie. Se describen también las implicaciones quimiotaxonómicas; relacionadas con la presencia frecuente de lignanos en especies del género Nectandra.
Palabras clave: Nectandra turbacensis, lignanos diarildimetilbutánicos, flavonoides, esteroles, esteroides.
Abstract
Eight known compounds were isolated from the ethanol extract of bark Nectandra turbacensis (Kunth) Nees (Lauraceae); which were identified as meso-dihydroguaiaretic acid 1, threo-dihidroguaiaretic acid 2, sauriol B 3, and threo-austrobailignan-6 4; vitexin (8-C-β-D-glucopyranosyl-5,7,4'-trihydroxyflavone) 5; stigmast-4-en-3-one 6; and sitosterol 7/ stigmasterol 8 mixture. The structures of the compounds were elucidated by spectroscopic methods, techniques involving 1D and 2D NMR, GC/MS and by comparison of spectral data, reported in the literature, of related compounds. This is the first report of the presence of such compounds in the species. The chemotaxonomic implications are also described; related to the frequent presence of lignans in the genus Nectandra.
Keywords: Nectandra turbacensis, diaryldimethylbutane lignans, flavonoid, sterols and steroid.
Resumo
Oito compostos conhecidos foram isolados do extrato etanólico da casca de Nectandra turbacensis (Kunth) Nees (Lauraceae). Quais foram identificados como ácido meso-dihidroguayarético 1, ácido treo-dihidroguayarético 2, sauriol B 3, e treo-austrobailignano-6 4; vitexina (8-C-β-D-glucopiranosil-5,7,4'-trihidroxiflavona) 5; estigmast-4-en-3-ona 6 e mistura sitosterol 7/ estigmasterol 8. As estruturas dos compostos foram determinadas por métodos espectroscópicos, técnicas que envolvem a 1D e 2D RMN, CG/EM e a comparação dos dados espectroscópicos, relatados na literatura, compostos relacionados. Este é o primeiro relato da presença de tais compostos na espécie. As implicações quimiotaxonômicos também são descritos; relacionada com a presença freqüente de lignanas no gênero Nectandra.
Palavras-chave: Nectandra turbacensis, diarildimetilbutanos lignanas, flavonóides, esteróis, esteróides.
Introducción
La Química de los Productos Naturales Vegetales, entendida como la investigación en metabolitos secundarios procedente de plantas (1), contempla generalmente aspectos relacionados con una o varias de las siguientes líneas generales: a-elucidación de la bioactividad o mecanismo de acción directa (biodirigidos) y caracterización de compuestos activos, b-modificación y/o síntesis de análogos, c-estudios de los mecanismos de acción. Por lo tanto, el estudio de los metabolitos, es un proceso interactivo donde se combinan el aislamiento, la caracterización y la síntesis y/o transformaciones de nuevos análogos para la determinación de, por ejemplo, los perfiles farmacológicos (2). En este contexto, son diversos los estudios fitoquímicos que involucran diferentes géneros; entre los que se encuentra Nectandra, y que en términos de caracterización y elucidación estructural de los metabolitos secundarios aislados de este, está articulado con las líneas generales planteadas anteriormente. De hecho, son diversos los estudios reportados en la literatura, que involucra, el género Nectandra, los cuales permitieron determinar la presencia de algunos tipos de metabolitos secundarios, encontrándose sesquiterpenos, fitoesteroles, polialcoholes, derivados de arilpropanoides, flavonoles, arilpropanoides; lignanos furofuránicos, neolignanos del tipo dihidrobenzofuránicos (3) y algunos norlignanos (4). Otros estudios han reportado, también, la presencia de alcaloides indólicos (5), taninos (6), diterpenos (7), y componentes de aceites esenciales (8). No obstante, a pesar de la variedad de metabolitos aislados en el género Nectandra, la característica quimiotaxonómica la da la presencia de compuestos del tipo lignano (9), en donde varios poseen incluso actividad biológica quimioterapéutica (5). Se presenta en este trabajo el aislamiento de metabolitos secundarios de la especie Nectandra turbacensis.
Materiales y métodos
General
Los espectros de RMN 1H y RMN 13C, DEPT, HMQC, HMBC, y experimento COSY fueron tomados sobre un Bruker Avance 400 (CDCl3 o CD3OD) usando TMS como estándar interno. Las cromatografías en columna a gravedad (CC) fueron corridas usando silica gel (Merck, 40-63 mm), la cromatografía líquida al vacío (CLV) usando silica gel para placa, malla 70-230 (Merck), y la cromatografía de capa delgada (CCD) sobre silica gel 60 F254 (Merck, 0.30 mm de espesor). Se utilizó como complemento de purificación sephadex LH-20. El análisis CG/EM (cromatografía de gases acoplado a espectrometría de masas) fue corrido en un cromatógrafo de gases Shimadzu GC-17A acoplado a un espectrómetro de masas Shimadzu GCMS-QP5050A. Los disolventes hexano, tolueno, éter etílico, acetato de etilo, acetona y metanol; fueron purificados antes de su uso. Los reactivos de identificación preliminar fueron preparados minutos antes de la aplicación de los procedimientos, y entre ellos están: reactivo de Gibbs (utilizados para los lignanos diarildimetilbutánicos); prueba en medio básico y con AlC3 (para el flavonoide, vitexina); prueba del nitrato amónico cérico en dioxano, junto con la reacciones de Salkowski y de Liebermann-burchard (cada una independiente), para la identificación de la mezcla sitosterol y estigmasterol.
Material vegetal
El material vegetal utilizado para el estudio fitoquímico corresponde a la corteza de la especie Nectandra turbacensis, recolectada en la ciudad de Santa Marta (Magdalena, Colombia), en el corregimiento de Bonda (+11° 14' 13.20"), en marzo de 2010; asistido por el botánico Magister Eduino Carbonó de la Universidad del Magdalena (Director del Herbario de la Universidad del Magdalena) y determinada por el biólogo Adolfo Jara Muñoz de la Universidad Nacional de Colombia. Un espécimen reposa en el Herbario Nacional Colombiano del Instituto de Ciencias Naturales con el número COL- 556717.
Extracción y aislamiento
El material (corteza) seco y molido (1000 g) de Nectandra turbacensis fue sometido por una semana a extracción por percolación con etanol al 96%, y a temperatura ambiente. El disolvente fue retirado a presión reducida, obteniéndose el correspondiente extracto etanólico, denominado NtcEtOH (242 g); posteriormente fue sometido a fraccionamiento por cromatografía líquida al vacío (CLV) utilizando disolventes con polaridad específica (no mezclados) y de las cuales se obtuvieron seis fracciones (hexano, 10g; tolueno, 45g; éter etílico, 50 g; acetato de etilo 70 g, acetona 70 g; y metanol, 30 g) que fueron monitoreadas por cromatografía de capa delgada (CCD). Con base en el análisis de los perfiles cromatográficos, se reunieron, la fracción de tolueno con la de éter etílico (cuya unión fue denominada, Fr-1) (95 g), y la fracción de acetato de etilo con la de acetona (Fr-2) (140 g), las cuales fueron purificadas, en forma independiente, por cromatografía en columna sobre silica gel usando en ambos casos la mezcla de hexano: acetona en gradiente (95:5 a 0:100), obteniéndose 20 fracciones en cada una de ellas. Con base en el análisis del perfil cromatográfico de las fracciones monitoreadas con CCD de Fr-1 (95 g), se reunieron las subfracciones 4 a 7 (Fr-1.4 a Fr-1.7) (120 mg) y de 8 a 10 (Fr-1.8 a Fr-1.11) (150 mg), sometiéndose en forma independiente, a cromatografía en columna sobre silica gel utilizando como disolvente la mezcla hexano: acetona en proporción de 9:1 a 7:3, en ambos casos; seguido por filtración sobre sephadex LH-20. De las primeras subfracciones reunidas (Fr-1.4 a Fr-1.7), luego del proceso de cromatográfico y de filtración, se obtuvieron los compuestos: estigmast-4-en-3-ona 6 (30 mg) y la mezcla sitosterol 7 /estigmasterol 8 (en proporción, 80/20) (50 mg) (ver figura 1), las cuales fueron determinadas por CG/EM; y elucidadas por RMN; mientras que de las segundas subfracciones reunidas (Fr-1.8 a Fr-1.11), se aislaron e identificaron los compuestos: ácido meso-monometil dihidroguayarético 1(15 mg), ácido treo-dihidroguayarético 2 (19 mg), sauriol B 3 (15 mg), y treo-austrobailignano-6 4 (22 mg) (ver figura 1).
Paralelamente, del tratamiento de purificación de Fr-2 (140 g) y con base en el análisis del perfil cromatográfico de las fracciones monitoreadas con CCD, se reunieron las subfracciones (Fr-2.10 a Fr-2.20) (160 mg) las cuales se sometieron a CC, utilizando también la mezcla de los disolventes hexano: acetato de etilo, pero con mayor polaridad (6:4 a 4:6), obteniéndose el compuesto vitexina (8-C-β-D-glucopiranosil-5,7,4'-trihidroxiflavona o apigenin-8-C-β-D-glucopiranósido) 5 (30 mg) (ver figura 1).
Resultados y discusión
Los compuestos 1, 2, 3 y 4 dieron resultados positivos para la reacción del reactivo de Gibbs (2,6-dicloro-p-benzoquinona cloroimida); que suponen la presencia de fenoles o sus derivados sustituidos en la posición para (-p) ( 10 ), la cual es una de las características estructurales presente en los compuestos en mención. Los compuestos 1, 2, 3 y 4, muestran señales que de acuerdo a los valores de desplazamiento corresponden a lignanos del tipo diarildimetilbutano (11); y que en el caso del compuesto 1, el cual se presentó como un aceite incoloro; mostró, de acuerdo al análisis de los datos espectroscópicos, los siguientes valores de desplazamiento en RMN 1H; a δ 6,62 (1H, d, J=2,0, H-2), 6,82 (1H, d, J=8,0, H-5), 6,66 (1H, dd, J=8,2, H-6), 2.30 (1H, dd, 13,4, 9,3, H-7a), 2.76 (1H, dd, J=13,4, 4,8, H-7b), 1,77 (1H, m, H-8), 0,84 (3H, d, J=6.7, H-9), 6,64 (1H, d, J=2,0, H-2'), 6.78 (1H, d, J=8,0, H-5'), 6,69 (1H, dd, J=8,2, H-6'), 2,30 (1H, dd, J=13,4, 4,8, H-7'a), 2,76 (1H, dd, J=13,4, 4,8, H-7'b), 1,77 (1H, m, H-8'), 0,86 (3H, d, J=6,7, H-9'), 3,84 (6H, s, OMe), 3,85 (3H, s, OMe), 5,49 (1H, s, OH); correspondientes al ácido meso-monometil dihidroguayarético 1 ( 12 ); el compuesto 2 (aceite incoloro), el análisis del espectro de RMN 1H, mostró los siguientes valores de desplazamiento, RMN 1H (400 MHz, CDCl3) a δ 6,80 (2H d, J=7,9 Hz, H-5,5'), 6,58 (2H, dd, J=7,0, 1,6, H-6,6'), 6,52 (2H, d, J=1,6, H-2,2'), 5,43 (2H, s, Ar-OH), 3,81 (6H, s, OMe), 2,52 (2H, dd, J=13,6, 7,1, H-7b, 7'b), 2,38 (2H, dd, J=13,5, 7,5, H-7a, 7'a), 1,73 (2H, dd, J=12,9, 6,5, H-8, 8'), 0,83 (6H, d, J=6,6, H-9, 9'), los cuales concuerdan con el compuesto denominado, ácido treo-dihidroguayarético 2 ( 11 ); el compuesto 3, mostró los siguientes valores de desplazamientos de RMN 1H (400 MHz, CDCl3), δ 0,80 (6H, d, J =6,6, H-9/9'), 1,71 2H, (bm, H-8/8'), 2,34 (1H, dd, H-7'), 2,37 (1H, dd, H-7), 2,48 (1H, dd, H-7'), 2,51 (1H, dd, H-7'), 3,77 (3H, s, OMe,C-3'), 3,81 (3H, s, OMe, C-3/5), 5,19 (1H, s, OH, C-4' o 5'), 5,21 (1H, s, OH, C-4' o 5'), 5,33 (1H, s, OH, C-4), 6,12 (1H, d, J=1.7, H-2'), 6,26 (2H, s, H-2/6), y 6,33 (1H, d, J= 1,8, H-6,) (13). La rotación específica fue de (α)𝐷24,3=−52° (c, 1,5, CHCl3), lo cual concuerda con los datos espectroscópicos con el compuesto sauriol B (14); mientras que el compuesto 4, mostró valores de RMN 1H (400 MHz, CDCl3) a δ: 6,83 (1H, d, J=7,8, H-5´), 6,72 (1H, d, J=7,9, H-5), 6,63 (1H, m, H-6´), 6,56 (1H, m, H-6), 6,52 (1H, m, H-2´), 6,67 (1H, d, J=1,5, H-2,), 5,92 (2H, s, O-CH2-O), 5,51 (1H, s, Ar-OH), 3,87 (3H, s, OMe), 2,56 (2H, dd, J=13,0, 6,6, H-7b, 7'b), 2,30 (1H, dd, J=14,5, 9,5, H- 7'a) , 2,38 (1H, dd, J=13,4, 8,3, H-7a), 1.76 (2H, m, H-8, 8'), 0,83 (3H, d, J=6,4, H-9'), 0,83 (3H, d, J=6,9, H-9) (11).
El compuesto 5, vitexina nombrada como 8-C-β-D-glucopiranosil-5,7,4'-trihidroxiflavona o apigenin-8-C-β-D-glucopiranósido, fue obtenida como un polvo amarillo, con un punto de fusión de 262-264°C y que dio positivo a las pruebas de análisis fitoquímico preliminar como son: prueba en medio básico (15) y por formación del complejo con AlCl3 (16, 17); permitiendo presumir preliminarmente que se trataba de un flavonoide. El análisis del espectro de RMN 1H (400 MHz, DMSO-d6) mostró un protón con multiplicidad en singlete a δ 13,14, que corresponde a un grupo hidroxilo quelatado ubicado en el carbono 5; que ligado a las señales a δ 6,75 (1H, s, H-6), δ 6.25 (1H, s, H-3), sugiere que se trata de un flavonoide. Se observa, también, un sistema de acoplamiento del tipo A2X2 de los protones ubicados a desplazamientos de δ 8,01 (2H, d, J= 8,6 Hz, H-2', 6'), y δ 6,86 (2H, d, J = 8,6 Hz, H-3',5') que son atribuibles a un grupo fenilo con sustituyentes para (-p). También se observan valores de desplazamiento a δ 6,75 (1H, s, H-6), δ 6,25 (1H, s, H-3), correspondiente a los hidrógenos especificados, y un protón anomérico a δ 4,66 (1H, d, J= 9,9 Hz, H-1'') cuyo valor de desplazamiento junto con la ausencia de las señales del hidrógeno anomérico de un O-glicósido; sugieren la presencia de un flavonoide C-glicósidado. El espectro también muestra una serie de señales a δ 3,19-3,98 que correspondería a una unidad de azúcar, que para nuestro caso es la glucosa (18-20).
El análisis de los datos espectroscópicos de RMN 1D para el compuesto mencionado anteriormente y la interpretación de los experimentos DEPT-135, DEPT-135, HMQC y HMBC confirman que el compuesto aislado es la vitexina (8-C-β-D-glucopiranosil-5,7,4'-trihidroxiflavona o apigenin-8-C-β-D-glucopiranósido) 5.
El compuesto 6, se presentó como un sólido con punto de fusión de 92°C (89-90°C, reportado) (21). Con base en las características complejas de las señales observadas en el espectro de RMN 1H en especial de la zona δ 0,7-2,35 ppm, indican que se trata de un compuesto del tipo esteroidal. En el mismo se observan a campo alto algunas señales como a δ 0,71 ppm (s, 3H) que es generada por el grupo metilo de la posición 18; a δ 1,05 ppm (s, 3H) para el grupo metilo ubicado en la posición 19, a δ 0,95 ppm (d, 3H) para el grupo metilo ubicado en la posición 21; también muestra un multiplete ancho a campo bajo en el rango δ 2,2-2,35 ppm (para dos protones) generado por el sistema (-CH2-CO-) y la señal del protón vinílico (como un singlete ancho) a δ 5,72 ppm correspondiente al sistema (-CO-CH=C). Por su parte el análisis del espectro de RMN 13C, presentó valores de desplazamientos a δ 123,6 ppm que es consistente con la insaturación ubicada en el carbono 4 (C4), a δ 171,5 ppm con el carbono de la posición beta (5 ppm con el carbono de la posición beta (β-C) del sistema α, β-insaturado; mientras que el carbono con el grupo carbonilo aparece a δc 199,49 ppm (22, 23). El EIMS del compuesto mostró un m/z (intensidad relativa) a 412 (M+) como un ion molecular consistente con la fórmula molecular (C29H48O). El espectro de masas del compuesto con un peso molecular de 412 sugiere que este es un 4-3-ceto esteroide y adicionalmente los picos fuertes a m/z 124 (100%) el cual resulta del rompimiento del anillo B. Otras fragmentaciones observadas en el espectro de masas del compuesto incluye fragmentos a m/z 398 (M-15)+ (18), 370 (M-42)+ (4.5), 289 (M-124)+ (10), y 124 (100), entre otros, que resultan de la fisión de enlaces alílicos. Por lo tanto estos resultados y los valores de desplazamiento de RMN que son consistente con la literatura, permiten sugerir que el compuesto debe ser estigmast-4-en-3-ona 6 (21).
La mezcla sitosterol 7 /estigmasterol 8 (en proporción 80/20), se presentó como un sólido de color blanco, dando positivo tanto a la prueba del nitrato amónico cérico en dioxano como a las reacciones de Salkowski y de Liebermann-burchard (24). El análisis de los datos espectroscópicos de esta mezcla muestran algunos valores representativos para estos compuestos, por ejemplo, para el sitosterol 7, a δH 3.25 (tdd, J=4,5, 1,1) que correspondería al hidrógeno ubicado en la posición 3 (H-3), un protón olefínico (H-6) que se presenta como un multiplete a δH= 5,14, dos protones olefínicos que aparecen a campo bajo (δH 4,14, m) y a (δH=4,61, m) parecidos a los del estigmasterol 8. No obstante, este último (estigmasterol) presente en la mezcla mostró señales a δH 3,29 con multiplicidad de un triplete de un doble de doble (J=4,5, 1,1) y un protón olefínico similar al anterior compuesto. En la mezcla se observan señales que se solapan en algunos casos y que pertenecen a estos compuesto como son: δH = 1,07, 1,26, 0,91, 1,01, 1,00, 0,97, 1,16, 1,25 y que de acuerdo a la literatura los valores δH =1.16, 1.25 deben ser del estigmasterol 8 y δH =1,07, 1,00 y 0,97 deben corresponder al sitosterol 7 (25). El análisis del espectro de masas permite ubicar un pico a m/z 414 y otro a m/z 367, lo cual sugiere que se trata de una mezcla de dos compuestos con peso molecular 414 y 412; mientras que los picos a m/z 271 y m/z 273 (por la formación de un carbocatión) se explica por la fisión del enlace beta (β), que luego de la deshidratación de este ultimo daría el pico a m/z 255. Sucesivas dealquilaciones de este explican la presencia de otros picos, por ejemplo, a 188, 189, 175, etc. (24).
En la especie N. turbacensis se ha reportado previamente la presencia de lignanos del tipo 2,6-diarilfurofuranos, tales como: (+)-sesamina, (+)-demetoxiexcelsina, (+)-piperitol, (+)-metoxipiperitol y (1R,2S,5R)-2-(3'-metoxi-4',5'-metilenodioxifenil)-3,7-dioxa-6-oxobiciclo(3.3.0)octano aislados de madera y de corteza tronco (26). Sin embargo, este es el primer reporte de este tipo de metabolitos secundarios tanto en la especie como en el género; contribuyendo al estudio fitoquímico del género; y donde el aislamiento, de lignanos, como los aislados en el presente trabajo, está en concordancia con las implicaciones quimiotaxonómicas planteadas por Rohwer, que propone que los compuestos del tipo fenilpropanoides y productos de dimerización (lignanos y neolignanos) corresponden a los metabolitos secundarios más comunes en el género Nectandra (9).
Conclusiones
Del extracto etanólico de corteza de la especie Nectandra turbacensis, se lograron aislar cuatro lignanos del tipo diarildimetilbutano (ácido meso-dihidroguayarético 1, y ácido treo-dihidroguayarético 2, sauriol B 3, treo-austrobailignano-6 4, un flavonoide (vitexina 5) y tres compuestos de tipo esteroidal (estigmast-4-en-3-ona 6 y la mezcla sitosterol 7 /estigmasterol 8); los cuales fueron determinados y elucidados mediante la utilización de técnicas espectroscópicas 1D y 2D, IR, y EM. Se considera importante el estudio de otras partes estructurales (raíces y hojas, por ejemplo) de la especie como forma de presentar su estudio fitoquímico completo; y adicionalmente, dada la gran diversidad de metabolitos, reportados en el género, plantear la posibilidad de ensayos biológicos como forma de complementar la investigación fitoquímica.
Agradecimientos
Los autores agradecen al laboratorio de Resonancia Magnética Nuclear de la Universidad Nacional de Colombia-Sede Bogotá, por la toma de los espectros; al Profesor Eduino Carbonó por la asistencia en la recolección e identificación preliminar de la muestra vegetal; al Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, en especial al biólogo Adolfo Jara Muñoz, por la confirmación en la identificación de la muestra vegetal y al grupo de Química Orgánica y Medicinal de la Universidad Jaume I, Castellón de la Plana, España; por sus orientaciones académicas.
Referencias
1. Pomilio, A.B. Investigación en Química de Productos Naturales en Argentina: Vinculación con la Bioquímica. Acta Bioquím. Clín. Latinoam. 2012, 46(1): 73-82. [ Links ]
2. Lee, K-H. Current Developments in the Discovery and Design of New Drug Candidates from Plant Natural Product Leads. J. Nat. Prod. 2004, 67: 273-283. [ Links ]
3. Barbosa-Filho, J.M.; Yoshida, M.; Gottlieb, O.R. Lignoids from Nectandra amazonum and N. Glabrescens. Phytochemistry 1989, 28(7): 1991. [ Links ]
4. Chérigo, L.; Polanco, V.; Ortega-Barria, E.; Heller, M.V.; Capson, T.L.; Rios, L.C. Antitrypanosomal activity of a novel norlignan purified from Nectandra lineata. Nat. Prod. Res. 2005, 19(4): 373-377. [ Links ]
5. Filho A.; Albuquerque, S.; Silva, M.; Eberlin, M.; Tomazela, D.; Bastos, J. Tetrahydrofuran Lignans from Nectandra megapotamica with Trypanocidal Activity. J. Nat. Prod. 2004. 67: 42-45. [ Links ]
6. Moreno, S.; Arnobio, A.; Carvalho, J.; Nascimento, A.; Timoteo, M.; Olej, B.; Rocha, E.; Pereira, M.; Bernardo-Filho, M.; Caldas, L. The ingestion of a Nectandra membranacea extract changes the bioavailability of technetium-99m radiobiocomplex in rat organs. Biol. Res. 2007. 40: 131-135. [ Links ]
7. Moro, J.; Fernandes, J.; Vieira, P.; Yoshida, M.; Gottlieb, O.; Gottlieb, H. Neolignans from Nectandra puberula. Phytochemistry. 1987. 26(1): 269-272. [ Links ]
8. Agius, B.; Setzer, M.; Stokes, S.; Walker, T.; Haber, W.; Setzer, W. Composition and bioactivity of essential oils of Lauraceae from Monteverde, Costa Rica. Int. J. Essen. Oil Ther. 2007. 1(14): 167-171. [ Links ]
9. Rohwer, J. Lauraceae: Nectandra. Flora Neotropica, Monograph 60. In: Flora Neotropica Monograph. Volume 60, edn. Ed. by Zanoni, T., New York: Garden TNYB. pp.1-332. 1993. [ Links ]
10. Josephy, P.; Van Damme, A. Reaction of Gibbs reagent with para-substituted phenols. Anal. Chem. 1984. 56(4): 813-814. [ Links ]
11. Guzmán, J.; Cuca, L.; Isaza, J. Fragmentación diastereoespecífica en NCI de dos lignanos dibencilbutánicos de la corteza de Dugan diodendron argyrotrichum (Magnoliaceae). Rev. Prod. Nat. 2008. 1: 6-12. [ Links ]
12. Miyazawa M, Kasahara H, Kameoka H: O-demethylation of meso-dimethyl dihydroguaiaretic acid in Spodoptera litura. Phytochemistry. 1997. 46(7): 1173-1175. [ Links ]
13. Kubanek, J.; Fenical, W.; Hay, M.E.; Brown, P.J.; Lindquist, N. Two antifeedant lignans from the freshwater macrophyte Saururus cernuus. Phytochemistry. 2000. 54(3): 281-287. [ Links ]
14. Mori, N.; Watanabe, H.; Kitahara, T. Simple synthesis of enantiomerically pure sauriols A and B. Biosci. Biotechnol., Biochem. 2006. 70(7): 1750-1753. [ Links ]
15. Ajayi, I.; Ajibade, O.; Oderinde, R. Preliminary phytochemical analysis of some plant seeds. Res. J. Chem. Sci. 2011. 1(3): 58-62. [ Links ]
16. Mbaebie, B.; Edeoga, H.; Afolayan, A. Phytochemical analysis and antioxidants activities of aqueous stem bark extract of Schotia latifolia Jacq. APJTB. 2012. 2(2): 118-124. [ Links ]
17. Meda, A.; Lamien, C.E.; Romito, M.; Millogo, J.; Nacoulma, O.G. Determination of the total phenolic, flavonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity. Food Chem. 2005. 91(3): 571-577. [ Links ]
18. Kim, J.; Lee, B.; Kim, J.; Sim, G.; Lee, D.; Lee, K.; Yun, Y.; Pyo, H. The isolation and antioxidative effects of vitexin from Acer palmatum. Arch. Pharmacal. Res. 2005. 28(2): 195-202. [ Links ]
19. Peng, X.; Zheng, Z.; Cheng, K-W.; Shan, F.; Ren, G-X.; Chen, F.; Wang, M. Inhibitory effect of mung bean extract and its constituents vitexin and isovitexin on the formation of advanced glycation endproducts. Food Chem. 2008. 106(2): 475-481. [ Links ]
20. Choo, C.; Sulong, N.; Man, F.; Wong, T. Vitexin and isovitexin from the Leaves of Ficus deltoidea with in-vivo α-glucosidase inhibition. J. Ethnopharmacol. 2012. 142(3): 776-781. [ Links ]
21. Alexander-Lindo, R.; Morrison, E.; Nair, M. Hypoglycaemic effect of stigmast-4-en-3-one and its corresponding alcohol from the bark of Anacardium occidentale (cashew). Phytother. Res. 2004. 18(5): 403-407. [ Links ]
22. Jamaluddin, F.; Mohameda, S.; Lajis, M. Hypoglycaemic effect of Stigmast-4-en-3-one, from Parkia speciosa empty pods. Food Chem. 1995. 54(1): 9-13. [ Links ]
23. Fernández, I.; Pedro, J.; Seoane, E. Constituents of a hexane extract of Phoenix dactylifera. Phytochemistry. 1983. 22(9): 2087-2088. [ Links ]
24. Kamboj, A.; Saluja, A. Isolation of stigmasterol and β-sitosterol from petroleum ether extract of aerial parts of Ageratum conyzoides (Asteraceae). Int. J. Pharm. Pharm. Sci. 2011. 3(1): 94-96. [ Links ]
25. Habib, M.; Nikkon, F.; Rahman, M.; Haque, Z.; Karim, M. Isolation of stigmasterol and ß-sitosterol from methanolic extract of root. Pak. J. Biol. Sci. 2007. 10(22): 4174-4176. [ Links ]
26. De Carvalho, M.; Yoshida, M.; Gottlieb, O.; Gottlieb, H. Lignans from Nectandra turbacensis. Phytochemistry. 1986. 26(1): 265-267. [ Links ]




![Photochemical and electrochemical studies on lanthanide complexes of 6-(hydroxymethyl) pyridine-2-carboxaldehyde[2-methyl-pyrimidine-4,6-diyl]bis-hydrazone](/img/en/prev.gif)