Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.43 no.2 Bogotá May 2014
https://doi.org/10.15446/rev.colomb.quim.v43n2.53118
DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v43n2.53118
Efecto del aceite esencial de Eucalyptus citriodora sobre el metabolismo energético mitocondrial
Essential oil Eucalyptus citriodora effect on mitochondrial energy metabolism
Efeito do óleo essencial de Eucalyptus citriodora sobre o metabolismo energético mitocondrial
Luis Carlos Vesga1,2, Yenny Bueno1,2, Elena E. Stashenko1,3,4, Stelia C. Mendez-Sanchez1,2,*
1 Escuela de Química, Facultad de Ciencias, Universidad Industrial de Santander, Bucaramanga, Colombia, Calle 9 carrera 27 Ciudad Universitaria Bucaramanga, Santander, Colombia. Tel-Fax: 57-7-6349069.
2 Grupo de Investigación en Bioquímica y Microbiología GIBIM. Colombia
3 Centro de Investigación en Biomoléculas CIBIMOL. Colombia
4 Centro Nacional de Investigaciones para la Agroindustrialización de Especies Vegetales Aromáticas Medicinales Tropicales CENIVAM. Colombia
* Autor para correspondencia: scmendez@uis.edu.co.
Article citation: Vesga. L. C.; Bueno, Y.; Stashenko, E. E.; Mendez-Sanchez, S. C. Efecto del aceite esencial de Eucalyptus citriodora sobre el metabolismo energético mitocondrial. Rev Colomb Quim. 2014. 43(2): 10-17. DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v43n2.53118
Recibido: 19 de junio de 2014. Aceptado: 22 de julio de 2014
Resumen
Con el fin de contribuir al conocimiento de su actividad a nivel celular, se evaluó el mecanismo de acción del aceite esencial de Eucalyptus citriodora (Fam. Myrtaceae) sobre la bioenergética mitocondrial, su efecto sobre la velocidad de consumo de oxígeno de mitocondrias energizadas (estados 3 y 4) y su coeficiente de control respiratorio (CCR). Además, se analizó la actividad de los complejos de la cadena respiratoria usando técnicas espectrofotométricas. Los resultados obtenidos indican que el aceite esencial de E. citriodora aumenta la velocidad del consumo de oxígeno en los estados 3 y 4, disminuye el CCR, desacopla la fosforilación oxidativa, aumenta la actividad de la citocromo c oxidasa y aumenta la actividad ATPasa en mitocondrias íntegras, a partir de la concentración de 10 µg/mL. Estos resultados sugieren que el aceite esencial o sus metabolitos afectan el funcionamiento normal del transporte de electrones de la cadena respiratoria y la síntesis de ATP.
Palabras Claves: Mitocondria, Eucalyptus, fosforilación oxidativa, citocromo c oxidasa.
Abstract
In order to contribute to the knowledge of its activity at the cellular level, the mechanism of action of the essential oil of Eucalyptus citriodora (Fam. Myrtaceae) on mitochondrial bioenergetics, the rate of oxygen consumption of energized mitochondria (states was assessed 3 and 4), and respiratory control ratio (CCR) were evaluated. The activity of the respiratory chain complexes was analyzed using spectrophotometric techniques. The results indicate that the essential oil of E. citriodora increases the rate of oxygen consumption in states 3 and 4, reduces the CCR, uncouples oxidative phosphorylation, increases the activity of cytochrome c oxidase, and increases the ATPase activity in mitochondria intact at concentrations ≥ 10 mg/mL. These results suggest that the essential oil or its metabolites affect the normal operation of the electron transport in the respiratory chain and ATP synthesis.
Keywords: Mitochondria, Eucalyptus, oxidative phosphorylation, cytochrome c oxidase.
Resumo
Com o fim de contribuir ao conhecimento da sua atividade a nível celular, foi avaliado o mecanismo de ação do óleo essencial de Eucalyptus citriodora (Fam. Myrtaceae) sobre a bioenergética mitocondrial, o efeito sobre a taxa de consumo de oxigênio de mitocôndrias energizadas (estados 3 e 4) e o coeficiente de controle respiratório (CCR). Usando técnicas espectrofotométricas, foi analisada a atividade dos complexos da cadeia respiratória. Os resultados obtidos indicam que o óleo essencial de E. citriodora aumenta a velocidade do consumo de oxigênio nos estados 3 e 4, reduz o CCR, desacopla a fosforilação oxidativa, aumenta a atividade da citocromo c oxidase e aumenta a atividade ATPase em mitocôndrias intatas, a partir da concentração de 10 µg / mL. Estes resultados sugerem que o óleo essencial ou seus metabolitos afetam o funcionamento normal do transporte de elétrons na cadeia respiratória e na síntese de ATP.
Palavras-chave: Mitocôndria, Eucalyptus, fosforilação oxidativa, citocromo c oxidase.
Introducción
El impacto y la importancia de los productos naturales son notables en la búsqueda de nuevos agentes químicos, orientados al descubrimiento de nuevos medicamentos (1). En la naturaleza se encuentran componentes activos que pueden ser útiles en la fabricación de nuevos modelos de fármacos contra una gran variedad de enfermedades (2). Con ayuda de los resultados científicos y la síntesis orgánica se han podido obtener compuestos con una mayor selectividad y actividad biológica, lo que ha contribuido al gran avance de la industria farmacéutica (3).
Una de la plantas empleadas tradicionalmente para el tratamiento de diversas enfermedades es el Eucalyptus citriodora, familia Myrtaceae, comúnmente conocida como eucalipto limón. Las mirtáceas son árboles ricos en aceites esenciales, incluyen cerca de unos 130 géneros y alrededor de 2900 especies, crecen en regiones tropicales y subtropicales (4). El género Eucalyptus tiene cerca de 700 especies, la mayoría oriundas de Australia. El eucalipto crece en casi todas las áreas tropicales y subtropicales, y se utiliza para tratar algunas enfermedades humanas y del ganado (5). Los extractos de eucalipto, el aceite y las hojas frescas se utilizan en tratamientos por inhalación del vapor, infusiones o se usan en baños para tratamientos como la mastitis (6, 7).
Muchas especies del género Eucalyptus presentan un gran número de actividades biológicas, por lo que son usadas para el tratamiento de diversas afecciones de la salud. Tradicionalmente, en muchos de los países de América Latina se emplea el extracto caliente de las hojas del eucalipto para el tratamiento de los síntomas presentados por infecciones respiratorias (8). E. citriodora presenta actividad antimicrobial, antioxidante y es un excelente pesticida natural (9–11); también, se ha reportado para el aceite vegetal actividad antifúngica, antiséptica, antiespasmódica (8), antiviral y actividad antioxidante (10), entre otras (11). En ganado, el aceite esencial de E. citriodora ha demostrado actividad contra la mastitis y ha sido usado para el tratamiento preventivo contra la endometritis (6); éste se emplea actualmente en una gran cantidad de productos cosméticos, farmacéuticos y en alimentos (12, 13). Estas actividades han sido atribuidas a sus metabolitos secundarios (14). El aceite esencial de E. citriodora está compuesto principalmente de citronellal (60%), β-citronellol (12%) y 1,8-cineol (2%) (10).
La mitocondria regula los niveles de ATP celular, controla los picos de calcio citoplasmático, mantiene el balance redox de la célula, así como otros procesos metabólicos; es el común denominador de muchos de los procesos de muerte celular tanto apoptótica como necrótica (15, 16). Esto la convierte en una diana biológica de gran importancia para el estudio de la actividad biológica de aceites esenciales y búsqueda de nuevos fármacos (17–19). A pesar de los reportes de propiedades farmacológicas del aceite esencial de E. citriodora, poco se conoce sobre su mecanismo de acción (20). Por consiguiente, es necesario estudiar el efecto del aceite esencial de E. citriodora sobre la bioenergética mitocondrial, en particular lo relacionado con los estados 3 y 4, el coeficiente de control respiratorio (CCR) y la cadena respiratoria mitocondrial.
Materiales y métodos
Animales
Ratas machos albinas de raza Wistar WI IOPS AF/Han, de peso aproximado 180-210 g, fueron obtenidas del Bioterio de la Facultad de Salud de la Universidad Industrial de Santander. Los animales fueron sometidos a ayuno durante 12 h y posteriormente, fueron sacrificados por decapitación; para el desarrollo de esta investigación, se cumplieron las disposiciones Colombianas de la Ley 84 de 1989 de investigación con animales.
Obtención del aceite esencial
Todas las plantas usadas en este estudio fueron colectadas en el Departamento de Santander, Colombia. El material fue identificado hasta el nivel de especie y una muestra fue depositada en el herbario nacional (Bogotá-Colombia).
El aceite esencial de E. citriodora se obtuvo por hidrodestilación asistida por microondas, según el protocolo reportado por Stashenko et al. (21). La unidad de hidrodestilación se colocó en un horno de microondas doméstico (2,45 GHz, 800 W) con un agujero en un lado, por el cual se conectó un condensador de vidrio al matraz de fondo redondo que contenía el material vegetal (500 g) y el agua (0,2 L). La unidad se hizo funcionar durante 30 min a la máxima potencia, lo que causó que el agua hirviera vigorosamente manteniendo el reflujo. El aceite esencial se acumuló en una trampa Dean-Stark; más tarde se decantó del condensado y se secó con sulfato de sodio anhidro.
Determinación de los compuestos mayoritarios
Para determinar la composición química del aceite esencial se usó un cromatógrafo de gases de alta resolución Agilent Technologies, modelo GC 6890 Series PLUS MSD. El cromatógrafo estaba equipado con una columna capilar HP-5 MS (30 m × 0,25 mm ID × 0,25 m, df), acoplado a un detector selectivo de masas (MSD) Agilent Technologies MSD 5973. Para la detección por cromatografia de gases acoplada a espectrometría de masas (GC-MS) se utilizó un sistema de ionización por impacto de electrones a 70 eV. Se usó helio (99,995%) como gas de arrastre a una velocidad de 1 mL/min. Las temperaturas del inyector de la línea de transferencia se fijaron en 250 y 285 °C, respectivamente. La temperatura de la columna se fijó a 50 °C, luego se incrementó gradualmente hasta 150 °C, a una velocidad de 3 °C/min; se mantuvo durante 10 min, y finalmente, se incrementó a 250 °C a una velocidad de 10 °C/min. Las muestras diluidas (1:20 v/v en CH2Cl2) se inyectaron (1 μL) en el modo splitless. Los componentes fueron identificados por comparación de sus índices de retención lineales y los espectros de masas con los de compuestos estándar, usando las bases de datos NIST, Wiley y ADAMS.
Aislamiento de mitocondrias de hígado de rata
Se aislaron mitocondrias de hígado de rata siguiendo el procedimiento descrito por Voss et al. (22), con algunas modificaciones. Se utilizó como medio de aislamiento: D-manitol 250 mmol/L, HEPES 10 mmol/L, pH 7,2, EGTA 1 mmol/L y BSA 0,1% p/v (Sigma-Aldrich, St. Louis, MO, USA). El hígado fue inmediatamente retirado e inmerso en medio de extracción a 4 ºC. Después de lavado, el órgano fue cortado y homogeneizado mediante un homogeneizador Van Potter Elvehjen. La suspensión obtenida se centrifugó a 600 x g a 4 ºC durante 5 min. El sedimento fue descartado y el sobrenadante centrifugado a 7000 x g durante 10 min a 4 ºC. El sedimentado obtenido, constituido de mitocondrias intactas, fue resuspendido y lavado dos veces en medio de extracción por centrifugación a 8100 x g durante 10 min a 4 ºC. Las mitocondrias obtenidas fueron resuspendidas en medio de extracción y mantenidas para su uso inmediato a 4 ºC o congeladas a -70 °C.
Determinación de la concentración de proteínas mitocondriales
La cuantificación de proteínas se llevó a cabo espectrofotométricamente por el método descrito por Bradford et al. (23). En este ensayo se diluyen alícuotas de las mitocondrias en agua desionizada, en este medio hipotónico las mitocondrias se hinchan y estallan. Se usó albumina de suero bovino como proteína estándar.
Determinación del consumo de oxígeno
Se usaron mitocondrias intactas de hígado de rata aisladas tal como se describió anteriormente. El medio de incubación estaba compuesto de: HEPES 10 mmol/L (pH 7,4), EGTA 0,1 mmol/L, manitol 125 mmol/L, KCl 65 mmol/L y suplementadas con glutamato de sodio 5 mmol/L y ácido málico 2,5 mmol/L o succinato de sodio 3 mmol/L, fosfato inorgánico (Pi) 1,6 mmol/Ly ADP 0,6 mmol/L (Sigma-Aldrich,ST. Louis, MO, USA). Al suplementar las mitocondrias con succinato de sodio, se adicionó rotenona 1 µmol/L para inhibir el complejo I de la cadena respiratoria. El aceite de E. citriodora se disolvió en DMSO y se adicionó en diferentes concentraciones (10, 25, 50 y 100 µg/mL), manteniendo una concentración máxima de 0,5% del disolvente. Cada solución fue incubada durante dos min con la proteína mitocondrial antes de inducir la respiración.
Los experimentos fueron realizados bajo agitación constante en cámara termostatizada a 28 °C (24). El consumo de oxígeno para las mitocondrias intactas fue determinado por medio de un oxígrafo marca Hansatech, utilizando un electrodo tipo Clark. Los resultados fueron expresados en nmol de O2 consumido/min/mg de proteína considerándose la solubilidad del oxígeno en agua a la temperatura usada y a una atm (26).
Preparación de la suspensión de mitocondrias para la determinación de la actividad de las enzimas mitocondriales
Las mitocondrias aisladas fueron congeladas a -70 °C y la suspensión mitocondrial fue sometida a un baño de ultrasonido (Elmasonic E30H), usando una frecuencia de 37 kHz por diez min, y mantenidas a 4 °C en baño de hielo hasta la realización de las pruebas enzimáticas. Las mitocondrias fragmentadas resultantes de este proceso fueron usadas como fuente del sistema transportador de electrones.
Determinación de la actividad de las enzimas relacionadas con la cadena respiratoria mitocondrial
La actividad enzimática de la NADH y succinato oxidasa fueron determinadas polarográficamente en un oxígrafo Hansatech. Las actividades de la NADH-deshidrogenasa (NADH: ubiquinona oxidoreductasa) y succinato deshidrogenasa se establecieron espectrofotométricamente, según el método descrito por Singer (24). Las actividades de la NADH citocromo c reductasa (NADH: citocromo c oxidoreductasa) y succinato citocromo c reductasa (succinato: citocromo c oxidoreductasa) fueron medidas por reducción del citocromo c a 550 nm, tal como lo describe Somlo (25). La actividad de la citocromo c oxidasa fue determinada a 550 nm, según la metodología descrita por Mason y colaboradores (26). La actividad de la ATPasa en mitocondrias íntegras y fragmentadas fue evaluada, según la metodología descrita por Pulmann et al. (27). Para esta última, el Pi fue tomado del sobrenadante de la reacción siguiendo el método de Summer (28); los resultados se expresaron como nmol de Pi liberado/mg de proteína/min. La actividad ATPasa de mitocondrias íntegras fue evaluada a temperatura ambiente en presencia y ausencia de FCCP 1 μM.
Análisis estadístico
Los datos son presentados como la media ± DS. El análisis estadístico de los datos fue realizado como un análisis de varianza, seguida por el test de Tukey para la comparación de promedios. Los resultados fueron considerados estadísticamente significativos cuando p<0,05.
Resultados y discusión
Obtención y caracterización del aceite esencial de E. citriodora
El aceite esencial obtenido por hidrodestilación tuvo un rendimiento de 0,9%, densidad de 0,857 g/ml y contenido de compuestos mayoritarios así: citronelal (49,3%), citronelol (13,0%), α-humuleno (12,9%), β-pineno (4,8%), 1,8-cineol (3,4%) y linalool (2,9%).
A continuación se describen los resultados obtenidos al evaluar concentraciones del aceite esencial de 10, 25, 50 y 100 µg/mL/mg de proteína mitocondrial sobre el metabolismo energético. Todos los resultados fueron expresados como porcentaje en relación al control.
Efecto del aceite esencial de E. citriodora sobre la bioenergética mitocondrial
El efecto del aceite esencial de E. citriodora se evaluó en mitocondrias íntegras bajo los siguientes parámetros de la respiración mitocondrial: consumo de oxígeno en presencia de ADP (estado 3), velocidad del consumo de oxígeno después del agotamiento del ADP (estado 4) y coeficiente de control respiratorio (CCR). Cada uno de estos parámetros fue evaluado con dos sustratos independientes, una mezcla de glutamato-malato (5,0 mM–2,5 mM) y succinato 3 mM, ambos sustratos son adecuados para la evaluación de los complejos I y II de la cadena respiratoria mitocondrial, respectivamente. Para la realización de todos los ensayos, el aceite se incubó durante dos minutos con la suspensión mitocondrial, antes de la adición de sustrato.
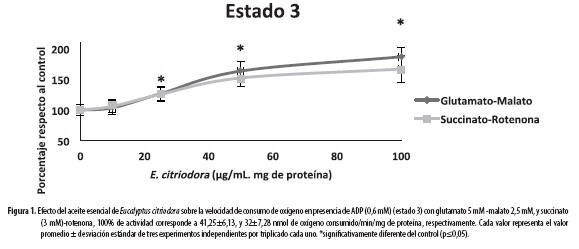
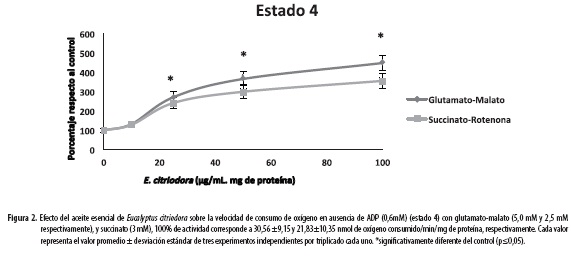
En la Figura 1 se compara el consumo de oxígeno en mitocondrias íntegras con los dos sustratos para el estado 3 en presencia de ADP. Los resultados muestran que la adición del aceite, en las concentraciones anteriormente citadas, causa un aumento en la velocidad del consumo de oxígeno, el aumento fue estadísticamente significativo a partir de la concentración de 25 µg/mL/mg de proteína mitocondrial con un porcentaje desde 120 a 190% para glutamato-malato y un aumento desde 120 a 170% para succinato, siendo mayor la velocidad de consumo para la concentración de 100 µg/mL/mg de proteína para los dos sustratos. En la Figura 2 se muestran los resultados para el consumo de oxígeno en ausencia de ADP (estado 4). Se observa que la adición del aceite esencial causa un aumento dosis dependiente en el estado 4 para ambos sustratos, y estadísticamente significativo a partir de la concentración de 25 µg/mL, con un porcentaje desde 250 a 325% para la mezcla glutamato-malato y 200 a 255% para el succinato.
El aceite genera un aumento en la velocidad de consumo de oxígeno dosis dependiente para los dos sustratos, tanto en el estado 3 como en el estado 4, siendo mayor el aumento para este último; en ambos sustratos se vieron resultados estadísticamente significativos a partir de la concentración de 25 µg/mL/mg de proteína mitocondrial; el estado 4, que se reporta aquí, obedece a un estado 4 aproximado debido a que no se observaban claras diferencias entre las velocidades del estado 3 y del estado 4, lo que sugiere que el aceite tiene una posible actividad desacoplante entre el sistema respiratorio y la ATPasa sintasa (29).
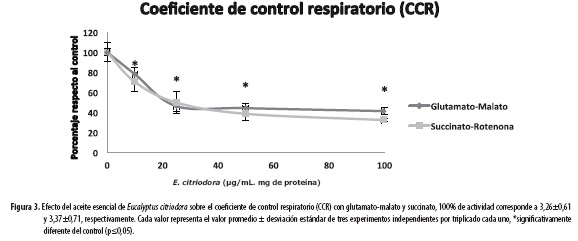
Como se mencionó anteriormente, el aceite esencial de E. citriodora genera un aumento en la taza de consumo de oxígeno tanto para el estado 3 como para el estado 4 con los dos sustratos suministrados; este aumento del consumo de oxígeno para el estado 4, ocasiona que el coeficiente de control respiratorio disminuya considerablemente. Tal como se muestra en la Figura 3, el CCR decae a medida que aumenta la concentración de aceite, siendo mayor la caída en presencia de succinato (∼32%) que con glutamato-malato (∼20%), para ambos sustratos a partir de la concentración de 10 µg/mL/mg de proteína mitocondrial. Esta reducción implica una disminución en el acople de la cadena respiratoria y la producción de ATP en la mitocondria.
Efecto del aceite sobre las enzimas de la cadena respiratoria mitocondrial
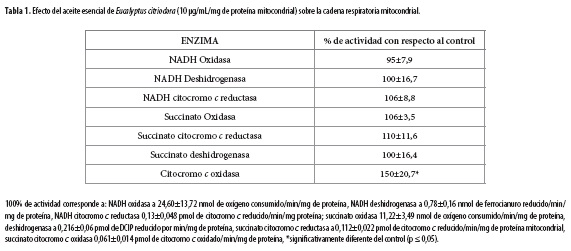
Con el estudio con mitocondrias fragmentadas se describen los efectos generados por el aceite esencial de E. citriodora sobre la cadena respiratoria. Para esto se utilizó únicamente la concentración de aceite de 10 µg/mL/mg de proteína mitocondrial, ya que fue la menor concentración con la cual se obtuvieron resultados estadísticamente significativos en el CCR. Los resultados obtenidos (Tabla 1) para la actividad enzimática muestran que el complejo respiratorio que sufrió cambios significativos en su actividad, fue la citocromo c oxidasa, pues su actividad aumentó alrededor de un 50% con respecto al control.
Los resultados observados sobre las actividades de los complejos de la cadena respiratoria sugieren que el aumento en la velocidad de consumo de oxígeno en estado 3 (a partir de 25 µg/mL/mg de proteína mitocondrial), podría estar relacionado con el aumento de la actividad de la citocromo c oxidasa, observado a partir de la concentración de 10 µg/mL/mg de proteína mitocondrial. Aunque a esta concentración no se observan cambios significativos en los estados 3 y 4, este comportamiento puede estar relacionado con la mayor disponibilidad del aceite esencial en las mitocondrias fragmentadas con las que se realizan los análisis de enzimas. Esto contrasta con la dificultad del aceite para atravesar la membrana en las mitocondrias íntegras, además se observan efectos sobre la fosforilación oxidativa a concentraciones bajas (30). Sin embargo, esto no explica el aumento de la velocidad en el estado 4, lo que sugiere que el efecto del aceite sobre la citocromo c oxidasa, puede comportarse como un ionóforo o un agente desacoplador de la síntesis de ATP (31).
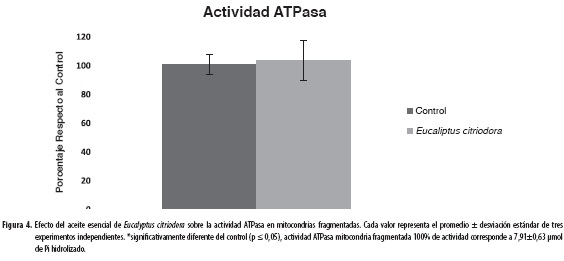
Actividad ATPasa
Para el análisis de la enzima ATPasa se hicieron dos estudios por separado: en el primer ensayo, se trabajó con mitocondrias fragmentadas (Figura 4) y, en el segundo, con mitocondrias íntegras (Figura 5); en ambos casos, se cuantificó el fosfato liberado por la hidrólisis del ATP. En el ensayo con mitocondrias fragmentadas no se observó un efecto significativo en la actividad enzimática. Sin embargo, con mitocondrias íntegras el aceite produjo un aumento del 50% en la actividad ATPasa respecto al control, incrementando la cantidad de fosfato hidrolizado y dañando el potencial de membrana de la mitocondria; lo anterior indica que el aceite desacopla la fosforilación oxidativa.
En el último ensayo se usó el ionóforo FCCP (carbonyl cyanide p(trifluoromethoxy) phenylhydrazone) para confirmar el aumento de la actividad ATPasa en presencia de un desacoplante. El efecto del FCCP sugiere que el aceite de E. citridora induce el transporte de protones hacia la matriz mitocondrial, esto afecta el potencial de membrana que se requiere para el acoplamiento entre el transporte de electrones y la fosforilación oxidativa. Diversos estudios comprueban que los agentes desacoplantes poseen actividad anticancerígena, el FCCP induce apoptosis en células Calu-6 por activación de las caspasas 3, 6 y 9 (32) e induce efectos citotóxicos en células PC12 (15), el fipronil reduce la viabilidad de células de neuroblastoma (33), al igual, que el nemorosone frente a células de hepatocarcinoma humano HEP G2 (34). Además, el desacoplamiento mitocondrial puede generar permeabilización de la membrana interna, lo que podría permitir la liberación del citocromo c y la posterior activación de caspasas (35, 36). De este modo, los resultados sugieren que los agentes desacoplantes como el aceite esencial de E. citridora, son potenciales agentes antitumorales (37).
Los resultados obtenidos en este estudio muestran que el aceite esencial de E. citridora afecta los estados 3 y 4 y la actividad de la cito-cromo c oxidasa. De acuerdo con los resultados mostrados en la Tabla 1 y tal y como lo mencionan Azzone et al. (38) se infiere que el aumento en la actividad de este complejo respiratorio implica una elevación en el flujo de electrones a través de la cadena transportadora de electrones, generando un desacoplamiento intrínseco o extrínseco de la fosforilación oxidativa, Por otro lado, algunos estudios muestran que cambios en la actividad del complejo IV están relacionados directamente con un aumento en la velocidad de consumo de oxígeno en estado 3 (39).
Estos resultados despiertan un gran interés en el potencial farmaceútico del aceite de E. citridora, pues la disminución en la actividad de la citocromo c oxidasa se ha relacionado con varias patologías como la ataxia, la enfermedad de Alper, la enfermedad de Leber, las miopatías, la rabdomiólisis y la enfermedad de Leigh (40–42). De igual manera, en estudios recientes Du et al. (43) atribuyen la demencia vascular a una disminución en la actividad de la citocromo c oxidasa, a la pérdida en las funciones cognitivas y la memoria en ratas.
Asimismo, los avances en el conocimiento de la farmacología mitocondrial de las enfermedades neurodegenerativas han llevado al desarrollo de estudios sobre la activación de complejo IV y su acción sobre la enfermedad de Alzheimer, tal como lo muestran Atmna et al. (44), en su trabajo sobre la acción del azul de metileno sobre el complejo IV de la cadena respiratoria mitocondrial. Además, sugieren un mecanismo para el paso de electrones desde complejo I mediado por el azul de metileno, directamente hacia el citocromo c pasando al complejo de la citocromo c oxidasa (45). El aumento en la actividad de la citocromo c oxidasa, mediada por el aceite de E. citridora, y la activación de esta enzima, sugieren una alternativa terapéutica contra la enfermedad de Alzheimer (46). Estos resultados demuestran la importancia de evaluar el efecto del aceite de E. citridora, sus metabolitos o mezcla de ellos, para avanzar en el estudio sobre su efecto en la citocromo c oxidasa y el tratamiento de esta enfermedad.
Conclusiones
Se concluye con este estudio que el aceite esencial de E. citridora afecta el funcionamiento de la cadena respiratoria, disminuye el CCR, desacopla la fosforilación oxidativa, lo que se refleja en la velocidad de consumo de oxígeno, presenta un marcado aumento en la actividad del complejo IV de la cadena respiratoria y aumenta la actividad de la ATPasa en mitocondrias íntegras. Estos resultados contribuyen al avance en el entendimiento del mecanismo de acción de las diversas actividades farmacológicas reportadas para este aceite.
Agradecimientos
Este estudio fue soportado por "Patrimonio Autónomo Fondo Nacional de Financiamiento para la Ciencia, la Tecnología y la Innovación, Francisco José de Caldas, Contrato RC-0572-2012-Bio-Red-Co-CENIVAM".
Referencias
1. Koehn, F.; Carter, G. T. The Evolving Role of Natural Products in Drug Discovery. Nat. Rev. Drug Discov. 2005. 4: 206-220. [ Links ]
2. Salvador, J.; Moreira, V. Highlights of Natural Products in Prostate Cancer Drug Discovery. In prostate cancer; 2011; pp 463-482. [ Links ]
3. Nirmala, M. J.; Samundeeswari, A.; Sankar, P. D. Natural Plant Resources in Anti-Cancer Therapy. Res. plant Biol. 2011.1(3): 1-14. [ Links ]
4. Kumar, P.; Mishra, S.; Malik, A.; Satya, S. Compositional Analysis and Insecticidal Activity of Eucalyptus Globulus (family: Myrtaceae) Essential Oil against Housefly (Musca Domestica). Acta Trop. 2012. 122(2): 212-218. [ Links ]
5. Batish, D. R.; Singh, H. P.; Setia, N.; Kaur, S.; Kohli, R. K. Chemical Composition and Inhibitory Activity of Essential Oil from Decaying Leaves of Eucalyptus Citriodora. Z. Naturforsch. C. 2006. 61 (1-2): 52-56. [ Links ]
6. Hase, P.; Digraskar, S.; Ravikanth, K.; Dandale, M.; Maini, S. Management of Subclinical Mastitis with Mastilep Gel and Herbal Spray ( AV / AMS / 15 ). 2013. 2(4): 64-67. [ Links ]
7. Raut, J. S.; Karuppayil, S. M. A Status Review on the Medicinal Properties of Essential Oils. Ind. Crops Prod. 2014. 62: 250-264. [ Links ]
8. Silva, J.; Abebe, W.; Sousa, S. M.; Duarte, V. G.; Machado, M. I. L.; Matos, F. J. A. Analgesic and Anti-Inflammatory Effects of Essential Oils of Eucalyptus. J. Ethnopharmacol. 2003. 89(2-3): 277-283. [ Links ]
9. Luqman, S.; Dwivedi, G. R.; Darokar, M. P.; Kalra, A.; Khanuja, S. P. S. Antimicrobial Activity of Eucalyptus Citriodora Essential. Int. J. Es sent. Oil Ther. 2008. 2: 69-75. [ Links ]
10. Singh, H. P.; Kaur, S.; Negi, K.; Kumari, S.; Saini, V.; Batish, D. R.; Kohli, R. K. Assessment of in Vitro Antioxidant Activity of Essential Oil of Eucalyptus citriodora (lemon-Scented Eucalypt; Myrtaceae) and Its Major Constituents. LWT-Food Sci. Technol. 2012. 48(2): 237-241. [ Links ]
11. Batish, D. R.; Singh, H. P.; Kohli, R. K.; Kaur, S. Eucalyptus Essential Oil as a Natural Pesticide. For. Ecol. Manage. 2008. 256(12): 2166- 2174. [ Links ]
12. Gomes, M. R.; Felzenszwalb, I.; Paumgartten, F. J. R. Mutagenicity Testing of Camphor, 1,8-Cineole, Citral, Citronellal, Menthol and Terpineol with the Salmonella/microsome Assay. Genet. Toxicol. Environ. Mutagen. 1998. 416: 129-136. [ Links ]
13. Burt, S. Essential Oils: Their Antibacterial Properties and Potential Applications in Foods. Int. J. Food Microbiol. 2004. 94(3): 223-253. [ Links ]
14. Victoria, F. N.; Radatz, C. S.; Sachini, M.; Jacob, R. G.; Alves, D.; Savegnago, L.; Perin, G.; Motta, A. S.; Silva, W. P.; Lenardão, E. J. Further Analysis of the Antimicrobial Activity of Α-Phenylseleno Citronellal and Α-Phenylseleno Citronellol. Food Control. 2012. 23(1): 95-99. [ Links ]
15. Dispersyn, G.; Nuydens, R.; Connors, R.; Borgers, M.; Geerts, H. Bcl-2 Protects against FCCP-Induced Apoptosis and Mitochondrial Membrane Potential Depolarization in PC12 Cells. Biochim. Biophys. Acta-Gen. Subj. 1999. 1428(2-3): 357-371. [ Links ]
16. Jordán, J.; Ceña, V.; Prehn, J. H. M. Mitochondrial Control of Neuron Death and Its Role in Neurodegenerative Disorders. J. Physiol. Biochem. 2003. 59(2): 129-141. [ Links ]
17. Cullen, K. J.; Yang, Z.; Schumaker, L.; Guo, Z. Mitochondria as a Critical Target of the Chemotheraputic Agent Cisplatin in Head and Neck Cancer. J. Bioenerg. Biomembr. 2007. 39(1): 43-50. [ Links ]
18. Krähenbühl, S. Mitochondria: Important Target for Drug Toxicity? J. Hepatol. 2001. 34(2): 334-336. [ Links ]
19. Smith, R. A.; Hartley, R. C.; Cochemé, H. M.; Murphy, M. P. Mitochondrial Pharmacology. Trends Pharmacol. Sci. 2012. 33(6): 341-352. [ Links ]
20. Duh, P. Der; Chen, Z. T.; Lee, S. W.; Lin, T. P.; Wang, Y. T.; Yen, W. J.; Kuo, L. F.; Chu, H. L. Antiproliferative Activity and Apoptosis Induction of Eucalyptus citriodora Resin and Its Major Bioactive Compound in Melanoma B16F10 Cells. J. Agric. Food Chem. 2012. 60: 7866-7872. [ Links ]
21. Stashenko, E. E.; Jaramillo, B. E.; Martínez, J. R. Analysis of Volatile Secondary Metabolites from Colombian Xylopia Aromatica (Lamarck) by Different Extraction and Headspace Methods and Gas Chromatography. J. Chromatogr. A. 2004. 1025: 105-113. [ Links ]
22. Voss, D. O.; Campello, A. P.; Bacila, M. The Respiration Chain and the Oxidative Phosphorylation of Rat Brain Mitochondria. Biochem. Biophys. Res. Commun. 1961. 4(1), 48-61. [ Links ]
23. Bradford, M. M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal. Biochem. 1976. 72: 248-254. [ Links ]
24. Singer, T. Determination of the Activity of Succinate, NADH, Choline, and a-Glycerophosphate Dehydrogenases. Methods Biochem. Anal. 1974. 22: 123-175. [ Links ]
25. Somlo, M. Induction Des Lactico-Cytochrome c Reductases (d-et L-) de La Levure Aerobie Par Les Lactates (d- et L-). Biochim. Biophys. Acta-Gen. Subj. 1965. 97(2): 183-201. [ Links ]
26. Mason, T. L.; Poyton, R.; Wharton, D. C. Cytochrome c Pxidase Fron Bakers' Yeast. J. Biol. Chem. 1973. 248(4): 1346-1354. [ Links ]
27. Pullman, M. E.; Penefsky, H. S.; Datta, A.; Racker, E. Partial Resolution of the Enzymes Catalyzing Oxidative Phosphorylation: Purification and Properties of Souble, Dinitrophenol-Stimulated Adenosine Triphosphatase. J. Biol. Chem. 1960. 235: 3322-3329. [ Links ]
28. Dickman, S. R.; Bray, H. Colorimetric Determination of Phosphate Preparation of Reagents. Methods. 1940. 12(11): 665-668. [ Links ]
29. To, M.-S.; Aromataris, E. C.; Castro, J.; Roberts, M. L.; Barritt, G. J.; Rychkov, G. Y. Mitochondrial Uncoupler FCCP Activates Proton Conductance but Does Not Block Store-Operated Ca(2+) Current in Liver Cells. Arch. Biochem. Biophys. 2010. 495(2): 152-158. [ Links ]
30. Cristiane, M.; D'Arrigo, M.; Mandalari, G.; Castelli, F.; Sarpietro, M.; Micieli, D.; Venuti, V.; Bisignano, G.; Saija, A.; Trombetta, D. Interaction of Four Monoterpenes Cointained in Essential Oil with Model Membranes: Implications for Their Antibacterial Activity. J. Agric. Food Chem. 2007. 55: 6300-6308. [ Links ]
31. Pires, A. D. R. A.; de Oliveira, M. B. M.; Echevarria, A.; Silva, E. F.; Rocha, M. E. M.; Carnieri, E. G. S.; Martinez, G. R.; Noleto, G. R.; Cadena, S. M. S. C. Comparative Study of the Effects of 1,3,4-Thiadiazolium Mesoionic Derivatives on Energy-Linked Functions of Rat Liver Mitochondria. Chem. Biol. Interact. 2010. 186(1): 1-8. [ Links ]
32. Han, Y. H.; Kim, S. H.; Kim, S. Z.; Park, W. H. Carbonyl Cyanide P-(trifluoromethoxy) Phenylhydrazone (FCCP) as an O2(*-) Generator Induces Apoptosis via the Depletion of Intracellular GSH Contents in Calu-6 Cells. Lung Cancer. 2009. 63(2): 201-209. [ Links ]
33. Vidau, C.; González-Polo, R. A.; Niso-Santano, M.; Gómez-Sánchez, R.; Bravo-San Pedro, J. M.; Pizarro-Estrella, E.; Blasco, R.; Brunet, J.L.; Belzunces, L. P.; Fuentes, J. M. Fipronil Is a Powerful Uncoupler of Oxidative Phosphorylation That Triggers Apoptosis in Human Neuronal Cell Line SHSY5Y. Neurotoxicology. 2011. 32(6): 935-943. [ Links ]
34. Pardo-Andreu, G. L.; Nuñez, Y.; Tudella, V. G.; Cuesta-Rubio, O.; Rodrigues, F. P.; Pestana, C. R.; Uyemura, S. A.; Leopoldino, A. M.; Alberici, L. C.; Curti, C. The Anti-Cancer Agent Nemorosone Is a New Potent Protonophoric Mitochondrial Uncoupler. Mitochondrion. 2011. 11(2): 255-263. [ Links ]
35. Kantrow, S. P.; Piantadosi, C. A. Release of Cytochrome c from Liver Mitochondria during Permeability Transition. Biochem. Biophys. Res. Commun. 1997. 232(3): 669-671. [ Links ]
36. Morin, D.; Pires, F.; Plin, C.; Tillement, J. P. Role of the Permeability Transition Pore in Cytochrome C Release from Mitochondria during Ischemia-Reperfusion in Rat Liver. Biochem. Pharmacol. 2004. 68(10): 2065-2073. [ Links ]
37. Bhagat, M.; Sharma, V.; Saxena, A. K. Anti-Proliferative Effect of Leaf Extracts of Eucalyptus Citriodora against Human Cancer Cells in Vitro and in Vivo. Indian J. Biochem. Biophys. 2012. 49(December):451-457. [ Links ]
38. Azzone, G. F.; Zoratti, M.; Petronilli, V.; Pietrobon, D. The Stoichiometry of H+ Pumping in Cytochrome Oxidase and the Mechanism of Uncoupling. J. Inorg. Biochem. 1985. 23(3-4): 349-356. [ Links ]
39. Paradies, G.; Ruggiero, F. M.; Petrosillo, G.; Quagliariello, E. Enhanced Cytochrome Oxidase Activity and Modification of Lipids in Heart Mitochondria from Hyperthyroid Rats. Biochim. Biophys. Acta-Mol. Basis Dis. 1994. 1225(2): 165-170. [ Links ]
40. Shamoto, M. N.; Wakako M. M. Oxidative Stress in Mitochondria: The Involvement in Neurodegenerative Diseases. In; 2005; pp 423-444. [ Links ]
41. Riederer, P.; Mandel, M. Y. S. Profiling in Parkinson's Disease: In; 2007; pp 62-76. [ Links ]
42. Maruszak, A.; Żekanowski, C. Mitochondrial Dysfunction and Alzheimer's Disease. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2011. 35(2): 320-330. [ Links ]
43. Du, J.; Ma, M.; Zhao, Q.; Fang, L.; Chang, J.; Wang, Y.; Fei, R.; Song, X. Mitochondrial Bioenergetic Deficits in the Hippocampi of Rats with Chronic Ischemia-Induced Vascular Dementia. Neuroscience. 2013. 231: 345-352. [ Links ]
44. Atamna, H.; Kumar, R. Protective Role of Methylene Blue in Alzheimer's Disease via Mitochondria and Cytochrome c Oxidase. J. Alzheimers. Dis. 2010. 20 Suppl 2, S439-S452. [ Links ]
45. Atamna, H.; Nguyen, A.; Schultz, C.; Boyle, K.; Newberry, J.; Kato, H.; Ames, B. N. Methylene Blue Delays Cellular Senescence and Enhances Key Mitochondrial Biochemical Pathways. FASEB J. 2008. 22(3): 703-712. [ Links ]
46. Siddique, Y. H.; Mujtaba, S. F.; Jyoti, S.; Naz, F. GC-MS Analysis of Eucalyptus Citriodora Leaf Extract and Its Role on the Dietary Supplementation in Transgenic Drosophila Model of Parkinson's Disease. Food Chem. Toxicol. 2013. 55: 29-35. [ Links ]