Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.44 no.3 Bogotá Sept./Dec. 2015
https://doi.org/10.15446/rev.colomb.quim.v44n3.55604
DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v44n3.55604
Producción de ácido láctico a partir del lactosuero utilizando Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophilus
Production of lactic acid from whey using Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus
Produção de ácido láctico de soro de leite coalhado usando Lactobacillus delbrueckii subsp. bulgaricus e Streptococcus thermophilus
Adriana M. Rojas1, Liceth P. Montaño1, Marlon J. Bastidas2,*
1 Grupo Energías Alternativas y Biomasa (GEAB), Universidad Popular del Cesar, Sede Hurtado, Colombia
2 Grupo Desarrollo de Estudios y Tecnologías Ambientales del Carbono, Universidad de La Guajira, km 5 vía a Maicao.
* Autor para correspondencia: marlonjoseb@uniguajira.edu.co. Tel +57 (5) 7282729 ext. 221
Article citation:
Rojas, A.M.; Montaño, L.P.; Bastidas, M.J. Producción de ácido láctico a partir del lactosuero utilizando Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophilus. Rev. Colomb. Quim. 2015, 44 (3), 5-10. DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v44n3.55604
Recibido: 30 de septiembre de 2015. Aceptado: 17 de noviembre de 2015.
Resumen
El objetivo principal de esta investigación fue determinar las condiciones adecuadas de crecimiento del Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophilus para la producción de ácido láctico, utilizando como sustrato lactosuero proveniente del departamento del Cesar, Colombia. El ácido láctico es producto de la extracción y purificación de caldos de fermentación donde se usa como bacterias fermentativas el co-cultivo Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophilus, usualmente usadas para la producción de yogurt. El sustrato es suplementado con extracto de levadura, fosfato de amonio como fuente de nitrógeno y carbonato de calcio como neutralizante. Esto con el fin de optimizar el consumo, por parte de las bacterias, del carbohidrato principal presente en el suero (lactosa). Durante la fermentación se controló la concentración del inóculo y temperatura, el tiempo máximo fue 72 h. La purificación se llevó a cabo mediante esterificación, filtración de sólidos formados con la reacción y extracción de agua por evaporación y posterior arrastre con nitrógeno. Finalmente se obtuvo ácido láctico con un 78,0% de pureza (36,7 g/L), el cual se caracterizó a través de espectroscopía infrarroja.
Palabras clave: ácido láctico, lactosuero, bacterias acido lácticas, Lactobacillus delbrueckii, Streptococcus thermophilus.
Resumo
O principal objetivo desta pesquisa foi determinar as condições adequadas de crescimento do Lactobacillus delbrueckii subsp. bulgaricus e Streptococcus thermophilus para a produção de ácido láctico utilizando como substrato soro de leite obtido do Departamento do Cesar, Colômbia. O ácido láctico é um produto da extração e purificação de caldos de fermentação, no qual são usadas como bactérias fermentativas Lactobacillus delbrueckiisubsp. bulgaricus e Streptococcus thermophilus, normalmente usadas para a produção de iogurte. O substrato é suplementado com extrato de levedura, fosfato de amonio como fonte de nitrogênio e de carbonato de cálcio como um neutralizador, para optimizar o consumo, pelas bactérias, do principal hidrato de carbono presente no soro (lactose). Durante a fermentação os seguintes fatores foram controlados: concentração do inóculo e temperatura, e atingiu num máximo de 72 h. A purificação foi efetuada por esterificação, filtração dos sólidos formados com a reação e remoção de água por evaporação e varrimento com nitrogênio. Finalmente o ácido láctico foi obtido com 78,0% de pureza (36,7 g/L), e foi caracterizado por espectroscopia de infravermelho.
Palavras-Chave: ácido láctico, soro de leite coalhado, bactérias de ácido láctico, Lactobacillus delbrueckii, Streptococcus thermophilus.
Abstract
The main objective of this research was to determine the proper growth conditions of Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus for the production of lactic acid using serum as substract. This serum was obtain from the department of Cesar, Colombia. Lactic acid is the result of the extraction and purification of fermentation broths in which bacteria Lactobacillus delbrueckii subsp bulgaricus and Streptococcus thermophilus are used, which are usually used for the production of yogurt. The substrate was supplemented with yeast extract, ammonium phosphate as a nitrogen source, and calcium carbonate as a neutralizer, in order to optimize the consumption, by the bacteria, of the main carbohydrate present in serum (lactose). During the fermentation (up to 72 h) the inoculums concentration, and temperature were controlled. Purification consisted in esterification, filtration of solids formed during the reaction, and removing of water by evaporation and nitrogen influx. Finally, lactic acid was obtained with 78,0% purity (36.7 g/L), which was characterized by infrared spectroscopy.
Keywords: lactic acid, whey, lactic acid bacteria, Lactobacillus delbrueckii, Streptococcus thermophilus.
Introducción
En las últimas décadas ha aumentado la preocupación por la conservación del ambiente tanto en las industrias como en las actividades urbanas debido a los crecientes efectos que ha causado la emisión de contaminantes al aire, agua y suelo. El agua potable, a pesar de ser una de las matrices más importantes para la preservación de la humanidad, se contamina indiscriminadamente por las actividades antrópicas, llevando a los investigadores a buscar metodologías eficientes para su recuperación (1).
El sector industrial lácteo es uno de los mayores contaminantes del agua, especialmente en la elaboración de quesos, debido al componente residual denominado lactosuero; teniendo en cuenta que por cada kilogramo de queso elaborado se generan 9 L de suero, alcanzando una producción anual de 110 millones de toneladas en el mundo de este residuo. Los altos niveles de producción de lactosuero derivan en un problema serio para los acuíferos ya que por cada 1000 L de lacto-suero se generan aproximadamente 35 kg de demanda bioquímica de oxígeno (DBO) y cerca de 68 kg de demanda química de oxígeno (DQO) (2,3). Por otro lado, el significativo contenido de lactosa del lactosuero lo transforman en una materia prima de alto interés para la producción de ácido láctico (4), utilizado a su vez especialmente en productos alimenticios, químicos, cosméticos y farmacéuticos (5).
Actualmente hay un aumento en la demanda de ácido láctico como materia prima para la producción del biopolímero denominado ácido poli láctico (PLA), que es una alternativa biodegradable, biocompatible, amigable con el ambiente y prometedora en la sustitución de los plásticos derivados de petroquímicos (6).
El ácido láctico se puede obtener por síntesis química o por fermentación de hidratos de carbono, mediante un proceso económico y fácilmente disponible. El primer proceso da como resultado una mezcla racémica de los ácidos lácticos, mientras que el segundo conduce a un estereoisómero de ácido láctico D(-) o L (+). El 90,0 % de la producción mundial de ácido láctico se consigue por fermentación, lo que muestra la preferencia por este método frente a la síntesis química (7,8). Uno de los principales intereses científicos es la reducción de costos de materias primas y el mejoramiento de los niveles de producción de ácido láctico por medio de la fermentación (5). Así, se han planteado alternativas más económicas para obtener ácido láctico: en vez de partir de la fermentación de azúcares refinados, se ha propuesto partir de productos o residuos alimenticios agroindustriales entre los que se identifican los almidones y el lactosuero, entre otros (9,10). Por otra parte, se han realizado numerosas investigaciones sobre el desarrollo de procesos biotecnológicos para la producción de ácido láctico, con el objetivo de optimizar el proceso desde el punto de vista técnico y económico, involucrando bacterias lácticas (LAB), algunos hongos filamentosos como fuentes microbianas principales de ácido láctico (9,11) y diferentes cepas (4,12-14).
La finalidad de este trabajo es plantear una alternativa adecuada para el manejo residual del lactosuero del sector lácteo del departamento del Cesar, con el fin de evitar el derrame de estos residuos a las aguas residuales sin tratamiento previo, y así reducir la contaminación por DBO y DQO. Se realizó una fermentación del lactosuero para obtención de ácido láctico, empleando bacterias combinadas Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophilus, ampliamente utilizadas por la industria láctea del Cesar en la producción de yogur. De esta manera, los residuos de la producción de queso pasan a tener un valor agregado con la implantación de un proceso económico y práctico que contribuye a la minimización del impacto ambiental.
Materiales y métodos
Microorganismos
La cepa utilizada fue el co-cultivo liofilizado Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophillus, adquirido en la empresa Colombiana Interenzimas S.A.S, bajo el nombre DRISET YOGUR 432- 50LU. Las bacterias fueron escogidas teniendo presente su capacidad homofermentativa de producción de ácido láctico, la disponibilidad en el mercado, su uso frecuente en la industria local para otras aplicaciones y finalmente varios reportes bibliográficos de producción de ácido láctico a partir de lactosuero con diferentes microorganismos (15). Las bacterias se activaron en una solución de agua pectonada al 1,0%, con adición de lactosuero y glucosa en porcentajes de 2,5 y 1,0% respectivamente, por 12 h a 40 °C. Este cultivo fue usado como inóculo para las fermentaciones.
Sustrato
El suero lácteo utilizado fue suministrado por la empresa Lácteos La Granja ubicada en Valledupar, Cesar, Colombia. Este suero se sometió a desproteinización por tratamiento térmico a temperatura de 90 °C durante 20 min, posteriormente se enfrió a 20 °C para que finalmente fuera pre filtrado, centrifugado y filtrado a vacío con papel Whatman número 42 (12). El suero fue caracterizado antes y después de la desproteinización midiendo el índice de acidez, contenido de lactosa, proteína, humedad y cenizas. El suero desproteinizado se esterilizó en autoclave a una presión de 0,1 MPa, temperatura de 120 °C y un tiempo de 15 min. Las pruebas finales se hicieron en suero Fresco (F) y suero Desproteinizado (D).
Fermentación
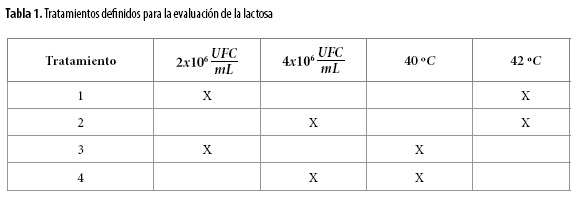
Con el fin de establecer las mejores condiciones para la producción de ácido láctico por las bacterias, se analizaron los efectos por la temperatura y concentración del inóculo de las bacterias, bajo las condiciones señaladas en la Tabla 1, el tratamiento 1 está compuesto por 2 millones de UFC/mL a 42 °C, mientras que el tratamiento 3 está compuesto por la misma cantidad de UFC/mL a 40 °C. Los tratamientos 2 y 4, cuentan con 4 millones de UFC/mL, pero a 42 y 40 °C respectivamente. Cabe resaltar que los niveles de concentración del inóculo fueron escogidos mediante pre ensayos, para lo cual se partió de la concentración dada en la ficha técnica del co-cultivo, y la cantidad de bacterias usadas por experiencia en la elaboración del yogur (1,0-3,0%). La adición de bacterias se realizó de dos maneras: i) activando las bacterias al inicio del proceso, para el caso denominado estado de bacterias sin activar (SA) y ii) activando las bacterias 24 h antes del inicio del proceso, para el caso denominado estado de bacterias activadas (A).
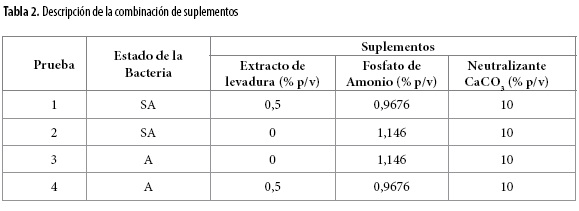
Posterior al diseño se realizaron ensayos de fermentación con el lactosuero previamente suplementado con el objeto de aumentar el rendimiento de producción de ácido láctico. Inicialmente se enriqueció con sulfato de amonio en cantidades de 1,25; 1,50 y 1,80% p/v, en búsqueda de un mayor aprovechamiento de la lactosa presente en el desecho lácteo. Se realizó un nuevo ensayo donde se enriqueció el lactosuero con fosfato de amonio y extracto de levadura, a la vez que se valoró la influencia del estado de las bacterias en la producción de ácido láctico, así se efectuaron 4 nuevos ensayos a los que se les denominó: prueba 1, 2, 3 y 4, tal como se muestra en la Tabla 2.
Todas las pruebas fueron realizadas por triplicado, con adición de carbonato de calcio al 10,0% como neutralizante y con agitación constante a 150 rpm. La fermentación se llevó a cabo en un biofermentador modelo BF-2000, marca New Brunswick Scientific, con capacidad para 2 L.
Extracción y purificación del ácido láctico
El ácido láctico producido se extrajo de los caldos en forma de lactato de calcio. El medio se calentó para solubilizar el lactato de calcio y coagular las proteínas presentes. Posteriormente se filtró para eliminar sustancias insolubles como la biomasa. El ácido libre se obtuvo por adición de ácido sulfúrico seguido de filtración para eliminar el sulfato de calcio formado. El ácido láctico fue entonces concentrado por evaporación, evacuando la humedad por arrastre con nitrógeno (16).
Métodos de análisis
Proteínas: Se determinó mediante el contenido de Nitrógeno (método Micro-Kjeldahl, Norma Técnica Colombiana 4657) (17).
Lactosa: Por el método colorimétrico del Fenol-Ácido Sulfúrico para micro determinación de carbohidratos totales propuesto por Dubois et al.(18), en un espectrofotómetro marca Spectronic modelo Genesys 20.
Ácido láctico: La producción se monitoreó durante la fermentación de manera indirecta a través del consumo de lactosa, la concentración de ácido láctico se determinó mediante acidez titulable bajo la NTC 4978 de 2001 (19) y se caracterizó por espectroscopía infrarroja. Para los análisis de espectroscopía infrarroja por transformada de Fourier - reflectancia total atenuada (FTIR-ATR) se utilizó un espectrómetro IRPrestige-21 /FTIR-8400S, con accesorio de reflectancia total atenuada. Los espectros fueron obtenidos en el rango de 4000-500 cm-1.
Resultados y discusión
Composición del lactosuero
Se tiene en cuenta el pH medido en el lactosuero desproteinizado y fresco, el cual está en 6,26 y 6,30, respectivamente (ver Tabla 3). Lo anterior permite mostrar que para ambos casos se trata de un suero dulce. El procedimiento de desproteinización permitió reducir en un 48,0% la cantidad de proteína pasando de un 0,85% en el lactosuero fresco a un 0,44% al lactosuero desproteinizado. Este valor de reducción porcentual de proteínas es similar a otras investigaciones como la de Urribarrí etal.(20) que reportó un 43,0% y la de Sánchez etal. (4) que reportó a su vez un 42,0%. Así mismo, se obtienen valores de lactosa para el suero fresco y desproteinizado de 46 y 47 g/L, respectivamente, similares a los reportados por Jakymec etal. (12).
Definición de las pruebas
La Figura 1 muestra que el mayor consumo de lactosa se dio en el tratamiento 1, seguido del tratamiento 2 con 64,5 y 59,2% de lactosa consumida respectivamente, mientras que para los tratamientos 3 y 4 el consumo de lactosa fue menor con 58,6 y 49,9% respectivamente. Se observa que a 42 °C se tiene mayor consumo de lactosa y, por ende, mayor producción de ácido láctico. Sin embargo, se puede apreciar que hay un mayor rendimiento para niveles menores de UFC/mL.
Con la finalidad de aumentar el rendimiento de producción de ácido láctico se procedió a enriquecer el lactosuero previo a la fermentación. Para esto se tomaron las condiciones aplicadas al tratamiento 4, debido a que tiene los mayores rendimientos de producción de ácido láctico de todos los tratamientos, para las mismas condiciones de suplemento. Cabe resaltar que, en principio, la suplementación no había tenido lugar en el proceso de fermentación a fin de tener un escenario de bajo costo. Gran cantidad de suplementación contribuye a un incremento en la concentración de impurezas y a su vez un aumento del costo de separación y bajos rendimientos en la recuperación de ácido láctico (9).
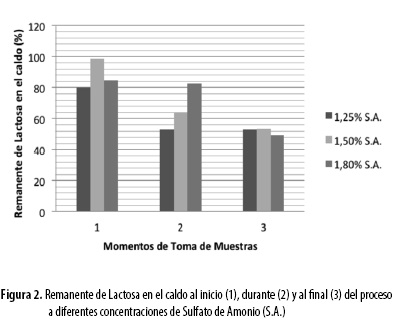
La primera suplementación se realizó con sulfato de amonio en concentraciones de 1,25; 1,50 y 1,80% con resultados poco favorables, tal como se muestra en la Figura 2. Para este caso el porcentaje de lactosa sin consumir seguía siendo alto, llegando a quedar, en el mejor de los casos, aproximadamente un 49,9% de lactosa en el caldo, pasadas 72 h de proceso.
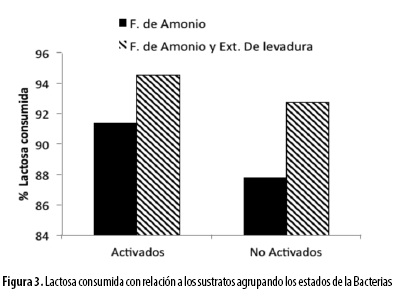
Caso contrario a la suplementación con sulfato de amonio ocurre con fosfato de amonio y extracto de levadura. Para este caso, se obtuvieron valores porcentuales de consumo de lactosa de 87,8%. La Figura 3, muestra cómo el estado de las bacterias es un factor influyente en el resultado de la fermentación, pero no tan relevante como la suplementación en este proceso. También se puede observar la comparación de resultados entre los fermentos con diferentes suplementos, permitiendo establecer que al suplementar el lactosuero con fosfato de amonio y extracto de levadura se obtienen mejores resultados (con rendimientos del 92,8 y 94,6%, respectivamente).
El ensayo con bacterias en estado SA, enriquecido con fosfato de amonio y extracto de levadura arrojó mejores resultados con un 92,8% de consumo de lactosa frente a un 91,4% alcanzado por el ensayo con bacterias en estado A y enriquecido sólo con fosfato de amonio. De los ensayos suplementados con fosfato de amonio y extracto de levadura, se alcanzaron rendimientos porcentuales de consumo de lactosa para las cuatro pruebas, cuyos resultados en su orden son: 92,8%; 87,8%; 91,4% y 94,6%.
Teniendo en cuenta que los mayores rendimientos se dieron en la prueba 4 (mayor consumo de lactosa), donde se adicionaron cepas activadas, fosfato de amonio y extracto de levadura, se puede afirmar que estas son las mejores condiciones para la fermentación.
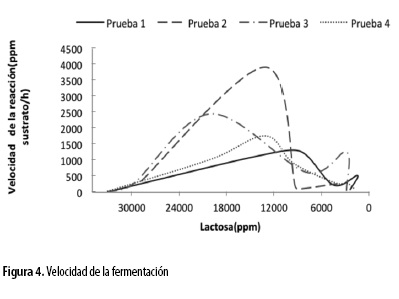
Al valorar la velocidad de fermentación de los ensayos suplementados se encuentra que la prueba 2 tiene mayor velocidad de consumo de lactosa, tal como se muestra en la Figura 4. Esta condición es importante para obtener un producto continuo, por lo que una posible aplicación del proceso requerirá mantener en el tiempo una concentración de lactosa de 15000 ppm, para obtener un gasto de lactosa de 4000 ppm/h. En este sentido, un montaje adecuado empleando las materias primas seleccionadas en este trabajo debe tener en cuenta las condiciones de producción empleadas en la prueba 2 con el tratamiento 1. Sin embargo, en cualquier otro caso dentro de las cuatro pruebas reportadas la producción tendrá un retardo considerable.
Del mismo modo, aunque la prueba 2 presentó la mayor velocidad de fermentación, la eficiencia en el consumo de lactosa fueron menores (87,8%), comparado con el rendimiento de la prueba 4 (94,6%) con una velocidad más baja de fermentación.
Caracterización del ácido láctico
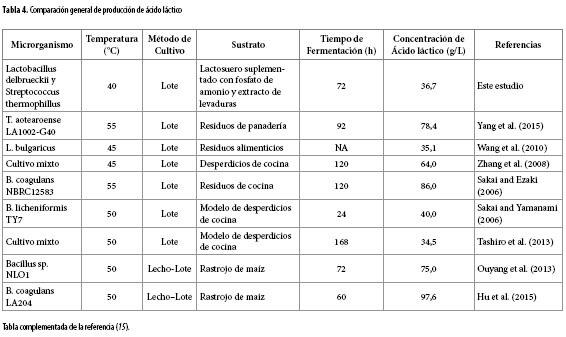
El ácido láctico extraído del caldo de fermentación y purificado, de acuerdo a la metodología, presenta una apariencia viscosa y color amarillo claro. La pureza del ácido láctico fue de 78,0% (p/v) similar a la de otras investigaciones (21). En la Tabla 4 se muestran las concentraciones de ácido láctico en procesos de obtención similares. Se observa que los valores de ácido láctico de este estudio son aproximados a los obtenidos por Tashiro et al. (5) y Wang et al. (22). Aunque estos valores no son altos, permiten reducir los niveles de DQO de 35 g/L de lactosuero hasta 7,7 g/L. Se requiere un dispositivo para el control de DBO5 menos costoso, de manera que se logren reducir hasta 1,54 g/L los niveles de DBO o emplear una cantidad de agua mucho menor para alcanzar la dilución hasta los niveles requeridos.
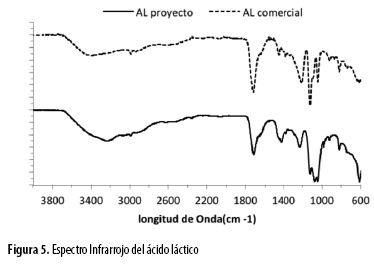
En la Figura 5 se compara el espectro de un ácido L láctico comercial marca Carlo Erba con una concentración entre 88,0-92,0% y el obtenido en la investigación. La semejanza que presenta permite comprobar que es ácido láctico lo que se recuperó de los caldos de fermentación ya que muestra las señales características: estiramiento OH a 3238 cm-1 de los grupos alcohol y ácido, especialmente a 2995 cm-1 y 2944 cm-1. Grupo COOH: tensión a 1716 cm-1 indica la presencia del enlace C=O perteneciente al grupo ácido. Estiramientos a 1432 y 1376 cm-1 flexiones simétricas de los grupos CH y CH3 y los picos a 1232, 1122, 1075 y 1046 cm-1son estiramientos de C-O de los grupos ácido y alcohol.
Conclusiones
Se obtuvo ácido láctico con un 78,0% de pureza (36,7 g/L en el caldo de fermentación), el cual se caracterizó con espectroscopía infrarroja, mediante un proceso de condiciones controladas de fermentación de lactosuero para alcanzar niveles de consumo de lactosa de 94,6%. Para alcanzar dichos resultados, se aprovechó la actividad de las bacterias Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophilus y el enriquecimiento de subproducto lácteo previo a la fermentación con fosfato de amonio y extracto de lavadura a una temperatura de 40 ºC.
La suplementación del lactosuero es un factor limitante para alcanzar un buen rendimiento en la producción biotecnológica de ácido láctico con el co-cultivo estudiado en la presente investigación. Es necesario suplementar el lactosuero con el fin de aportar a las bacterias los nutrientes del que carece el lactosuero y que son fundamentales para su crecimiento y desarrollo.
Agradecimientos
Los autores agradecemos especialmente al profesor Einer Gutiérrez por los valiosos consejos en la preparación de la investigación; a la Universidad Popular del Cesar, al grupo de investigación Procesos Químicos Industriales - PQI-, a su director Luis Ríos, al Ingeniero químico Andrés Guzmán por su colaboración y ayuda y a COLCIENCIAS (Convocatoria 566 Jóvenes Investigadores e Innovadores) por el apoyo económico aportado para la finalización exitosa del trabajo.
Referencias
1. Khan, S.; Deere, D.; Leusch, F.; Humpage, A.; Jenkins, M.; Cunliffe, D. Extreme weather events: Should drinking water quality management systems adapt to changing risk profiles?. Water Res. 2015, 85, 124 -136. DOI: http://dx.doi.org/10.1016/j.watres.2015.08.018. [ Links ]
2. Inda, A. Optimización de rendimiento y aseguramiento de inocuidad en la industria de la quesería. Organización de los Estados Americanos (OEA): 2000; p. 63. [ Links ]
3. Padín, C.; Diaz, M. Fermentación alcohólica del lactosuero por Kluyveromyces marxianus y solventes orgánicos como extractantes. RSVM., 2009, 29,110-116. [ Links ]
4. Sánchez, R.; Ramirez D.; Zapata, A. Evaluación de un sistema de fermentación extractiva para la producción de ácido láctico utilizando suero de leche como sustrato. Vitae. 2007, 14, 27-34. [ Links ]
5. Abdel-Rahman, M., Tashiro, Y.; Sonomoto, K. Recent advances in lactic acid production by microbial fermentation processes. Biotechnol. Adv. 2013, 31(6), 877-902. DOI: http://dx.doi.org/10.1016/j.biotechadv.2013.04.002. [ Links ]
6. Abdel-Rahman, M., Tashiro, Y.; Sonomoto, K. Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria: Overview and limits. J. Biotechnol.2011,156 (4),286-301. DOI: http://dx.doi.org/10.1016/j.jbiotec.2011.06.017. [ Links ]
7. Boontawan, P., Kanchanathawee, S.; Boontawan, A. Extractive fermentation of l-(+)-lactic acid by Pediococcus pentosaceus using electrodeionization (EDI) technique. Biochem. Eng. J. 2011, 54 (3), 192-199. DOI: http://dx.doi.org/10.1016/j.bej.2011.02.021. [ Links ]
8. Singh Yadav, J. S.; Yan, S.; Pilli, S.; Kumar, L.; Tyagi, R.D.; Surampalli, R.Y. Cheese whey: A potential resource to transform into bioprotein, functional/nutritional proteins and bioactive peptides. Biotechnol. Adv. 2015, 33, 756-774. DOI: http://dx.doi.org/10.1016/j.biotechadv.2015.07.002. [ Links ]
9. John, R. P.; Madhavan Nampoothiri, K.; Pandey, A. Fermentative production of lactic acid from biomass: an overview on process developments and future perspectives. Appl. Microbiol. Biotechnol. 2007, 74 (3), 524-534. DOI: http://dx.doi.org/10.1007/s00253-006-0779-6. [ Links ]
10. Madhavan Nampoothiri, K.; Rajendran Nair, N.; John, R. P. An overview of the recent developments in polylactide (PLA) research. Bioresour. Technol. 2010, 101 (22), 8493-8501. DOI: http://dx.doi.org/10.1016/j.biortech.2010.05.092. [ Links ]
11. Litchfield, J. H. Microbiological production of lactic acid. Adv. Appl. Microbiol. 1996, 42, 45-95.DOI: http://dx.doi.org/10.1016/S0065-2164(08)70372-1. [ Links ]
12. Jakymec, M.; Moran, H.; Paez, G.; Ferrer, J. R.; Mármol, Z.; Ramones, E. Cinética de la producción de ácido láctico por fermentación sumergida con lactosuero como sustrato. Rev. Cient. 2001, 11 (1), 53-59. [ Links ]
13. Sanchez Podlech, P. A.; Furia Luna, M.; Jerke, P. R.; Souza Neto, C.; Dos Passos, R.; Souza, O.; Borzani, W. Semicontinuous lactic fermentation of whey by Lactobacillus bulgaricus I. Experimental results. Biotechnol. Lett. 1990, 12 (7), 531-534. [ Links ]
14. Roukas, T.; Kotzekidou, P. Lactic acid production from deproteinized whey by mixed cultures of free and coimmobilized Lactobacillus casei and Lactococcus lactis cells using fedbatch culture. Enzyme Microb. Technol. 1998, 22 (3), 199-204. DOI: http://dx.doi.org/10.1016/S0141-0229(97)00167-1. [ Links ]
15. Yang, X.; Zhu, M.; Huang, X.; Sze Ki Lin, C.; Wang, J.; Li, S. Valorisation of mixed bakery waste in non-sterilized fermentation for L-lactic acid production by an evolved Thermoanaerobacterium sp. Strain. Bioresour. Technol. 2015, 198, 47-54. DOI: http://dx.doi.org/10.1016/j.biortech.2015.08.108. [ Links ]
16. Serna, L., Rodríguez, A. Producción biotecnológica de ácido láctico. Cienc. Tecnol. Aliment. 2005, 5 (1), 54-65. [ Links ]
17. Gil, L.M.; Manjarrez, K.; Piñeros, Y.; Rodriguez, E. Influencia de la adición de una fuente de nitrógeno en la producción de ligninasas. Biotecnología en el Sector Agropecuario y Agroindustrial. 2012. 10 (1), 173-181. [ Links ]
18. Dubois, M., Gilles, K., Hamilton, J., & Rebers. Colorimetric method for determination of sugar and related substances. Analytical Chemistry. 1956. 28, 350-354. DOI: http://dx.doi.org/10.1021/ac60111a017. [ Links ]
19. Agudelo, C.; Ortega, R.; Hoyos, J.L. Determinación de parámetros cinéticos de dos inóculos lácticos: Lactobacillus plantarum A6 y bacterias ácido lácticas de yogurt. Facultad de Ciencias Agropecuarias. 2010. 8 (2), 8-16. [ Links ]
20. Urribarrí, L.; Vielma, A.; Paéz, G.; Ferrer, J.; Mármol, Z.; Ramones, E. Producción de ácido láctico a partir de suero de leche, utilizando Lactobacillus helveticus en cultivo continuo. Rev. Científ. FCV-LUZ. 2004, 14 (4), 297-302. [ Links ]
21. Jimenez, P.; Sibaja, M.; Vega-Baudrit, J. Síntesis y caracterización de poli(ácido l-láctico) por policondensación directa, obtenido del fermento de desechos agroindustriales de banano (musa acuminata aaa variedad cavendish cultivar gran naine) en Costa Rica. Rev.iberoam.polim. 2012, 13 (2), 52-59. [ Links ]
22. Wang, M., Xu, Z.J., Qiu, T.L., Sun, X.H., Han, M.L., Wang, X.M. Kinetics of lactic acid fermentation on food waste by Lactobacillus bulgaricus. Adv. Mat. Res. 2010, 113, 1235-1238.DOI: http://dx.doi.org/10.4028/www.scientific.net/AMR.113-116.1235. [ Links ]