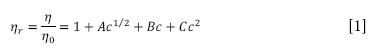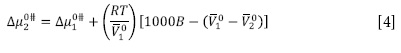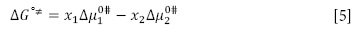Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Química
versão impressa ISSN 0120-2804
Rev.Colomb.Quim. vol.44 no.3 Bogotá set./dez. 2015
https://doi.org/10.15446/rev.colomb.quim.v44n3.55608
DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v44n3.55608
Propiedades viscosimétricas de la DL-alanina en soluciones acuosas de trifluorometanosulfonato de 1-butil-3-metil imidazolio a diferentes temperaturas
Viscometric properties of DL-alanine in aqueous solutions of 1-Butyl-3-methyl imidazolium trifluoromethanesulfonic acid at different temperatures
Propriedades viscosimétricas da DL-alanina em soluções aquosas de trifluorometanossulfonato de 1-butil-3-metil imidazólio a diferentes temperaturas
Manuel S. Páez1,*, Juan D. Garcia1, María K. Vergara1
1 Universidad de Córdoba. Departamento de Química. Facultad de Ciencias Básicas. Carrera 6 No. 76-103. Km 3. vía Cereté. Córdoba. Colombia.
* Autor para correspondencia: mspaezm@unal.edu.co
Article citation:
Páez, M. S.; García, J. D.; Vegara, M. K. Propiedades viscosimétricas de la DL-alanina en soluciones acuosas de trifluorometanosulfonato de 1-butil-3-metil imidazolio a diferentes temperaturas. Rev. Colomb. Quim. 2015, 44 (3), 39-48. DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v44n3.55608
Recibido: 13 de octubre de 2015. Aceptado: 10 de diciembre de 2015.
Resumen
Se determinaron los tiempos de flujo de la DL-alanina en soluciones acuosas del líquido iónico trifluorometanosulfonato de 1-Butil-3-metil imidazolio (0,1000-1,0000 mol/Kg) usando un viscosímetro Anton Paar® modelo AMVn a temperaturas de 283,15; 288,15; 293,15; 298,15; 303,15; 308,1; 313,15 y 318,15 K y 0,10 MPa. A partir de los datos obtenidos se calcularon las viscosidades absolutas, los coeficientes B de viscosidad, la pendiente 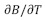 y los parámetros de activación del flujo viscoso
y los parámetros de activación del flujo viscoso 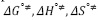 del estado de dilución infinita. Los valores obtenidos para estos parámetros fueron discutidos en términos de las interacciones presentes en solución.
del estado de dilución infinita. Los valores obtenidos para estos parámetros fueron discutidos en términos de las interacciones presentes en solución.
Palabras clave: líquido iónico, viscosidad, parámetros de activación, flujo viscoso.
Abstract
Flow times of DL-alanine in aqueous solutions of ionic liquid 1-butyl-3-methyl imidazolium trifluoromethanesulfonate (0.1000-1.0000 mol/Kg) were determined, using a viscometer model Anton Paar® AMVn at 283.15, 288.15, 293.15, 298.15, 303.15, 308.1, 313.15 and 318.15 K and 0.10 MPa. From the data obtained the absolute viscosities, viscosity coefficients B, the slope 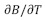 and the activation parameters of viscous flow
and the activation parameters of viscous flow 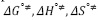 at state of infinite dilution were calculated. The values obtained for these parameters were discussed in terms of the interactions present in solution.
at state of infinite dilution were calculated. The values obtained for these parameters were discussed in terms of the interactions present in solution.
Keywords: ionic liquid, viscosity, activation parameters, viscous flow.
Resumo
Foram determinados os tempos de fluxo da DL-alanina em soluções aquosas do líquido iónico trifluorometanossulfonato de 1-butil-3-metil imidazólio (0,100-1,000 mol/Kg) utilizando um viscosímetro Anton Paar® de modelo AMVn a temperaturas de 283,15; 288,15; 293,15; 298,15; 303,15; 308,1, 313,15 e 318,15 K e 0,10 MPa. A partir dos dados obtidos foram calculadas as viscosidades absolutas, os coeficientes de viscosidade B, o gradiente 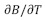 e os parâmetros de ativação de fluxo viscoso
e os parâmetros de ativação de fluxo viscoso 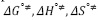 no estado de diluição infinita. Os valores obtidos para estes parâmetros são discutidos em termos das interações presentes na solução.
no estado de diluição infinita. Os valores obtidos para estes parâmetros são discutidos em termos das interações presentes na solução.
Palavras-Chave: líquido iônico, viscosidade, parâmetros de ativação, fluxo viscoso.
Introducción
El estudio de las interacciones soluto-solvente tiene gran importancia en diversos campos de la ciencia, incluyendo la química médica, bioquímica, procesos industriales, etc. (1,2). En este sentido, el estudio fisicoquímico de sistemas pseudobinarios, por ejemplo: aminoácido + líquido iónico + agua, podría ser útil para comprender varios procesos bioquímicos, tales como: deshidratación, desnaturalización y agregación de proteínas, entre otros.
Los electrolitos orgánicos incluyendo a los líquidos iónicos pueden brindar una excelente visión acerca del efecto de las interacciones electrostáticas e hidrofóbicas sobre la estabilidad de los aminoácidos (3,4). Así mismo, es de esperar que estos compuestos influyan sobre las conformaciones macromoleculares, a través del debilitamiento o fortalecimiento de las interacciones repulsivas o atractivas (inter o intra cadena y carga-carga), afectándose de esta forma las interacciones hidrofóbicas de las cadenas laterales con los grupos alquílicos (5).
La viscosidad es una propiedad de transporte muy importante, especialmente para el diseño de productos químicos y para la optimización de procesos químicos. El estudio de las propiedades viscosimétricas desempeña un papel importante en muchos sistemas industrialmente interesantes, tales como la síntesis orgánica, sistemas de extracción de iones, disolventes de adsorción de gas, y fenómenos de transferencia de masa. Por otra parte, el estudio de las propiedades de transporte de mezclas binarias da información significativa en relación con la comprensión más profunda de la estructura líquida molecular y las interacciones intermoleculares (6).
Por tanto, en el presente trabajo se reportan las viscosidades dinámicas (h) de la DL-alanina a diferentes molalidades usando ocho solventes pseudobinarios derivados del líquido iónico (LI) trifluorometanosulfonato de 1-Butil-3-metil imidazolio ([Bmim][OTF]). Estas viscosidades fueron obtenidas a las temperaturas de 283,15; 288,15; 293,15; 298,15; 303,15; 308,15; 313,15 y 318,15 K y a la presión atmosférica de 0,10 MPa.
Los valores experimentales de la viscosidad dinámica se usaron para calcular los coeficientes de viscosidad A, B y C de la Ecuación de Jones-Dole (2), la pendiente 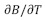 , los parámetros de activación del flujo viscoso a dilución infinita
, los parámetros de activación del flujo viscoso a dilución infinita 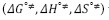 y las contribuciones por mol del solvente y del soluto a la energía libre en relación a ese estado
y las contribuciones por mol del solvente y del soluto a la energía libre en relación a ese estado 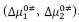 . Los resultados obtenidos para estos parámetros se usaron para indagar sobre el efecto causado por el soluto a la estructura del solvente.
. Los resultados obtenidos para estos parámetros se usaron para indagar sobre el efecto causado por el soluto a la estructura del solvente.
Materiales y métodos
Los reactivos empleados fueron los siguientes: DL-alanina de la casa comercial Alfa Aesar, 99% de pureza, trifluorometanosulfonato de 1-Butil-3-metil imidazolio ([Bmim][OTF]) obtenido de la casa comercial Across Organic, pureza ≥ 99%. Para reducir el contenido de agua y los compuestos volátiles que tienen influencia sobre las propiedades fisicoquímicas de las soluciones, el LI se secó con agitación a temperatura moderada (T = 343 K) y bajo vacío (P = 0,2 Pa) aproximadamente durante 48 h antes de su uso. Después del secado se guardó en una botella bajo una atmósfera de gas inerte. Luego se midió el contenido de agua de este líquido iónico usando un Coulómetro Metrohm 831 (Karl Fischer® Mettler Toledo). En este proceso, el yodo se genera eléctricamente con precisión en la solución de Karl Fisher y el contenido de agua se determina por la cantidad de yodo que reacciona con el agua en una relación de uno a uno. Para este propósito se usó un tamaño de muestra de aproximadamente 0,1 g para cada medición, y se repitió dos veces para cada muestra, dando como resultado un contenido de agua de 100 ppm. La DL-alanina fue doblemente recristalizada desde soluciones acuosas de etanol y secada al vacío sobre P2O5. El agua usada para la preparación de las soluciones fue desgasificada, desionizada y doblemente destilada, con una conductividad menor de 2 μS/cm.
Las soluciones fueron preparadas gravimétricamente usando una balanza OHAUS® modelo Explorer con una incertidumbre de ± 1 x 10-4 g en botellas herméticamente cerradas para minimizar pérdida por evaporación de alguno de los componentes. Los tiempos de flujo y las densidades de los líquidos puros y las soluciones se midieron usando un microviscosímetro Anton Paar® modelo AMVn y un densímetro de tubo vibratorio Anton Paar® modelo DMA 5000, respectivamente; con incertidumbres de ± 0,001 mPa·s y ± 1 x 10-5 g/cm3.
Resultados y discusión
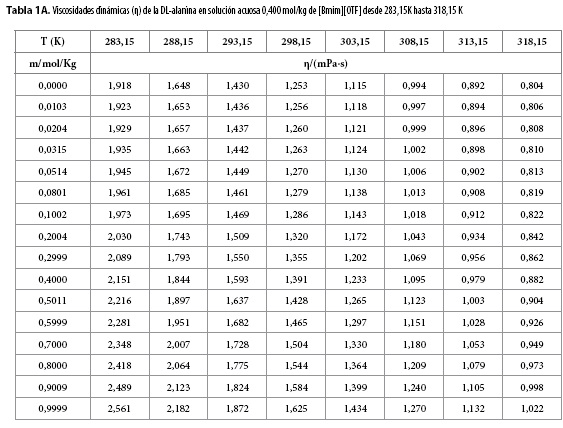
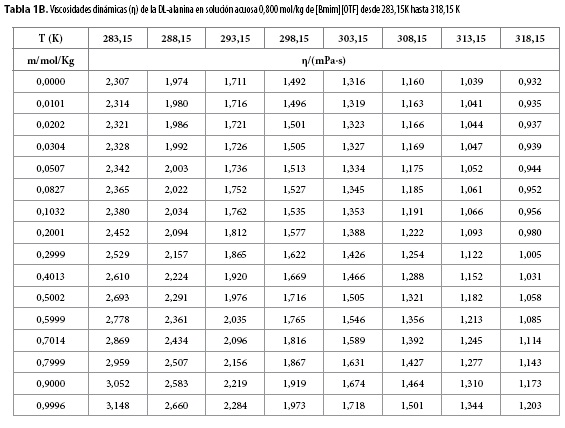
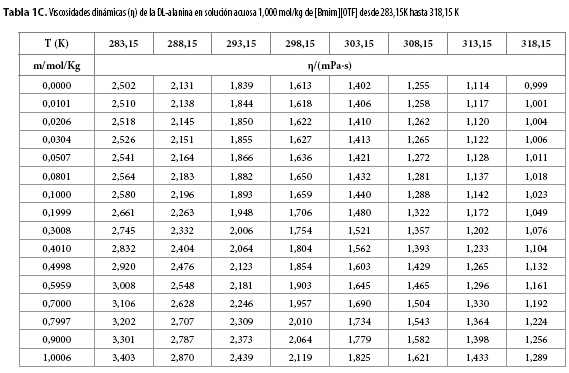
Las viscosidades dinámicas (η) obtenidas en este trabajo desde 283,15 K hasta 318,15 K para diferentes concentraciones de DL-alanina en los ocho solventes pseudobinarios (agua + m[Bmim][OTF] ), se muestran en las Tablas 1A-1C.
En las Tablas 1A-1C se observa que los valores de la viscosidad dinámica (η) aumentan ligeramente con el aumento de la concentración de DL-alanina en cada solvente pseudobinario y disminuyen con el aumento de la temperatura. Este comportamiento podría ser consecuencia de la intensificación de las fuerzas eléctricas entre de los iones en las capas adyacentes de la solución, ya que, cuando un ion entra en un solvente produce una modificación de la estructura del mismo con pérdida de entropía, que tiende a construir y mantener una estructura de red espacial de los iones en la solución (7); mientras que la disminución de la viscosidad con el incremento de la temperatura, podría ser una consecuencia de la perturbación de la red espacial en la solución por el movimiento térmico de las moléculas.
A partir de los datos de las Tablas 1A-1C se determinó la viscosidad relativa (ηr) como la razón de la viscosidad dinámica de la solución (η) respecto a la del solvente puro (η0), estas viscosidades se ajustaron con ayuda de la Ecuación Jones-Dole [1] para soluciones electrolíticas (8-10):
Donde c es la molaridad en mol/L y A, B y C son parámetros ajustables. A es una constante que mide las interacciones de largo alcance ion-ion y sus valores positivos podrían indicar la presencia de interacciones iónicas en las soluciones (11); B es una constante que tiene en cuenta la interacción ion-solvente y C incluye todas interacciones estructurales soluto-solvente y soluto-soluto que no se toman en cuenta los términos AC½ y Bc (2,11-13).
Se ha encontrado experimentalmente que si el signo de B es positivo se asocia a la formación de agregados hidrofóbicos en solución acuosa y que el soluto está fuertemente hidratado; mientras que un signo negativo para B se asocia a solutos que desestabilizan la estructura de los agregados hidrofóbicos en solución acuosa y además indica que los solutos están débilmente hidratados (14); sin embargo, el signo del coeficiente B podría no ser indicativo especialmente para grandes solutos hidrofóbicos. Por ello se sugiere usar mejor la primera derivada de B con respecto a la temperatura, la razón es porque el signo de 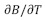 es un criterio más indicativo de formación o disrupción de estructura. En este sentido, el signo negativo de
es un criterio más indicativo de formación o disrupción de estructura. En este sentido, el signo negativo de 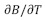 indica formación de estructura (cosmotrópico), mientras que el signo positivo sugiere disrupción de estructura (caotrópico) (12,14).
indica formación de estructura (cosmotrópico), mientras que el signo positivo sugiere disrupción de estructura (caotrópico) (12,14).
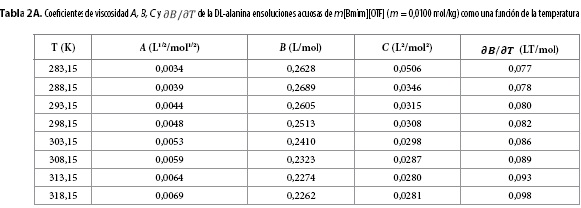
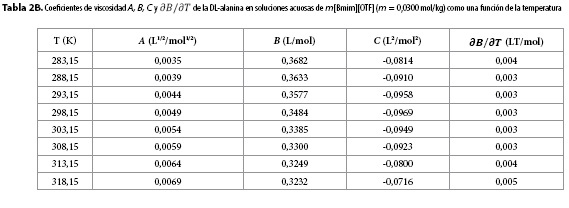
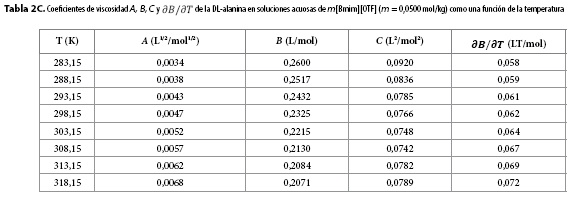
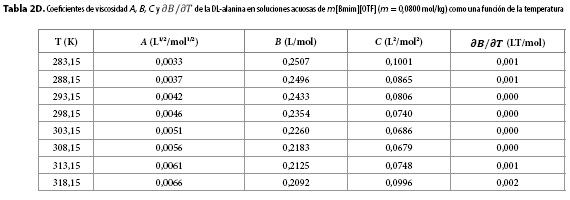
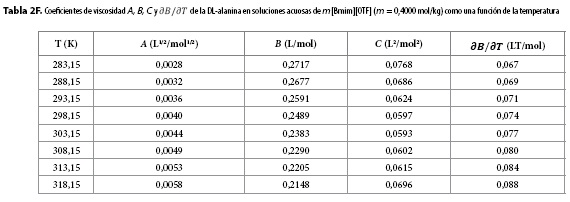
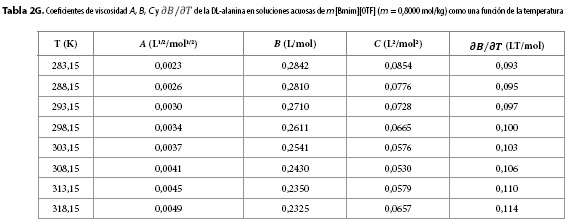
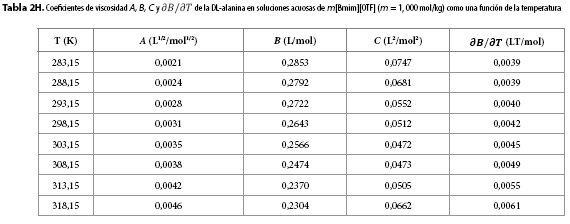
Los resultados obtenidos para los parámetros A, B, C y para 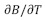 se muestran en las Tablas 2A-2H. Aquí se observa que el coeficiente A presenta órdenes de magnitud típicos de soluciones electrolíticas (15), no obstante su valor se ve opacado por los valores del coeficiente B, que presentó valores positivos para todos los solventes pseudobinarios e isotermas de estudio; sugiriendo con ello que en estos sistemas priman las interacciones soluto-solvente (ion-ion), entre las que se pueden identificar (9,16-18):
se muestran en las Tablas 2A-2H. Aquí se observa que el coeficiente A presenta órdenes de magnitud típicos de soluciones electrolíticas (15), no obstante su valor se ve opacado por los valores del coeficiente B, que presentó valores positivos para todos los solventes pseudobinarios e isotermas de estudio; sugiriendo con ello que en estos sistemas priman las interacciones soluto-solvente (ion-ion), entre las que se pueden identificar (9,16-18):
a) Interacciones entre el Bmim+ del solvente pseudobinario y el grupo COO- de la DL-alanina.
b) Interacciones entre el OTF- del solvente pseudobinario y el grupo NH3+ de la DL-alanina.
Por su parte, el valor no nulo del coeficiente C revela la presencia de autointeracciones iónicas e interacciones entre iones de signos opuestos no contempladas en los términos AC½ y Bc (9,19).
Los valores de 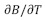 resultaron positivos para todos los solventes pseudobinarios a todas las isotermas de trabajo, este hallazgo, podría indicar que la DL-alanina actúa como un soluto disruptor de la estructura del solvente.
resultaron positivos para todos los solventes pseudobinarios a todas las isotermas de trabajo, este hallazgo, podría indicar que la DL-alanina actúa como un soluto disruptor de la estructura del solvente.
Por otra parte, los datos de viscosidad dinámica han sido analizados utilizando la teoría de Eyring (9,11,19,20). De acuerdo a esta teoría, en un líquido puro en reposo, las moléculas están constante movimiento, pero debido al empaquetamiento compacto, el movimiento queda reducido prácticamente a la vibración de cada molécula dentro de una «jaula» formada por las moléculas más próximas. Esta jaula sufre reordenaciones continuas, durante las cuales una molécula escapa desde una «jaula» a un «hueco» adyacente (21). Eyring (9,11,19,20), sugirió que la energía libre de activación del flujo viscoso para que una molécula salte sobre una barrera de potencial hacia el interior de un sitio vacante, puede expresarse con ayuda de la Ecuación [2]
Donde h, NA, 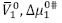 y T son: la constante de Planck, el número de Avogadro, el volumen molar parcial del solvente, la energía libre de activación por mol del solvente, la constante universal de los gases y la temperatura en Kelvin, respectivamente. Feakins y colaboradores (9,11,22) aplicaron esta teoría a las viscosidades relativas de las soluciones, y mostraron que el coeficiente B puede escribirse como:
y T son: la constante de Planck, el número de Avogadro, el volumen molar parcial del solvente, la energía libre de activación por mol del solvente, la constante universal de los gases y la temperatura en Kelvin, respectivamente. Feakins y colaboradores (9,11,22) aplicaron esta teoría a las viscosidades relativas de las soluciones, y mostraron que el coeficiente B puede escribirse como:
Donde 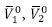 son el volumen molar parcial solvente y del soluto cuando
son el volumen molar parcial solvente y del soluto cuando 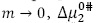 es la contribución por mol del soluto. De esta forma
es la contribución por mol del soluto. De esta forma 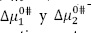 fueron calculados a partir de las Ecuaciones [2] y [4] respectivamente
fueron calculados a partir de las Ecuaciones [2] y [4] respectivamente
Por otra parte, se sabe que la energía de activación del flujo viscoso puede escribir como:
Donde x1, x2 son las fracciones molares del solvente y del soluto respectivamente. Los valores obtenidos para 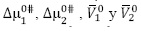 son presentados en las Tablas 3A-3H. Aquí se observa que los valores de
son presentados en las Tablas 3A-3H. Aquí se observa que los valores de 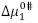 son aproximadamente constantes a todas las temperaturas y composiciones del solvente pseudobinario estudiado. Los valores de
son aproximadamente constantes a todas las temperaturas y composiciones del solvente pseudobinario estudiado. Los valores de 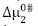 son positivos y mayores que los valores de
son positivos y mayores que los valores de 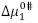 ; según la teoría del estado de transición cada molécula de solvente por mol de solución pasa por un estado de transición e interactúa de forma más o menos fuerte con la molécula de soluto (11), lo que sugiere que el estado de transición es menos favorecido en presencia de DL-alanina y que la formación de este estado va acompañado de la disrupción y distorsión de los enlaces intermoleculares en la estructura del disolvente (22-24). Este hecho sugiere que las interacciones que involucran a los iones presentes en el solvente pseudobinario [Bmim+], [OTF-] con los centros cargados de la DL-alanina (COO-, NH3+) son fuertes y por consiguiente ocurre un favorecimiento de las interacciones soluto-solvente (ion-ion). Los valores para la entalpía de activación
; según la teoría del estado de transición cada molécula de solvente por mol de solución pasa por un estado de transición e interactúa de forma más o menos fuerte con la molécula de soluto (11), lo que sugiere que el estado de transición es menos favorecido en presencia de DL-alanina y que la formación de este estado va acompañado de la disrupción y distorsión de los enlaces intermoleculares en la estructura del disolvente (22-24). Este hecho sugiere que las interacciones que involucran a los iones presentes en el solvente pseudobinario [Bmim+], [OTF-] con los centros cargados de la DL-alanina (COO-, NH3+) son fuertes y por consiguiente ocurre un favorecimiento de las interacciones soluto-solvente (ion-ion). Los valores para la entalpía de activación 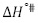 y la entropía de activación
y la entropía de activación 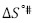 del flujo viscoso a dilución infinita, fueron calculados mediante la Ecuación [6] (9,25,26).
del flujo viscoso a dilución infinita, fueron calculados mediante la Ecuación [6] (9,25,26).
Donde los valores de 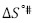 y
y 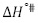 se obtuvieron usando el método de los mínimos cuadrados a partir de la pendiente y el intercepto de la gráfica de
se obtuvieron usando el método de los mínimos cuadrados a partir de la pendiente y el intercepto de la gráfica de 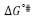 en función de T.
en función de T.
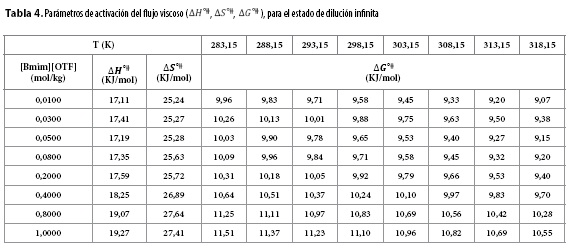
Los datos obtenidos para 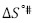 ,
, 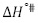 y
y 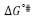 se muestran en la Tabla 4. En la Tabla 4 se observa que los valores de
se muestran en la Tabla 4. En la Tabla 4 se observa que los valores de 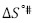 y
y 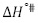 son positivos a todas las temperaturas de trabajo para todos los solventes pseudobinarios, lo cual sugiere que la formación del estado de transición va acompañada de una disrupción de los enlaces intermoleculares y una estructura más desordenada de las especies en el estado activado. Este comportamiento se ha observado en otros sistemas de aminoácidos en solventes mixtos o pseudobinarios (9,25,26).
son positivos a todas las temperaturas de trabajo para todos los solventes pseudobinarios, lo cual sugiere que la formación del estado de transición va acompañada de una disrupción de los enlaces intermoleculares y una estructura más desordenada de las especies en el estado activado. Este comportamiento se ha observado en otros sistemas de aminoácidos en solventes mixtos o pseudobinarios (9,25,26).
Conclusiones
En este trabajo se reportan datos experimentales para las viscosidades dinámicas del sistema DL-alanina en ocho solventes pseudobinarios, en el intervalo de concentración (0,0100-1,0000 mol/Kg), a las temperaturas de 283,15; 288,15; 293,15; 298,15; 303,15; 308,1; 313,15 y 318,15 K y a presión atmosférica 0,10 MPa. Los valores del coeficiente B resultaron positivos y mucho mayores que los coeficientes A y C, para todos los solventes e isotermas de estudio, lo que sugiere que en estos sistemas predominan las interacciones soluto-solvente (ion-ion). Adicionalmente los valores de 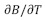 resultaron positivos para todos los sistemas; hecho que podría indicar que la DL-alanina actúa como un soluto disruptor de la estructura del solvente pseudobinario (cosmotrópico).
resultaron positivos para todos los sistemas; hecho que podría indicar que la DL-alanina actúa como un soluto disruptor de la estructura del solvente pseudobinario (cosmotrópico).
Referencias
1. Sanjibita, D.; Upendra, D. Viscometric study of glycine, α-alanine and β-alanine in aqueous and aqueous D-glucose solutions at different temperatures. J. Chem. Pharm. Res. 2012, 4 (8), 3869-3876. [ Links ]
2. Horvat, J.; Bešter-Rogaˇc, M.; Klofutar, C.; Rudan-Tasic, D. Viscosity of aqueous solutions of lithium, sodium, potassium, rubidium and caesium cyclohexylsulfamates from 293.15 to 323.15 K. J. Solution. Chem. 2008, 37 (9), 1329-1342. DOI: http://dx.doi.org/ 10.1007/s10953-008-9311-1. [ Links ]
3. Páez, M.; Vergara, M.; De la Espriella, N. Interacciones de la DL-alanina en Soluciones acuosas de trifluorometanosulfonato de 1-butil-3-metilimidazolio a diferentes temperaturas. Inf. tecnol. 2015, 26 (1), 63-70. DOI: http://dx.doi.org/10.4067/S0718-07642015000100007. [ Links ]
4. Páez, M.; Vergara, M.; Pérez, O. Propiedades volumétricas de la DL-alanina en soluciones acuosas del líquido iónico cloruro de 1-butil-3-metilimidazolio a las temperaturas desde 283.15 hasta 313.15.K. Inf. tecnol. 2015, 26 (5), 113-120. DOI: http://dx.doi.org/10.4067/S0718-07642015000500015. [ Links ]
5. Shekaari, H.; Jebali, F. Densities and electrical conductances of amino acids + iónic liquid ([Hmim]Br) + H2O mixtures at 298.15K. Fluid. Phase. Equilib. 2010, 295 (1), 68-75. DOI: http://dx.doi.org/10.1016/j.fluid.2010.04.002. [ Links ]
6. Yang, J.; Dai, L.; Wang, X.;Chen,Y. Densities and viscosities of binary mixtures of methyl 4-chlorobutyrate with aromatic hydrocarbons at T = (298.15 to 318.15)K. J. Chem. Eng. Data. 2009, 54 (8), 2332-2337. DOI: http://pubs.acs.org/doi/abs/10.1021/je900194. [ Links ]
7. Zamir, T. Thermodynamical Behaviour of 1-1 Strong Electrolytes In Water, Dimethyl Sulfoxide And Water-Dimethyl Sulfoxide Mixtures. Ph.D. Dissertation [Online], University of Balochistan, Pakistan, February 2004. http://prr.hec.gov.pk/Thesis/298S.pdf (consultado el 15 de abril de 2015). [ Links ]
8. Páez, M.; Vergara, M.; Pérez, O. Interacciones moleculares de la mezcla de [Bmim][TfO] + agua a partir de datos de viscosidad. Inf. tecnol. 2014, 25 (6), 85-90. DOI: http://dx.doi.org/10.4067/S0718-07642014000600011. [ Links ]
9. Páez, M.; Alvarino, G .; Cantero, P. Viscosidades y propiedades viscosimétricas de la glicina en soluciones acuosas de tiosulfato de sodio pentahidratado (Na2S2O3 .5H2O) a diferentes temperaturas. DYNA. 2014, 81 (186), 218-225. DOI: http://dx.doi.org/10.15446/dyna.v81n186.40023. [ Links ]
10. Mansour, S. E.; Hasieb, I. H. Viscosity B-coefficient for viscous flow of some amino acids during the passage of alternating current at different voltages. Int. J. Biol. Chem. 2012, 6 (1), 17-23. DOI: http://dx.doi.org/10.3923/ijbc.2012.17.23. [ Links ]
11. Anwar, A.; Sabir, S.; Tariq, M. Volumetric, Viscometric and refractive index behaviors of a Amino acids in aqueous caffeine solution at varying temperatures. Acta Phys-chim Sin. 2007, 23 (1), 79-84. DOI: http://dx.doi.org/10.1016/S1872-1508(07)60008-4. [ Links ]
12. Páez, M.; Alvis, A.; Arrázola, G. Efecto de la temperatura sobre la viscosidad de soluciones acuosas diluidas de cloruro de 1-butil-3-metil imidazolio [Bmim+][Cl-]. Inf. tecnol. 2014, 25 (3), 185-190. DOI: http://dx.doi.org/10.4067/S0718-07642014000300021. [ Links ]
13. Zhao, H. Viscosity B-coefficients and standard partial molar volumes of amino acids, and their roles in interpreting the protein (enzyme) stabilization. Biophys. Chem. 2006, 122 (3), 157-183. DOI: http://dx.doi.org/10.1016/j.bpc.2006.03.008. [ Links ]
14. Abdulagatov, I.; Zeinalova, A.; Azizov, N. Experimental viscosity B-coefficients of aqueous LiCl solutions. J. Mol. Liq. 2006, 126 (1-3), 75-88. DOI: http://dx.doi.org/10.1016/j.molliq.2005.10.006. [ Links ]
15. Falkanhagen, H. The quantitative limiting law for the viscosity of strong binary electrolytes. Physik. Z. 1931, 32, 745-764. [ Links ]
16. Bhat, R.; Kishore, N.; Ahluwalia, J.C. Thermodynamic studies of transfer of some amino acids and peptides from water to aqueous glucose and sucrose solutions at 298.15 K. J. Chem. Soc., Faraday Trans. 1. 1988, 84 (8), 2651-2665. DOI: http://dx.doi.org/10.1039/F19888402651. [ Links ]
17. Li, S.; Sang, W.; Lin, R. Partial molar volumes of glycine, L-alanine and L-serine in aqueous glucose solutions at T = 298.15 K. J. Chem. Thermodyn. 2002, 34 (11), 1761-1768. DOI: http://dx.doi.org/10.1016/S0021-9614(02)00125-8. [ Links ]
18. Jiang, X.; Zhu, C.; Ma, Y. Volumetric and viscometric studies of amino acids in L-ascorbic acid aqueous solutions at T=(293.15 to 323.15) K. J. Chem. Thermodyn. 2014, 71, 50-63. DOI: http://dx.doi.org/10.1016/j.jct.2013.11.002. [ Links ]
19. Sharma, S.; Sharma, K. Viscosities of lithium chloride in different composition of lactose at different temperatures. Arch. Appl. Sci. Res. 2012, 4 (4), 1771-1777. [ Links ]
20. Salman, T. A.; Khatab, A. A. Thermodynamic properties of nicotinic acid in dilute HCl and in aqueous NaCl solutions at (293.15, 298.15, 303.15 and 308.15)K. Baghdad Science Journal. 2013, 10(2), 432-441. [ Links ]
21. Bird, R.; Stewart, W.; Lightfoot, E. Fenómenos de Transporte, 2da ed. Editorial LIMUSA WILEY: México, 2006; pp 29-31. [ Links ]
22. Alp, A.; Nain, A. K.; Kumar, N.; Ibrahim, M. Density and viscosity of magnesium sulphate in formamide + ethylene glycol mixed solvents. Proc. Indian Acad. Sci. (Chem. Sci.). 2002, 114 (5), 495-500. DOI: http://dx.doi.org/10.1007/BF02704193. [ Links ]
23. Sinha, B.; Roy, P. K.; Roy, M. N. Apparent molar volumes and viscosity B-coefficients of glycine in aqueous silver sulphate solutions at T = (298.15, 308.15, 318.15) K. Acta Chim. Slov. 2010, 57 (3), 651-659. [ Links ]
24. Roy, M. N.; Banerjee, A.; Roy, P. K. Partial molar volumes and viscosity B-coefficients of nicotinamide in aqueous resorcinol solutions at T = (298.15, 308.15, and 318.15) K. Int. J. Thermophys. 2009, 30 (2), 515-528. DOI: http://dx.doi.org/10.1007/s10765-009-0567-5. [ Links ]
25. Khanuja, P. Volumetric and viscometric study of interactions of amino acids in aqueous sucrose solution at different temperatures. Chem. Sci. Trans. 2013, 2 (4), 1268-1275. DOI: http://dx.doi.org/10.7598/cst2013.524. [ Links ]
26. Yan, Z.; Wang, J.; Zhang, H.; Xuan, X. Volumetric and Viscosity Properties of α-Amino Acids and Their Groups in Aqueous Sodium Caproate Solutions at (298.15,308.15) K. J. Chem. Eng. Data. 2005, 50 (6), 1864-1870. DOI: http://dx.doi.org/10.1021/je0501484. [ Links ]