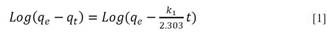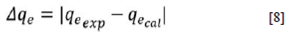Introducción
La contaminación de los ríos y lagos generada por el vertimiento de colorantes provenientes de diferentes sectores industriales (textil, papel, plástico, madera y alimentos) está en continuo crecimiento. Los colorantes reducen la penetración de la luz en las corrientes de agua, generando una reducción en la capacidad de autopurificación de los ríos y lagos, lo cual produce deterioro de los ecosistemas acuáticos debido a la microtoxicidad. Por lo anterior, se han creado normas cada vez más estrictas relacionadas con la eliminación de dichos contaminantes desde aguas residuales provenientes de las industrias generadoras de dichos residuos, antes de realizar la descarga a los cuerpos de agua 1.
Lo anterior conlleva a la búsqueda de nuevos procedimientos eficientes en la remoción de colorantes en aguas residuales. En este sentido, técnicas como la adsorción, coagulación, floculación, oxidación, precipitación y filtración han sido propuestas para dicha remoción. La mayoría de estos procesos son métodos químicos que producen alta cantidad de lodos, causando problemas de disposición de residuos.
Sin embargo, dentro de las técnicas antes mencionadas, el proceso de adsorción es un método adecuado y promisorio para ser utilizado en plantas de tratamiento de aguas residuales con el fin de dar cumplimiento a las regulaciones vigentes. Este método es de fácil operación y posee buena relación entre costo y efectividad 2. Dentro de los materiales adsorbentes comúnmente usados se encuentra el carbón activado comercial, que, aunque es muy eficiente en el proceso de adsorción debido a su alta área superficial, buen volumen de poro y a los diferentes grupos funcionales superficiales activos, presenta alto costo en su producción. Esto ha motivado la búsqueda de adsorbentes alternativos que tengan una mejor relación costo-efectividad. Se ha investigado la conversión de residuos agrícolas en adsorbentes para el tratamiento de aguas residuales, dado que es ambientalmente amigable y tiene el potencial de reducir el costo de la disposición de residuos. Actualmente, se ha estudiado la producción de carbones activados usando precursores renovables y económicos, por ejemplo, subproductos agrícolas como residuos de coco 3, arroz, cáscaras de huevo 4, talas de árboles 1,5, residuos de cosechas 6, entre otros 2,7,8.
Ahora bien, el aceite de palma es el aceite vegetal de mayor producción a nivel mundial 9. Del mismo modo, se ha reportado que la biomasa sólida residual generada en los molinos de aceite de palma es el doble de la cantidad de aceite producido, dicha biomasa residual incluye: troncos, frondas, fibras, conchas y racimos vacíos (9, 10). Dada la disponibilidad de esta biomasa en un solo punto durante todo el ano (plantas de beneficio) y las preocupaciones económicas y ambientales relacionadas con su disposición, los usos potenciales de dicha biomasa para diferentes propósitos ha llamado cada vez más la atención. Así, la cáscara de palma de aceite ha demostrado ser un buen precursor para la producción de carbón activado 10.
Por un lado, la producción de carbón activado involucra dos etapas: la carbonización de la materia prima y la posterior activación del carbonizado en el ambiente oxidativo. La carbonización implica la descomposición térmica destinada a la eliminación de la materia volátil (MV) y la producción de carbono fijo (CF) con desarrollo de porosidad. Parámetros como el tipo de biomasa, tiempo, temperatura y tipo de activación definen la porosidad desarrollada en el material 1,2,7,10.
Por otro lado, el AM es un colorante catiónico ampliamente utilizado en procesos de tinción y es frecuentemente investigado debido a su fuerte capacidad de adsorción en sólidos ya que a menudo sirve como un compuesto modelo en estudios de adsorción de contaminantes orgánicos desde soluciones acuosas 2,6,11.
Con el objetivo de predecir la velocidad de adsorción de AM sobre los carbones activados preparados se utilizan los modelos cinéticos de pseudo primer orden y de pseudo segundo orden.
El modelo de cinética de pseudo primer orden está basado en la ecuación [1].
Donde k1 es la constante de velocidad de adsorción de pseudo primer orden (min-1); qt y qe son las cantidades de AM adsorbidos en un tiempo t y en el equilibrio respectivamente, t (min). Al realizar una gráfica de log (qe - qt) en función del tiempo, los valores de qe y k1 pueden ser determinados a partir del intercepto y la pendiente, respectivamente 8. El modelo de pseudo segundo orden se describe mediante la ecuación [2].
Donde qe y qt es la cantidad de AM adsorbido (mg/g) en el equilibrio y en el tiempo t (min), respectivamente, y k2 es la constante de velocidad de pseudo segundo orden (g/mg min). Basados en los datos experimentales de qt y t, la capacidad de adsorción en el equilibrio (qe) y la constante de velocidad de pseudo segundo orden (k2) pueden ser determinadas a partir de un gráfico de t/qt Vs t usando la pendiente y el intercepto, respectivamente.
Para describir la interacción entre el contaminante y el material adsorbente y cuantificar la capacidad de adsorción en el equilibrio de los carbones pueden usarse los modelos de isotermas de Langmuir y Freundlich. El modelo de Langmuir tiene varias suposiciones, entre las que están: (i) una molécula de adsorbente ocupa un solo sitio de adsorción sobre una superficie homogénea; (ii) cuando todos los sitios de adsorción están ocupados el adsorbente se satura (con una capacidad de max) y no habrá más adsorción, donde el adsorbato forma una superficie de espesor de una sola molécula (mono-capa); (iii) la energía de adsorción no depende de las interacciones entre moléculas adyacentes de adsorbato, es decir no hay interacción entre ellas (12). La Ecuación [3] se usa ampliamente para describir este modelo.
Donde Ce y Qe representan la concentración de AM en el equilibrio (mg/L) y la capacidad de adsorción en el equilibrio (mg/g), respectivamente. Qm indica la capacidad máxima de adsorbato (mg/ g) adsorbido en el equilibrio cuando el adsorbente está saturado y la constante KL es proporcional a la energía de adsorción (L/g). Al graficar Ce/Qe vs , se obtienen líneas rectas, de donde KL y Qmax se pueden calcular usando el intercepto y la pendiente, respectivamente.
En el modelo de Langmuir por medio del factor de separación adimensional también se puede decir si el proceso de adsorción es favorable, lineal, desfavorable o irreversible. El factor de separación adimensional (RL) se calcula según la Ecuación [4] 13.
Donde RL es el factor de separación adimensional, KL es la constante de Langmuir y C i es la concentración inicial de AM.
Para sistemas heterogeneos es común usar el modelo de Freundlich, el cual maneja los siguientes supuestos: (i) la energía de adsorción disminuye logarítmicamente con el incremento lineal del número de sitios ocupados, y (ii) no existe límite para la cantidad de adsorbato que pueda unirse a la superficie del adsorbente 12. La forma lineal de la ecuación de Freundlich se da como se muestra en la Ecuación [5].
Donde KF es la constante de disociación de Freundlich, la cual presenta altos valores cuando el adsorbato tiene mayor afinidad hacia los sitios de adsorción o enlace y la constante n es proporcional a la intensidad de reacción. KF y n se pueden determinar a partir del intercepto y pendiente de la relación lineal de log Qe Vs log Ce, respectivamente.
En el presente estudio se produjeron carbones activados a partir de residuos generados en la producción de palma de aceite mediante activación química. Se evaluó su habilidad de remover AM y se caracterizaron mediante diferentes técnicas de análisis.
Materiales y métodos
Preparación y caracterización de los materiales
Para obtener carbón activado se usaron dos tipos de residuos, F y C procedentes de la producción de palma de aceite. Para la activación química, se utilizó la relación, biomasa: ZnCl2 de 1:2 (g:mL) y se dejó en agitación durante 24 horas.
La relación de impregnación fue escogida dado que ha sido reportado que el incremento del agente activante lleva a obtener carbones activados con alta área superficial 14-17. Transcurrido este tiempo, se calcinaron las dos biomasas en una mufla a 550 °C durante 30 min con una velocidad de calentamiento de 20 °C/min; se lavaron con 50 mL de HCl 37% (p/p) manteniéndolas en agitación a 30 °C durante tres horas.
Las muestras se pasaron por un filtro (fibra de vidrio Advantec OC 50, Vernon Hills, USA.) y se lavaron con agua destilada, repitiendo el proceso hasta obtener un pH entre 6 y 7. Finalmente se secaron en una estufa a 105 °C durante 1 h. Se obtuvieron dos carbones activados: FA y CA. Para efectos de comparación se sometieron las dos biomasas solo al proceso de calcinación a 550 °C durante 30 minutos y se denominaron fibra calcinada (FC) y cáscara calcinada (CC).
El análisis próximo (TOA Q500, TA Instruments, New Castle, USA), análisis elemental (CHN/CHNS/O TrueSpec® Micro, LECO, Michigan, USA) y la humedad presente en cada una de las biomasas utilizadas determinada por TOA se presentan en la Tabla 1. Todos los análisis se realizaron por triplicado. Los carbones activados fueron caracterizados en su área superficial (ASAP 2020, Micrometrics, Oeorgia, USA.), siguiendo el método BET (Brunauer, Emmett y Teller) 14, mediante la adsorción de nitrógeno el cual es un procedimiento estándar para la determinación de la porosidad de adsorbentes. La morfología se determinó mediante escanografía de barrido electrónico, SEM-EDS (Philips XL 30 SFEO, Tustin, California, USA).
Tabla 1 Propiedades de la biomasa.
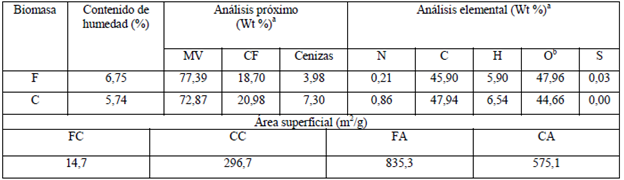
F: fibra; C: cáscara; MV: material volátil; CF: carbono fijo; N: nitrogeno; C: carbono; H: hidrogeno; O: oxlgeno; S: azufre; FC: fibra calcinada; CC: cáscara calcinada; FA: fibra activada; CA: cáscara activada. a En base seca. bPor diferencia (O% = 100% - C% - N% - H%) Todos los valores reportados corresponden a promedios de análisis realizados portriplicado.
Pruebas de adsorción
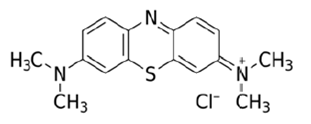
Para los experimentos de adsorción se usaron soluciones sintéticas de AM (la estructura química del AM se muestra en la Figura 1) a concentraciones de 50, 100 y 150 mg/L; las pruebas se realizaron en un montaje tipo Batch a 200 rpm. Mediante el estudio cinético se pudo determinar el tiempo óptimo de contacto y mediante el estudio de equilibrio se determinó la capacidad de adsorción de los materiales en cada solución. Con el fin de determinar la concentración final de AM se realizó una curva de calibración y se obtuvo la ecuación de la recta (Ecuación [6]) con un R2 de 0.9999. La absorbancia para determinar la concentración se midió en el espectrofotómetro VIS-DR 3900 (Hach, Loveland, Colorado, USA) a una longitud de onda de 665 nm.
Donde y es la absorbancia y x es la concentración de AM (mg/L).
Experimentos de cinética
Para la determinación del tiempo óptimo de contacto se adicionaron 0,02 g de carbón activado a un erlenmeyer con 50 mL de las diferentes soluciones de AM. La mezcla se agito y se tomaron muestras a 5, 10, 15, 20, 25, 30, 45, 60, 90, 120 y 180 min y se midió la absorbancia de cada muestra.
Con los experimentos de cinética de adsorción se puede predecir la velocidad a la que un contaminante es removido desde soluciones acuosas y proporcionar datos que faciliten la comprensión del mecanismo de adsorción 12. En el presente estudio, se utilizaron los modelos cinéticos de pseudo primer orden y de pseudo segundo orden. La adecuación entre valores predichos por los modelos y los datos experimentales se estimó a partir del coeficiente de correlación, R2.
Para analizar la velocidad de adsorción de AM dentro del material adsorbente y la cantidad adsorbida a un tiempo determinado (t) se debe calcular el balance de masa entre la concentración inicial y la concentración en el tiempo t de acuerdo a la ecuación [7].
Donde qt es la capacidad de adsorción del adsorbente (mg/g), Ci y Ct son las concentraciones iniciales y en el tiempo t de AM en la solución (mg/L), V es el volumen de la solución (L) y w es la masa del adsorbente (g). Mediante este proceso también es posible determinar el tiempo óptimo de contacto 12.
Experimentos de equilibrio
Para los experimentos de equilibrio se adicionaron cantidades entre 0,02 y 0,1 g de adsorbente en un erlenmeyer y 50 mL de las diferentes soluciones de AM. Después de 2 h de agitación (tiempo óptimo de contacto) se tomaron las muestras y se midió la absorbancia a 665 nm.
Con estos experimentos se puede describir como se da la interacción entre el contaminante y el material adsorbente, y son importantes para optimizar el uso de dichos adsorbentes. Por medio de modelos de isotermas de Langmuir y Freundlich, se cuantifico la capacidad de adsorción en el equilibrio de los carbones activados y se describió el proceso de adsorción.
Resultados y discusión
Caracterización de los materiales
El análisis próximo (Tabla 1) involucra la determinación de humedad, MV, CF y cenizas presentes en la biomasa. Puede observarse que tanto la fibra como la cáscara poseen alto contenido de MV, contenido medio de CF y bajo contenido de cenizas (materia mineral). Con estos análisis es posible decir que en el proceso de calcinación se perdió alrededor de un 75% en masa debido a la eliminación del MV, quedando el carbono listo para ser activado. Estos resultados están dentro del rango de valores reportados en la literatura para residuos de palma, lo que indica que este material puede ser usado para la fabricación de carbón activado 10,18.
Para observar la morfología de los dos tipos de biomasa residual tanto calcinadas como activadas (FC, FA, CC y CA) se realizó el análisis SEM, el cual se presenta en la Figura 2. En las micrografías pueden observarse cambios significativos en la morfología de las biomasas estudiadas. Las imágenes para las biomasas calcinadas, FC y CC, muestran un bajo desarrollo de porosidad, lo que está de acuerdo con los valores determinados de áreas superficiales (14,7 m2/ g para la FC y 296,7 m2/g para la CC); esta porosidad es generada por la liberación de los compuestos volátiles durante el proceso de calcinación 19. Las micrografías para las biomasas activadas (FA y CA) con ZnCl2, muestran una superficie discontinua causada por la acción de deshidratación del agente activante 7,20,21, que conlleva al buen desarrollo de porosidad y por lo tanto al incremento del área superficial, con valores de 835,3 m2/g y 575,1 m2/g para la FA y CA, respectivamente.

Figura 2 Micrografia SEM de los materiales calcinadosy activados. FC: fibra calcinada; FA fibra activada; CC: cáscara calcinada; CA: cáscara activada.
Lo anterior indica que el proceso de activación es más eficiente para la FA dado que el área superficial es 57 veces mayor con respecto a la FC, mientras que para la cáscara el proceso de activación solo incrementa al doble el área superficial. Este parámetro es uno de los más importantes a tener en cuenta en los carbones activados dado que es ampliamente conocido que, a mayor área superficial del solido poroso, mayores serán los sitios disponibles para el proceso de adsorción, lo cual implica mayor capacidad de adsorción 22.
Selección del adsorbente
Una serie de experimentos fueron desarrollados con el objetivo de evaluar el potencial adsorbente de los dos tipos de biomasa, F y C sin ningún tratamiento previo, con calcinación FC y CC y con el posterior proceso de activación, FA y CA.
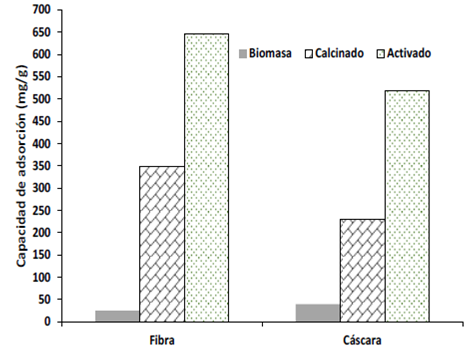
La Figura 3 muestra las capacidades de adsorción para las diferentes muestras trabajadas. Puede observarse que las diversas modificaciones realizadas a la biomasa original generan un impacto positivo en la capacidad de adsorción. Al comparar las dos biomasas calcinadas (FC y CC) con las biomasas activadas (FA y CA) se puede encontrar un incremento en la capacidad de remoción del 46 y 56% para la fibra y la cáscara, respectivamente. Esta tendencia puede explicarse por el incremento del área superficial (Tabla 1) en los materiales activados y por la posible existencia de grupos funcionales superficiales que mejoran dicho rendimiento. Con las consideraciones antes mencionadas, se seleccionaron la FA y la CA como adsorbentes para realizar el estudio.
Las diferencias entre la capacidad de adsorción y el área desarrollada puede estar directamente relacionada con la composición química de cada biomasa, si bien las dos biomasas proceden de los residuos de la palma de aceite, cada uno de ellas presenta diferentes características químicas. En la Tabla 1 puede observarse que la mayor diferencia en composición para las dos biomasas se encuentra en los porcentajes de cenizas y material volátil. El material que obtuvo mayor capacidad de adsorción fue la fibra (646,75 mg/g) (Figura 3), que a su vez presenta mayor área superficial (835 m2/g).
El mayor desarrollo de área superficial puede estar directamente relacionado con la mayor cantidad de material volátil que presenta este tipo de biomasa (Tabla 1), el cual puede generar mayor cantidad de poros durante el proceso de evolución desde el carbonizado 19. La mayor área superficial desarrollada por la fibra implica una mayor capacidad de adsorción del AM. Con lo anterior podría concluirse que el contenido de cenizas no presenta un efecto sinérgico en este proceso de adsorción dado que la cantidad de cenizas para la cáscara es 1,83 veces mayor que la encontrada para la fibra.
Efecto del tiempo de contacto y la concentración inicial en el proceso de adsorción
La Figura 4 describe el efecto del tiempo de contacto y de la concentración inicial de AM en el proceso de adsorción sobre los carbones activados producidos, FA y CA. Tres concentraciones iniciales, 50, 100 y 150 mg/L fueron seleccionadas para una dosis constante de adsorbente de 0,02 g a 28 °C. Los resultados muestran que en un inicio hay adsorción rápida, seguida de una disminución hasta alcanzar el equilibrio.
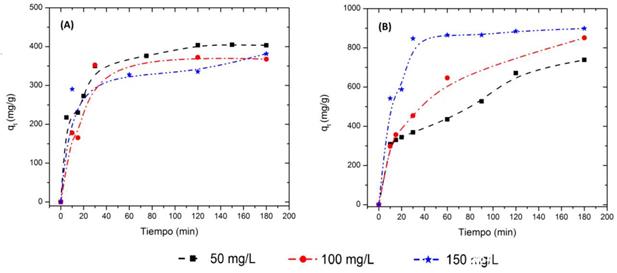
Figura 4 Efecto del tiempo de contacto y la concentración inicial de AM en el proceso de adsorción de AM usando A: CA y B: FA. CA: cáscara activada y FA: fibra activada.
Esto puede explicarse porque inicialmente hay alta disponibilidad de sitios activos utilizables a etapas tempranas del proceso de adsorción. Con la evolución del proceso, la competencia entre partículas de AM con los grupos funcionales superficiales del material adsorbente retarda el proceso de adsorción 22. La capacidad de adsorción en el equilibrio incrementa desde 671,1 mg/g hasta 884,5 mg/g para el FA cuando la concentración inicial de AM incrementa de 50 a 150 mg/L, mientras que para el CA ocurre lo contrario, la capacidad de adsorción en el equilibrio disminuye desde 403,5 mg/g hasta 335,5 mg/g.
La transferencia de masa incrementa con la concentración, resultando en alta adsorción de AM. Esta tendencia puede deberse a que la CA se satura rápidamente a bajas concentraciones, lo que conlleva a que no haya una evidencia en el efecto del incremento de la concentración inicial en la capacidad de adsorción. Estos dos resultados dan indicio de la diferencia en la estructura de poro que presentan los dos materiales. El caso contrario se observó en el porcentaje de remoción, a medida que la concentración inicial incrementa de 50 a 150 mg/L, el porcentaje de remoción disminuye de 58% a 25% y de 36% a 10% para FA y CA, respectivamente. Con todo lo anterior, es posible determinar que la adsorción de AM sobre el carbón activado producido está fuertemente influenciado por la concentración inicial.
Experimentos de cinética
Los estudios cinéticos son de gran valor, porque a través de ellos es posible obtener información relacionada con la velocidad límite del proceso de adsorción y sobre los diferentes estados de transición que pueden llevar a la formación del complejo final adsorbato-adsorbente 23. La Tabla 2 muestra los parámetros cinéticos de los modelos pseudo primer orden y pseudo segundo orden. Para los dos carbones activados producidos se observó una cinética rápida de adsorción en los primeros 30 min y para garantizar un buen tiempo de equilibrio se tomó 2 h como el tiempo óptimo de contacto.
Tabla 2 Parámetros de los modelos cinéticos de pseudo primer orden y pseudo segundo orden en la adsorción de AM a diferentes concentraciones.
| Material | C AM (mg/L) | qe exp. (mg/g) | Pseudo-primer orden | Pseudo-segundo orden | |||||
| qe (mg/g) | kj (min-1) x 10-3 | R2 | qe (mg/g) | kj (min-1) x 10-3 | R2 | ||||
| FA | 50 | 671,1 | 407,9 | -38,00 | 0,79 | 769,2 | 0,57 | 0,94 | |
| 100 | 1090,3 | 773,9 | 6,70 | 0,96 | 1010,1 | 0,46 | 0,93 | ||
| 150 | 884,5 | 700,0 | -65,40 | 0,87 | 925,9 | 2,12 | 1,00 | ||
| CA | 50 | 403,5 | 562,6 | -25,30 | 0,97 | 420,2 | 3,56 | 1,00 | |
| 100 | 372,3 | 321,1 | -56,00 | 0,87 | 398,4 | 6,70 | 0,96 | ||
| 150 | 335,5 | 209,3 | -97,20 | 0,83 | 411,5 | 2,02 | 0,96 | ||
FA: fibra activada; CA: cáscara activada; Ci AM: concentración inicial de azul de metileno; qe: capacidad de adsorción en el equilibrio; exp.: experimental; kx: constante de velocidad de adsorción; R2: coeficiente de correlación de Pearson.
Con los datos obtenidos, puede destacarse que el modelo de pseudo primer orden no es apropiado para describir los datos experimentales. Esto se puede verificar por los valores bajos de R2 (0,79 - 0,97) y por los valores altos de Δqe (Ecuación [8]).
Para el modelo de pseudo segundo orden, pueden observarse coeficientes de correlación cercanos a la unidad (R2 > 0,93), y diferencias más pequeñas (Δqc Ecuación [8]) que las encontradas en el modelo de pseudo primer orden para todas las concentraciones trabajadas con los dos carbones activados producidos. Estos resultados indican que hay un ajuste satisfactorio de todos los datos experimentales. Esto sugiere que la quimisorción del AM sobre el carbon activado es la etapa que determina el proceso deadsorción 24,25. El modelo pseudo segundo orden puede interpretarse como un tipo especial de modelo cinético de Langmuir, suponiendo que la concentración del adsorbato es constante en relación al tiempo y a la cantidad de sitios de enlace sobre la superficie que dependen de la cantidad de adsorbato adsorbido en el equilibrio (7).
Resultados similares han sido reportados en la literatura para la remoción de AM usando carbones activados producidos desde diferentes tipos de biomasas 3,7,8.
Experimentos de equilibrio
Las isotermas de adsorción son herramientas útiles para predecir cómo las moléculas del adsorbato están distribuidas sobre la interface sólido-liquido cuando se alcanza el equilibrio químico dando información importante acerca de la capacidad de adsorción del material. Las isotermas de adsorción del AM sobre los carbones activados y los respectivos ajustes para los modelos de Langmuir y Freundlich se muestran en la Figura 5. Los parámetros para cada modelo se indican en la Tabla 3. De acuerdo a esta, la capacidad máxima de adsorción (qm) es de 763,4 y 724,6 mg/g para la FA y la CA, respectivamente, en una solución de 150 mg/L. La capacidad máxima incrementó con el aumento de la concentración inicial de AM. Los altos valores de R2 para el modelo de Langmuir muestran que este modelo ajusta de manera satisfactoria los datos experimentales. El modelo de Langmuir considera que la adsorción ocurre sobre una superficie con sitios homogéneos de energía que están disponibles para la interacción. Sin embargo, esto es solamente válido hasta completar la monocapa.
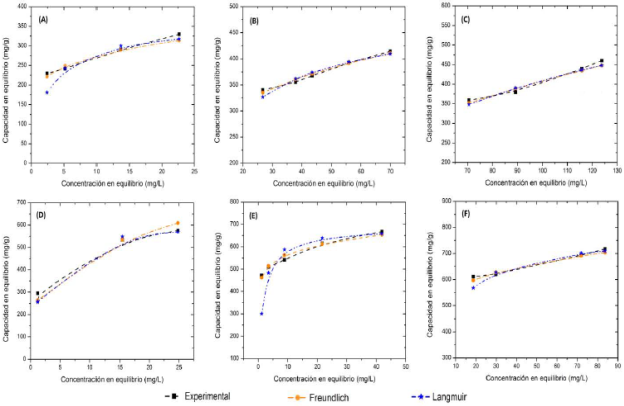
Figura 5 Isotermas de los modelos de Freundlich en la adsorción de AM a diferentes concentraciones comparando carbones activados. Paneles superiores isotermas con CA donde A: 50 mg/L; B: 100 mg/L y C: 150 mg/L; paneles inferiores isotermas con FA donde D: 50 mg/L; E: 100 mg/L y F: 150 mg/L. CA: cáscara activada y FA: fibra activada.
El factor de separación adimensional de las isotermas de Langmuir (RL) es un parámetro importante que indica si el proceso de adsorción es favorable (0 < RL< 1), lineal (RL = 1), desfavorable (RL > 1) o irreversible (RL = 0) 26. Los valores de RL a 50 mg/L y 150 mg/L como concentración inicial de AM están en el rango de 0,01 a 0,04 y de 0,04 a 0,34 para FA y CA, respectivamente. Lo anterior indica que el proceso de adsorción es favorable para el rango de concentraciones trabajadas usando los dos tipos de adsorbentes producidos.
El modelo de Freundlich toma en cuenta el postulado que dice que en el proceso de adsorción ocurre adsorción en multicapas sobre una superficie heterogénea. En la Tabla 3 pueden observarse buenos coeficientes de linealidad (R2 > 0.90), lo cual indica que el modelo describe de manera satisfactoria los datos experimentales. Los parámetros n y dan información importante sobre la interacción del sistema AM-carbón activado. El es definido como el factor de heterogeneidad e indica cuando el proceso de adsorción es lineal (n = 1), físico (n > 1) o químico (n < 1) 27. Los valores determinados para los dos carbones activados muestran valores de n > 1 dando cuenta de procesos de fisisorción.
Tabla 3 Parámetros de las isotermas de Langmuir y Freundlich en la adsorción de AM comparando carbones activados
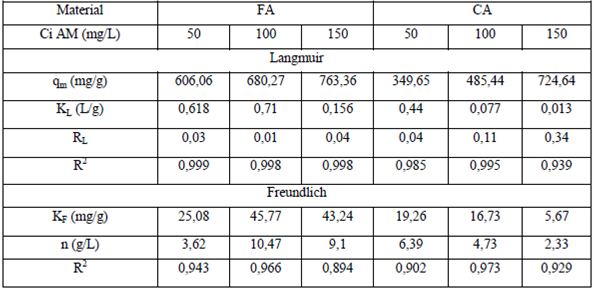
FA: fibra activada; CA: cáscara activada; Ci AM: concentración inicial de azul de metileno; qm: capacidad máxima de adsorción; KL: constante de Langmuir; RL: factor de separación adimensional; R1: coeficiente de correlación de Pearson; KF: constante de disociación de Freundlich; n: constante.
Comparación con otros adsorbentes
En la Tabla 4 se comparan las capacidades máximas de adsorción de los carbones activados obtenidos en este estudio con las de otros carbones activados que están reportados en la literatura 19,20,25 y que se obtuvieron con el mismo agente activante (ZnC12). Adicionalmente, se presenta la comparación de carbones activados obtenidos de residuos de palma de aceite preparados por diferentes métodos de activación (28-30). Se puede ver que la FA y la CA, materiales obtenidos en este estudio, tienen capacidades superiores, lo cual sugiere que poseen un gran potencial para aplicarlos como adsorbentes en la remoción de colorantes desde soluciones acuosas.
Tabla 4 Comparación de capacidades máximas de adsorción de AM de diferentes adsorbentes activados química y físicamente.
| Material precursor | Qm (mg/g) | Metodo de activación | Referencia | |
| Quimico | fisico | |||
| FA | 763,4 | ZnCl2 | Ene ste estudio | |
| CA | 724,6 | ZnCl2 | ||
| Residuos de papa | 540,0 | ZnCl2 | (19) | |
| Huesos de dátil | 398,2 | ZnCl2 | (20) | |
| Cáscaras de avellanas | 476,2 | ZnCl2 | (25) | |
| Cáscara de palma | 243,9 | koh | CO2 | (28) |
| Fibra de palma | 312,5 | Microondas | (29) | |
| Madera de palma | 90,9 | CO2 y H2O | (30) | |
Conclusiones
Los carbones activados producidos por activación química con ZnCl2 a partir de los residuos de la palma de aceite, fibra (mesocarpio) y cáscara (endocarpio) exhiben áreas superficiales de 835,30 y 575,13 m2/g, respectivamente, lo que indica que pueden ser usados como adsorbentes de AM. Los estudios cinéticos y de equilibrio para la adsorción de AM se llevaron a cabo a diferentes concentraciones iniciales y los datos experimentales se ajustaron a los modelos matemáticos. El modelo de pseudo segundo presentó el mejor ajuste, lo que sugiere que la quimisorción del AM sobre los carbones activados es la etapa que determina el proceso de adsorción.
El modelo de Langmuir es adecuado para describir la adsorción de AM en los carbones activados producidos en este trabajo, mostrando una capacidad máxima de adsorción qm de 763,4 y 724,6 mg/g para FA y CA, respectivamente. Por todo lo anterior, los resultados mostrados en este estudio permiten concluir que los residuos de palma (fibra y cáscara) son precursores potenciales para la producción de carbón activado para la adsorción de contaminantes orgánicos, tal como el AM.