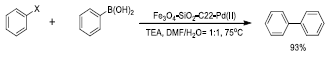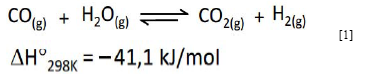Introducción
Recientemente la catálisis heterogénea se ha convertido en una herramienta estrategica tecnológica debido a sus ventajas relacionadas con los procesos de producción, competitividad y economia. Esta catálisis se aplica en diversas transformaciones quimicas a nivel industrial, por ejemplo en la refineria de petróleo, en la sintesis de productos de quimica fina y farmaceuticos y en diversas sintesis orgánicas. En dichos procesos se minimiza el impacto ambiental, pues frecuentemente el uso de disolventes orgánicos inflamables y de reactivos tóxicos es menor. Asi mismo, se reducen las condiciones drásticas de reacción y se simplifican las separaciones complejas mediante la generación de productos con mayor selectividad; además permite la fácil separación de los catalizadores de los sistemas de reacción y posibilita su reutilización 1).
Muchos de estos procesos de catálisis heterogénea han integrado el uso de catalizadores con particulas de tamaño nanometrico, por lo que en los Ultimos anos un gran número de investigaciones se ha enfocado en la sintesis de nanoparticulas ferricas o ferrosas. Asi, diversas formas de óxidos de hierro como FeO (wustita), a-Fe2O3 (hematita) y y-Fe2O3 (maghemita) se han empleado exitosamente en catálisis 2-4. Sin embargo, las nanoparticulas de Fe3O4 (magnetita) han tomado mayor importancia en sus posibles aplicaciones gracias a que exhiben buena actividad catalitica, además de la posibilidad de ser modificadas mediante anclaje de ciertas especies quimicas y a sus propiedades ferrimagneticas que facilitan su separación de los medios de reacción mediante la aplicación de campos magneticos de intensidad apropiada.
La magnetita se puede prepar fácilmente, sin embargo, tambien existen yacimientos a nivel mundial de los cuales puede ser obtenida y posteriormente purificada. Este óxido de hierro tiene una superficie suficientemente reactiva para inmovilizar metales, ligantes orgánicos, enzimas y otros tipos de moleculas que le confieren funcionalidades específicas. Generalmente se considera inerte en medios biológicos, lo que hace apropiado su uso en metodos de imagen y de separación en tejidos vivos 5. En este sentido, en el campo de la medicina y de la biotecnologia, las nanoparticulas de magnetita son útiles en la detección de hipertermia y en el transporte selectivo y liberación de fármacos, fenómenos con futuras aplicaciones en terapias contra el cáncer 6, en el mejoramiento y contraste de las imágenes por resonancia magnetica para efectos de diagnóstico medico 7 , 8, en la caracterización de fluidos magneticos inteligentes 9, en la reparación de tejidos y en la separación celular 10.
La magnetita tambien se utiliza como soporte versátil de un gran número de catalizadores funcionalizados, empleados en la catálisis de una gran variedad de reacciones orgánicas e inorgánicas. En general, diversos óxidos nanoestructurados basados en magnetita son buenos dispositivos para la manufactura de materiales magneticos, peliculas de protección sensibles y pigmentos, asi como para el tratamiento y eliminación de residuos y agentes contaminantes del agua 11.
De esta manera, se considera de gran importancia destacar los trabajos cientificos actuales más relevantes que involucran el uso de este mineral en el diseño de catalizadores heterogeneos. En el presente trabajo se realizó una revisión actualizada de las aplicaciones potenciales de la magnetita en la preparación de diversos sistemas cataliticos en estado sólido, utilizados en sintesis orgánica.
Con ello se pretende consolidar cierta información fundamental que contribuya a avanzar en el diseño de nuevos materiales magneticos, basados en Fe3O4, con propiedades cataliticas y de fácil separación. De igual manera, se describen otras aplicaciones de la magnetita como soporte funcional involucrado en procesos biotecnológicos e industriales. La caracterización de las microparticulas o nanoparticulas sintetizadas en los estudios mencionados no se discute en esta revisión. Finalmente, se hace una descripción de los yacimientos de este mineral en Colombia y la importancia de su explotación para usos potenciales en procesos de catálisis heterogénea.
Estructura y propiedades de la magnetita (Fe 3 0 4 )
Mineralógicamente la magnetita es una mena corriente de hierro, se halla diseminada como mineral accesorio en muchas rocas igneas, en ocasiones formando grandes masas de mineral que generalmente son muy titaniferas y aparece asociada a rocas metamórficas cristalinas. Tambien se encuentra en las arenas negras de las playas de mar, como hojas finas y como dendritas entre hojas de mica; es constituyente común de las formaciones ferricas del precámbrico con origen quimico sedimentario, principalmente en la región del Lago Superior. Estas formaciones contienen un 25% de hierro en forma de magnetita y constituyen hoy la fuente principal de hierro en los Estados Unidos de America 12. Los mayores depósitos del mundo se encuentran al norte de Suecia y otros depósitos importantes en Noruega, Rumania, Rusia, Siberia y África del sur 12.
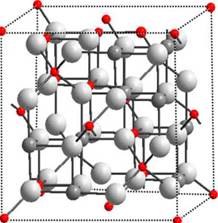
Quimicamente la magnetita, Fe3O4 (o tambien FeFe2O4), es un óxido mixto de hierro; su composición corresponde a 27,6% de oxigeno y 72,4% de hierro. Cristaliza en un sistema cúbico centrado en las caras (FCC de oxigenos, a = 8,40 A) con estructura de espinela inversa, como se ilustra en la Figura 1. Su relación estequiometrica de cationes puede expresarse en la forma Fe3+(Fe2+.Fe3+)O4, con un grupo espacial Fd3m1,6. En su celda unitaria de 56 átomos, 32 son de oxigeno y 24 son cationes de hierro, de los cuales 16 están en forma ferrica (Fe3-) y 8 en forma ferrosa (Fe2-). Los átomos de oxigeno forman una celda unitaria cúbica centrada en las caras y los cationes de hierro están alojados en los espacios intersticiales; las posiciones tetraedricas corresponden especificamente a cationes Fe3-y en las posiciones octaedricas se alojan cationes Fe3- y Fe2- por igual 6,13.
La mezcla de ambas posiciones (capas octaédricas y octaédricas/ tetraédricas) a lo largo de la dirección [111] genera superposición de pianos 111, los cuales se consideran más estables (con menor energía de superficie) en las estructuras FCC 14,15. Una velocidad de crecimiento mayor en la dirección [100] con respecto a la velocidad de crecimiento del cristal en la dirección [111] ocasiona cristales de magnetita preferiblemente octaédricos 6. Los octaedros regulares presentan estructuras energéticamente favorables desde el punto de vista cristalográfico (energías de red cristalina más bajas), razón por la cual los cristales de magnetita se encuentran con mayor frecuencia en esta forma 16,17. Sin embargo, de manera sintética es posible ejercer control sobre el crecimiento del cristal en direcciones preferenciales y con ello la obtención de partículas con diferentes morfologías (6, 14) . En la Tabla 1 se describen algunas características generales para la magnetita natural.
Tabla 1 Características generales de la magnetita natural 12.
| Fórmula quimica | FeFe2O4(Fe2+Fe:+ 2O4),Fe3O4 |
| Clase | Oxido |
| Grupo | Espinela |
| Etimologia | El nombre probablemente se deriva de la localidad de Magnesia, en Macedonia |
| Sistemay clase | Isometrico 4/m32/m |
| Tipo de celda unitaria | Cubica (espinela inversa) |
| Grupo espacial | Fd3m, a = 8,40 A; Z = 8 |
| Posiciones en | Valores de espaciado interplanar d (A): |
| difracción de rayos X | 2,96-2,53- 1,61 - 1,48- 1,09 |
| (DRX) | |
| Color | Negro |
| Brillo | Metálico |
| Densidad | 5,2 g/cm3 |
| Optica | Opaco, de color gris e isótropo |
| Magnetismo | Ferrimagnetica |
| Forma de presentarse | Frecuentemente en cristales |
| en la naturaleza | octaédricos, raramente en dodecaedricos. Masivo o diseminado en agregados, gránulos compactos, también en arenas sueltas magnéticas |
En la estructura de Fe3O4, las dos posiciones cristalinas (tetraédricas y octaédricas) forman la base para dos subredes cubicas intercaladas con contribuciones de momentos magnéticos desiguales y antiparalelos (18). Esto da lugar al comportamiento ferromagnético a temperaturas menores que la temperatura Curie (T = 585 °C): los momentos magnéticos de los espines de todos los cationes Fe3+ se anulan entre si y no contribuyen a la magnetización del sólido, en comparación con los cationes Fe2+ que si tienen sus momentos magnéticos alineados en la misma dirección y su momento total es responsable de la magnetización neta de este tipo de material. Por encima de la temperatura Curie el óxido muestra un comportamiento paramagnético 19.
A temperaturas superiores a TV = 120 R (temperatura de Verwey) los electrones en los sitios octaédricos de la magnetita se encuentran térmicamente deslocalizados entre los cationes Fe3+ y Fe2+ (fenómeno conocido como electrón hopping)18,20. Lo anterior ocasiona la mayor conductividad electrica y térmica en comparación con otros óxidos de características similares. Debido a este hecho la magnetita es la única ferrita que presenta comportamiento semimetálico 18.
Por otro lado, las propiedades magnéticas de este tipo de ferrita dependen fuertemente del tamaño de partícula. Cuando las partículas de Fe3O4 se reducen a escala nanométrica, sus propiedades magnéticas decaen: la magnetización de saturación (Ms), la remanencia magnética (Br) y la fuerza coercitiva (Hc) disminuyen drásticamente y, en consecuencia, las nanopartículas exhiben un comportamiento denominado superparamagnetic 21. Dicho comportamiento se produce cuando la energía térmica de estas partículas puede superar ciertas fuerzas de unión, ocasionando que los momentos magnéticos atómicos fluctúen al azar. Así, las partículas superparamagnéticas adquieren cierta magnetización cuando se aplica un campo magnético externo pero, debido a su energía térmica, dicha magnetización se pierde cuando este último es retirado 22,23
Finalmente, a nivel de la superficie, los sitios activos de la magnetita son tanto los cationes Fe3+ y Fe2+ como los átomos de oxigeno (aniones O2") y su nivel de exposición depende de los planos mostrados preferencialmente por el cristal Por ejemplo, para los planos 111, frecuentemente muy estables para esta estructura (Figura 2), los cationes Fe3+ que se comportan como ácidos de Lewis 24 se exponen en una monocapa formando celdas 2x2 de 5,94 A 25 De igual manera, los átomos de oxigeno que no están totalmente coordinados actúan como bases de Brónsted 24. Por tanto, ambos sitios activos (átomos de hierro y de oxigeno) se encuentran en la superficie accesible a los sustratos, lo que confiere a la magnetita características potenciales como catalizador y como soporte catalitico magnético 24,25
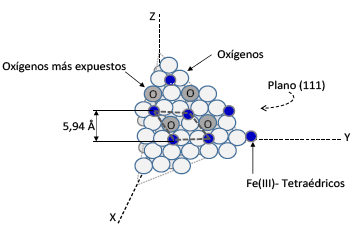
Figura 2 Sitios activos expuestos en el plano (111) de la superficie de la magnetita (Fe3O4), de acuerdo a la información de Rim et al25.
Importancia de la magnetita en catálisis heterogénea
A pesar de sus ventajas, muchos sistemas catalíticos homogéneos no se comercializan debido a la dificultad para separar el catalizador del producto final de reacción (26) El uso de sistemas catalíticos heterogéneos es una estrategia adecuada que supera los problemas de separación, debido al empleo de materiales en fase diferente (típicamente sólidos) a la correspondiente de los reactivos y productos de la reacción Sin embargo, muchas veces la separación del catalizador sólido se dificulta como consecuencia del tamaño de partícula, generalmente de escala nanométrica, haciendo ineficiente los procesos de filtración e incluso de centrifugación En dicha situación es deseable contar con sólidos cuyas propiedades magneticas faciliten su separación. En este sentido, la magnetita es usada con frecuencia en catálisis heterogénea por sus caracteristicas: comportamiento ferrimagnetico o superparamagnetico (cuando las particulas son nanometricas) 27, fácil preparación, posibilidad de funcionalización de su superficie, estabilidad durante las reacciones y baja toxicidad, entre otras.
El efecto del tamaño de particula es un factor determinante en los procesos cataliticos. Las nanoparticulas (1-100 nm) exhiben propiedades substancialmente diferentes de las que presenta el material en forma másica con macroparticulas 1. Generalmente, la actividad catalitica de la magnetita se incrementa con el empleo de nanoparticulas, ya que estas presentan mayor cantidad de sitios activos accesibles en comparación con las particulas más grandes, debido a la cantidad de átomos expuestos en la superficie del material. En una nanoparticula de 13 átomos se calcula que el 92% de estos son átomos en la superficie, mientras que en una nanoparticula de 55 átomos sólo el 76% son átomos de la superficie, en una de 147 el 63%, en una de 309 el 52% y en una de 1415 el 35% 27. Esto favorece la funcionalización de la superficie de la magnetita con metales o ligantes apropiados con actividad catalitica especifica.
Algunas generalidades sobre la caracterización de las particulas de magnetita
La caracterización de estas particulas magneticas implica el análisis de un número amplio de parámetros quimicos y fisicos, como la morfologia, la estructura, el tamaño, las caracteristicas quimicas de la superficie y la presencia de impurezas 1,27. Dentro de las tecnicas empleadas para dicha caracterización se contemplan la microscopia electrónica de transmisión (TEM) y la microscopia electrónica de barrido (SEM) para la determinación de morfologia y tamaño; la dispersión dinámica de la luz (DLS) para la determinación de tamaño y distribución; microscopia de fuerza atómica (AFM) para el análisis de las caracteristicas de la superficie a escala molecular; difracción de rayos X (DRX) para la identificación de estructuras cristalinas; fluorescencia de rayos X (FRX) para la determinación de la composición elemental; espectroscopia de fotoelectrones de rayos X (XPS) para determinar la naturaleza y estado de oxidación de los átomos de la superficie del material.
Adicionalmente, las isotermas de adsorción-desorción, donde se especifica la cantidad de gas adsorbido por unidad de masa del sólido a diferentes presiones, permiten determinar el área superficial y el tamaño de poros de estos materiales. Para la identificación de grupos funcionales presentes en la superficie del sólido y para la valoración de su acidez (Brónsted y Lewis) se emplea la espectroscopia infrarroja con transformada de Fourier (FT-IR). El cambio en los ambientes estructurales de los cationes de hierro de la magnetita, debido a modificaciones en el material, se evalúa frecuentemente por espectroscopia Móssbauer. El análisis de las propiedades magneticas de las particulas de magnetita se desarrolla mediante curvas de magnetización-desmagnetización, a partir de las cuales se logra la determinación de parámetros como coercitividad, magnetización de saturación y magnetización remanente cuando se le somete a campos magneticos.
En este sentido, el interes de muchas investigaciones a lo largo de los últimos anos se ha centrado en la sintesis (y caracterización) de nanoparticulas de magnetita y su acción directa como catalizadores, o como soporte magnetico en la preparación de estos, sobre lo cual se han encontrado múltiples aplicaciones en sintesis y transformaciones orgánicas 28,29.
Aplicaciones en catálisis
La catálisis heterogénea está ganando, cada vez, más importancia en los procesos de producción de quimica fina y quimica farmaceutica debido a sus ventajas tecnicas 30 deseables en quimica verde, entre las que se destacan: fácil separación de los catalizadores de los medios de reacción (favorecida cuando los materiales poseen comportamiento magnetico) 27,31 , 32; reutilización de los mismos en varios ensayos sin perdida considerable de la actividad catalitica; condiciones de reacción frecuentemente suaves o moderadas; alta selectividad y buenos rendimientos de reacción en tiempos cortos.
El uso de catalizadores heterogeneos en muchas reacciones de sintesis orgánica conlleva frecuentemente a obtener mejores rendimientos en tiempos muy cortos, a aumentar la selectividad (por ejemplo, enantioselectividad, diasteroselectividad, quimioselectividad y regioselectividad) hacia subproductos deseados, permitiendo que los posibles procesos industriales tengan menor impacto ambiental.
A continuación, se aborda la descripción de algunos estudios de sintesis orgánica en los cuales se ha utilizado magnetita, Fe3C>4, como catalizador o como soporte catalitico para la inmovilización de metales o ligantes de diferente naturaleza.
Magnetita como catalizador en sintesis orgánica
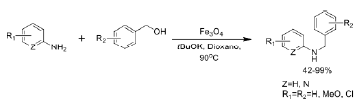
La magnetita puede aportar sitios activos directamente, sin modificaciones ni funcionalización de su superficie, siendo catalizador de ciertas reacciones orgánicas gracias a sus propiedades óxido-reductivas. Por ejemplo, la Figura 3 ilustra la n-alquilación de aminas aromáticas usando alcoholes como electrófilos mediante un proceso de autotransferencia de hidrógeno 1,33, pudiendose reutilizar el catalizador hasta en 10 ensayos 34.
La magnetita puede aportar sitios activos directamente, sin modificaciones ni funcionalización de su superficie, siendo catalizador de ciertas reacciones orgánicas gracias a sus propiedades óxido-reductivas Por ejemplo, la Figura 3 ilustra la n-alquilación de aminas aromáticas usando alcoholes como electrófilos mediante un proceso de autotransferencia de hidrógeno 1,33, pudiendose reutilizar el catalizador hasta en 10 ensayos (34)
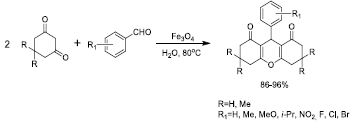
De igual forma, las nanopartículas de magnetita se usan predominantemente en reacciones multicomponentes debido a su carácter como ácido de Lewis. La síntesis de heterociclos tipo 2,3-dihidroquinazolin-4(lH)-onas 35 es un ejemplo de dichas reacciones catalizadas por Fe3O4 (Figura 4). Los ensayos de reacción se llevan a cabo con diferentes sustituyentes de aminas y aldehídos, variando la cantidad de Fe3O4 (se encontró que la mínima cantidad requerida corresponde a 15% molar). En todos los casos se obtuvieron elevados rendimientos de reacción (51a 88%).
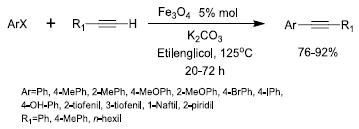
Otra aplicación de interés es la reacción de Sonogashira-Hagihara (Figura 6), que puede ser catalizada con Fe3O-, lo que posibilita el acoplamiento entre alquinos y yoduros arilicos para producir alquinos arilicos en etilenglicol (33, 37). Esta reacción es Ml en la síntesis de moléculas complejas; sus aplicaciones incluyen productos farmacéuticos y nanomateriales orgánicos de interés. El catalizador se reutilizo hasta en cinco ciclos de reacción.
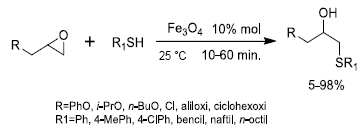
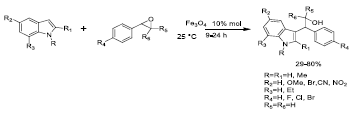
Por otro lado, se han usado nanopartículas de magnetita para catalizar reacciones de apertura de epóxidos en forma selectiva a traves de tioles 38, pirroles e indoles 39, como se muestra en las Figuras 7 y 8, respectivamente. En esta última reacción (Figura 8), se utilizaron epóxidos quirales para garantizar el proceso estereoselectivo con inversión total del estereocentro del epóxido. En ambos procesos se pudo reutilizar el catalizador seis y tres ciclos, respectivamente.
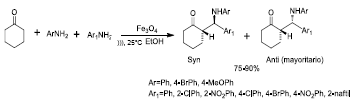
De igual manera, se ha estudiado el uso de magnetita como catalizador en la síntesis estereoselectiva de ß-amino cetonas (Figura 9) vía reacción de Mannich, asistida por ultrasonido 40. Las imágenes SEM mostraron partículas de Fe3O- con tamaño promedio de 40 nm y morfología esférica. Se analizaron diversos parámetros de reaccion, como el tipo de disolvente, temperatura y la cantidad de catalizador, con el fin de obtener los mayores rendimientos de reacción (90%).
El estudio de esta reacción demuestra que el catalizador Fe3O4 permite la síntesis estereoselectiva de compuestos amino-carbonílicos en un paso, a partir de aldehídos, cetonas y aminas.
Magnetita como soporte de catalizadores de metales de transición u óxidos metálicos(M/Fe 3 O 4 o OM/ Fe 3 O 4 ; M = metal, OM = óxido metálico)
La magnetita se ha utilizado como soporte catalitico haciendo uso de la capacidad de modificacion de su superficie, la cual resulta apropiada para la inmovilización de metales y de óxidos metálicos.
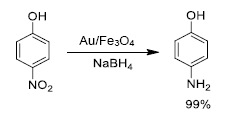
Dentro de los estudios de inmovilizacion de metales y de oxidos sobre la superficie de Fe3O4, Gawande et al.41 diseñaron un catalizador mixto de (Ni, NiO)/ Fe3O4 mediante impregnación de cloruro de níquel sobre magnetita y posterior reducción con NBH4 en solución acuosa. El catalizador en polvo (nanopartículas entre 8 y 30 nm, según análisis por TEM) fue aplicado en reacciones regio y quimioselectivas de reducción de compuestos carbonílicos y nitroaromáticos en presencia de glicerol como agente reductor. De acuerdo a estos resultados, el sistema (Ni, NiO)/Fe3O4, abreviado como Fe3O4-Ni, mostro excelente actividad y selectividad en las reacciones de transferencia de hidrogeno en las que fue utilizado (Figura 10).
De igual manera, Gawande et al.42 sintetizaron nanopartículas catalíticamente activas de MoO3/ Fe3O4 (oxido de molibdeno soportado sobre magnetita), mediante impregnación húmeda. Las imágenes obtenidas por TEM mostraron nanopartículas de morfología esférica con tamaño predominante entre 15 y 30 nm.
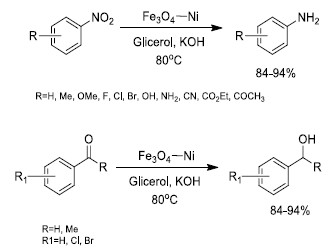
Figura 10 Reacciones de reducción de compuestos nitroaromáticosy compuestos carbonilicos catalizadas por nanoparticulas mixtas formadas de Ni y NiO soportados sobre Fe3O4 abreviadas como Fe3O4 - Ni.
Este catalizador evidenció elevada actividad y selectividad en varias reacciones de oxidación-reducción controladas (oxidaciones, transferencias de hidrógeno, hidrataciones y otras reacciones tricomponentes), como se muestra en la Figura 11. En todos los procesos se obtuvo excelente rendimiento de la reacción, comparados con el uso de nanoparticulas de Fe3O4 solamente; además, el catalizador se utilizó en posteriores ensayos sin perdida significativa de la actividad catalitica inicial.
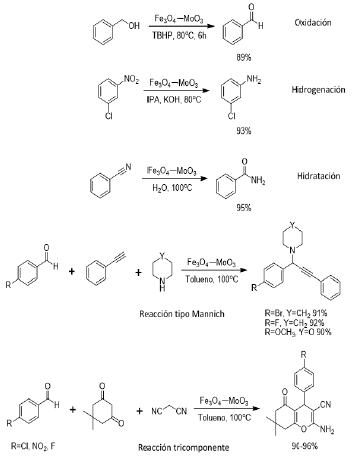
Figura 11 Reacciones catalizadas por óxido de molibdeno soportado sobre magnetita (MoO3/Fe3O4), abreviado como Fe3O4 - MoO3.
Lin y Doong 43 prepararon catalizadores de Au soportado sobre FexO4 mediante descomposición termica de oleatos de hierro en presencia de nanoparticulas de oro (4 a 5 nm). Las imágenes SEM y TEM de la heteroestructura cristalina Au/ Fe3O4 sintetizada mostraron morfologia caracteristica con un tamaño de 5 a 28 nm. Las particulas de Au/Fe3O4 se utilizaron como catalizadores bifuncionales eficientes en la reducción controlada de p-nitrofenol (Figura 12). Otros autores como Huang et al.44 y Goergen et al.45 utilizaron exitosamente catalizadores de Au/FexO4 en reacciones de deshidrogenación de 1,4-butanodiol a y-butirolactona y de ciclohexano a ciclohexeno y benceno, respectivamente. Huang et al. 44 encontraron mayor actividad en los catalizadores de Au/Fe3O4 que en los catalizadores de oro soportado en otros óxidos de hierro.
Estos catalizadores de Au/ fueron separados eficientemente del medio de reacción mediante la aplicación de campos magneticos y algunos de ellos fueron reutilizados hasta seis veces en ensayos sucesivos sin perdida importante de la actividad catalitica.
Dependiendo del interes particular de ciertas reacciones, otros investigadores han preparado eficientemente catalizadores basados en platino, paladio, iridio, rodio, rutenio, o los óxidos de estos metales, soportados en magnetita. La hidrosililación de alquinos catalizada por PtO-PtO 2 / Fe3O4 (46); las reacciones de acoplamiento carbonilativo tipo Sonogashira, catalizadas por Pd/ Fe3O4 para obtener a,ß-alquinilcetonas 47; la sintesis de aminas arilicas mediante la reacción de Buchwald-Hartwig catalizada por Pd-PdO/ Fe3O448 y la alquilación cruzada de alcoholes primarios catalizada por IrO 2 / Fe3O449 son ejemplos del empleo exitoso de estos metales en el diseño de catalizadores soportados basados en magnetita.
Adicionalmente, se ha publicado la catálisis eficiente de algunas reacciones de oxidaciónreducción (oxidación de alcoholes, oxidación de aminas y reducción de compuestos carbonilicos a alcoholes) con catalizadores de Ru(OH)x/ Fe3O450, como tambien el empleo exitoso de catalizadores de Rh/ Fe3O4 en procesos de metanación de carbono usando H2 gaseoso como agente reductor 51. En todos estos casos, los catalizadores mostraron actividad elevada, fueron empleados en varios ciclos de reacción y las especies metálicas (u óxidos metálicos) fueron debidamente caracterizadas por tecnicas apropiadas, como XPS.
La utilización de catalizadores de osmio sobre magnetita (OsO2/ Fe3O4) tambien es frecuente en literatura. Cano et al.52 sintetizaron este tipo de catalizadores, empleándolos con exito en reacciones de dihidroxilación de alquenos para producir dioles en conformación syn (Figura 13). El catalizador se preparó a partir de magnetita (Fe3O4) comercial de tamaño micrometrico (< 5 μm) y una solución acuosa de OsCl3, por el metodo de impregnación húmeda. Las imágenes obtenidas por SEM y TEM mostraron una distribución homogénea de las partículas de osmio (de aproximadamente 2 nm) que corresponden a dos especies caracteristicas OsOg y OsO2(OH)2 sobre la superficie de la magnetita (Fe3O4) .
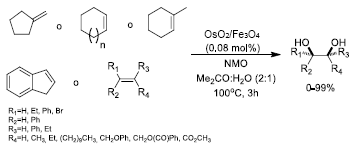
Figura 13 Reacción de dihidroxilación de alquenos, catalizada por OsO2/Fe3O 4 . Se empleo N-óxido de N-metilmorfolina (NMO) como oxidante.
Recientemente se publicó la síntesis de nanopartículas de CuO, con tamaño entre 20 y 30 nm, soportadas sobre Fe3O4 (53). La preparación de este catalizador se llevó a cabo mediante precipitación-depositación (aunque los autores lo describen como una impregnación) de las especies de cobre formadas a partir del precursor CuCl 2 .2H2O en medio acuoso básico. El análisis por EDX (energía dispersiva de rayos X) mostró señales correspondientes a los elementos Fe y Cu como componentes mayoritarios, como consecuencia de la impregnación de las nanopartículas de CuO en la superficie de Fe3O4. El catalizador CuO/ Fe3O4 mostro actividad en la condensación de Knoevenagel de aldehídos pirazolicos con malononitrilo o con dimedona para la obtención de derivados pirazolicos. También catalizo eficientemente reacciones tipo condensación de Ullmann y reacciones para la síntesis de 4-metoxianilina como se muestra en la Figura 14.
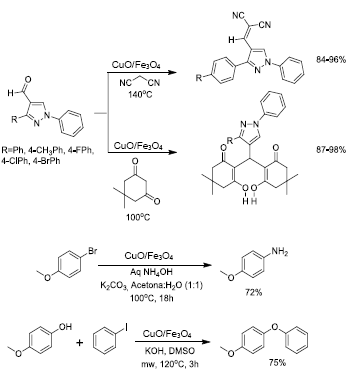
Figura 14 Reacción de Knoevenagel para la obtención de derivados pirazolicos, síntesis de 4-metoxianilina y reacción de condensación de Ullmann, catalizadas por CuO/Fe3O4.
Los derivados pirazolicos son compuestos de gran importancia por su actividad farmacológica, así como los productos de las reacciones de condensación de Ullmann que exhiben excelente actividad biológica 54. El catalizador CuO/ Fe3O4 fue magnéticamente separado del medio de reacción y reutilizado hasta en seis ensayos consecutivos sin perdida de eficiencia 53.
Se observaron rendimientos elevados en los 3 tipos de reacciones, llevadas a cabo desde el primer ensayo hasta el sexto, lo que lo hace un catalizador estable y promisorio a nivel industrial.
Otros autores han sintetizado CuO/Fe3O4 para diferentes aplicaciones cataliticas, como la preparacion de propargilaminas mediante síntesis multicomponente (reacción tipo Mannich) usando alquinos terminales, aminas secundarias y aldehídos o cetonas 55. Adicionalmente, en Perez et al.56 se sintetizo el sistema mixto CuO-NiO/ Fe3O4 y se usó exitosamente en reacciones de cicloadicion multicomponente a partir de alquinos terminales, azida de sodio y derivados de bromuro de bencilo. Se encontró un posible efecto sinérgico en el óxido mixto cuya actividad catalítica se conservó hasta en diez ensayos sucesivos. Por otra parte, en Cano et al.57 se demostró la síntesis eficiente y selectiva de benzofuranos e indoles catalizada por CuO/Fe3O4 y Pd-CuO/Fe3O4, respectivamente, vía reacción de acoplamiento tipo Sonogashira.
Kokate et al.58 abordaron la síntesis del nanomaterial Au-SiO 2 - Fe3O4 , otro tipo de catalizador de magnetita que incluye Au en su estructura, mediante reacciones simultáneas (coprecipitacion de sales de hierro, reducción de cloruro de oro y formación de sílice) en un solo paso. El tamaño promedio de las partículas del catalizador oscilo entre 30 y 40 nm, las imágenes obtenidas por TEM y HRTEM (TEM de alta resolución) revelaron la distribución de partículas de Fe3O4 y Au (menor tamaño) en los poros de la sílice. El material sintetizado mostro actividad catalítica con rendimiento promedio para la oxidacion-esterificacion de alcohol bencílico, libre de solventes en el proceso, que fue magnéticamente separable y reutilizable.
La oxidación total del alcohol en presencia de oxigeno como agente oxidante se lleva a cabo en tres pasos como se muestra en la Figura 15. Inicialmente se da la conversión de alcohol bencílico a benzaldehído en presencia de Au-SiO 2 - Fe3O4; el benzaldehído continúa la oxidación hasta ácido benzoico; finalmente, el alcohol bencílico, no oxidado hasta el momento, reacciona con el ácido para formar benzoato de bencilo como producto final 58.
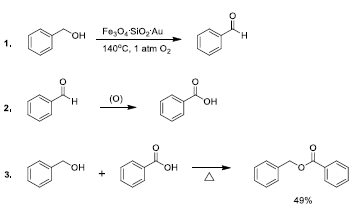
Figura 15 Pasos consecutivos llevados a cabo en la oxidación-esterificación de alcohol bencílico catalizada por Au- SiO2-Fe3O4.
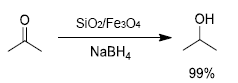
Recientemente, en Shah et al.59 se inmovilizo SiO2 en la superficie de nanopartículas de Fe3O4 utilizando TEOS (tetraetoxido de silicio) como precursor, por el método de coprecipitacion. Los análisis de FTIR y TEM confirmaron la formación de nanopartículas de SiO 2 / Fe3O4 con estructura core-shell. Este solido catalizo la hidrogenación de acetona a isopropanol (Figura 16), con rendimientos de reacción apropiados y una cinética de reacción de segundo orden, mediada por un mecanismo de Langmiur-Hinshenwood.
La máxima eficiencia catalitica en terminos de rendimiento se presentó bajo condiciones de reacción modificables, que involucran irradiación con microondas, efecto de NaBH4, tiempo y dosificación del catalizador. El catalizador fue magneticamente reciclado y reutilizado hasta en cuatro ensayos de reacción.
Magnetita como soporte para el anclaje de ligantes orgánicos en el diseño de catalizadores heterogéneos
Es necesario mencionar algunos estudios en los que este tipo de óxido (Fe304) actúa como soporte de catalizadores heterogeneos separables magneticamente, en los cuales los metales o iones metálicos no se anclan directamente sobre la superficie de la magnetita sino a traves de ligantes y/o conectores especificos funcionales. En general, para el anclaje de las especies SiO 2 / Fe3O4 metalicas, las particulas de magnetita previamente modificadas se hacen reaccionar con los metales o iones metalicos requeridos, a menudo usando grupos funcionales que actúen como una base 1. Los grupos funcionales de interes, actuando frecuentemente como una base de Lewis, coordinan sobre el metal o ion metalico para fijar la especie metalica generando un ambiente quimico que opera como sitio activo. Este tipo de catalizadores es comúnmente utilizado en catalisis asimetrica, donde se aprovecha el entorno estereoquimico generado por los grupos funcionales.
La catalisis asimetrica constituye una forma altamente valiosa de obtener moleculas ópticamente activas, que son utilizadas como precursores de compuestos de importancia farmaceutica (60). Uno de los metodos favorables para sintetizar compuestos enantiomericamente puros (sintesis enantioselectiva) es el empleo de catalisis asimetrica por complejos de metales de transición, para lo cual se requieren complejos metalicos quirales que actúen como catalizador. Para lograr altas eficiencias es necesario seleccionar el metal y los ligantes quirales apropiados que generen el ambiente estereoquimico deseado. De nuevo, la recuperación del catalizador es esencial debido a los costos de los metales preciosos y a la necesidad de eliminar posibles contaminaciones en el producta final. BINAP (2,2'-bis(difenilfosfino)-l,r-binaftaleno) es un ligante quiral organofosforado usado frecuentemente en sintesis asimetrica.
En Hu et al.61 se sintetizó un catalizador soportando el complejo de rutenio BINAP(4,4'-sustituido)-Ru-DPEN (DPEN: 1,2-difeniletilenodiamina) sobre nanoparticulas de magnetita. Este material con propiedades magneticas catalizó eficientemente la hidrogenación asimetrica de cetonas aromaticas (Figura 17), mostrando elevada enantioselectividad (98%) y conversiones mayores al 99%.
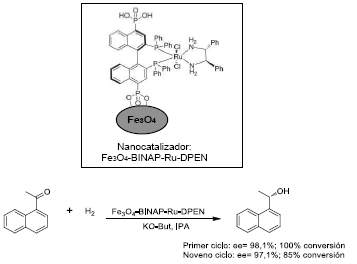
Figura 17 Estructura del catalizador Fe304-BINAP-Ru-DPEN y la reacción de hidrogenación asimetrica de cetonas catalizada por dicho sólido.
Una investigación anterior 60 permitió establecer claramente las caracteristicas superparamagneticas de las nanoparticulas de magnetita funcionalizadas, Fe3O4-BINAP-Ru-DPEN, garantizando tambien la alta eficiencia de los procesos de separación del catalizador mediante campos magneticos.
En otro estudio, Zeng et al.32diseñaron un catalizador de cobre (I) soportando un ligante tipo pibox [bis(oxazolinil)piridina] sobre nanoparticulas de Fe3O4, recubiertas con SiO2 (tipo core-shell), con posterior coordinación de dicho ligante al ion Cu(I). El catalizador se diseñó para la sintesis de propargilaminas, obteniendo excelentes rendimientos y enantioselectividad. Las reacciones se llevaron a cabo tras la adición directa de alquinos terminales a iminas, como se muestra en la Figura 18. La sintesis de propargilaminas es de gran interes en la actualidad debido a sus propiedades neuroprotectoras, antioxidantes y antiapoptóticas 62.
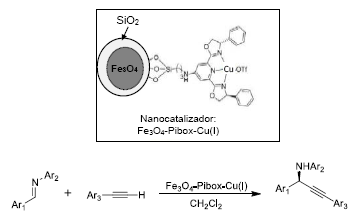
Figura 18 Estructura del catalizador y reacción de alquinos terminales con iminas catalizada por Fe3O4-pibox-Cu(I).
Movassagh et al.63 anclaron el complejo C22-Pd(II), formado a partir del eter tipo corona 1,4,10,13-tetraoxo-7,16-diazaciclooctadecano (conocido como criptando 22), sobre nanoparticulas tipo core-shell de Fe3O4-SiO 2 . La estructura del catalizador se corroboró mediante analisis IR, XPS y TEM. La actividad catalitica se midió en reacciones de acoplamiento Suzuky-Miyaura de haluros de arilo con acidos aril borónicos (Figura 19) y de haluros de arilo con tioles. Las reacciones se llevaron a cabo bajo diferentes condiciones de temperatura, solventes y tiempos de reacción. Las caracteristicas superparamagneticas del catalizador fueron evidentes mediante las curvas de magnetización y su separación magnetica eficiente.
Organocatalizadores soportados en nanopartículas de magnetita
Los organocatalizadores son moléculas o especies quimicas puramente orgánicas (compuestas principalmente de carbono, hidrógeno, nitrógeno, oxigeno, azufre y fósforo), de peso molecular relativamente bajo, capaces de catalizar reacciones quimicas 64,65. Contrario a los catalizadores típicos de complejos con ligantes orgánicos unidos a metales de transición, en los organocatalizadores la actividad catalítica no reside en un metal o ion metálico, sino en la molécula orgánica 64.
La prolina (un aminoácido) es una molécula prototípica empleada exitosamente como organocatalizador en ciertas reacciones de catálisis asimetrica, como reacciones aldólicas, reacciones de Mannich y reacciones de Michael, entre otras. Típicamente, las reacciones organocatalizadas requieren entre 10 y 30% molar de catalizador y su separación y reciclaje del medio de reacción es un trabajo dispendioso 1. Con el fin de utilizar cantidades menores de catalizador y realizar procesos económicamente favorables, actualmente los estudios se centran en inmovilizar los organocatalizadores sobre superficies sólidas apropiadas, como es el caso de la magnetita.
La inmovilización o anclaje covalente de prolina sobre la superficie de nanopartículas de Fe3O4, mediada por el anclaje primario de un derivado de ácido fosfónico, permitió la síntesis del catalizador Fe3O4-(derivado)-prolina y su evaluación catalítica en reacciones de acoplamiento tipo Ullmann a 110 °C, para la arilación de varios heterociclos a partir de bromuros de arilo 66. Los rendimientos de reacción fueron excelentes, en su mayoría mayores al 80%. Después de cada proceso, el catalizador fue separado magnéticamente, conservando su actividad hasta en cuatro ciclos de reacción.
Generalmente se han fijado diversos grupos amino a las nanopartículas de magnetita para obtener organocatalizadores soportados de carácter básico con propiedades magnéticas 67. En particular, el ácido 4-piperidincarboxilico (4-ppc) fue anclado sobre partículas nanométricas de Fe3O4 mediante el grupo carboxílico, exponiendo los grupos amino de las moléculas inmovilizadas como sitios activos para la síntesis catalizada de nitroalquenos mediante la reacción de Knoevenagel 68. Los rendimientos de la reacción elevados (Figura 20) y la separación magnética exitosa del catalizador, además de las caracterizaciones realizadas y su reutilización en cuatro ciclos de reacción sin perdida considerable de actividad, indican la potencialidad y las ventajas de este sistema soportado.
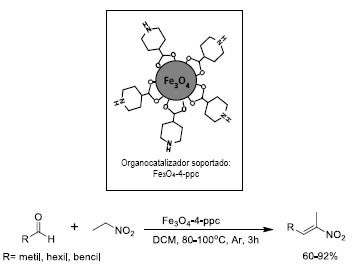
Figura 20 Representación del organocatalizador soportado Fe304-4-ppc (magnetita funcionalizada con el ácido 4-pipiridincarboxilico) y de la síntesis (catalizada) de nitroalquenos mediante una reacción de condensación de Knoevenagel.
Una de las estrategias más comunes para anclar covalentemente los organocatalizadores a núcleos de magnetita es el empleo de recubrimientos de SiO° o materiales similares sobre las partículas de Fe3O4 . La sílice, además de proteger la partícula de magnetita del medio de reacción, provee grupos -Si-O-Si- y -Si-OH que facilitan la reactividad y formación de enlaces covalentes con ciertas especies orgánicas.
Recientemente, en Akceylan et al.69 se inmovilizó el complejo calixareno-prolina sobre un sistema core-shell de Fe3O4 -SiO2 con tamaño aproximado de 15 nm, obteniendo un organocatalizador quiral reciclable. La actividad catalítica del organocatalizador nanoestructurado Fe3O4-SiO 2 -calixareno-prolina (M-S-Calix-Pro) se midió en reacciones aldólicas asimétricas entre ciclohexanona y aldehídos aromáticos (Figura 21). Los productos obtenidos mostraron buena diasteroselectividad (anti/syn, 97:3) y enatioselectividad (93%) usando agua como solvente y reutilizando el catalizador en cinco oportunidades.
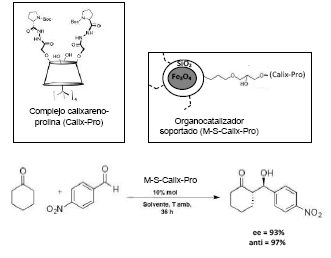
Figura 21 Representación de la estructura del organocatalizador soportado Fe3O4-SiO: calixareno-prolina (M-S-Calix-Pro) y de la reacción aldólica de ciclohexanona con un ale
Actualmente existe un creciente interés por la síntesis de organocatalizadores elaborados mediante el anclaje de diversas estructuras (desde aminoácidos hasta polimeros, vitaminas y líquidos iónicos) con actividad catalítica en diferentes reacciones orgánicas.
Son ejemplos ilustrativos de la variedad de estructuras orgánicas cataliticamente activas con las que puede funcionalizarse la magnetita para este tipo de aplicaciones los trabajos de Kalhafi-Nezhad et al.70 y Gawande et al.71, relacionados al anclaje de cisteina sobre magnetita; el estudio de Arundhathi et al.72 sobre polianilina soportada en Fe3O4 ; el trabajo publicado por Saberi et al.73, quienes inmovilizaron vitamina C en la superficie de magnetita y el diseño de un organocatalizador soportado mediante anclaje de un liquido iónico sobre nanoparticulas tipo core-shell de Fe3O4-SiO 2 , desarrollado por Isaad 74.
Empleo de magnetita en catálisis ambiental
El uso de magnetita ha potencializado los estudios actuales sobre tratamientos de remediación ambiental que buscan eliminar materia orgánica y otros tipos de contaminantes del agua y del aire, como alternativa de control ante las emisiones provenientes de muchos procesos industriales. En este contexto, los procesos avanzados de oxidación (PAOs), en los cuales se producen radicales hidroxilo y perhidroxilo (OH y HO 2 ) altamente oxidantes en medio acuoso, se han desarrollado via catálisis heterogénea con peróxido de hidrógeno o mediante fotocatálisis empleando magnetita o magnetita modificada como catalizador eficiente.
Algunos estudios comprenden la mineralización (oxidación total hasta CO 2 , agua y otros subproductos) de pentaclorofenol 75; la degradación total de p-nitrofenol logrando conversiones mayores al 90% en 10 horas de reacción y lixiviaciones de hierro menores a 0,25 ppm 76 y la oxidación total de nitrobenceno 77. Todos los estudios anteriores emplearon procesos tipo Fenton bajo condiciones ambientales de temperatura y presión, usando peróxido de hidrógeno en medio acuoso diluido y Fe3O4 como catalizador. El proceso Fenton (la reacción entre H 2 O 2 y Fe(II)/Fe(III) en medio acuoso) es uno de los PAOs más usados para la producción de radicales hidroxilo y perhidroxilo.
De acuerdo con Munoz et al.78, las investigaciones sobre el desempeno catalitico de la magnetita en procesos tipo Fenton son relativamente recientes. Es probable que el trabajo de Zhang et al.79 sobre la degradación de fenol como contaminante, haya sido el primero en ser publicado. Desde entonces, el empleo de magnetita y magnetita modificada tanto natural (80) como sintetica 81 en procesos tipo Fenton, destinados a la eliminación de contaminantes orgánicos ha aumentado 78,82.
Tambien vale la pena resaltar el empleo de radiación ultravioleta (UV) para evaluar el desempeno de la magnetita en procesos de fotocatálisis. Por ejemplo, se realizó la degradación de azul de metileno en solución acuosa mediante un proceso tipo Fenton foto asistido con radiación UV, en el que se empleó Fe3O4 como fotocatalizador. Se alcanzaron niveles de conversión cercanos al 80% a 25 °C 83. Tambien se realizó la oxidación total de fenol en medio acuoso mediante procesos tipo foto-Fenton heterogéneos, utilizando cuatro tipos de magnetita sintética 81.
Adicionalmente, el acoplamiento de ultrasonido al sistema tipo Fenton heterogéneo, basado en Fe3O4 y H2O2 diluido, incrementó la eficiencia en la degradación de tetraciclina (considerada un contaminante emergente en aguas residuales de ciertas industrias farmacéuticas) en medio acuoso, a temperatura ambiente y presión atmosférica, permitiendo elevada remoción de esta molécula durante 60 min de reacción 84.
Por otra parte, Costa et al.11diseñó un fotocatalizador magnetico con estructura core-shell (Fe3O4-SiO2-TiO2) compuesto por una capa exterior de TiO2 sobre núcleos de Fe3O4, separados por una capa de SiO2; se utilizó un proceso de heterocoagulación coloidal y secado por secado por atomización. Los resultados mostraron la preparación eficiente del sistema core-shell con actividad catalitica elevada en la degradación del colorante rojo de metilo en solución acuosa, bajo irradiación con luz UV: se alcanzó 90% de conversión en 60 min de reacción. Este tipo de sistemas jerárquicamente nanoestructurados (magnetita-SiO2-TiO2) tambien han sido sintetizados por otro metodo (sol-gel), consiguiendo el anclaje de nanoparticulas de TiO2 sobre la superficie del core-shell de Fe3O4-SiO2 y buena actividad en la degradación fotocatalitica del colorante rodamina B en medio acuoso 85.
Finalmente, la eliminación de compuestos orgánicos volátiles (COVs) en fase gaseosa mediante combustión catalitica tambien es un tema ambiental que se ha abordado empleando magnetita o magnetita modificada como catalizador. Aunque en este tema ambiental se encuentran muy pocos trabajos con aplicación de magnetita, vale la pena mencionar como ejemplos de la utilización de magnetita en el diseño de catalizadores para la eliminación de COVs: por un lado, la remoción (oxidación total) de isopropanol, empleando Fe3O4 como catalizador en procesos asistidos por microondas 85 y, por otro lado, la combustión catalitica de 1,2-diclorobenceno sobre particulas de Fe3O4 recubiertas con TiO287.
Magnetita en las reacciones de desplazamiento de vapor de agua y en la sintesis de amonfaco
El uso de hidrógeno de alta pureza para procesos como el funcionamiento de celdas combustibles y la sintesis de amoniaco ha mantenido en la actualidad el interes por reacciones cataliticas que conduzcan a la formación predominante de hidrógeno, con la menor cantidad posible de productos gaseosos diferentes y de gases de reacción remanentes. La reacción de desplazamiento de vapor de agua (en ingles water gas shift reaction) 88 es de gran interes industrial. En ella el agua (gaseosa) desplaza el equilibrio hacia la formación de hidrógeno (ecuación [1]).
Dicha reacción, una de las más antiguas en catálisis heterogénea industrial 89, favorece la producción de hidrógeno a partir de la mezcla de gases conocida como gas de sintesis (CO + H2), la cual se obtiene preliminarmente mediante reacciones como el reformado de hidrocarburos o el reformado de alcoholes (por ejemplo el reformado de metano o el reformado de etanol). Los catalizadores clásicos para esta reacción contienen magnetita (Fe3O4) como fase activa, promovida por óxidos de cromo o de cobre. El sólido mixto conformado por Fe3O4-Cr2O3 fue patentado en 1911 por la empresa BASF, como catalizador de la reacción de desplazamiento de vapor de agua 90. Posteriormente, variadas modificaciones de este catalizador con diferentes promotores han permitido mejorar su actividad catalítica en dicha reacción y su estabilidad frente a la desactivación 90,91.
La reacción de desplazamiento de vapor de agua es un proceso reversible y moderadamente exotérmico, por lo que se ve favorecida a temperaturas relativamente bajas 91,92. Debido a que la reacción se favorece termodinámicamente a temperaturas relativamente bajas, pero la elevación de la temperatura aumenta la velocidad de reacción, es necesario desarrollarla en dos etapas 89,91,93: en la primera etapa (300 a 500 °C) se emplea Fe 3 O4-Cr 2 O3-CuO como catalizador para reducir rápidamente los contenidos de CO a concentraciones cercanas al 3% molar 91. En la segunda etapa (200 a 250 °C) se emplean catalizadores de CuO-ZnO-Al 2 O 3 alcanzando la reducción de CO a valores de 0,3% molar 91.
Así, en la primera etapa de reacción la fase activa es la magnetita (Fe 3 O4:), el óxido de cromo (Cr 2 O 3 ) se utiliza para aumentar la estabilidad térmica de la ferrita ya que esta puede sinterizar rápidamente. Trabajos anteriores 94,95 indican que la estabilidad puede ser explicada mediante la sustitución de cantidades iguales de los cationes Fe2+ y Fe3+ (de los sitios octaédricos de la magnetita) por cationes Cr3+. De igual manera, el catalizador, contiene pequeñas cantidades de Cu2+ como promotor para una mejor selectividad y actividad catalítica 91.
Estudios recientes muestran diferentes estrategias relacionadas con la optimización de catalizadores basados en magnetita para ser utilizados en la reacción de desplazamiento de vapor de agua. Subramanian et al.93 publicaron la síntesis de catalizadores de Fe3O4 con cationes Al3+ y Cu2+ incorporados, mediante el método sol-gel y el uso de ácido citrico como agente quelante, para la producción de H2 a partir de gas de síntesis derivado de residuos. La reacción mostró 80% de conversión de CO, sin reducción previa del catalizador. La elevada actividad que presentó el catalizador es asociada a la formación de complejos citrato-metal que finalmente condujo a elevar la dispersión y el área superficial.
En otras investigaciones, se sintetizaron catalizadores con Cr3+ y Cu2+ incorporados en nanocristales de Fe 3 O4 mediante el metodo de pirolisis y se emplearon para la obtención 89 y purificación 92 de H2 mediante la reacción de desplazamiento de vapor de agua, mostrando mayor actividad catalitica en comparación con los catalizadores comerciales utilizados para el mismo proceso. Sin embargo, el uso de catalizadores de cromo incorporado causa elevado impacto ambiental, por lo que la sustitución de cromo por molibdeno ha resultado apropiada. Martos et al.91 sintetizaron catalizadores de Fe3O4-Mo-Cu y encontraron que la actividad catalitica de estos sólidos, en la reacción de desplazamiento de vapor de agua, es similar a la de catalizadores con cromo incorporado, por lo que resultan potencialmente aplicables en este proceso.
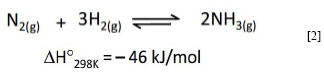
Por otra parte, la sintesis de amoniaco es una reacción de elevado interes industrial a nivel mundial en la cual se emplea tipicamente la magnetita como precursor catalitico 96,97. El empleo de amoniaco como fuente de nitrógeno en la sintesis de muchos compuestos quimicos y la demanda de enormes cantidades de fertilizantes, en cuya preparación es fundamental el amoniaco como materia prima, motivó el desarrollo del proceso Haber-Bosch hace ya cien anos 98. Dicho proceso permite la conversión de nitrógeno e hidrógeno gaseosos en amoniaco, a temperaturas y presiones elevadas (alrededor de 450 °C y presiones superiores a 100 atmósferas, ecuación [2]) 99,100.
Aunque esta reacción es moderadamente exotermica y favorecida a bajas temperaturas, la elevación de la temperatura aumenta la velocidad de reacción y las limitaciones termodinámicas se reducen mediante el aumento de presión. Esto permite el desplazamiento del equilibrio de reacción hacia la formación del amoniaco con la consecuente formación del producto en cantidades importantes. El catalizador clásico para el proceso Haber-Bosch se prepara fundiendo Fe3O4 junto con diversos promotores cataliticos, como óxidos o carbonatos de Ca2+, K+, Al3+, entre otros 96,97,101 y reduciendo parcialmente el óxido de hierro.
La magnetita se ha empleado como precursor del catalizador fundido para el proceso Haber-Bosch durante más de cien anos 98 y diversos estudios han confirmado su valiosa utilidad en la preparación de este catalizador 97,98,102. Sin embargo, en la actualidad se han desarrollado optimizaciones de este catalizador, entre las cuales vale la pena mencionar el empleo de óxidos de tierras raras (óxidos de cerio, lantano, praseodimio y de neodimio) como promotores cataliticos 97. Tambien se conocen estudios sobre el diseño de catalizadores de Ru y Os soportados en alúmina y nitruros de cobalto y molibdeno como catalizadorespotenciales para el proceso Haber-Bosch 97,98. Recientemente se ha encontrado que la wüstita (FeO) como precursor permite la preparación de catalizadores fundidos con mejor desempeno en la sintesis de amoniaco 101,102.
Aplicaciones de la magnetita (Fe 3 O 4 ) en otros campos
Aunque la presente revisión se centra en las aplicaciones de la magnetita en catálisis heterogénea, debido a la versatilidad de este material, es pertinente mencionar brevemente algunos enfoques promisorios en otros campos de la ciencia, como la biologia, la paleontologia, la medicina, la astronomia y la fisica. En este sentido, algunas aplicaciones biomedicas y biotecnológicas se centran en el análisis de celulas y especies animales que pueden sintetizar sus propios cristales de magnetita, los cuales hacen parte de mecanismos especiales de magneto-recepción. Los estudios sobre la biomineralización de magnetita bacteriana 103 se han centrado en analizar la formación de magnetosomas en el interior de bacterias (Candidatus Desulfamplus magnetomotoris strain BW-1), lo que permite contar con nuevas posibilidades para el diseño y producción sostenible de partículas magnéticas con propiedades relevantes a nivel celular. El uso de la magnetita en el campo de la medicina ha cobrado interés en los últimos anos, no sólo por sus propiedades magnéticas sino por su alto grado de biocompatibilidad. De esta manera, muchos tratamientos terapéuticos se centran en el uso de este óxido de hierro capaz de introducirse en el metabolismo regular de los sistemas biológicos.
Por otro lado, en Long et al.104 se presentó un método simple para desarrollar nanoparticulas de quitosano/carragenina/Fe3O4 por sintesis in situ en condiciones suaves. Estos autores evaluaron el potencial de este nanomaterial en la liberación controlada de macromoleculas (albumina de suero de bovinos), mostrando ventajas potenciales en la administración de fármacos dirigidos y otras aplicaciones biomedicas.
Dentro de este tipo de aplicaciones se incluyen otros materiales nanocompuestos magneticos biocompatibles (CMC/ Fe3O4; CMC: carboximetilcelulosa), capaces de fijar y luego liberar el medicamento 5-fluorouracil (5-FU), utilizado en quimioterapias contra el cáncer 105. Las nanoparticulas transportan el compuesto 5-FU y son dirigidas hacia los tejidos afectados mediante un campo magnetico externo. Igualmente, en Ivashchenko et al. (106) se prepararon nanocompuestos a partir de la adsorción de diferentes moleculas (clorhidrato de doxorubicina, rifampicina, clorhidrato de doxiciclina, cefazolina sódica, ceftriaxona disódica, cefotaxima sódica, clorhidrato de ciprofloxacina) sobre la estructura de Ag/ Fe3O4 y se evaluó su capacidad como antibióticos para la terapia microbiana dirigida.
Otras aplicaciones importantes comprenden: la sintesis de liposomas magneticos, usados como medios de contraste para la obtención de imágenes por resonancia magnetica 107; la preparación de polimeros mediante la incorporación de magnetita para obtener copolimeros con capacidad de magnetización 108-110; el mejoramiento en la producción de biogás 111 y la preparación de sistemas core-shell Fe3O4-SiO2, funcionalizados con propiedades adsorbentes para la eliminación de iones cromato y dicromato de aguas residuales industriales 112.
Panorama general de la magnetita en Colombia
Como parte final de esta revisión es pertinente mencionar algunas caracteristicas mineralógicas referentes a la presencia de la magnetita en el territorio colombiano, resaltando la importancia de encontrar este mineral naturalmente y, a su vez, describir algunos estudios colombianos relacionados con este mineral y los alcances cient ficos que se han logrado en la materia
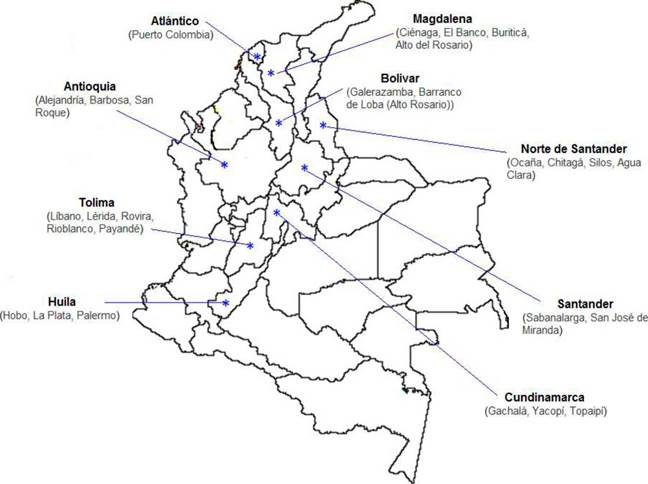
A lo largo del territorio colombiano existe una diversidad de minerales cuya formación se atribuye a procesos mineralógicos llevados a cabo durante el precámbrico, ya que más de la mitad de la producción mundial de minerales de origen no orgánico provienen de mineralizaciones depositadas en este periodo de tiempo 113. Se considera que la magnetita es proveniente de este tipo de mineralizaciones en el territorio colombiano 114. En la Figura 22 se muestra la localización de los yacimientos de este mineral, que son atribuidos a procesos de formación mediante el contacto entre rocas igneas y sedimentarias. Debe tenerse en cuenta que en la actualidad algunos depósitos ya han sido objeto de explotación y en otros la magnetita no es el componente mayoritario
Los yacimientos de magnetita están comúnmente asociados con otros minerales como hematita, piritas, silicatos y cuarzo 114,115. Los minerales inorgánicos hematita, ilmenita, limonita y magnetita (Fe3O4) aparecen localizados principalmente en regiones especificas y sólo hasta la decada de los 60 fueron estudiados durante el Inventario Minero Nacional. A partir de este inventario se puede establecer que las mineralizaciones llevadas a cabo en lugares espec ficos (como la Sierra Nevada de Santa Marta, por ejemplo) pueden generar interes no sólo en lo que se refiere a los óxidos de hierro, sino tambien a la existencia de vanadio, que se presenta en más de 1% en magnetitas de este origen 113.
Ahora bien, dentro de esta revisión cabe mencionar brevemente los alcances de algunos estudios desarrollados en Colombia Durante la última decada, la magnetita de origen natural ha sido objeto de análisis de algunas investigaciones orientadas a la caracterización y usos espec ficos de este mineral Forero y Díaz 117 utilizaron magnetita como fuente de hierro metálico, procedente de la región de Payande (Tolima) para la producción de pellets destinados a procesos de reducción directa antes de la hematización para obtener un prereducido de hierro con un grado de metalización óptimo Vargas et al.118 emplearon arenas de playas del departamento del Atlántico (desembocadura del r o Magdalena) ricas en magnetita para la obtención de hierro metálico mediante procesos de reducción Trabajos importantes sobre el diseño de fluidos magneto-reológicos destinados a procesos de separación industrial de minerales 119,120 muestran el empleo de magnetita de origen natural; por ejemplo, muestras de magnetita provenientes del Hobo (Huila) y de arenas negras del Rio Magdalena (Puerto Colombia, Atlántico).
Otros estudios a nivel de f sica computacional han sido abordados por Mazo-Zuluaga y Restrepo 20, quienes utilizando un modelo de Ising-Monte Carlo 3D estudiaron la evolución termica de la magnetización y el comportamiento histeretico de la magnetita con el fin de elucidar algunas propiedades magneticas de este sólido Estudios teóricos adicionales de estos autores colombianos se encuentran referenciados en una revisión publicada sobre aplicaciones tecnológicas y biomedicas de la magnetita 18
Finalmente, aunque a nivel cient fico se prefiere la s ntesis de magnetita debido a las posibilidades de control en el tamaño de las part culas (algo muy importante para obtener las propiedades deseadas del material), a nivel tecnológico e industrial es preferible el uso de magnetita natural ya que implica reducción de costos Por ello, en la actualidad tambien es pertinente profundizar la investigación referente a la caracterización completa de yacimientos minerales y las diferentes rutas de modificación del material natural para los usos deseados Algunos estudios, como el abordado por Kumar et al.21, demostraron la obtención de nanoparticulas de magnetita con tamaño promedio de 14 nm (determinado por la ecuación de Scherrer) a partir de residuos de minerales de hierro recogidos de plantas de procesamiento El tratamiento llevado a cabo consistió inicialmente en una fase de molienda mecánica seguida de una ruta qu mica relativamente sencilla (lixiviación ácida y posterior hidrólisis con urea)
En este sentido, la industria colombiana Green Magnetita S A S está dedicada a la producción de grandes volúmenes de magnetita sintetica a partir de residuos minerales de siderúrgicas, con el fin de proveer de este óxido a otras industrias para diferentes usos De otro lado, en el grupo de investigación Estado Sólido y Catálisis Ambiental (ESCA), de la Universidad Nacional de Colombia, se adelantan estudios sobre la caracterización completa de esta magnetita sintetizada industrialmente y su empleo en el diseño de estructuras sólidas inorgánicas tipo core-shell con posible actividad catal tica Esto abre las puertas hacia aplicaciones potenciales de este mineral sintetico industrial en el campo de la catálisis heterogénea y tambien en otros campos cient ficos y tecnológicos
Conclusiones
Evidentemente, las propiedades superficiales y estructurales de la magnetita (FeFe 2 O4 o Fe 3 O4) proveen ciertas habilidades ácido-base y de óxido-reducción que potencializan el desempeño catalitico de esta estructura sólida en diversas reacciones de interés cientifico y tecnológico, debido a la presencia de especies Fe3+, Fe2F y O2-accesibles en la superficie y al contenido coexistente de los cationes de hierro (Fe3+/Fe2+). Adicionalmente, su estabilidad química y sus propiedades magnéticas han permitido dirigir la atención hacia este material como pieza clave en el diseño de nuevos catalizadores con tamaños nanométricos, fácilmente separables mediante la aplicación de campos magnéticos moderados, reutilizables en múltiples ciclos de reacción y con ventajas sobresalientes en la aplicación de catálisis heterogénea con enfasis en procesos ambientalmente favorables.
En la ultima decada, este mineral de hierro (Fe3O4) se ha utilizado ampliamente en catálisis heterogénea: como catalizador másico particulado (en polvo); como soporte de nanoparticulas metálicas y de óxidos de metales (por ejemplo, Pt, Pd, Au, Ir, Ru, Rh, Cu, Ni, Mo) activas para ciertas reacciones; en el diseño de sistemas core-shell con actividad catalitica y en el anclaje de complejos de iones metálicos, de organocatalizadores y de variados grupos funcionales capaces de catalizar reacciones orgánicas.
La magnetita como catalizador másico y los diversos catalizadores sólidos preparados mediante modificaciones de este óxido se han empleado con exito en el desarrollo de reacciones orgánicas de oxidación-reducción, de sintesis multicomponente, de acoplamiento C-C, de alquilación y sintesis asimetricas, entre otras. Muchas de dichas reacciones se enmarcan en el contexto de la quimica fina, de la quimica verde, de la catálisis ambiental (fotocatálisis, procesos avanzados de oxidación y eliminación de compuestos orgánicos volátiles, COVs) y en general en el marco de la sintesis orgánica para la obtención de moleculas con actividad biológica y de productos e intermediarios de interés farmaceutico.
Finalmente, es necesario destacar los elevados niveles de conversión y de selectividad alcanzados en la gran mayoria de los sistemas cataliticos diseñados a partir de la magnetita y evaluados en las reacciones mencionadas, lo que genera gran expectativa sobre la versatilidad y la potencialidad de este mineral en el desarrollo de nuevos materiales sólidos con actividad catalitica en reacciones deseadas.