Introducción
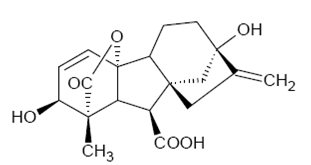
El ácido giberélico (GA3) (Figura 1) es una fitohormona que hace parte de la familia de los diterpenos tetracíclicos de naturaleza ácida 1. Este ejerce efectos diversos en el crecimiento y desarrollo de la planta, promueve la germinación de las semillas que se encuentran en estado de dormancia, la elongación del tallo, el brote de las yemas y el desarrollo de los frutos 2 , 3. La acción del GA3 en el crecimiento de los tejidos puede estar regulada por la modulación celular de sus concentraciones, por la habilidad de la célula para responder al estímulo de esta fitohormona, o por ambas 4.
El GA3 ha sido obtenido a partir de diferentes tejidos vegetales utilizando principalmente métodos de extracción sólido-líquido, procesos en los cuales se extraen uno o varios solutos de un sólido mediante la utilización de un disolvente líquido. Ambas fases entran en contacto íntimo y el soluto o los solutos pueden difundirse desde la matriz sólida a la fase líquida, lo cual produce la separación de los componentes constitutivos de la muestra 5. Para llevar a cabo la lixiviación se han utilizado diferentes tipos de disolventes tales como el metanol frío 6-9, el metanol acuoso (80% v/v)10,11, el metanol acuoso acidificado con ácido fórmico (0,05% v/v)12, el acetato de etilo 13,14, el acetonitrilo acidulado con ácido fórmico (5% v/v)15,16 y mezclas de isopropanol-ácido acético 17,18. El período de extracción ha sido variable debido a que se han empleado tiempos cortos, una o dos horas 6,16,19,20, hasta períodos prolongados, 24 o 48 h 21-23.
Otro método moderno de extracción sólido-líquido es la extracción dinámica con disolvente asistida por sonicación (DSASE). En este proceso la muestra es depositada en una celda por la cual hay paso continuo de solvente fresco y al mismo tiempo se aplican vibraciones acústicas con frecuencias por encima de 20 kHz, que promueven la transferencia de analitos desde la matriz en estudio hasta el disolvente. Esta técnica emplea los mismos solventes que la lixiviación, pero los tiempos de extracción y las cantidades de muestra son inferiores 24. La técnica de DSASE se ha empleado en la extracción de analitos como ésteres organofosforados, blanqueadores, colorantes y polifenoles, empleando flujos de solvente desde los 0,2 hasta 1,0 mL/min, con porcentajes de recuperación que se encuentran por encima del 85% 25-27.
Por otro lado, la cromatografía se encuentra entre las técnicas más empleadas para la identificación y la cuantificación del GA3, que tiene como ventajas mayor eficiencia en la separación y alta especificidad 11,13,28. La cromatografía líquida de alta eficiencia (HPLC, por sus siglas en inglés) es preferida sobre la cromatografía de gases ya que esta última requiere la derivatización previa del analito, lo cual aumenta el grado de complejidad del análisis 29-31.
Ahora bien, el GA3 ha sido evaluado por su importancia en la germinación y desarrollo de las plantas en diferentes especies vegetales como Arabidopsis15, fresno blanco 21 y arroz 32. Sin embargo, no se han encontrado reportes de esta fitohormona en cereales como el maíz, el segundo cultivo más importante del mundo después del trigo 33. El maíz se cultiva en más de 140 millones de hectáreas con una producción anual de más de 580 millones de toneladas métricas. Toda la planta puede ser aprovechada y las aplicaciones posibles de este cereal incluyen alimento, forraje o materia prima para diferentes industrias 34. Adicionalmente, es de gran utilidad investigativa debido a su corto tiempo de germinación, lo que permite hacer diversidad de ensayos en los que se miden múltiples variables permitiendo alcanzar conclusiones de diferente índole 33.
El objetivo de este trabajo fue comparar los métodos de extracción por lixiviación y la extracción dinámica con disolvente asistida por ultrasonido (DSASE), con el fin de determinar el protocolo más eficiente para la obtención del ácido giberélico (GA3) a partir de semillas germinadas de maíz (Zea mays L.).
Materiales y métodos
Reactivos químicos
El estándar del ácido giberélico empleado fue Sigma Aldrich (Sigma, USA); el acetonitrilo y el metanol fueron grado cromatográfico (Fisher Scientific, USA); el acetato de etilo y el ácido fórmico fueron grado analítico (Scharlau, España). El agua fue purificada empleando un sistema Direct-Q (Millipore, USA).
Muestra de estudio
Se usaron semillas de maíz (Zea mays L.) variedad ICA-V305 tipo comercial producidas por la empresa Semillas del Pacífico (Cartago, Colombia). Se seleccionaron semillas sin daños visibles y con forma uniforme, con masa promedio de 0,3878 g ± 0,0002 g y volumen promedio de 0,356 cm3 ± 0,008 cm3.
Preparación de la muestra
Las semillas de maíz previamente seleccionadas se sembraron en cajas Petri (100 x 15 mm), con papel absorbente como soporte. A cada caja se le adicionaron 12,0 mL de agua destilada y se colocaron en una incubadora Incucell de 222 L sin luz, a una temperatura de 30,1 °C ± 0,1 °C. La humedad del sistema fue de 59,00% ± 3,39%. Después de 48 h, las semillas se sacaron de la incubadora y fueron trituradas con ayuda de un molino eléctrico hasta obtener un material muy fino que se guardó en bolsa con sello hermético y en nevera a -20 °C para su posterior extracción 35.
Método de extracción sólido-líquido (lixiviación)
Para la extracción del GA3 mediante lixiviación se emplearon tres solventes diferentes: solvente B, acetonitrilo-ácido fórmico 5% (80:20) 15; solvente C, metanol-ácido fórmico 5% (80:20) 13; solvente D, acetato de etilo 32. Se emplearon dos tiempos de extracción (1 y 2 h) y dos métodos extractivos diferentes, como se presenta a continuación.
Método I: agitación orbital
La extracción se realizó utilizando el procedimiento planteado por Stirk y colaboradores 16, con algunas modificaciones. Se adicionaron 20,0 mL del solvente de extracción (solvente B,CoD)a 10,0000 g de la muestra molida y se ésta se puso en un agitador orbital durante una o dos horas. Al cabo del respectivo tiempo, el material se decantó obteniéndose un sobrenadante y un pellet; el primero se retiró y se conservó, mientras que al segundo se le adicionó una nueva porción del respectivo solvente fresco y se reextrajo dos veces más. Los sobrenadantes obtenidos se mezclaron y se centrifugaron a 5000 rpm durante 10 min, obteniéndose un nuevo sobrenadante el cual fue secado en rotaevaporador a 40 °C. El extracto sólido final se reconstituyó con acetonitrilo hasta un volumen de 5,0 mL previo a su análisis.
Método II: Ultrasonido
Se adicionaron 20,0 mL del solvente de extracción (solvente B, C o D) a 10,0000 g de la muestra molida y la mezcla se puso en un equipo de ultrasonido durante una o dos horas. En el transcurso de la extracción, la temperatura del agua en el baño nunca fue superior a 35 °C. Al cabo del respectivo tiempo, el material se decantó obteniéndose un sobrenadante y un pellet; el primero se retiró y se conservó, mientras que al segundo se le adicionó una nueva porción del respectivo solvente fresco y se reextrajo dos veces más. Los sobrenadantes obtenidos se unieron y se centrifugaron a 5000 rpm durante 10 min, obteniéndose un nuevo sobrenadante el cual fue secado en rotaevaporador a 40 °C. El extracto sólido final se reconstituyó con acetonitrilo hasta un volumen de 5,0 mL previo a su análisis.
Método de extracción DSASE
El procedimiento de extracción DSASE se basó en el trabajo previo de López y colaboradores 36 y se realizó con dos solventes diferentes: solvente B, acetonitrilo-ácido fórmico 5% (80:20) 15; solvente C, metanol-ácido fórmico 5% (80:20) 13. Se empleó una celda de extracción de acero inoxidable de 3,0 mL que se llenó con 0,8000 g de muestra y se colocó en el interior de un baño ultrasonido; se controló la temperatura del agua para que nunca fuera superior a 35 °C. Posteriormente, el sistema se conectó a una bomba peristáltica que controló el flujo del solvente: (B o C) = 0,2 mL/min o 0,4 mL/ min a través de la celda; la extracción se realizó por 12,5 min o 25,0 min. Al final de este periodo, se obtuvo el volumen de extracto deseado para cada una de las combinaciones de solvente y flujo.
Condiciones cromatográficas
Para el análisis del GA3, se utilizó un cromatógrafo líquido de alta eficiencia Shimadzu Prominence (USA), equipado con un desgasificador DGU 205 (USA), un detector de arreglo de diodos (DAD) prominence SPD-M20A (USA), un horno Shimadzu CTO-10AS VP (USA) y un automuestreador Shimadzu SIL-10AF (USA). El software empleado para el análisis de los datos fue LCsolution Shimadzu (USA).
Para la identificación y la cuantificación, se empleó la técnica de HPLC con modificaciones de la metodología planteada por Bhalla y colaboradores (13). Se utilizó una columna Supelcosil™ LC-18-DB 5,0 μm (150 x 4,6 mm). La fase móvil fue acetonitrilo-ácido fórmico 0,01% con gradiente lineal como se detalla a continuación: acetonitrilo-ácido fórmico 0,01% (10:90) 5,0 min; (70:30) 40,0 min; (10:90) 10,0 min a un flujo de 0,5 mL/min. Una alícuota de 10 μL de cada solución que contenían las giberelinas se inyectó en el cromatógrafo y fueron detectadas a una longitud de onda de 195 nm. Previo al análisis cromatográfico, todas las muestras fueron filtradas a través de membranas (QLS) de 0,2 μm de poro.
Recta de calibración
La recta de calibrado fue elaborada con un estándar del GA3, empleando siete niveles con concentraciones de 1,0; 5,0; 10,0; 20,0; 30,0; 40,0 y 50,0 mg/kg. Las soluciones fueron preparadas al disolver el estándar con acetonitrilo.
Análisis estadístico
La optimización de los métodos de extracción por lixiviación y por DSASE se realizó mediante un ANOVA multifactorial, previa verificación de los supuestos (normalidad, homocedasticidad e independencia). Las diferencias estadísticas presentadas entre los tratamientos se analizaron mediante la prueba de rangos múltiples de Tukey. La comparación entre los métodos óptimos de extracción se realizó mediante la prueba t para diferencia de medias independientes con varianzas iguales, previa verificación de tal igualdad por el test E Los análisis fueron realizados empleando el software Statgraphics centurión XI en modo demo.
Resultados y discusión
Recta de calibración
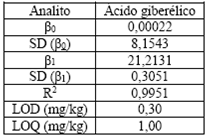
El modelo obtenido a partir de la recta de calibración explica el 99,51% de la variabilidad en las áreas calculadas en función de la concentración El límite de detección (LOD) se determinó experimentalmente eligiendo la menor concentración del analito que presentó una señal cromatográfica integrable y el límite de cuantificación (LOQ) se calculó aplicando la expresión LOQ = 10/3 LOD. Los resultados de la recta de calibración se muestran en la Tabla 1.
Evaluación de las condiciones de la extracción sólido-líquido
En el proceso de lixiviación para la obtención del GA3 a partir de semillas germinadas de maíz, se determinó que los factores método y solvente de extracción tuvieron un efecto estadísticamente significativo sobre la concentración del analito en estudio. Por el contrario, el tiempo de extracción (1 y 2 h) no mostró diferencias en la obtención del GA3. Los resultados obtenidos se presentan con una significancia del 5% (Figura 2).
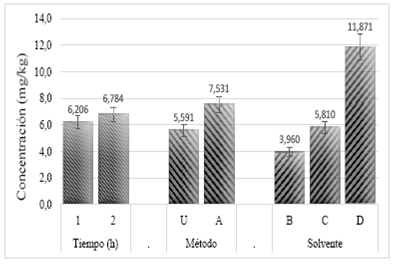
Figura 2 Resultado de los factores empleados en la extracción por lixiviación [U: ultrasonido; A: agitación; D: acetato de etilo; C: metanol-ácido fórmico 5% (80:20); B: acetonitrilo-ácido fórmico 5% (80:20)]
El solvente con el cual se obtuvo la mayor extracción del GA3 fue acetonitrilo-ácido fórmico 5% (80:20), obteniéndose una concentración de 11,871 mg/kg para el GA3 (Figura 2). Esto concuerda con los resultados obtenidos por Urbanová y colaboradores 15, quienes realizaron extracción del GA3 en Arabidopsis thaliana empleando diferentes combinaciones de solvente y obtuvieron como mejor resultado la mezcla de acetonitrilo-ácido fórmico 5%. Vale la pena resaltar que el GA3 es un analito de alta polaridad debido a la presencia de grupos funcionales como carboxilos, hidroxilos y lactonas en su estructura (Figura 1), por lo cual es más afín con solventes con índices de polaridad alta como el acetonitrilo y el metanol 37. Sin embargo, se podría decir que el acetonitrilo fue mejor en la extracción del GA3, debido a que este solvente es buen aceptor de protones, por lo cual interactúa fácilmente con solutos hidrolixados tales como el GA3, mientras que el metanol es un donador de protones e interacciona mayormente con solutos básicos 38. También es una ventaja la alta polaridad del acetonitrilo, dado que evita la extracción de compuestos lipídicos que pueden interferir en el proceso de cuantificación 39.
De los trabajados, el mejor método físico fue la agitación, pues se obtuvo una concentración de 7,531 mg/kg (Figura 2). Este resultado podría estar relacionado con la ausencia de ondas en el solvente extractor que pueden producir la degradación del analito y, por ende, conllevar a una disminución en la concentración del GA3 extraído 40. De igual manera, el método de agitación no conduce a la disociación de las moléculas de agua por lo cual no se generan radicales hidroxilos que, eventualmente, podrían reaccionar con el analito en estudio 41.
En resumen, las mejores condiciones evaluadas para extraer el GA3 por medio del método de lixiviación fueron: agitación como método físico, acetonitrilo-ácido fórmico 5% (80:20) como solvente y una hora como tiempo de extracción. Este tiempo fue el elegido dado que permite extraer la misma cantidad de GA3 que al emplear dos horas y, por tanto, fue el tratamiento más eficiente.
Evaluación de las condiciones de la extracción DSASE
Para la extracción por DSASE, los factores flujo y tiempo tuvieron diferencias estadísticamente significativas, mientras que con el factor solvente no se presentaron diferencias estadísticamente considerables, con una significancia del 5% (Figura 3).
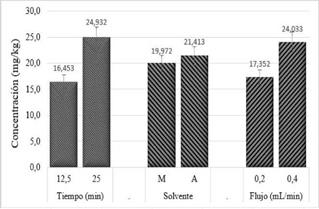
Figura 3 Resultado de los factores empleados en la extracción por DSASE [C: metanol-ácido fórmico 5% (80:20); B: acetonitrilo-ácido fórmico 5% (80:20)]
El mejor flujo dentro de los dos niveles evaluados fue 0,4 mL/ min, pues permitió una desorción rápida del analito presente en la matriz. Lo anterior debido a que, posiblemente, al haber solvente fresco en tiempos cortos, las interacciones solvente-matriz repetidas veces conllevaron a un equilibrio químico, lo que facilita la obtención de una mayor cantidad de analito extraído 24,26. Finalmente, y dado que el factor tiempo presentó diferencias significativas, siendo 25,0 min el tiempo que permitió una mayor extracción con una concentración del GA3 de 24,93 mg/kg, se escogió este valor como el óptimo para la extracción por DSASE (Figura 3).
Lo anterior permitió determinar que las mejores condiciones evaluadas para la extracción del GA3 por el método de DSASE fueron: acetonitrilo-ácido fórmico 5% (80:20) con 0,4 mL/min de velocidad de flujo y un tiempo de extracción de 25,0 min.
Al comparar los procedimientos de extracción por lixiviación y DSASE, se encontró que las concentraciones medias obtenidas por los dos métodos empleados fueron diferentes con un nivel de confianza del 95%. Estos valores, así como sus desviaciones estándar, se muestran en la Tabla 2.
Tabla 2 Concentración de GA3 obtenida con los métodos de extracción empleados Medias ± desviación estándar
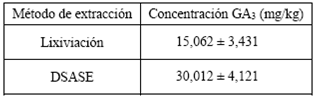
En la Tabla 2 se observa que la extracción por DSASE fue la más eficiente, reportándose una concentración del GA3 de 30,012 mg/kg. Esta técnica tiene varias ventajas sobre la extracción por lixiviación dado que presenta bajo consumo de solvente, emplea menor cantidad de muestra, disminuye drásticamente los tiempos de extracción y es menos laboriosa al momento de implementarse 25.
Además, al ser un sistema dinámico la muestra está continuamente expuesta al disolvente fresco, lo cual promueve la transferencia de analitos desde la matriz hasta el disolvente 24. Todo esto confirma la bondad de esta técnica por lo cual es usada en la actualidad para la obtención de diferentes biomoléculas.
Conclusiones
Se evaluaron las mejores condiciones para la extracción del ácido giberélico (GA3) en semillas de maíz (Zea mays L) por lixiviación y por DSASE. Para la primera metodología los parámetros óptimos fueron agitación, con acetonitrilo-ácido fórmico 5% (80:20) y una hora. Para el segundo proceso las condiciones óptimas fueron acetonitrilo-ácido fórmico 5% (80:20), a un flujo de 0,4 mL/min y 25,0 min.
Se compararon los procedimientos de extracción por lixiviación y por DSASE, siendo este último el mejor método, debido a su alta eficiencia y correspondiéndose con las tendencias de la química verde al utilizar las mínimas cantidades de disolvente y muestra.
Se aplicó por primera vez una metodología de extracción por DSASE para la obtención del GA3 en semillas de maíz, obteniéndose una concentración del analito de 30,012 mg/kg. Este resultado abre el camino para usar esta técnica en estudios posteriores en el campo de los productos naturales.