Introducción
En la actualidad hay un interés creciente por los materiales inorgánicos laminares, su manipulación permite especies huéspedes intercambiables que le confieren diferentes propiedades físicas y químicas al material sintetizado, dado que entre sus láminas se pueden alojar polímeros, biomoléculas, moléculas neutras o iones tanto orgánicos como inorgánicos 1,2. Entre estos materiales laminares se encuentran los hidróxidos metálicos que poseen aniones, utilizados para la obtención de estructuras en dimensiones nanométricas, con reconocidas aplicaciones: como material de soporte para catalizadores 3,4, en la industria como retardantes de llamas 5, tamices moleculares o intercambio de iones y adsorbentes 6,7, entre otras.
Particularmente, las propiedades fisicoquímicas y aplicaciones de hidroxisales laminares (LHS) han sido poco estudiadas. Hay reportes de un compuesto relacionado, conocido como hidroxiacetato de zinc 4,8, con fórmula general Zn5(OH)8(An-)2/n -2H2O, en el que la cuarta parte de los octaedros coordinados al ion zinc es reemplazada por dos tetraedros coordinados al zinc, localizados por encima y debajo del plano, coordinando moléculas de agua en el vértice del tetraedro 9. Estos materiales pueden servir como soporte de especies metálicas para ser utilizados en reacciones de catálisis en fase heterogénea, permitiendo la reutilización del catalizador y proporcionando mayor utilidad industrial y, por lo mismo, beneficios económicos y ambientales.
Algunos de los métodos reportados en la literatura 10 para la síntesis de hidroxisales son: (i) método de coprecipitación, (ii) método sal-óxido y (iii) tratamiento hidrotérmico. Otros métodos se basan en reacciones de hidrólisis que se producen cuando se añade agua a complejos metálicos que se forman en las disoluciones de los cationes.
Por otra parte, el paladio es utilizado como catalizador en una variedad de reacciones orgánicas, dentro de las cuales las reacciones de acoplamiento C-C 11 juegan un importante rol en la química orgánica sintética, ya que sus productos tienen diversas aplicaciones como intermediarios en la preparación de productos naturales y compuestos bioactivos 12. Desde el punto de vista de la catálisis, las nanopartículas de paladio han sido usadas en una variedad de reacciones químicas incluyendo las reacciones de acoplamiento C-C tipo Heck, Suzuki, Sonogashira y Stille 13,14.
Además de la síntesis de derivados de acetileno, la reacción de Sonogashira permite también la preparación de heterociclos condensados, lo cual ha sido demostrado en la síntesis de productos como vignafurano y cicerfurano 15,16, productos de interés por su potencialidad farmacológica 17. Aunque hay reportes que describen el uso de nanopartículas de paladio soportadas en arcillas aniónicas modificadas en reacciones de Sonogashira 5,18,19, hasta la fecha no se ha reportado su uso en la obtención de heterociclos condensados.
Con la expectativa de que las moléculas de surfactante actúen como plantilla para aumentar el espacio interlaminar, el área superficial y la lipolificidad de las hidroxisales laminares de este estudio, similar a como se reportó en hidróxidos dobles laminares 20, se sintetizaron dos nuevos materiales laminares con nanopartículas de paladio soportadas (LHS-Zn-Ac/Pd0 y LHS-Zn-Suf/Pd0), mediante una modificación del procedimiento reportado por Martínez y colaboradores 21.
Se realizaron estudios preliminares de la actividad de estos materiales como potenciales catalizadores en reacciones de acoplamiento tipo Sonogashira, específicamente para la síntesis de difenilacetilenos y benzofuranos. El método utilizado se basa en el intercambio de la hidroxisal de acetato de zinc con surfactante seguida de intercambio con el anión tetracloropaladato ([PdCl4]2-) y la posterior reducción del paladio allí contenido. En este artículo se describen los procedimientos llevados a cabo y los respectivos resultados.
Materiales y métodos
Reactivos
Los reactivos utilizados proceden de fuentes comerciales: Sigma-Aldrich: ZnO (99+% pureza), Zn(OAc)22H2O (98+% pureza), 2-yodofenol (98%), fenilacetileno (98%), yoduro cuproso (Cul) (98%); Carlo Erba CH3(CH2)uOSO3Na (92%), Alfa-Aesar: K2[PdCl4] (99,99%) y Calbiochem: acetato de potasio (KOAc) (99,9%).
Síntesis de materiales inorgánicos
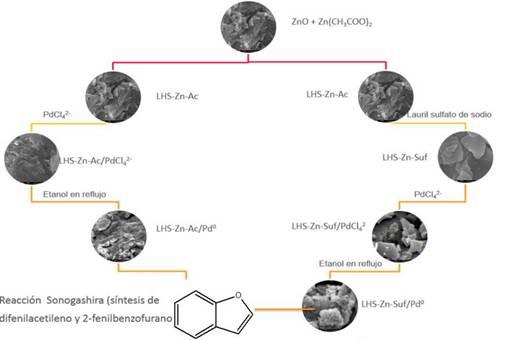
En la Figura 1 se presenta la secuencia gráfica para la preparación de los materiales inorgánicos, cuyo procedimiento experimental se describe a continuación:
Etapa 1. Síntesis de hidroxisales de acetato de zinc (LHS-Zn-Ac)
La síntesis de hidroxisales de acetato de zinc se llevó a cabo de acuerdo a lo reportado en la literatura 21. Se mezclaron 83 g (1 mol) de óxido de zinc (ZnO) con 31° g (1,4 mol) de acetato de zinc dihidratado (Zn(OAc)2 2H2O) en 2,5 L de agua destilada y desionizada. La mezcla se agitó a 2000 rpm durante 34 h bombeando nitrógeno (N2) cada hora. Después de 34 h de reacción, la mezcla se dejó de agitar y el material se lavó dos veces con agua destilada y desionizada sin verificación de la desionización total, filtrando la mezcla con un sistema convencional de vacío. Se dejaron secar las muestras por dos días al aire libre, a temperatura ambiente, sin el uso adicional de solventes de secado. El producto final fue un sólido blanco, se pesó y se obtuvieron 4°6 g de LHS-Zn-Ac.
Etapa 2. Síntesis de LH S-Zn-Suf: intercambio de la hidroxisal de acetato de zinc con surfactante (laurilsulfato de sodio)
Se mezclaron 200 g de LHS-Zn-Ac y 203 g (0,7 mol) de laurilsulfato de sodio (CH3(CH2)11OSO3Na) en 2,5 L de agua destilada y desionizada, bombeando nitrógeno (N2) cada hora; la mezcla se agitó a 2000 rpm durante 24 h bajo condiciones ambientales. Después, el material se lavó dos veces con agua destilada y desionizada filtrando la mezcla con un sistema convencional de vacío. Se dejaron secar las muestras durante cinco días al aire libre, a temperatura ambiente y sin el uso de solventes de secado. El producto final fue un sólido blanco del que se obtuvieron 141 g (LHS-Zn-Suf).
Etapa 3. Síntesis de LHS-Zn-Ac/[PdCl 4 ] 2- y LHS-Zn-Suf/[PdCl 4 ] 2- : intercambio de las hidroxisales precursoras con el anión [PdCl4] 2-
Las dos hidroxisales sintetizadas (LHS-Zn-Ac y LHS-Zn-Suf) se sometieron a intercambio con tetracloropaladato (II) de potasio (K2 [PdCl4]), utilizando los procedimientos reportados en la literatura 21, pero variando la concentración del complejo de paladio. Se preparó una solución de K2[PdCl4] a una concentración de 2,7 g/L (el doble de la concentración utilizada por Martínez y colaboradores 21), pesando 4,8 g del compuesto en 1,75 L de agua destilada y desionizada. Luego, se pesaron 17,5 g de LHS-Zn-Ac que se adicionaron a una batidora industrial y 1,75 L de la solución; se bombeó nitrógeno (N2) durante 5 min cada hora.
Se tomó la precaución de realizar la reacción bajo atmósfera inerte con el fin de prevenir la formación de carbonatos que pueden ser derivados de la reacción del material con CO2- La mezcla se agitó a 2000 rpm durante 48 h bajo condiciones ambientales para LHS-Zn-Ac y 24 h para LHS-Zn-Suf. Después, el material se lavó dos veces con agua destilada y desionizada filtrando la mezcla con un sistema convencional de vacío; se dejaron secar las muestras durante cinco días al aire libre, a temperatura ambiente y sin el uso de solventes de secado. Al final, se obtuvieron 12,9 g de LHS-Zn-Ac/[PdCl4]2- como un sólido café. El mismo procedimiento se llevó a cabo con LHS-Zn-Sufpreparando una solución de K2[PdCl4] a una concentración de 2,7 g/L, a partir de 3,4 g en 1,25 L de agua destilada y desionizada. Luego se partió de 12,5 g del compuesto para obtener 9,1 g de LHS-Zn-Suf/[PdCl4]2- como un sólido café.
Etapa 4. Síntesis de LHS-Zn-Ac/Pd 0 y LHS-Zn-Suf/Pd 0 : reducción de paladio en las hidroxisales modificadas
El paladio contenido en los materiales (LHS-Zn-Ac/[PdCl4]2- y LHS-Zn-Suf/[PdCl4]2-) se sometió a reducción a paladio metálico a partir de reflujo en etanol 21,22. Se pesaron 12,0 g de LHS-Zn-Ac/ [PdCl4]2- y se adicionaron 300 mL de etanol en un balón de fondo redondo de 500 mL. Se realizó el montaje de reflujo y se controló la temperatura en un baño de aceite entre 77-80 °C con una velocidad de agitación constante durante 2 h. La muestra se dejó decantar y se centrifugó 6 veces lavando el material con etanol (5000 rpm durante 5 min); se pasaron a un vidrio de reloj dejando secar al aire libre, a temperatura ambiente y sin el uso adicional de solventes, durante ocho días. Al final del proceso se obtuvieron 11,7 g de LHS-Zn-Ac/ Pd0 como un sólido negro. El mismo procedimiento se llevó a cabo con 12,0 g LHS-Zn-Suf/[PdCl4]2- donde hubo una pequeña variación en la temperatura entre 78-82 °C, al final se obtuvieron 8,1 g de LHS-Zn-Suf/Pd0 como un sólido negro.
Caracterización inorgánica
Las fases cristalográficas de los materiales en polvo preparados se visualizaron por medio de los patrones de difracción de rayos X, que se obtuvieron usando un difractómetro Rigaku MiniFlex II, equipado con una fuente de alto voltaje de 30 kV y 15 mA de corriente. Los análisis se realizaron a una velocidad de 5 °/min en el rango de 1,2-70° en 2θ. El porcentaje del anión laurilsulfato en los materiales laminares se determinó mediante el método de sustancias activas al azul de metileno (SAAM), un colorante catiónico 23.
La morfología de los materiales se observó por microscopio electrónico de barrido de alta resolución con energía dispersiva (SEM por su sigla en inglés); el equipo empleado fue un modelo Quanta 250 de FEI. La fuente de electrones es de tungsteno y provee una resolución de 3.0 nm a 30 KV en todos los modos de operación. El microscopio cuenta con un sistema analítico de rayos X EDAX modelo Genesis Apex 2i para hacer análisis químico a nivel superficial.
La identificación de las nanopartículas formadas en la reacción de reducción se realizó en un microscopio electrónico de transmisión, (TEM por su sigla en inglés), áeol 1200 EX. A partir de la espectroscopía de infrarrojo (IR) se analizó la presencia o ausencia de grupos funcionales claves. Los análisis fueron realizados en el equipo FT-IR marca ThermoFischer SCIENTIFIC referencia Nicole™t iS™ 5 con detector DTGS y divisor de haz KBr.
Análisis de los compuestos orgánicos
Los productos orgánicos se monitorearon por cromatografía de capa delgada (TLC) que se llevó a cabo en silica gel (Kieselgel 60 F254 sobre aluminio) y se visualizó utilizando luz UV de 254 nm de longitud de onda. Además, las reacciones se siguieron por cromatografía de gases (GC) acoplado a espectrometría de masas (MS) analizadas en el cromatógrafo GC-MS-QP2010 Ultra marca Shimadzu.
Se utilizó una columna DB-1 para GC-MS (1% difenildimetilpolisiloxano, 30 m, 0,25 mm, 0,25 μm). La programación del horno inició en 50 °C (durante 2 min), se incrementó hasta 200 °C a 20 °C/min (durante 2 min) y, finalmente, se llevó a 300 °C a razón de 20 °/min (durante 3 min). Se analizó 1 μL de la muestra en el inyector a 280 °C con un split 5 y una velocidad de flujo 0,7 mL/min. Con respecto a las condiciones de MS la temperatura de fuente de iones fue 290 °C y la temperatura de interfase de 300 °C. El tiempo de corte de solvente fue 6 min y el tiempo final del análisis fue 19,5 min.
Con el uso de cromatografía de columna se purificaron los productos de acoplamiento Sonogashira (difenilacetileno y 2-fenilbenzofurano), usando silica gel Kieselgel 60 marca Merck como fase estacionaria. Los compuestos fueron caracterizados por 1H-NMR y 13C-NMR, en un espectrómetro Bruker Avance II 400 MHz, utilizando CDCl3-
Síntesis de difenilacetileno
En un balón de tres bocas de 25 mL se mezclaron 114 μL de yodobenceno (1 mmol), 140 μL de fenilacetileno (1,25 mmol), 147 mg de KOAc (1,5 mmol) y 50 mg de catalizador (LHS-Zn-Ac/Pd0 o LHS-Zn-Suf/Pd0) en 2 mL de N,N-dimetilformamida (DMF), bajo atmósfera de nitrógeno. La mezcla de reacción se agitó a 500 rpm, controlando la temperatura de reflujo entre 110-112 °C durante 45 min. Se realizó el seguimiento de la reacción con TLC y GC-MS, luego la reacción se filtró con DMF y se realizó una extracción líquido-líquido con éter etílico-agua.
Después, se realizó cromatografía de columna eluyendo con 100% éter de petróleo, obteniendo un sólido blanco con punto de fusión 58-59 °C. 1H-NMR (CDCl3, 400 MHz): δ/ppm = 7,49-7,43 (m, 4H), 7,31-7,23 (m, 6H); 13C-NMR (CDCl3, 101 MHz): δ/ppm = 131,6, 128,3, 128,2, 123,3, 89,4; MS (EI, 70 eV) m/z (% intensidad relativa, ion): 178 (100, [M+]), 152 20, 126 6, 89 9, 76 12.
Síntesis del 2-fenilbenzofurano
En un balón de tres bocas de 25 mL, se mezclaron 224 mg de 2-yodofenol (1 mmol), 147 mg de KOAc (1,5 mmol), 50 mg de catalizador (LHS-Zn-Ac/Pd0 o LHS-Zn-Suf/Pd0), 16 mg de CuI (cuando se realiza con co-catalizador) y se gotearon 140 μL de fenilacetileno (1,25 mmol) en 2 mL de DMF, bajo atmósfera de nitrógeno. La mezcla de reacción se agitó a 500 rpm, controlando la temperatura de reflujo entre 112-113 °C durante 45 min. Se realizó el seguimiento de la reacción con TLC y GC-MS. Luego, la mezcla de reacción se filtró con DMF y se realizó una extracción líquido-líquido con éter etílico-agua. Después se realizó cromatografía de columna eluyendo con 100% éter de petróleo, obteniendo un sólido blanco con un punto de fusión 119-120 °C. 1H-NMR (CDCl3, 400 MHz): δ/ppm = 7,82-7,76 (m, 2H), 7,53-7,15 (m, 7H), 6,95 (d, 1H, J = 0,8 Hz); 13C-NMR (CDCl3, 101 MHz): δ/ppm = 155,9, 154,9, 130,5, 129,2, 128,8, 128,6, 124,9, 124,3, 122,9, 120,9, 111,2, 101,3; MS (EI, 70 eV) m/z (% intensidad relativa, ion): 194 (100, [M+]), 165 (68), 139 10, 115 5, 97 9, 82 11.
Resultados y discusión
Materiales inorgánicos
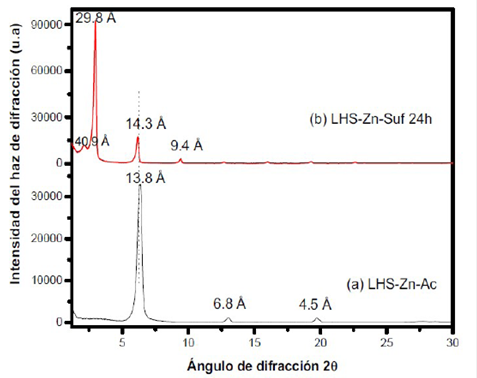
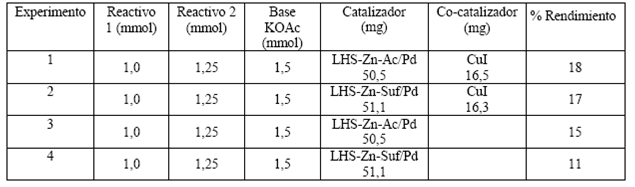
En la Figura 2 se muestran los patrones de difracción de rayos X de los materiales de partida, ZnO y Zn(CH3COO)2 así como el material sintetizado reportado en la literatura (21). Al comparar los patrones de difracción del ZnO y Zn(CH3COO)2 con la Figura 2c (LHS-Zn-Ac) se observa la formación de un nuevo material laminar producto de la reacción entre éstos. El pico observado para LHS-Zn-Ac (Figura 2c) indica un tipo de reflexión que revela la formación de un espacio interlaminar correspondiente a 13,8 Å. Este espacio interlaminar es igual al reportado por Martínez y colaboradores (13,8 Å) 21. Los picos que aparecen correspondientes a 6,8 Å y 4,5 Å son asignados al segundo y tercer orden de reflexión del espaciamiento interlaminar, respectivamente.
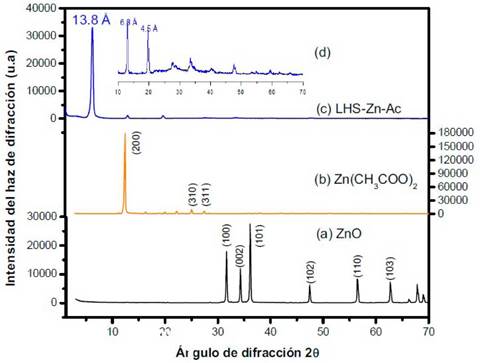
Figura 2 Patrones de Difracción de Rayos X (XRD). (a) Óxido de zinc (ZnO), (b) Acetato de zinc (Zn(CH3COO)2), (c) LHS-Zn-Ac, (d) Aumento del patrón de 10 * a 70 * en 29 de LHS-Zn-Ac
Con el propósito de mejorar la lipolificidad de los catalizadores heterogéneos, el material sintetizado (LHS-Zn-Ac) se intercambió con laurilsulfato de sodio para aumentar el espacio interlaminar y el área superficial 20. En la Figura 3 se observa el patrón de difracción que ilustra el efecto del intercambio en la estructura del material, que evidencia un aumento en el espacio interlaminar de 13,8 Å a 29,8 Å. Lo anterior se puede atribuir al fenómeno de estratificación de las moléculas de laurilsulfato 9, teniendo en cuenta que la literatura reporta una longitud de 22,3 Å del anión surfactante 24. Los picos que aparecen a 6,1 ° y 9,4 ° en el eje 20 dan lugar a distancias de 14,3 Å y 9,4 Å respectivamente y son asignados, a su vez, al segundo y tercer orden de reflexión del espaciamiento interlaminar, mientras que el pico a 2,2 ° genera un espacio interlaminar de 40,9 Å que puede atribuirse a una fase diferente del material, debido a un ordenamiento diferente del ion surfactante.
Al contrastar los tres difractogramas de la Figura 4 se evidencian los cambios en el espacio interlaminar y la intensidad de las señales en los tres materiales sintetizados. El material precursor LHS-Zn-Suf presenta un espacio interlaminar a 29,8 Å (3,0 ° en eje 2 θ), que luego es intercalado con los complejos de paladio aumentando el espacio interlaminar a 31,6 Å (2,8 °); estos datos concuerdan con lo reportado por Shiyong y colaboradores 20. Finalmente, en la reducción de paladio se conserva parte de la interlámina mostrando la señal de paladio metálico en el material LHS-Zn-Suf/Pd0, en el cual se evidencia un espacio interlaminar de 29,4 Å (3,0 °), además del pico alrededor de 40 °, característico del paladio metálico 20. Al ampliar el patrón de 20 ° a 50 ° (Figura 4d) se observa una señal más clara de paladio y no se observan las señales características de ZnO, lo que permite sustentar que la estructura laminar del material permanece sin sufrir descomposición. El contenido estimado de laurilsulfato de sodio en el LHS-Zn-Suf/Pd0 fue del 2,1%, medido mediante el método sustancias activas al azul de metileno 23.
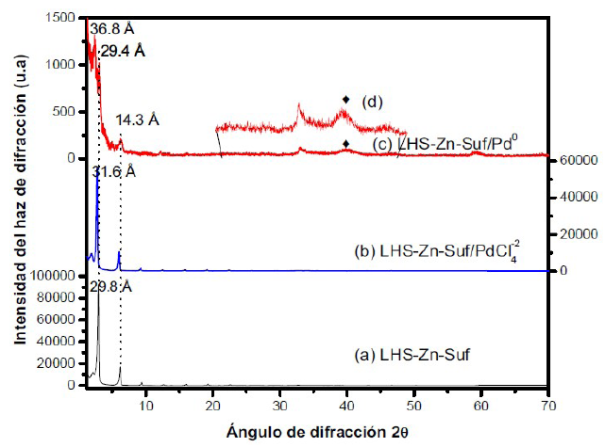
Figura 4 Patrones de Difracción de Rayos X. (a) LHS-Zn-Suf, (b) LHS-Zn-Suf/[PdCÍ4]2-, (c) LHS-Zn-Suf/Pd0, (d) Aumento del patrón de 20 ° a 50 o 2θ de LHS-Zn-Suf/Pd0
Por otra parte, en la Figura 4 también se observa que la intensidad de los difractogramas es diferente en el intercambio y reducción de las especies, mostrando un cambio de ordenamiento de la lámina. En la reducción final del material se observan los picos del precursor con menor intensidad, lo que permite deducir que parte del material conserva la interlámina mientras otra sufre exfoliación o delaminación 25,26.
Lo anterior se puede evidenciar en la morfología del material con las imágenes de SEM, al observar un cambio en las láminas de la hidroxisal.
En la Figura 5 se comparan los difractogramas de (a) LHS-Zn-Ac, (b) LHS-Zn-Ac/[PdCl4]2-, (c) LHS-Zn-Ac/Pd0, y se observan los cambios en el espacio interlaminar y el ordenamiento de las estructuras sintetizadas a partir de la intensidad de las señales. El material precursor LHS-Zn-Ac presenta un espacio interlaminar de 13,8 A (6,4 ° en el eje 20), el material LHS-Zn-Ac/[PdCl4]2- presenta un aumento del espacio interlaminar a 22,4 A (3,9 °) y finalmente en el LHS-Zn-Ac/Pd0 se conserva la interlámina presentando la señal de paladio metálico alrededor de 40 °. Aunque se muestre el mismo espacio interlaminar después de la reducción, posiblemente se debe a la falta de reducción total del [PdCl4]2- o la presencia de nanopartículas muy pequeñas (inferiores a 2 nm), como se evidencia en las imágenes de TEM. Al ampliar el patrón de 20 ° a 50 ° (Figura 5d) se observa una señal de paladio metálico alrededor de 40 ° lo que indica la presencia de metal en el material 27. No se observa ZnO (Figura 2a), lo que permite deducir que el material sintetizado no ha sufrido descomposición laminar.
Figura 5 Patrones de difracción de rayos X. (a) LHS-Zn-Ac, (b) LHS-Zn-Ac/[PdCÍ4]2-, (c) LHS-Zn-Ac/Pd0, (d) Aumento del patrón de 20 ° a 50 ° 2θ de LHS-Zn-Ac/Pd0
Al igual que el material LHS-Zn-Suf/Pd0, que sufrió exfoliación como lo muestran los picos 29,4 y 14,3 de la Figura 4, el LHS-Zn-Ac/Pd0 también sufrió delaminación por cuanto se observa la misma tendencia (Figura 5). El pico agudo que se observa a 2,7 ° en el eje 20 del difractograma corresponde a un espacio interlaminar de 32,2 A (Figura 5c), mostrando otra fase cristalográfica que puede atribuirse al reordenamiento de los iones acetatos y posiblemente a un contenido remanente de [PdCl4]2- sin reducir.
La Figura 6 muestra la morfología del material precursor (LHS-Zn-Ac) y el material intercambiado con laurilsulfato (LHS-Zn-Suf). Las microfotografías de ambos materiales evidencian la formación de láminas u hojuelas que se van modificando cuando se les inserta otras especies.
A partir de SEM-EDS, se realizó un análisis semicuantitativo de la composición porcentual de LHS-Zn-Ac y LHS-Zn-Suf. Los resultados evidencian que se incorpora azufre al material laminar, el cual proviene del laurilsulfato de sodio intercambiado con acetato (Tabla 1).
Tabla 1 Porcentajes de los elementos que conforman las hidroxisales estimados por la técnica de SEM-EDS
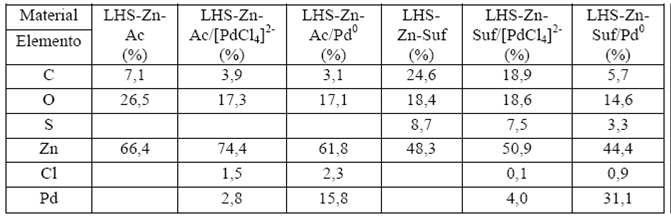
La morfología de los materiales sintetizados con acetato y surfactante sufre modificaciones durante el intercambio con el complejo aniónico de paladio y su posterior reducción a paladio metálico, que se ven reflejadas en las imágenes de las Figuras 7 y 8. Es evidente que la morfología de los materiales pierde uniformidad en el proceso, lo cual es coherente con las diferencias de intensidad observadas en los difractogramas (Figuras 4 y 5). Por su parte, la composición porcentual de los elementos en áreas específicas delimitadas de los materiales también se puede obtener cualitativamente a partir del análisis por SEM-EDS. Los resultados para LHS-Zn-Ac/[PdCl4]2- y LHS-Zn-Ac/Pd0 se muestran en la Tabla 1, lo mismo que para LHS-Zn-Suf/[PdCl4]2- y LHS-Zn-Suf/Pd0. En ambos casos, los cambios de composición de un material con respecto a otro, en la respectiva secuencia sintética, se deben a que la reducción del paladio libera aniones cloruro que quedan estabilizando las láminas de la hidroxisal 29. Por su parte, el aumento del Pd se debe posiblemente a la aglomeración de las nanopartículas de paladio en determinadas áreas de los materiales donde se focalizó el análisis.

Figura 7 Imágenes de SEM a 41000 x de hidroxisales con acetato a) LHSCZnCAc, b) LHS-Zn-Ac/[PdCl4]2- y c) LHS-ZnCAc/Pd0

Figura 8 Imágenes de SEM a 41000 x de hidroxisales con surfactante a) LHS-Zn-Suf, b) LHS-Zn-Suf/[PdCl4]2- y c) LHS-Zn-Suf/Pd0
La formación de nanopartículas de paladio soportadas en los materiales laminares en la reducción de los precursores que contienen [PdCl4]2- bajo reflujo en etanol, observadas en los difractogramas (Figuras 4c y 5c), se puede confirmar mediante la técnica de microscopía electrónica de transmisión, (TEM según su sigla en inglés), Figuras 9a y 9c. Las respectivas imágenes muestran las fotografías de las nanopartículas de paladio metálico con un tamaño menor de 10 nm, un valor similar al reportado en la literatura 30. Probablemente este tamaño también se deba a la aglomeración de muchas nanopartículas de paladio en algunas áreas, dado que adicionalmente se observan partículas mucho más pequeñas en otras áreas.

Figura 9 Imágenes de TEM de los materiales sintetizados a) LHS-Zn-Ac/Pd0, b) aumento en el área marcada de (a), c) LHS-Zn-Suf/Pd0 yd) aumento en el área marcada de (c)
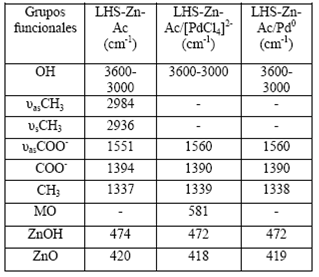
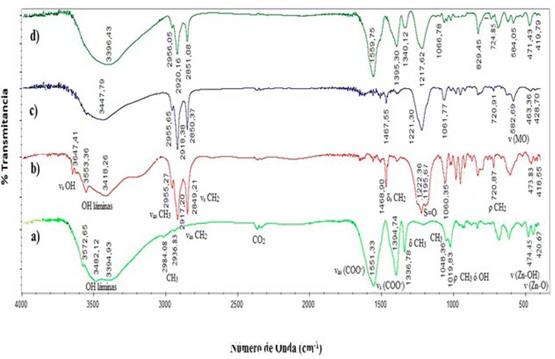
Los espectros infrarrojos con transformada de Fourier (FT-IR) de los materiales (a) LHS-Zn-Ac (b) LHS-Zn-Ac/[PdCl4]2- y (c) LHS-Zn-Ac/Pd0 se muestran en la Figura 10, y los datos de cada señal se presentan en la Tabla 2. Además de las señales esperadas para enlace C-H (29, 31), se observa una banda ancha e intensa en la región de 3600-3000 cm-1, asignada a los modos vibracionales del grupo hidroxilo (OH) en el material inorgánico y de las moléculas de agua 31. Particularmente, en el espectro FT-IR del precursor LHS-Zn-Ac se observan tres bandas de absorción a 3396, 3482 y 3573 cm-1. Mediante espectroscopia Raman, estas señales se han atribuido a los grupos OH de las láminas inorgánicas de las posiciones octaédricas o tetraédricas de la hidroxisal 29.
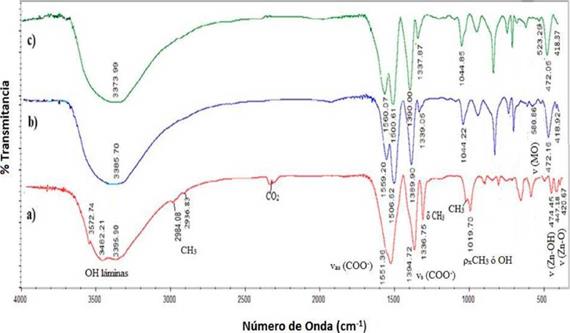
Figura 10 Espectros FT-IR de los materiales sintetizados (a) LHS-Zn-Ac (b) LHS-Zn-Ac/[PdCl4]2-, (c) LHS-Zn-Ac/Pd0
Igualmente, en relación con lo reportado en la literatura 32,33, se observan claramente en todos los materiales las señales correspondientes a la vibración asimétrica y simétrica del grupo carbonilo (1560 cm-1 y 1430-1350 cm-1 respectivamente). En el presente trabajo se observa una señal a 1394 cm-1 para el LHS-Zn-Ac, pero de 1390 cm-1 para el material intercambiado y reducido (LHS-Zn-Ac/[PdCl4]2-, LHS-Zn-Ac/Pd0).
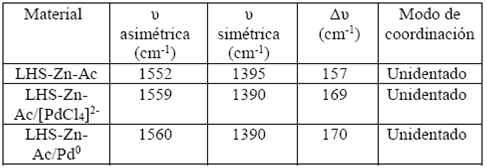
Biswick y colaboradores 31 reportan que la naturaleza y grado de interacción del ion acetato con la matriz catiónica puede ser inferida de la diferencia de energía (Δυ) de las vibraciones de tensión asimétricas y simétricas del ion carboxilato como se muestra en la Tabla 3. De acuerdo al (Δυ) calculado en los tres materiales, es posible afirmar que el modo de coordinación del ion carboxilato al átomo de zinc es unidentado 31,32,34.
Las vibraciones características del ion acetato disminuyen en el material LHS-Zn-Ac/[PdCl4]2-, por la inserción del ion [PdCl4] en el espacio interlaminar, que se confirma por la aparición de una banda a 581 cm-1, atribuible a una vibración tipo metal-oxígeno como lo reporta la literatura 35. En el material reducido LHS-Zn-Ac/Pd0 la última vibración no se observa en el espectro FT-IR (Figura 10c) posiblemente porque el paladio ya no se encuentra coordinado.
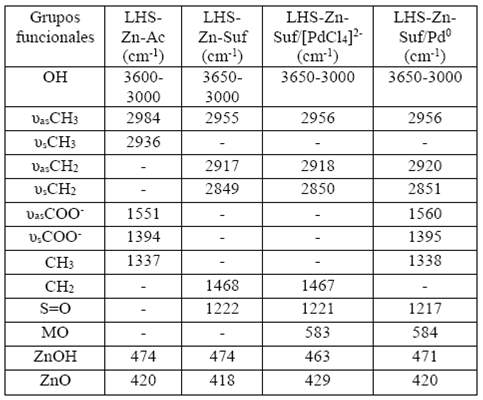
Por su parte, en los materiales con surfactante LHS-Zn-Suf, LHS-Zn-Suf/[PdCl4]2-, LHSZn-Suf/Pd0, las señales FT-IR (Figura 11) son las mismas con respecto a los materiales análogos con acetato (Figura 10), excepto por las siguientes señales: 3647 cm-1, 2920 cm-1, 2850 cm-1 y 1120 cm-1. Estas señales corresponden a vibraciones de tensión del OH del agua 37, vibración asimétrica y simétrica del grupo CH2 y a la vibración de enlaces S=O, respectivamente, que se originan por la presencia de moléculas de surfactante (Tabla 4). Igual que en los materiales con acetato se observa la misma tendencia a exhibir la señal a 581 cm-1 que evidencia la inserción del ion [PdCl4]2-, pero en estos materiales la señal no desapareció del todo después de la reacción de reducción, sugiriendo que no se llevó a cabo una reducción completa de paladio. Una relación más detallada y comparativa de las diferentes señales exhibidas por todos los materiales estudiados y su respectiva asignación se presenta en la Tabla 4. Estos valores son muy similares a los reportados por Menezes al utilizar laurilsulfato y mostrar una señal a 1222 cm-138,39. Las señales por debajo de 900 cm-1 son vibraciones de la estructura laminar que involucran el catión metálico como vibraciones Zn-O y Zn-OH (36).
Tabla 4 Números de onda (cm"1) asignados a las bandas de vibración de las hidroxisales con surfactante
Reacción de Sonogashira
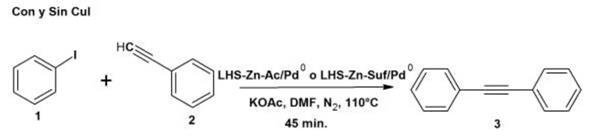
Después de caracterizar los materiales inorgánicos, se comparó la reactividad de cada uno de estos en la reacción de acoplamiento Sonogashira entre un haluro de arilo y un acetileno terminal. Primero se experimentó con la reacción de Sonogashira clásica entre yodobenceno y fenilacetileno de acuerdo a lo reportado en la literatura 39. Luego a partir de estas condiciones se sintetizó 2-fenilbenzofurano.
Síntesis de difenilacetileno
La Figura 12 muestra la síntesis de difenilacetileno utilizando los dos catalizadores; ambas reacciones conducen al mismo producto cuando se realiza con y sin CuI.
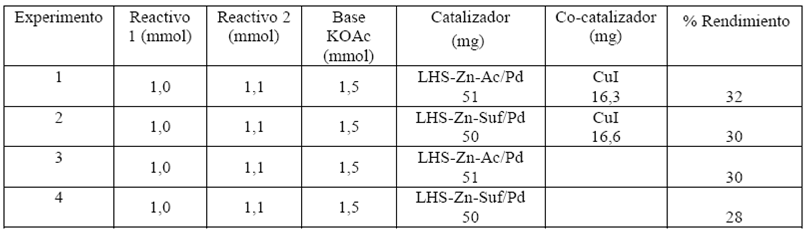
La Tabla 5 muestra los resultados obtenidos al realizar la síntesis de difenilacetileno con y sin CuI utilizando como base KOAc y 2 mL de DMF como solvente durante 45 min. Al mismo tiempo se tomó la precaución de utilizar atmósfera de nitrógeno y una menor cantidad de fenilacetileno con el fin de evitar el producto de homoacoplamiento en la reacción.
Los rendimientos obtenidos en la síntesis del difenilacetileno se encuentran alrededor de 32-30% cuando se realizan con CuI como co-catalizador. Sin co-catalizador, los rendimientos son del 30-28% disminuyendo 2%. Estos rendimientos fueron medidos por pesaje directo del producto aislado y purificado por cromatografía de columna. En general, siempre se observó una pequeña diferencia en los rendimientos de las reacciones de acoplamiento C-C catalizadas por LHS-Zn-Ac/Pd0 y LHS-Zn-Suf/Pd0, siendo un poco superiores con el primer material. Dado que el ambiente interlaminar en el material modificado con surfactante es altamente lipofílico, se afectan levemente las interacciones con los sustratos de polaridad intermedia o alta (yodobenceno y yodofenol) lo que presumiblemente podría explicar la reactividad ligeramente menor con el uso de LHS-Suf-Pd0.
Síntesis de 2-fenilbenzofurano
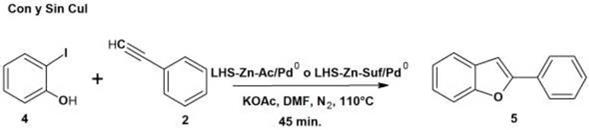
Varios autores han reportado la reacción de Sonogashira libre de CuI como cocatalizador 39. Con el fin de establecer las mejores condiciones de reacción, se realizó una comparación en la síntesis de 2-fenilbenzofurano a partir de 2-yodofenol y fenilacetileno (Figura 13), donde se establecieron las mismas condiciones para todos los experimentos como lo muestra la Tabla 6; las síntesis de 2-fenilbenzofurano se llevaron a cabo sin co-catalizador.
La Tabla 6 muestra los resultados obtenidos al realizar la reacción con y sin co-catalizador CuI. Se observa que la diferencia entre los catalizadores cuando se realiza con CuI es solo del 1%, mientras que sin éste la diferencia fue del 4%. Los rendimientos en la síntesis de 2-fenilbenzofurano están alrededor de 17-18% cuando se emplea CuI, mientras sin utilizar co-catalizador los rendimientos se encuentran entre el 11-15% mostrando mayores rendimientos en ambos casos con el catalizador de acetato. Por otra parte es importante notar que el incremento de los rendimientos cuando se utiliza CuI es poco significativo (2 y 3%) frente a las complicaciones de la reacción cuando se utiliza CuI como cocatalizador.
Cada uno de los experimentos se siguió por TLC y GC-MS mostrando la presencia de 2-yodofenol en el crudo de reacción. Algunos autores plantean que al aumentar la sustitución del anillo aromático con grupos electrodonadores como el caso de 2-yodofenol, la reactividad del acoplamiento Sonogashira disminuye 40, lo cual justifica la presencia de 2-yodofenol cuando se consume el exceso de fenilacetileno, explicando los bajos rendimientos obtenidos hasta el momento.
Finalmente es importante volver a mencionar que una estimación cualitativa del contenido de paladio metálico contenido en las hidroxisales LHS-Zn-Ac/Pd0 y LHS-Zn-Suf/Pd0 se deriva de los resultados del estudio por SEM, que muestra contenidos aproximados del 16% de paladio reducido en LHS-Zn-Ac/Pd0 y 31% en LHS-Zn-Suf/Pd0, datos tomados en los puntos de mayor aglomeración de partículas metálicas. Sin embargo, estos resultados son solo una guía preliminar, entre otras razones porque los materiales son de naturaleza heterogénea y la metodología del análisis SEM permite censar regiones a criterio del analista. En esta circunstancia, los porcentajes suministrados no reflejan necesariamente el contenido cuantitativo de paladio en la totalidad del material y no se espera que haya estricta concordancia entre el contenido aparente de paladio y la actividad catalítica.
Conclusiones
Se logró la síntesis de dos nuevos materiales con nanopartículas de paladio aglomeradas y soportadas en las láminas: LHS-Zn-Ac/Pd0 y LHS-Zn-Suf/Pd0 lo cual se verificó por TEM. El análisis por XRD de ambos materiales evidenció las estructuras laminares de acuerdo a los planos de difracción y modificaciones en el espacio interlaminar. Así, el material LHS-Zn-Ac mostró una distancia interlaminar de 13,8 Å. Cuando se realizó el intercambio con el anión laurilsulfato (LHS-Zn-Suf) aumentó el espacio interlaminar hasta 29,8 Å y, al intercambiarse con [PdCl4]2- (LHS-Zn-Suf/[PdCl4]2-), aumentó a 31,4 Å. Finalmente, una vez se redujo este material y se preparó LHS-Zn-Suf/Pd0 se observó una interlámina con una distancia de 29,4 Å.
Con respecto al intercambio del LHS-Zn-Ac con [PdCl4]2- (LHS-Zn-Ac/[PdCl4]2-), se evidenció un cambio en el espacio interlaminar de 13,8 Å a 22,4 Å, el cual se mantuvo al hacer la reducción (LHS-Zn-Ac/Pd0). Lo anterior se debe posiblemente a la falta de reducción total del [PdCl4]2- o la presencia de nanopartículas con un tamaño inferior a 2 nm en la interlámina.
Adicionalmente, mediante la técnica de SEM se mostró la morfología laminar de cada uno de los materiales. Además, se observaron leves cambios como la exfoliación o delaminación de los dos materiales reducidos usando etanol en reflujo. Cada uno de los materiales laminares sintetizados mostró actividad catalítica en la síntesis de difenilacetileno y 2-fenilbenzofurano.
Cuando se utilizó LHS-Zn-Ac/Pd0 y CuI (como co-catalizador) se obtuvieron rendimientos del 32% de difenilacetileno y 18% de 2-fenilbenzofurano, mientras que con LHS-Zn-Suf/Pd0 y CuI los rendimientos obtenidos fueron del 30% y 17% respectivamente.
En ausencia de CuI, los rendimientos fueron menores (30% de difenilacetileno y 15% 2-fenilbenzofurano con LHS-Zn-Ac/Pd 0 y 28% y 11% respectivamente con LHS-Zn-Suf/Pd0).