Introducción
La tuberculosis (TB) es una infección bacteriana causada por especies pertenecientes al complejo de Mycobacterium tuberculosis. Actualmente constituye un problema de salud pública a nivel mundial, con 10,4 millones de nuevos casos y 1,4 millones de muertes, reportados para el 2015 ante la Organización Mundial de la Salud 1. Los medicamentos anti-TB usados actualmente son poco eficientes e involucran cuatro fármacos diferentes en su tratamiento, por un periodo de 6 meses, razón por la cual se han hecho esfuerzos para desarrollar medicamentos anti-TB más efectivos.
Así mismo, la infección con M. tuberculosis, resistente a los medicamentos anti-TB, provoca un aumento del riesgo del fracaso terapéutico, un aumento del tiempo y costo del tratamiento, así como de sus efectos secundarios. Aunque la bedaquilina, aprobada por la FDA en 2013, se prescribe para el tratamiento de la tuberculosis multi-drogorresistente, este medicamento produce serios efectos secundarios como síndrome QT prolongado, disfunción del hígado y aumento en el riesgo de muerte 2, razones que demuestran la falta de desarrollo de nuevos agentes anti-TB que actúen a través de nuevos mecanismos de acción para garantizar un régimen efectivo en la próxima década 3.
Los productos naturales han sido una fuente importante de nuevos esqueletos bioactivos para tratar la TB, por ejemplo, las manzaminas, pleuromutilinas e hirsutelonas son utilizados en el desarrollo de medicamentos anti-TB 4. Del mismo modo, estudios previos sobre alcaloides aporfínicos aislados de especies de Lauraceae como Ocotea macrophylla ( 5 y Rhodostemonodaphne crenaticupula ( 6 han evidenciado una tendencia de actividad anti-TB en estas especies. El género Ocotea es uno de los más estudiados dentro de la familia Lauraceae, siendo fuente de terpenos 7 - 9 ) neolignanos y lignanos 10 - 14 ), alcaloides aporfínicos 15 - 17 ) y bencilisoquinolínicos 18 , 19, además de compuestos fenólicos y flavonoides 20 - 22 ). Los estudios de actividad biológica del género han demostrado que estas especies poseen efectos antimicrobianos 23 - 25, antiparasitarios 26, antitumorales y citotóxicos 19 , 27 , 28; estas últimas debido a las propiedades de los compuestos aislados en la inhibición de la topoisomerasa I 29.
Como ya se mencionó antes, entre las moléculas derivadas de productos naturales que han mostrado tener actividad antituberculosa prometedora, se destacan los alcaloides y, dentro de ellos, los aporfínicos 30. Como el género Ocotea ha reportado ser productor de este tipo de alcaloides, se escogió la especie Ocotea discolor para su aislamiento y su posterior medición de actividad antituberculosa. En Colombia, la especie se encuentra en la cordillera central, a alturas mayores a 1500 m s. n. m 31 ).
Debido a que no se ha publicado hasta el momento ningún reporte fitoquímico o de actividad biológica para esta especie, se describen aquí los compuestos de tipo alcaloide aporfínico aislados de la madera y se presenta su efecto en el crecimiento de la bacteria virulenta M. tuberculosis H37Rv.
Materiales y métodos
Material vegetal
La madera de Ocotea discolor fue colectada en octubre de 2011, en la vía Duitama-Charalá (Colombia). La especie fue determinada por el biólogo Adolfo Jara, del Herbario Nacional Colombiano. Un espécimen se depositó en el Herbario Nacional Colombiano del Instituto de Ciencias Naturales en la Universidad Nacional de Colombia con el número COL 566243.
Extracción y Aislamiento
La madera seca y molida de Ocotea discolor (1160 g) fue extraída con etanol al 96% (v/v) a temperatura ambiente. La evaporación del solvente se hizo por destilación a presión reducida quedando un extracto de 41,7 g. Una parte del extracto (30 g) fue fraccionada por cromatografía flash (FC) en silica gel 60 (Macherey-Nagel, Alemania) y eluído con AcOiPr-MeOH-H2O (91:8:1) hasta 100% (v/ v) MeOH, dando 12 fracciones. La fracción 8 (514 mg) fue purificada por FC con CHCl3-MeOH (98:2), para obtener el compuesto 1 (12 mg). La fracción 9 (370 mg) fue purificada por sucesivas FC con CHCl3-MeOH (9:1-95:5), donde se obtuvo el compuesto 2 (7 mg). De la fracción 11 (1500 mg), por columnas sucesivas con la fase móvil AcOiPr-MeOH en diferentes proporciones, se obtuvieron los compuestos 3 (30 mg) y 4 (20 mg). Todos los solventes utilizados fueron grado analítico de la casa Merck, Alemania.
Procedimiento experimental general
La rotación óptica fue medida en un polarímetro Bellingham & Stanley ADP440+. Los espectros de RMN 1H y 13C, así como los espectros 2D (COSY, HMQC y HMBC) fueron tomados en un equipo Bruker Avance™ 300 operado a 300 MHz para 1H y 75 MHz para 13C. Los desplazamientos químicos están en δ (ppm) y los experimentos fueron registrados a temperatura ambiente en CDCl3 (Merck, Alemania). La cromatografía en capa delgada (TLC) fue hecha en placas de silica gel 60 F254 (Merck, Alemania); los compuestos se visualizaron con el reactivo de Dragendorff, vapores de iodo y luz UV 32.
Ensayo de actividad anti-TB
Se adaptó del ensayo de microplato de 96 pozos con resazurina (REMA), protocolo publicado por Martin et al. ( 33. La cepa de M. tuberculosis H37Rv (ATCC 9360) que se usó como referencia estándar para estudios de investigación se cultivó a partir de criopreservado en 10 mL de medio líquido Middlebrook 7H9 (BD). Este fue suplementado con 0,2% (v/v) glicerol (Sigma), 0,05% (v/v) Tween® 80 (Sigma) y 10% (p/v) albumina, dextrosa y catalasa (ADC, BD) por incubación a 37 °C en tubos falcons estériles de 50 mL con agitación esporádica, durante 3-4 semanas. Posteriormente, se cambió a medio líquido en las mismas condiciones.
Se preparó una solución stock de cada compuesto en DMSO (Sigma) a una concentración de 100 mg/mL. Los compuestos fueron probados en cada microplato por diluciones seriadas empezando desde 100 μg/mL con Middlebrook 7H9 (BD), suplementado con 0,2% de glicerol (Sigma), 0,05% de Tween® (Sigma) y 10% de OADC (BD). Se utilizó agua estéril en los pocillos circundantes para evitar la evaporación del medio líquido; el ensayo se realizó por duplicado. El cultivo de M. tuberculosis H37Rv (ATCC 9360) creció en medio Middlebrook 7H10 (BD) a 37 °C, y antes del ensayo se realizó un paso del cultivo en medio líquido Middlebrook 7H9. El antibiótico rifampicina (Sigma) fue usado como control positivo. La concentración mínima inhibitoria fue determinada visualmente como la mínima concentración donde la bacteria no creció.
Resultados y discusión
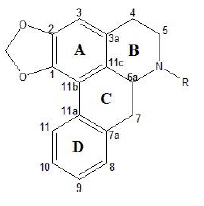
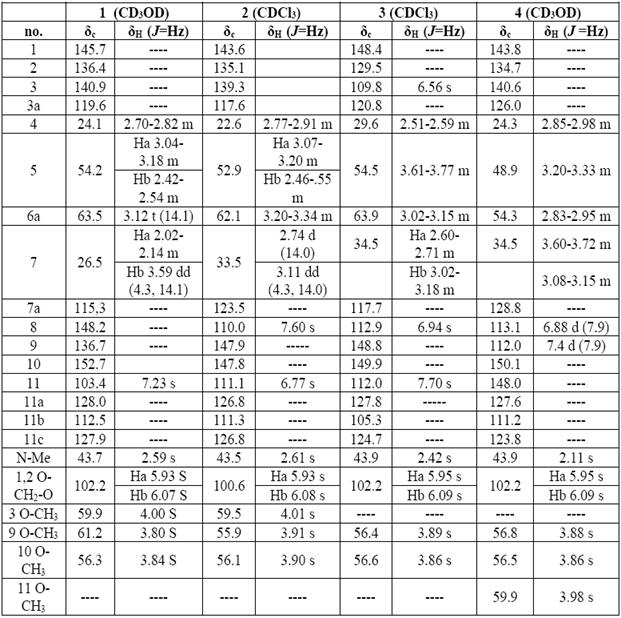
Los compuestos 1-4 fueron obtenidos como sólidos cafés amorfos, los cuales generaron un color naranja en TLC al revelarlos con el reactivo de Dragendorff, lo que sugiere la presencia de alcaloides. Los espectros de RMN 1D poseen una amplia similitud lo que sugiere una serie de compuestos estructuralmente relacionados. El espectro RMN 1H de 2 mostró hidrógenos de tipo aromático y alifático; las señales en δ 3,20- 3,34 (1H, m, H-6a), δ 3,07-3,20 (1H, m, H1-5), δ 2,46-2,55 (1H, m, H2-5), δ 3,11 (1H; dd; J= 4,3 y 14,0; H1-7) y δ 2,74 (1H, d, J=14,0 Hz, H2-7), corresponden a señales típicas del núcleo aporfínico 17 , 33, como se muestra en la Figura 1.
Adicionalmente, se observaron las señales entre: δ 3,90-4,10 (s, 9H) correspondientes a 3 grupos metoxi, algunos multipletes de grupos metilenos en δ 2,77-3,20; dos hidrógenos aromáticos en δ 7,60 (s, H-8) y 5 6,77 (s, H-11), junto con dos singletes típicos del grupo metilendioxi en δ 5,93 (s, Ha) y 5 6,08 (s, Hb) 19 ). La correlación en el experimento COSY de H-4 con Hb-5 y las correlaciones en HMBC de H-4 con C-3 y C-3a Hb-5 con C-3a Hb-7 con C-11c, H-8 con C-10 y C-11, H-11 con C-7a y C-9 permiten construir cuatro anillos de seis miembros dos aromáticos (A y D) y dos no aromáticos (B y C) 33 - 34, que en conjunto permiten llegar a la estructura del compuesto 2. A través de la comparación con los datos reportados en literatura 2 corresponde al alcaloide ocoteina el cual posee un centro asimétrico en la posición 6a cuya configuración fue inferida por el signo de la rotación específica igual al de otros alcaloides aporfínicos previamente aislados proponiendo así que la configuración relativa del centro 6a es S ( 35 - 37 ).
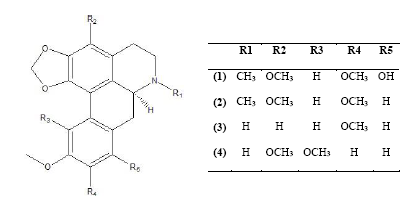
Para cada uno de los demás alcaloides aislados se reunió la misma información previamente descrita los datos espectroscópicos se presentan en la Tabla 1 y las estructuras en la Figura 2.
Tabla 1 Datos de resonancia magnética nuclear 1H y 13C para los cuatro alcaloides aporfínicos aislados de Ocotea discolor
Los compuestos 1 (12 mg) y 2 (7 0 mg) fueron identificados como ocoxilonina y ocoteina respectivamente los cuales fueron previamente aislados de las hojas y corteza Ocotea acutifolia ( 19. Los compuestos 3 (30 mg) y 4 (20 mg) fueron identificados como dicentrina y 1 2-metilendioxi-3 10 11-trimetoxiaporfina aislados de las especies Cassytha filiformis ( 37 ) y Cissampelos capensis ( 38.
Los resultados del ensayo de actividad anti-TB demuestran que todos los alcaloides aislados de la madera de Ocotea discolor inhiben en cierta medida el crecimiento de Mycobacterium tuberculosis H37Rv. El rango de los valores de la concentración mínima inhibitoria (MIC) se encuentra entre 140 y 310 μM, siendo la ocoteina (2) el alcaloide más activo con un valor de MIC de 50 μg/mL (140 μM) mientras que los otros compuestos muestran menor inhibición (Tabla 2).
Tabla 2 Actividad antituberculosa in vitro de la ocoxilonina (1), ocoteina (2), dicentrina (3) y 1,2-metilendioxi-3,10,11-trimetoxiaporfina (4)
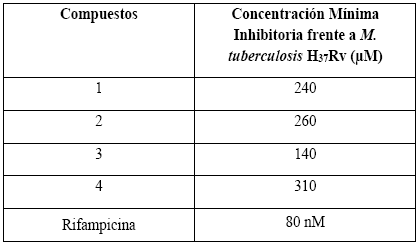
Una comparación estructural con algunos alcaloides similares tales como 3-metoxinordomesticina y leucoxina 5 , 6, indican que la presencia del benzodioxol es un requisito estructural necesario para la actividad anti-TB. Adicionalmente, la lipofilicidad juega un papel significativo en la actividad ya que la presencia de grupos hidroxilo cerca al anillo que contiene la sustitución metilendioxi reduce el efecto anti-TB como lo demuestra la comparación de la actividad entre la ocoxilonina (1) y la ocoteina (2).
No hay duda que los alcaloides aporfínicos con sustitución metilenodioxi muestran una tendencia de actividad anti-TB como lo demuestran no solamente los alcaloides de este estudio sino también 3-metoxinordomesticina leucoxina piperolactama A y (-)-nordicentrina 38 - 40 ).
Conclusiones
Los alcaloides ocoxilonina (1) ocoteina (2) dicentrina (3) y 1 2-metilendioxi-3 10 11-trimetoxiaporfina (4) se aislaron por técnicas cromatográficas de la madera de Ocotea discolor. Los datos espectroscópicos y la comparación con la literatura permitieron determinar inequívocamente su estructura química. El ensayo de actividad anti-TB confirmó la actividad promisoria de los alcaloides aporfínicos que presentan sustitución metilenodioxi en alguno de los anillos que conforman el núcleo básico de aporfina. La continuación de los estudios detallados de los alcaloides presentes en las especies neotropicales de la familia Laurácea puede arrojar nuevos esqueletos anti-TB que podrían constituir un punto de partida para el desarrollo de nuevos principios activos contra la tuberculosis.