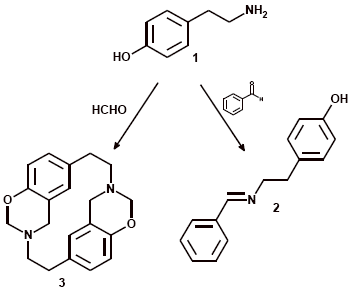
Introducción
Las β-feniletilaminas son conocidas por su actividad sobre el sistema nervioso central (neurotransmisores), por sus efectos psicotrópicos y por ser precursores en la síntesis y biosíntesis de moléculas de interés químico y biológico 1-7.
La tiramina (p-hidroxifeniletilamina) es una β-feniletilamina simpaticomimética que incrementa la presión arterial y estimula los músculos lisos. Este fármaco ha sido ampliamente usado en estudios sobre la fisiología y fisiopatología del sistema nervioso simpático y su influencia en el sistema cardiovascular 8.
La tiramina 1 reacciona con aldehídos aromáticos para formar las respectivas bases de Schiff 2 y con formaldehido para formar un azaciclofano pentacíclico 3 producto de una doble condensación tipo Mannich entre dos moléculas de tiramina y cuatro de formaldehído (Figura 1) 9 , 10.
N-benciltiramina 4 y (N-(4-metoxibencil)tiramina 5 reaccionan con formaldehído por medio de una reacción tipo Mannich para formar los respectivos azaciclofanos 6-7, mientras que (N-(3-nitrobencil)tiramina 8 produce una mezcla compleja cuyos productos mayoritarios son N-bencil-N-metiltiramina 9 y un dímero conformado por dos unidas por un metileno con una de las benciltiraminas N-metilada 10 (Figura 2). La metilación en los productos 9 y 10 ocurre por medio de una reacción de Eschweiler-Clarke con ácido fórmico generado in situ 11.
Considerando lo anterior surgió la pregunta: ¿una amina secundaria derivada de tiramina podrá reaccionar con aldehídos aromáticos? 12 , 13. Para obtener respuesta, se tomó como experimento modelo 4 y 3-nitrobenzaldehido 11 bajo diferentes condiciones experimentales. Los resultados mostraron que 4 no reacciona con 11 y solo fue posible obtener dos productos inesperados por reacción de 4 con el disolvente (Figura 3). En este artículo se presenta el análisis estructural de los productos obtenidos y se propone un mecanismo de reacción que permite racionalizar el curso de la reacción.
Materiales y métodos
General
Tiramina (Sigma-Aldrich, USA, grado síntesis) y los disolventes metanol, etanol y DMF (Merck, Alemania, grado analítico) se utilizaron sin purificación adicional. Los espectros de infrarrojo se adquirieron en un espectrofotómetro Nicolet™ iS™ 10 (Thermo Fisher Scientific, USA) empleando pastillas de KBr al 1% p/p. Los espectros de masas se registraron en un equipo Shimadzu LCMS-IT-TOF usando ionización por electrospray (ESI) en modo positivo. Las muestras se disolvieron en una mezcla acetonitrilo/agua/ácido fórmico 9O:1O:1 y se inyectaron directamente en el sistema. Los espectros de resonancia magnética nuclear se registraron en un espectrómetro Bruker Avance™ 400 operado a 400 MHz para 1H y 100 MHz para 13C empleando cloroformo o metanol deuterados (Merck, Alemania) como disolvente y tetrametilsilano (TMS) o la señal residual del disolvente como referencia. Los cálculos computacionales se realizaron empleando el programa Gaussian O3 (DFT-B3LYP/6-31G(d,p)).
Transamidación y transamidación-reducción de 4
Se sometió a calentamiento (13O-135 °C) una mezcla de 4 (5OO mg; 2,2O mmol) y TsOH monohidratado (8O mg; O,42 mmol) disueltos en DMF. El curso de la reacción se monitoreó por CCD y cuando no se observó más cambio (96 h), se retiró la fuente de calor, se adicionó agua y se extrajo con CHCl3 (tres veces). La fase orgánica se lavó con agua (tres veces), se secó con Na2SO4 anhidro y se retiró el disolvente a presión reducida. Del sólido obtenido se aislaron N-bencil-N-formiltiramina 12 y N-bencil-N-metiltiramina 13 por cromatografía en columna de silica gel eluyendo con mezclas CHCl3:AcOEt 14 ).
Resultados y discusión
Como se mencionó arriba, N-benciltiramina 4 empleando DMF como disolvente y TsOH como promotor, no reacciona con 3-nitrobenzaldehido 11 y solo se forman dos N-benciltiraminas N-sustituidas por reacción de 4 con el disolvente (Figura 3).
La primera de ellas corresponde a N-benciltiramina N-formilada 12 cuya formación se puede explicar por medio de una reacción de transamidación en la que el grupo amino de 4 realiza un ataque nucleofílico al grupo amido del DMF, este ataque lleva a una sustitución nucleofílica acílica como se muestra en la Figura 4.
N-bencil-N-formiltiramina (12)
Sólido rojo, C16H17NO2, rend. 2O%, P.f. 116-119 °C. FT-IR (KBr) cm-1: 337O, 3O68, 2925, 2854, 17O4, 1615. RMN 1H (CDCl3): Rotámero Z (54%), δ 7,83 (1H, s); 7,4O-7,13 (5H, m); 6,91 (2H, d, J = 8,5 Hz); 6,74 (2H, d, J = 8,5 Hz); 4,56 (2H, s); 3,34 (2H, t, J =7,4 Hz); 2,72 (2H, t, J = 6,5 Hz). Rotámero E (46 %) δ 8,25 (1H, s); 7,4O-7,13 (5H, m); 6,99 (2H, d, J = 8,5 Hz); 6,77 (2H, d, J = 8,5 Hz); 4,25 (2H, s); 3,44 (2H, t, J= 6,6 Hz); 2,7O (2H, t, J=6,5 Hz). RMN 13C (CDCl3): Rotámero Z, δ 163,4; 155,4; 136,2; 129,9; 128,9; 128,8; 128,4; 128,2; 115,8; 48,8; 45,6; 33,8. Rotámero E δ 163,2; 155,O; 135,8; 129,83; 129,79; 128,8; 127,8; 127,6; 115,5; 51,9; 43,9; 32,4. ESI-HRMS: m/z 256,1291 ([M+H]+, calculado 256,1332); 297,1512 ([M+CH3CN+H]+, calculado 297,1598) 14.
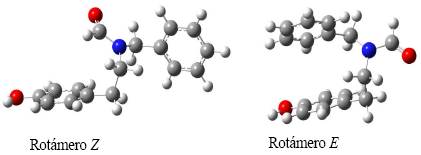
Los espectros de RMN (1H y 13C) del compuesto 12 muestran señales duplicadas para la mayoría de protones y carbonos. Como explicación para este comportamiento espectroscópico se propone la presencia de dos rotámeros que se encuentran en equilibrio en la solución. Esta presencia está favorecida por la alta barrera energética para la rotación del enlace C-N en el grupo amida (carácter parcial de doble enlace).
Adicionalmente, el análisis espectroscópico permitió establecer que la señal que aparece a 8,25 ppm corresponde al rotámero E. En este rotámero el hidrógeno del grupo formilo se encuentra en el mismo plano del anillo bencílico y es desprotegido por efecto de anisotropía del anillo (Figura 5). Este efecto no está presente en el rotámero Z y por ello aparece a campo alto (7,83 ppm). La relación de integrales de los hidrógenos asignados a grupos formilo, δ 7,83 y 8,25 ppm, permitió establecer que la mezcla de rotámeros se encuentra en proporción 54% (rotámero Z) a 46% (rotámero E). Cálculos computacionales también mostraron que el rotámero Z es la estructura de menor energía y se determinó una distribución de Boltzmann de 51% para el rotámero Z y de 49% para el rotámero E, confirmando lo observado con la relación de integrales en el espectro de RMN 1H.
El segundo compuesto obtenido corresponde a N-benciltiramina metilada 13, su obtención muestra que adicional a la formilación ocurre una reducción del grupo formilo hasta metilo. Para determinar si el 3-nitrobenzaldem'do 11 presente en el medio de reacción fue la especie que se comportó como donador de hidruro, se calentó 4 disuelta en DMF en presencia de TsOH, buscando reproducir las condiciones experimentales bajo las que se obtuvieron 12 y 13. Bajo estas condiciones, la reacción siguió el mismo curso y produjo nuevamente 12 y 13 demostrando que el aldehido 11 no tiene participación alguna en el curso de la reacción. Estos resultados permiten proponer que el agente donador de hidruro es ácido fórmico generado in situ por medio de hidrólisis ácida de DMF. Dicha hidrólisis ocurre por la presencia de agua proveniente tanto de humedad del disolvente como del TsOH monohidratado empleado como promotor de la transamidación El ácido fórmico en el medio actúa como agente reductor de 12, siguiendo un mecanismo similar al propuesto para la aminación reductiva de Leuckart-Wallach (Figura 6) 15,16.
N-bencil-N-metiltiramina (13)
Sólido naranja, C16H19NO. Rend. 36%. P.f. 72-74 °C. FT-IR (KBr) cm-1: 3500-2500, 2949, 1637. RMN BH (CD3OD): δ 7,37-7,30 (5H, m); 6,99 (2H, d, J =8,5 Hz); 6,69 (2H, d, J = 8,5 Hz); 3,74 (2H, s); 2,82-2,68 (4H, m); 2,38 (3H, s). RMN 13C (CD3OD): δ 156,9; 136,0; 130,9; 130,6; 129,6; 129,5; 128,9; 116,3; 62,5; 60,0; 41,9; 32,9. ESI-HRMS: m/z 242,1507 ([M+H]+, calculado 242,1539) (14).
Estudios previos sobre la reactividad de feniletilaminas frente a compuestos carbonílicos han demostrado que el curso de reacción depende de efectos estéricos, electrónicos y de pre-organización molecular 17. Para el caso de 4, la pre-organización molecular previamente observada disminuye la nucleofilia del nitrógeno 11; los efectos estéricos por la presencia de dos sustituyentes voluminosos impiden la reacción con aldehídos aromáticos bajo las distintas condiciones de reacción empleadas.
Cuando se utilizó DMF como disolvente, la elevada temperatura disminuyó los efectos de pre-organización molecular, el promotor ácido aumentó la electrofilia del disolvente y se disminuyeron los efectos estéricos. Lo anterior debido al bajo volumen que ocupa la DMF, lo que favoreció una reacción de transamidación del DMF que condujo a la formación del derivado formilado 12; la posterior reducción por ácido fórmico generado in situ permitió la formación de 13.
Conclusiones
La reacción de N-benciltiramina 4 con DMF conduce a la formación de N-bencil-N-formil-tiramina 12 y N-bencil-N-metiltiramina 13) por medio de reacciones de transamidación y de transamidación-reducción. Esta reacción está favorecida por las condiciones experimentales empleadas y por el tamaño de la DMF lo que disminuye efectos estéricos y de pre-organización molecular, efectos que usualmente controlan la reactividad y direccionalidad de las reacciones de feniletilaminas con compuestos carbonílicos.