Introducción
La flor de arena es una planta del genero Clinopodium de la familia Lamiaceae, endémica de la región andina norperuana 1. Las herboristerías del Perú la comercializan como un producto excelente para el tratamiento del hígado, cálculos vesiculares, eliminación de ácido úrico y problemas del riñón. Muchas de estas propiedades son atribuidas a los metabolitos secundarios conocidos como triterpenos, ampliamente distribuidos en las plantas de la familia Lamiaceae. El ácido ursólico (AU) es el principal triterpeno en la flor de arena; esta molécula ha mostrado, entre otras, actividad antioxidante 2, antimicrobial 3, gastroprotectora 4, anti-inflamatoria y analgésica 5.
El AU (C30H48O3) es un compuesto ópticamente activo y cuenta con una estructura considerablemente complicada de diez centros quirales. Debido a estas características, no ha podido ser sintetizado aún y solo se ha obtenido por extracción y purificación a partir de productos naturales.
Así mismo, el ácido oleanólico (AO) es un isómero estructural muy similar al AU (Figura 1) y, a menudo, ambos están presentes simultáneamente en la misma planta como agliconas de saponinas o como ácidos libres 6.La purificación de AU se ve interferida por este isómero debido a la similitud estructural y a sus estrechas propiedades fisicoquímicas que complican la purificación; esto se refleja, por ejemplo, en el elevado costo del AU. Por tanto, en un estudio a escala para la obtención de AU y una producción económica y accesible, se hace necesario encontrar un método de separación más favorable al método cromatográfico de contracorriente propuesta por Frighetto et al.7 y al de cromatografía en columna propuesta por Amzad y Zhari 8.
El objetivo de la presente investigación fue obtener AU de una manera fácil, rápida y económica a partir de la especie Clinopodium revolutum conocida comercialmente como flor de arena y aprovechando la baja proporción de AU:AO (4,5:1) 9. Se utilizó la técnica de recristalización selectiva para enriquecer la solución con AU o para reducir la cantidad de AO.
Materiales y métodos
Materiales y productos químicos
El material vegetal fue recolectado en el Departamento de Huánuco-Perú en enero de 2016. Se depositó un espécimen de comprobante en el Herbarium Truxillense (HUT-58329) identificado por el Botánico Eric Rodríguez - Universidad Nacional de Trujillo. Las hojas secas de flor de arena no se trituraron para la extracción sino que se trabajó con las hojas secas intactas, con dimensiones ≤ 1mm. Los reactivos químicos utilizados etanol (Merck, Alemania) y acetonitrilo (Merck, Alemania) fueron de grado HPLC y hexano (Merck, Alemania) junto con acetato de etilo (Merck, Alemania) fueron de grado analítico.
Instrumentos
La concentración de los extractos se realizó con un rotaevaporador BUCHI R-215. El análisis por HPLC se realizó con un equipo UltiMate 3000 (Thermo Fischer Scientific) con detector DAD, columna Lichrospher RPC18 (Phenomenex) de 250 x 4,6 mm x 5 µm. El espectro IR fue registrado (disco de KBr) en un equipo Nicolet™ 380 FT- IR. El espectro de 1H y 13C fue registrado en un equipo BRUKER Ascend™ 500 MHz con consola AVANCE III HD; se utilizó DMSO-d6 (Merck, Alemania) como solvente y TMS (Merck, Alemania) como estándar interno. Los desplazamientos químicos (δ) son reportados en ppm.
Proceso de purificación de ácido ursólico
Los trabajos realizados por Fan et al.10 , 11 sobre la solubilidad de AO y AU fueron imprescindibles a la hora de la elección del solvente de recristalización. El proceso de purificación se inició con 15 g de hojas secas de flor de arena. El diagrama de flujo de la Figura 2 muestra el proceso detallado de la purificación de AU. La pureza se determinó mediante HPLC, para lo cual se usó un método isocrático con una fase móvil de acetonitrilo : agua (80:20) a una velocidad de flujo de 1 mL/min, la muestra eluida fue detectada a 209 nm 12.
Resultados y discusión
Obtención de AU
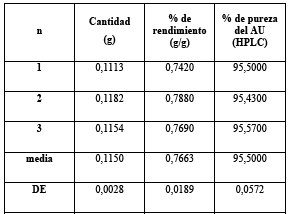
La extracción por inmersión en acetato de etilo fue reportado como un proceso efectivo debido a la selectiva y rápida extracción de triterpenos 13 - 15. El resultado del primer proceso de extracción que se inició con 15,0000 g de hojas secas de flor de arena, se obtuvo 1,3604 g de extracto, luego se desengrasó y se redisolvió en etanol de 96% a 60 °C, después de mantenerlo en refrigeración se obtuvo 0,4398 g de precipitado, se recristalizó y se obtuvieron 0,1113 g de cristales de ácido ursólico, en la Figura 3 se puede observar la fotografía digital de los cristales.
La pureza estimada por HPLC resultó ser de 95,5000%. En la Figura 4 se muestra el cromatograma realizado con un modo de elución isocrático acetonitrilo : agua (80:20), volumen de inyección 5µL, velocidad de flujo 1 rnL/min, detección 209 nm y a una temperatura de 30 °C.
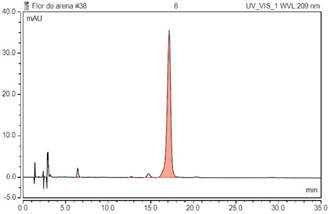
Figura 4 Cromatograma de los cristales de ácido ursólico (t.r = 17,16 min) obtenido utilizando una fase móvil de acetonitrilo: agua (80:20), velocidad de flujo 1mL/min y detección a 209 nm.
Con el objetivo de comprobar la reproducibilidad del método, se realizó el trabajo de la misma manera por triplicado. La Tabla 1 muestra el resumen de los resultados obtenidos en el proceso de purificación del AU.
Comparando los resultados con otros ya reportados 16 - 18, los obtenidos en este trabajo de investigación resultan ser mejores por el hecho de eliminar el uso de solventes tóxicos y no requerir el uso de columna cromatográfica preparativa de silica gel. Si bien es cierto que el rendimiento es menor comparado a los resultados obtenidos por Fan et al.19, también es cierto que el método propuesto es más fácil, no requiere el uso de equipos de ultrasonido ni de pre tratamientos de la muestra. Además de ser un método fácil es también rápido: aproximadamente en dos días se obtienen los cristales de AU.
Caracterización
El espectro IR obtenido (Figura 5) muestra las señales esperadas para los grupos funcionales del compuesto AU. Así, a 3442 cm-1 se tiene una señal que es característica del grupo OH, a 1698 cm-1 la del C=C, a 1716 cm-1 la del C=O del ácido carboxílico, en el intervalo 1460-500 cm-1 la huella dactilar y a 2870-2975 cm-1 los enlaces C-H.
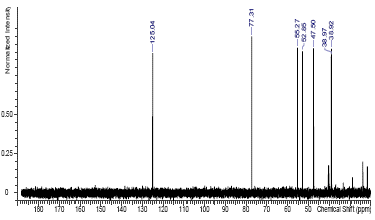
Los espectros de RMN de 1H y 13C confirman la estructura del AU. En la Figura 6 se observa la estructura y el espectro de 1H-RMN. Como se esperaba, resultó un espectro complejo por la cantidad de protones que se acoplan y multipletes solapados. Se pueden destacar algunas señales características como las de COO-H (s, δ 11, 93), O-H (d, δ 4,28) y de los protones del carbono 6C (m, δ 3,01) y 13C(t, δ 5,13).

Figura 6 Estructura y espectro 1H- RMN (500 MHz, DMSO-d6TMS) de los cristales de ácido ursólico obtenido.
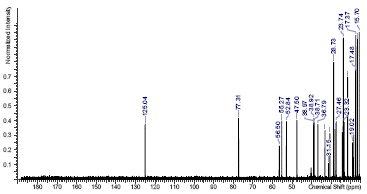
En la Figura 7 se observa el espectro de 13C-RMN. Para identificar el tipo y la cantidad de carbonos diferentes se utilizaron los espectros DEPT 45 (Figura 8), DEPT 90 (Figura 9) y DEPT 135 (Figura 10).
Comparando los espectros de la Figura 7 y 8, se observan las ausencias de siete señales (δ 178,72; δ 138,63; δ 47,28; δ 42,1; δ 39,57; δ 38,84 y δ 36,99) que corresponden a carbonos cuaternarios (C). En el espectro DEPT 90 las siete señales (δ 125,04; δ 77,30; δ 55,27; δ 52,84; δ 47,50; δ 38,97 y δ 38,92) corresponden a carbonos terciarios (CH). En el espectro DEPT 135 las señales positivas corresponden a los carbonos primarios (CH3) y terciarios (CH); las señales negativas corresponden a los carbonos secundarios (CH2).
Se encontraron nueve señales (δ 38,71; δ 36,79; δ 33,18; δ 30,18; δ 28,01; δ 27,46; δ 24,46; δ 23,32 y δ 18,48) en la zona negativa, que corresponden a los carbonos secundarios. En la zona positiva se encontraron 14 señales, de las cuales siete corresponden a los terciarios que se identificaron en el espectro DEPT 90 y las otras siete (δ 28,73; δ 23,74;; δ 21,55; δ 17,48; δ 17,37; δ16,54; y δ 15,70) corresponden a los carbonos primarios.
En total se identificaron 30 carbonos, lo que concuerda con la estructura del AU. Se realizó una comparación con las señales del espectro de 13C obtenido y los reportados en la literatura los datos se muestran en la Tabla 2.
Con los valores de la Tabla 2 se graficó la correlación 13C-RMN (ppm) de los desplazamientos químicos obtenidos y el reportado por Uddin (Figura 11).
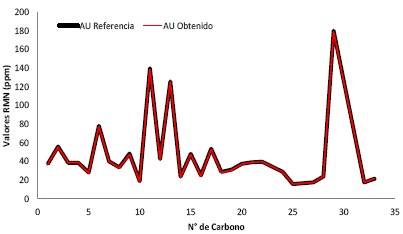
Figura 11 Correlación gráfica de los desplazamientos químicos de 13C de los cristales de ácido ursólico obtenido y el de la referencia reportada por Uddin et al. (20).
La Figura 11 muestra una perfecta correlación grafica entre los datos obtenidos y los de la literatura. Esto confirma que los cristales obtenidos son efectivamente AU.
Conclusiones
Tras la ejecución del proyecto se logró desarrollar un método de recristalización selectiva para obtener cristales de ácido ursólico de pureza mayor a 95% (HPLC) con un rendimiento de 0,742% (g/g) sin la necesidad de métodos cromatográficos preparativos con silica gel, ni uso de solventes tóxicos. Lo anterior convierte este método en uno fácil rápido económico y verde. Adicionalmente los resultados muestran que la flor de arena es una biofuente para la obtención de ácido ursólico.