Introducción
Los hidrogeles son materiales poliméricos reticulados capaces de absorber y retener grandes cantidades de agua y fluidos biológicos [1,2]. Las características físicas y químicas de estos materiales son importantes, ya que determinan la posible aplicación de los mismos. Desde el punto de vista físico, la propiedad más importante que presentan los hidrogeles es su grado de hinchamiento que mide su capacidad de absorción y controla gran número de sus propiedades mecánicas superficiales [3,4].
Normalmente, el comportamiento de los hidrogeles depende de las condiciones externas a las que están expuestos, por lo que pueden responder a diferentes estímulos externos tales como: cambio de pH, composición del solvente, fuerza iónica, luz, temperatura, antígeno, entre otros [5,6]. La biocompatibilidad es otra de sus características más frecuentes e importantes [7], lo que permite que se puedan utilizar en el campo de la biomedicina, farmacia, biotecnología, agricultura, industrias de alimentos, en la liberación controlada de fármacos, entre otros [1,8,9].
En este sentido, los hidrogeles son prometedores en diferentes áreas, como por ejemplo la descontaminación de aguas residuales debido a su capacidad de absorber iones [9-11]. Para estudiar su capacidad de remediación en efluentes industriales, Rojas et al. [11] sintetizaron un hidrogel de poli(acrilamida-co-ácido acrílico) lo cual dio buenos resultados en la absorción de iones Cu2+ y Mg2+.
Estos polímeros también son aplicables en la agricultura para aumentar la capacidad de retención de agua en el suelo, favoreciendo el desarrollo de las plantas [12]. Por ejemplo, Rojas et al. [13] usaron un hidrogel de poli(acrilamida-co-ácido maleico) con el propósito de analizar su aplicación en la germinación de semillas de tomate en diferentes tipos de suelos con características áridas. El hidrogel mejoró el suministro de agua a la planta y, por ende, incrementó la germinación en comparación con el suelo que no contenía el hidrogel.
Cuando estos materiales se sintetizan a escala nanométrica, se conocen como nanohidrogeles [8,14]. Gracias a su biocompatibilidad, la cual se atribuye a su similitud fisicoquímica con la matriz extracelular, estos nuevos materiales son muy prometedores en la biomedicina como dispositivos de liberación controlada de fármacos, particularmente cuando son sensibles al pH, como por ejemplo aquellos que contienen en su estructura poli(etilenglicol), polisacáridos o poli(aspartamidas) [15]. Otra ventaja de la aplicación de estos polímeros es su estructura altamente porosa que permite la incorporación de algún fármaco específico (antibiótico, cicatrizante, analgésico) u otra sustancia bioactiva (fertilizante, pesticida) y la posterior liberación de la dosis mínima necesaria [16].
También existen hidrogeles obtenidos a partir de las denominadas redes interpenetradas (IPNs, interpenetrating polymer networks). Estos se definen como la combinación de dos o más polímeros reticulados que son sintetizados de forma simultánea en el mismo medio de reacción [17]. Además han sido descritos como redes poliméricas que se mantienen unidas por los enredos permanentes que poseen [18]. Estas redes IPN son sintetizadas de distintas formas, entre las que se encuentran los semi-IPN o seudo-IPN constituidos por una mezcla de polímeros en el que uno de ellos es entrecruzado en presencia de un polímero lineal. Este último es incorporado durante la síntesis del hidrogel, de manera que, durante la polimerización por adición, el polímero queda ocluido dentro de la red polimérica tridimensional.
Se ha reportado que la estructura de los IPN y de los semi-IPN suministra resistencia adicional a los hidrogeles y nuevas propiedades de absorción [19-21].
En comparación con las mezclas poliméricas, constituidas por los componentes del hidrogel, estos materiales poseen propiedades mejoradas, como por ejemplo, la unión en un mismo material de polímeros que tengan propiedades diferentes: uno de los componentes puede poseer sensibilidad al pH, mientras que el otro puede ser sensible a los cambios de temperatura [22]. Se suelen utilizar dos tipos de clasificaciones para describir a los IPN: por vía química y por vía estructural [17].
Ahora bien, los plásticos biodegradables ideales son definidos como aquellos materiales que se degradan completamente en CO2, H2O y subproductos no tóxicos bajo la acción de los microorganismos [23]. Dentro de este tipo de materiales se encuentran los poliésteres alifáticos de origen bacterial de tipo poli(hidroxialcanoatos) que pueden ser biosintetizados, como por ejemplo el poli(3-hidroxibutirato) (PHB) y el P(HB-co-HV) [24-26]. El desarrollo de hidrogeles que contengan este tipo de biopolímeros permite generar materiales biodegradables, sobre todo en el área de la higiene personal, como absorbentes de fluidos corporales, por ejemplo, en compresas para mujeres y en pañales para bebés y personas adultas afectadas de problemas de incontinencia urinaria.
En un trabajo previo, reportamos la síntesis y caracterización de hidrogeles semi-IPN a partir de AAm y P(HB-co-HV)), evaluando sus propiedades de absorción, morfológicas y térmicas [27]. Sin embargo, en dicho trabajo no se evaluó el mecanismo de difusión del agua dentro de la red polimérica del material. Por lo anterior, en este trabajo se llevó a cabo la síntesis de varios hidrogeles semi-IPN de PAAm y del biopolímero P(HB-co-HV) de diferente masa molar, con el objetivo de analizar el efecto de la composición porcentual PAAm/biopolímero y del porcentaje de reactivo entrecruzante (MBAAm) sobre los mecanismos de transporte de agua. Además, se analizó el efecto de la masa molar del P(HB-co-HV) sobre las propiedades de hinchamiento en agua de los hidrogeles sintetizados.
Materiales y métodos
Reactivos
Los reactivos usados fueron: AAm (Sigma Aldrich, USA; 97%); MBAAm (Honeywell Riedel-de-Haën™, Alemania; 98%); ácido acético glacial (Sigma-Aldrich, USA) y azobisisobutironitrilo (AIBN) (Laboratory Reagents, USA; 98%).
El P(HB-co-HV) nativo tiene las siguientes características: Copersucar; composición molar: HB 93,2% y HV 5,5%; Mv = 170000 g-mol-1.
Hidrólisis del P(HB-co-HV)
Con el fin de obtener un poliéster de masa molar más baja, el P(HB-co-HV) nativo fue sometido a hidrólisis mediante el siguiente procedimiento: en un balón de tres bocas se introdujeron 2 g de P(HB-co-HV) y 100 mL de ácido acético concentrado. Luego, la mezcla de reacción fue sometida a reflujo a una temperatura de 60 °C durante 20 h. Se dejó enfriar la mezcla de reacción y, seguidamente, se agregaron 300 mL de agua. Se formó un precipitado que se aisló mediante filtrado a través de un embudo de Büchner. El producto se purificó disolviéndolo en cloroformo y, posteriormente, se precipitó con metanol. Se colectó nuevamente en un embudo Büchner y, finalmente, fue lavado con metanol.
Sintesis de los hidrogeles semi-IPN
La síntesis se llevó a cabo mediante el procedimiento previamente reportado por González et al. [23]. Los hidrogeles fueron sintetizados usando diferentes proporciones en peso PAAm/P(HB-co-HV): 100/0; 90/10 y 80/20. La MBAAm fue usada como agente entrecruzante en las proporciones en peso de 1 y 2 %. La reacción se llevó a cabo en agua y se inició vía radical libre usando AIBN como iniciador a 60 °C.
Resonancia magnética nuclear (RMN-1H)
Los espectros fueron obtenidos usando cloroformo deuterado como solvente en un espectrómetro de RMN Bruker AVANCE II 400 MHz y fueron referenciados usando los protones residuales en el solvente deuterado (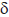 =7,25 ppm).
=7,25 ppm).
Espectroscopia de infrarrojo con transformada de Fourier (FT-IR)
Los espectros FT-IR fueron obtenidos empleando pastillas de KBr a través de un espectrofotómetro Perkin-Elmer Spectrum 2000. Todos los espectros fueron adquiridos después de 32 barridos usando una resolución espectral de ± 4 cm-1.
Calorimetría de barrido diferencial (CDB)
Estos análisis se realizaron con un calorímetro Perkin-Elmer DSC-7, con alrededor de 10 mg de muestra y con una velocidad de calentamiento de 10 °C/min en un intervalo de temperatura entre -40 y 200 °C, bajo atmósfera de nitrógeno con un flujo de 30 mL/min, calibrado con indio.
Viscosimetría
Las medidas de viscosidad para obtener la masa molar de los biopolímeros se realizaron usando la técnica descrita en la bibliografía [28,29]. La viscosidad intrínseca [η] del P(HB-co-HV) fue obtenida en CHCl3 a 30 °C y la masa molar viscosidad promedio (Mv) fue obtenida usando la ecuación (1) propuesta por Hermida et al. [30].
Hinchamiento
El grado de hidratación (hinchamiento, Hp) se determinó usando el método gravimétrico [26]. Con este fin, una película o pastilla de xerogel de aproximadamente 0,1 g fue sumergida en agua destilada a temperatura ambiente. A intervalos de tiempo previamente establecidos, se extrajo el hidrogel y se determinó su masa. Este procedimiento se repitió varias veces hasta que los hidrogeles alcanzaron el equilibrio fisicoquímico, es decir, donde no se observó variación en su masa.
Estudio de la morfología
El estudio de la morfología de los xerogeles se realizó a través de imágenes de microscopía electrónica de barrido (MEB) de la superficie liofilizada de muestras hinchadas. Las muestras fueron sumergidas en agua destilada hasta que alcanzaron el hinchamiento en el equilibrio, se enfriaron en nitrógeno líquido y, posteriormente, fueron liofilizadas durante 24 h usando un aparato Labconco FreeZone 2.5 durante 24 h. Transcurrido este tiempo, las muestras se recubrieron con una fina capa de oro para volverlas conductoras, mediante un recubridor iónico marca SPI modelo 11430E-AE.
Las imágenes fueron obtenidas usando un microscopio electrónico de barrido (HITACHI S-2500) operando a 12 kV con una magnificación de 500 veces.
Partiendo de las micrografías MEB obtenidas y utilizando el software TpsDig2 [31], se dividieron las micrografías en 4 cuadrantes y se pudieron realizar medidas de los diámetros internos de cada poro (4 medidas/poro) en distintas micrografías de la misma muestra. El tamaño de poro reportado es un promedio de las cuatro medidas.
Resultados y discusión
Hidrólisis del biopolimero
Antes del proceso de síntesis de los diferentes hidrogeles, el biopolímero fue sometido a una reacción de hidrólisis en medio ácido. Esto se llevó a cabo, dado que uno de los objetivos de esta investigación era estudiar el efecto de la masa molar del biopolímero en las propiedades de hinchamiento del hidrogel. La composición molar de las unidades comonoméricas en el P(HB-co-HV) (nativo e hidrolizado) se determinó mediante espectroscopia 1H-RMN, las composiciones molares que se obtuvieron se muestran en la Tabla 1.
Tabla 1 Proporciones de los comonómeros en el biopolímero nativo e hidrolizado.
P(HB-co-HV)=poli(hidroxibutirato-co-hidroxivalerato), nativo=muestra comercial (Copersucar)
Se puede notar que las composiciones molares de ambas unidades comonoméricas no tuvieron una variación significativa al hidrolizar el biopolímero nativo, es decir que su estructura cambia muy poco.
Por otra parte, tomando en cuenta que el proceso de hidrólisis debería provocar una disminución en la masa molar del biopolímero, se procedió a medir la masa molar mediante la técnica de viscosimetría del P(HB-co-HV) nativo y de aquel que fue sometido al proceso de hidrólisis [28-30]. Los valores de Mv obtenidos para el biopoliéster nativo y el hidrolizado fueron 66095 gmol-1 y 22135 gmol-1, respectivamente. Este resultado indica que el Mv del biopolímero hidrolizado disminuyó tres veces, aproximadamente, respecto al del biopolímero nativo y, por tanto, el proceso de hidrólisis fue efectivo.
Sintesis y caracterización de los hidrogeles semi-IPN
Los dos biopolímeros (nativo e hidrolizado) fueron usados para sintetizar los hidrogeles semi-IPN. En la Figura 1 se muestra, a manera de ejemplo, uno de los hidrogeles semi-IPN preparados, antes y después del proceso de purificación.

Figura 1 Hidrogeles semi-IPN (PAAm/ P(HB-co-HV): 80/20): (a) sin purificar; (b) purificado; (c) PAAm pura. Relación PAAm / P(HB-co-HV) de 100/0 con un 1% de MBBAm.
El color amarillo del material no purificado (Figura 1a) se debe a restos de los reactivos de partida que no reaccionaron, los cuales son extraídos de la matriz polimérica durante la purificación del hidrogel. Por otra parte, teniendo en cuenta que el hidrogel de PAAm pura en su estado de xerogel es transparente, el color blanco observado en el hidrogel semi-IPN podría deberse a la incorporación del biopolímero, el cual es un polvo de color blanco.
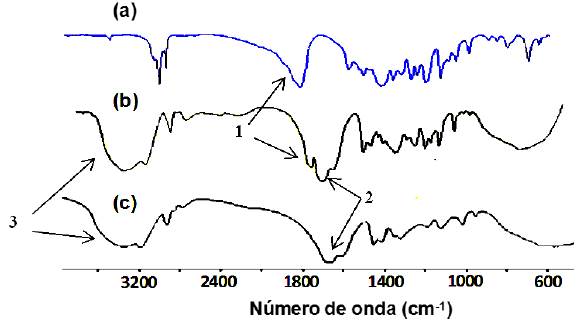
Los diferentes hidrogeles obtenidos en su estado seco (xerogel) fueron caracterizados mediante espectroscopia FT-IR. La Figura 2 muestra de forma comparativa los espectros FT-IR del biopolímero P(HB-co-HV) hidrolizado, de uno de los xerogeles semi-IPN sintetizado con el biopolímero hidrolizado y del xerogel de PAAm pura. Los espectros de los demás geles semi-IPN sintetizados fueron idénticos al mostrado en la Figura 2-(b).
Lo más importante a resaltar de la Figura 2 es que, en el espectro correspondiente a la red semi-IPN (b), es posible observar a 1726 cm-1 la señal correspondiente a la vibración de tensión del grupo carbonilo (C=O) del biopolímero (banda 1, en los espectros (a) y (b)). Esta señal no se observa en el espectro del xerogel de PAAm (c).
Este resultado indica la presencia del biopolímero en el interior del hidrogel. En el espectro del material semi-IPN (b) también se pueden notar las señales características del xerogel de PAAm: bandas de estiramiento de los grupos N-H entre 3200 y 3400 cm-1 (banda 3, en espectros (b) y (c)) e, igualmente, las vibraciones de estiramiento de grupo C=O en 1640-1650 cm-1 (banda 2, en espectros (b) y (c)).
Por otra parte, teniendo en cuenta que la PAAm es un material amorfo [32], sobre todo de manera entrecruzada, mientras que el biopolímero P(HB-co-HV) es un material semicristalino [33], los productos obtenidos fueron analizados mediante CDB. El comportamiento observado en los hidrogeles semi-IPN sintetizados fue similar al que se muestra en la Figura 3. Allí se presentan, de forma comparativa, los barridos del segundo calentamiento realizados al P(HB-co-HV) hidrolizado y al respectivo xerogel semi-IPN. Como se puede observar, tanto el biopolímero como el hidrogel semi-IPN muestran endotermas que aparecen en 162,5 °C, atribuidas a la fusión de los cristales de P(HB-co-HV). Este valor es similar al reportado previamente para este copolímero por Qiu et al. [33]. Además, en ambos barridos se observa un hombro adyacente al pico de fusión (a 146 °C aproximadamente), atribuido a la fusión de cristales de menor tamaño generados por la interrupción de las secuencias cristalizables de PHB por parte de las unidades de valerato en el copolímero P(HB-co-HV) [34]. Este resultado confirma la incorporación efectiva del biopolímero a la red tridimensional del hidrogel de PAAm.
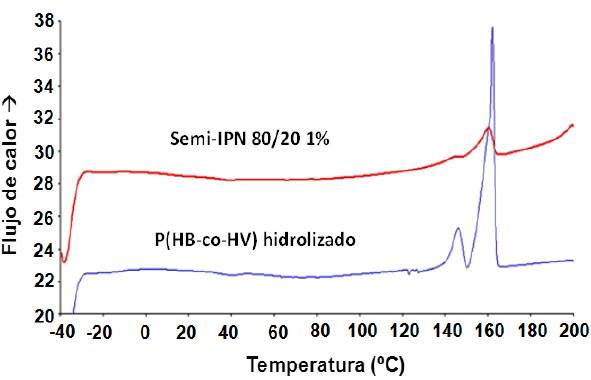
Figura 3 Barridos CDB del 2do calentamiento para el P(HB-co-HV) hidrolizado y el xerogel semi-IPN de PAAm con P(HB-co-HV) hidrolizado (% p/p (PAAm/biopolímero): 80/20, usando 1% de agente entrecruzante).
Como se puede notar, la absorción de agua aumenta con el tiempo hasta alcanzar los porcentajes de hidratación en el equilibrio (Hpmax). Estos valores son mostrados en la Tabla 2.
Tabla 2 Hpmax, coeficiente de difusión y constante de velocidad de hinchamiento de los hidrogeles semi-IPN con diferente composición (proporciones en peso) y agente entrecruzante.
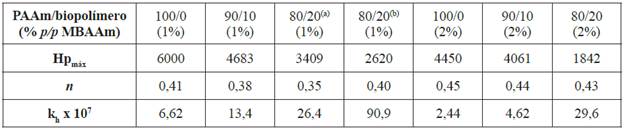
(a) Hidrogel sintetizado con el P(HB-co-HV) nativo; (b) hidrogel sintetizado con el P(HB-co-HV) hidrolizado; n: coeficiente de difusión; kh es la constante de velocidad de hinchamiento.
Con los datos obtenidos en la determinación del hinchamiento (Hp) de los hidrogeles, se desarrollaron las isotermas de hinchamiento para cada hidrogel sintetizado [26]. El comportamiento observado en todos los casos fue similar al que se muestra en la Figura 4.
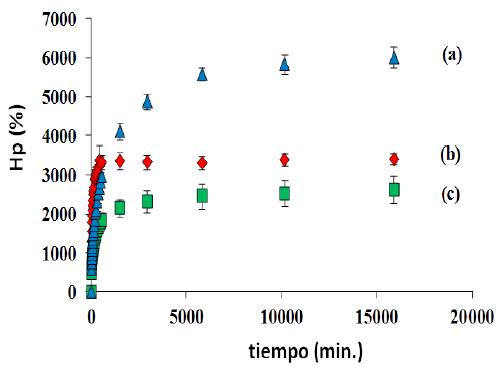
Figura 4 Isotermas de hinchamiento para los hidrogeles sintetizados: (a) PAAm pura, (b) semi-IPN con el P(HB-co-HV) hidrolizado y (c) semi-IPN con el P(HB-co-HV) nativo; ambos semi-IPN en proporciones en peso 80/20 de PAAm/ P(HB-co-HV) sintetizados usando 1% de agente entrecruzante. La barra fina corresponde a la desviación estándar de la muestra.
Es posible observar que, debido a que la hidrólisis del P(HB-co-HV) provoca una disminución en el tamaño de las cadenas macromoleculares del biopolímero, se originó un incremento de 40% del Hp del hidrogel semi-PN obtenido con el biopolímero hidrolizado, respecto al obtenido con el biopolímero nativo. Este aumento se debe a que las cadenas al ser más pequeñas originan una mayor cantidad de grupos finales hidrófilos en el biopoliéster.
Estudio cinético
El hinchamiento de los hidrogeles implica movimientos segmentales de gran escala, que generan una separación entre las cadenas de los hidrogeles que se va incrementando cada vez más con el hinchamiento. En estos sistemas, a medida que se difunde el solvente dentro del hidrogel, la respuesta del hidrogel no es inmediata [35-37], de manera que la penetración de las moléculas de agua dentro de las redes de un hidrogel es una función de la estructura de la red.
En una red semi-IPN, en la que uno de sus componentes es un material hidrófobo, los espacios entre las cadenas del hidrogel disminuyen y la red no puede ser expandida ni mantener una gran cantidad de agua.
La cinética de hinchamiento de los hidrogeles se estudió principalmente desde el punto de vista de difusión controlada (Fickiana), relajación controlada (no-Fickiana) y del modelo experimental de Schott. Se analizó el efecto de la composición porcentual y del porcentaje de reactivo entrecruzante (MBAAm) sobre los parámetros cinéticos del hinchamiento de los hidrogeles sintetizados.
La primera etapa del hinchamiento fue acelerada, tomó el 60% del tiempo antes de alcanzar Hpmax y estuvo gobernada por una cinética de orden cero [38]. Para esta etapa de hinchamiento se construyeron gráficos como los que se muestran en la Figura 5 a través de la ecuación (2).
Donde: M t y M 0 son las masas de la muestra de hidrogel hinchado en el tiempo t y de la misma muestra en estado seco (xerogel), respectivamente; t es el tiempo; k es una constante relacionada con el sistema de red y el medio de hinchamiento y n es el coeficiente de difusión que rige el modo de transporte del agua.
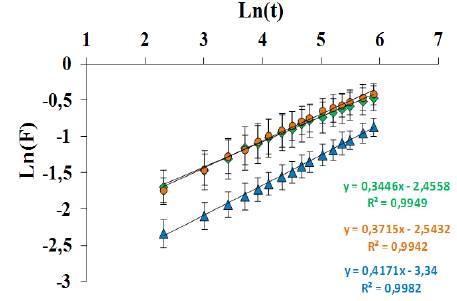
Figura 5 Difusión de Fick para los hidrogeles semi-IPN con distintas proporciones en peso PAAm/P(HB-co-HV): (▲)100/0, (●)90/10 y (♦)80/20, sintetizados usando 1% p/p de agente entrecruzante. La barra fina corresponde a la desviación estándar de la muestra.
La pendiente del gráfico corresponde al coeficiente de difusión (n) el cual proporciona el tipo de mecanismo de transporte del agua. Un valor de n = 0,50 indica un proceso de difusión Fickiana ideal. Esto quiere decir que la velocidad de difusión del solvente (Rdif ) es mucho más lenta que la relajación de los cadenas poliméricas (Rrelaj ) (por lo tanto Rdif << Rrelaj ).
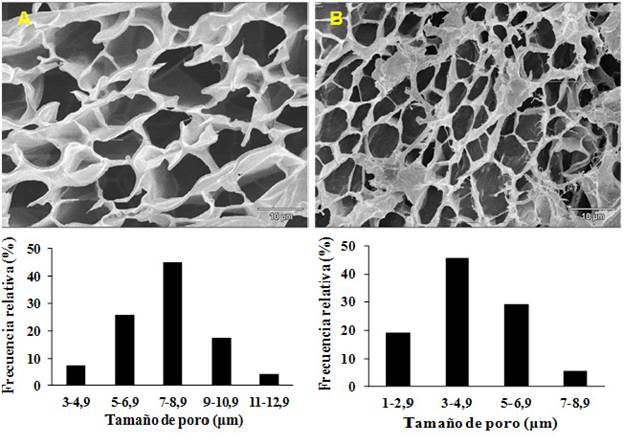
Figura 6 Micrografias MEB de hidrogeles de (A) poliacrilamida (PAAm) y (B) PAAm/P(HB-co-HV) 80/20 (proporción en peso), ambos con 1% p/p de agente entrecruzante.
Por el contrario, si se cumple que 1,00 > n > 0,50, el tipo de transporte es anómalo, es decir, la velocidad de difusión del solvente es proporcional a la relajación de las cadenas poliméricas (Rdif ~ Rrelaj). En la situación en que n = 1,00, el mecanismo de transporte es conocido como caso II, en el cual la velocidad de difusión del solvente es mayor que la relajación de las cadenas poliméricas (Rdif. >> Rrelaj.) [39].
Los valores del coeficiente de difusión (n), obtenidos a partir de las pendientes de las rectas, se presentan en la Tabla 2. En todos los casos se dio n < 0,50, lo cual indica que la velocidad de penetración del agua hacia la matriz polimérica del hidrogel es mucho menor que la relajación de las cadenas. En este caso, diversos autores consideran que la difusión sigue siendo fickiana o también se le denomina menos fickiana [40-42].
Es importante destacar que n, determinado para el hidrogel semi-IPN 80/20 y sintetizado con el P(HB-co-HV) hidrolizado, fue de 0,4. Por tanto, independientemente del tipo de biopolímero usado para realizar la síntesis del hidrogel semi-IPN, el valor fue de n < 0,5. Lo anterior indica que la disminución de la masa molecular del P(HB-co-HV) no influyó en el mecanismo de transporte del agua hacia la matriz polimérica del hidrogel. Por otro lado, el coeficiente de difusión tampoco cambió al variar el porcentaje de entrecruzante de 1 a 2%.
Ahora bien, para conocer la constante de velocidad de hinchamiento (kh) se empleó el modelo experimental de Schott, que es aplicable para la fase completa del hinchamiento y obedece a una cinética de segundo orden [43]. En este modelo se utilizó la ecuación de Robinson (3), la cual permitió la construcción de gráficos a partir de los que se pudo determinar k (ver Tabla 2).
Donde: Hp es hinchamiento del hidrogel en el tiempo t; B = 1/Hpmáx, es igual al inverso del hinchamiento máximo en el equilibrio; A = 1/khHp 2 es el igual al recíproco de la velocidad de hinchamiento y kh es la constante de velocidad de hinchamiento.
En los hidrogeles semi-IPN se halló que, al aumentar la composición del P(HB-co-HV), incrementó la constante de velocidad de hinchamiento, pero disminuyó el hinchamiento. Es de esperar este comportamiento en estos materiales ya que, en la caracterización de su morfología (Figura 6), se evidenció la formación de mayor número de poros por área en la estructura, facilitando la entrada del agua. No obstante, las interacciones repulsivas del P(HB-co-HV) con el agua (interacción hidrófoba) hacen que el hinchamiento disminuya.
Los histogramas de las micrografías reflejaron diferencias entre sí. Para los hidrogeles de PAAm el tamaño de poro está comprendido entre un intervalo de 3 y 13 μm, mientras que para los hidrogeles semi-IPN de PAAm/P(HB-co-HV), 80/20 el intervalo se encuentra entre 1 y 9 μm. Para este último se encontró un tamaño de mayor frecuencia alrededor de 4 μm.
Conclusiones
Se sintetizaron hidrogeles Semi-IPN formados a partir de la red de PAAm y del poliéster biodegradable P(HB-co-HV) de diferente masa molar, mediante polimerización en solución vía radicales libres. El contenido de agua en el equilibrio se vio influenciado por la masa molar: Hpmax aumenta con la disminución en la masa molar del biopolímero.
Por otra parte, de acuerdo con los valores del coeficiente de difusión (n), todos los hidrogeles mostraron un mecanismo de difusión de las moléculas de agua dentro del hidrogel del tipo menos Fickiano, lo cual indica que la velocidad de penetración del agua hacia la matriz polimérica del hidrogel es mucho menor que la relajación de las cadenas.
El parámetro cinético de absorción (kh) aumentó con la proporción de biopoliéster usado para realizar la síntesis y con la disminución de la masa molar del P(HB-co-HV). En relación con la morfología del hidrogel, esta se ve afectada por la incorporación del P(HB-co-HV), generando una mayor cantidad de poro por área en la matriz polimérica.