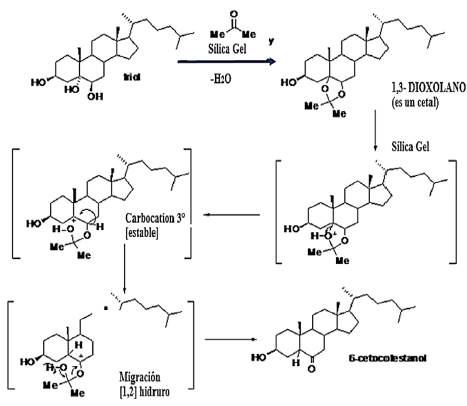
Introducción
La toxicidad de los productos de óxidos de colesterol (COP), compuestos que están presentes en los alimentos procesados, es bien conocida [1-4], tal como se ha observado con los 5a y 6α-epóxidos de colesterol relacionados con lesiones ateroscleróticas y carcinogénicas [5], así como con los compuestos 5-colesterol-3β -25-diol y colesterol-3β-5α-6β -triol que tienen actividad angiotóxica y citotóxica [6-10]. Estos compuestos afectan la fisiología celular al incrementar la permeabilidad en sus membranas [11-17]. Por ello, la presencia de COP en alimentos de origen animal, así como su actividad biológica nociva son objeto de muchas investigaciones que buscan comprender su mecanismo de formación y determinar sus efectos sobre la salud del ser humano [18-21].
Los COP son compuestos apolares y muy hidrosolubles que se fijan a los tejidos liposómicos y a las lipoproteínas sanguíneas. Se forman a partir del colesterol mediante tratamiento térmico, irradiación o cualquier manejo inadecuado en los procesos de fabricación de alimentos [22,23]. Su determinación se realiza por métodos analíticos cromatográficos que permiten conocer parcialmente su comportamiento [24]. Estas técnicas analíticas presentan muchas limitantes, sobre todo en las fases de preparación de las muestras y, especialmente, en alimentos con alto contenido de grasa, ya que los pretratamientos facilitan la transformación de estos compuestos. Lo anterior genera problemas analíticos relacionados con la complejidad de la matriz y sesga su cuantificación final [25,26].
Habitualmente, el proceso de extracción y limpieza de los COP se realiza mediante SPE (extracción en fase sólida, por sus siglas en inglés) y suele hacerse con cartuchos polares (sílica gel y amino propil). El criterio de esta elección ha sido la tradición desde 1957 [25].
Las comparaciones de los contenidos de COP a menudo son difíciles de interpretar, debido a las diferencias metodológicas usadas para su determinación, así como por la formación de artefactos creados durante su procesamiento, principalmente durante los procesos de limpieza [24].
Algunas reacciones de transformación de los COP han sido detectadas en diferentes estudios [26,27], sin dar importancia a los procesos de preparación de las muestras en las fases preanalíticas. Es de resaltar que, durante los procesos de análisis en las metodologías convencionales, los disolventes se evaporan al limpiar las muestras, aunque tengan trazas de agua. En estos procesos el pH no se afecta en las fases iniciales, pero sí en las etapas finales (debido a la evaporación de las trazas de agua), de modo que se ha obviado el efecto del pH en las transformaciones de los COP. Esto cobra importancia en el pretratamiento de muestras de alimentos grasos, ya que, por su complejidad, presentan diversos compuestos con carácter ácido o básico. Razones por las que antes de la determinación de los COP por cromatografía de gases (GC), se debe realizar una reacción de derivatización con Tri-Sil. Esta reacción requiere extractos libres de agua para evitar la producción de ácido en el medio, lo que implica disminución del pH y reacciones de transformación de los COP y del colesterol [27].
La fase preanalítica en la preparación de muestras de alimentos para analizar los COP implica extracción, limpieza y derivatización. Estos pasos son importantes en la transformación de los COP, por lo cual se deben aplicar bajo condiciones suaves, generalmente por procesos de lixiviación [25,28,29,31,35-37]. En la Tabla 1 se resumen algunas condiciones de extracción de COP, así como sus ventajas y limitaciones. La fase preanalítica en la preparación de muestras de alimentos para analizar los COP implica extracción, limpieza y derivatización. Estos pasos son importantes en la transformación de los COP, por lo cual se deben aplicar bajo condiciones suaves, generalmente por procesos de lixiviación [25,28,29,31,35-37]. En la Tabla 1 se resumen algunas condiciones de extracción de COP, así como sus ventajas y limitaciones.
Tabla 1 Compendio de métodos analíticos para determinar COP en alimentos, de acuerdo a las fuentes citadas para este estudio.
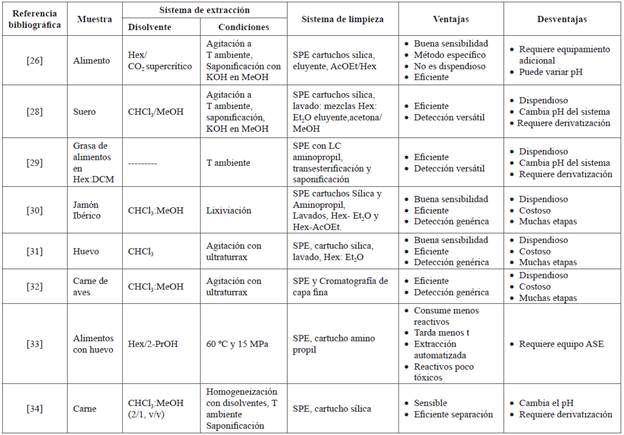
ACN: acetonitrilo; Metanol: MeOH; Hex: hexano; Pr-OH: propanol;
SPE: extracción fase solida; Et2O: éter etílico; AcOEt: acetato de etilo; T: temperatura; ASE: sistema de extracción acelerada de solventes.
Sin embargo, no se encontraron datos sobre las condiciones críticas de la limpieza de la muestra en el proceso de análisis de los COP [23-38]. Por lo anterior, el propósito de este estudio fue comparar los COP obtenidos por dos métodos de extracción: SPE polar y apolar, así como el perfil de elución de los analitos extraídos. Además de optimizar los procesos de limpieza de muestras de alimentos grasos para reducir las transformaciones de COP y evitar artefactos en la cuantificación de este tipo de compuestos.
Materiales y métodos
En este trabajo se determinaron las transformaciones de los COP durante los procesos de limpieza de muestras aplicando SPE-GC. Para ello, se utilizaron estándares y muestras de alimentos de origen animal con alto contenido lipídico y ricos en agua (37% p/p).
Los cartuchos para SPE se utilizaron en dos modos: elución total y colección de fracciones (cromatografía líquida-LC). Se construyeron patrones de elución para comparar y detectar las diferencias entre ambos métodos, además se probaron empaques polares y no polares de los cartuchos y distintos disolventes de elución de acuerdo al sistema de limpieza probado.
También se estudió el comportamiento de siete COP y del colesterol, utilizando como técnica la separación GC-FID. Como resultado, en este estudio se propuso una metodología de preparación de muestras más confiable y menos dispendiosa para la determinación de COP en alimentos.
Reactivos
Los solventes y reactivos fueron: metanol (MeOH), n-hexano y acetona (Romil, Teknokroma. Barcelona, España); 2-propanol (2-PrOH) cloroformo, acetonitrilo (ACN), grado HPLC (Scharlau, Barcelona, España); éter de petróleo grado HPLC (Scharlau. Barcelona, España); dietil éter y acetato de etilo (Carlo Erba. Milán, Italia) grado para pesticidas; Tri-Sil (Thermo Fisher Scientific. Sunnyvale, CA, USA); tierras de diatomeas (Cultek S.L.U. Barcelona, España), monofosfato y difosfofato de sodio (Merck. Darmstadt, Alemania). El agua fue purificada por medio de un sistema Milli-Q de Millipore (Bedford, MA, USA).
Los estándares COP fueron: 7P-hidroxicolesterol (7β-OH, 98%); colesterol 5 β,6β -epóxido (β-epóxido, 98%); colesterol 5α,6α-epóxido (α-epóxido, 9%), colestan-3β,α6β-triol (triol, 9%); 6-cetocolestanol (6-ceto, 9%); 7-cetocolesterol (7-ceto, 9%), (Sigma-Aldrich. Steinheim, Alemania); 25-hidroxicolesterol (25-OH, 98%. Fluka, St. Louis, MO, USA) y colesterol (99% Sigma-Aldrich. Steinheim, Alemania). Se prepararon soluciones patrón de COP de 1000 mg/L, pesando las cantidades adecuadas de cada estándar sólido y disolviendo con 2-PrOH.
Muestras
Se usaron muestras de salmón ahumado, jamón serrano y lomo de cerdo procedentes de un supermercado de Madrid (España). Estas carnes fueron cortadas en trozos menores a 1,0 cm x 1,0 cm; se obtuvieron rebanadas de 50,0 g. Luego, fueron trituradas en un mortero y mezcladas hasta homogenización con 6,0 g de tierra de diatomeas. Seguidamente, fueron envasadas al vacío en bolsas de poliestireno. Se almacenaron y protegieron de la luz a -18 °C hasta su procesamiento. Los análisis químicos fueron realizados por triplicado para cada muestra.
Confirmación de la identificación de los COP
La identificación de los COP se realizó por comparación de los tiempos de retención (tR) de los cromatogramas de las muestras con los obtenidos de los patrones.
Adicionalmente, cada COP se confirmó comparando los espectros de masas obtenidos en las muestras y los espectros disponibles en la librería del NIST [39]. Cuando el espectro no estuvo disponible en esta librería, la identificación se confirmó por medio de los espectros obtenidos a partir de los derivados de los patrones individuales.
Condiciones cromatográficas para GC
La temperatura del inyector y del detector fue de 300 °C. El gas transportador fue He a un flujo de 1,2 mL/min; la temperatura de la columna se mantuvo constante a 270 °C. Se usaron 2,0 μL de soluciones de 5,0 mg/L de los derivados de los COP que fueron inyectados al cromatógrafo de gases usando una relación de 3:1; el tiempo de análisis fue menor a 30 min.
Obtención del extracto lipídico
Se usó un equipo para la extracción acelerada de solventes (ASE, por sus siglas en inglés) ASE™ 200 de Dionex™ (Sunnyvale, CA, USA). Para eliminar el disolvente del extracto lipídico se usó un evaporador casero con capacidad para seis muestras y un agitador vórtex.
Para la limpieza de las muestras se usó un sistema al vacío para SPE (visiprep) de Supelco (St. Louis, MO, USA). Se usaron también cartuchos de sílica gel y de amino propil SPE de 500 mg de separación aplicada (Allentown, PA, USA); cartuchos de C18 y C8 para SPE (500 mg de Discovery Supelco, USA); filtros de nylon para jeringas de 4,0 mm y 0,45 μm (National Scientific. Rockwood, TN, USA). Adicionalmente, se usó un mortero de porcelana (Staatlich. Berlin, Alemania) y viales de color ámbar de 1,4 y 12,0 mL para la separación.
Evaluación de la limpieza de la muestra aplicando el modo LC
Aplicando las ventajas de la cromatografía (fase normal e inversa), las soluciones de mezclas de COP (5,0 mg/L) se pasaron por los cartuchos acondicionados sin dejar perder el equilibrio de fases y se eluyeron de acuerdo a los experimentos de la Tabla 2.
Tabla 2 Condiciones para los experimentos de limpieza de las muestras de alimentos grasos ricos en agua (salmón ahumado, jamón serrano y lomo de cerdo) analizados mediante cromatografía líquida de columna (LC) para detección de óxidos de colesterol (COP).
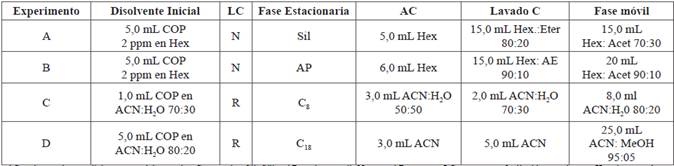
AC: solvente de acondicionamento del cartucho; C: cartucho; Sil: Sílica AP: amino propil; N: normal;R: reversa; LC: cromatografia líquida en columna; Hex: hexano; Acet: acetona; AE: acetato de etilo; ACN: acetonitrilo; mL: mililitro; ppm partes por millón; C8 y C18: cartuchos para SPE (500 mg de Discovery Supelco,E.U).
Luego, se adicionaron alícuotas de 10 μL de solución estándar de 1000 mg/L de COP a un vial de 5,0 mL. Posteriormente se agitaron en vórtex durante 30 s y se evaporó el solvente con flujo de Ar. El residuo de COP fue disuelto con los disolventes iniciales indicados en la Tabla 2. Estas soluciones se pasaron por los cartuchos, en viales de 1,0 mL; se tomaron fracciones de los eluidos de 0,5 y 1,0 mL. Las fracciones de los COP se obtuvieron separadamente del colesterol de acuerdo a la estrategia experimental, debido a la interferencia en la evaluación de los sistemas de limpieza y a las transformaciones en COP. Se evaporó el solvente a cada fracción mediante flujo de Ar a temperatura ambiente. Se adicionaron 200 mL del agente derivatizante Tri-Sil, se agitó en vórtex por 2 min y se calentó a 65 °C durante 40 min. Luego se dejó reposar durante 5 min a temperatura ambiente. Posteriormente se eliminó el exceso de Tri-Sil mediante flujo de Ar a temperatura ambiente. El residuo fue disuelto con 400 mL de hexano y agitado en vórtex durante 2 min. Finalmente se usó un filtro de teflón de 0,45 ¡m y se inyectaron 4,0 μl de cada fracción al cromatógrafo.
Evaluación de la limpieza de las muestras
Este procedimiento se realizó mediante dos modos de cromatografía, una en fase liquida y otra en sólida (modo LC y SPE, respectivamente). Para determinar las diferencias entre LC y SPE (fase normal e inversa), se diseñaron los experimentos detallados en la Tabla 3, aplicando los resultados de los experimentos de la Tabla 2, los cuales permitieron conocer las cantidades adecuadas de los solventes de elución para los COP libres de colesterol.
Tabla 3 Experimentos para el modo de limpieza SPE para analizar COP en muestras previamente tratadas de alimentos grasos ricos en agua (salmón ahumado, jamón serra lomo de cerdo).
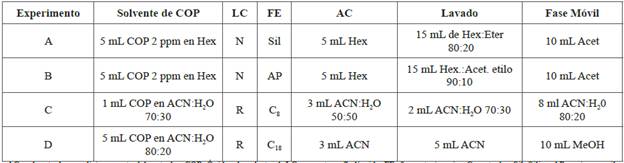
AC: solvente de acondicionamento del cartucho; COP: Oxidos de colesterol; LC: cromatografía líquida; FE: fase estacionaria; C: cartucho; Sil: Silica; AP: amino propil; Hex: hexano; Acet: acetona; ACN: acetonitrilo N: normal R: reversa; mL: mililitro; ppm partes por millón; C8 y C18: cartuchos para SPE (500 mg de Discovery Supelco,E.U).
Los COP fueron eluidos en un solo paso, eliminando el solvente inicial usado en el cartucho con flujo de Ar a 40 °C. Los eluidos se colectaron en viales de 10 mL (Tabla 3). Luego se agregaron 200 μL de Tri-Sil, se agitó en vórtex durante 2 min y se calentó a 65 °C durante 40 min. Se dejó reposar durante 5 min a temperatura ambiente y, después, el Tri-Sil se evaporó con flujo de Ar. Luego se añadieron 500 μL de hexano, se agitó en vórtex durante 2 min, se filtró a través de membranas de teflón de 0,45 μm y al final se inyectaron 4 μL en el cromatógrafo.
Reacción de derivatización
Al residuo lipídico se le agregaron 200 μL de Tri-Sil siguiendo el procedimiento previamente descrito.
Extracción de los COP por extracción acelerada de solventes
La muestra homogenizada fue empaquetada en la celda del equipo de extracción acelerada de solventes (22 mL). El extracto lipídico se obtuvo con éter de petróleo: cloroformo (85:15, v/v), a 40 °C y 1500 psi. El extracto se colectó en viales de vidrio de 60 mL. Estos se calentaron en un termostato Tembloc a 40 °C con flujo de Ar y se evaporó el solvente hasta sequedad [38].
Determinación de los COP
El extracto obtenido en la sección anterior se filtró con membrana de nylon de 45 μm. Se tomaron 2 μL y se inyectaron al cromatógrafo usando las condiciones indicadas anteriormente.
Para identificar los derivados Tri-Sil se utilizó un cromatógrafo de gases acoplado a un detector de masas con analizador de tiempo de vuelo (Waters® Q-Tof Premier™, Milford, MA, USA). Además se usó la librería de espectros de masas NIST 2.0 [39]. Los espectros se obtuvieron en el rango 50-800 unidades de masa aplicando el modo escaneo a 70 eV. Se inyectó 1 μL de esta mezcla al equipo GC-Q-TOF.
Identificación de los derivados de COP mediante GC-Q-TOF
Patrones
Se identificaron los Tri-Sil derivados de los COP por GC-Q-TOF a partir de una mezcla de estándar de COP de 5 mgL-1. Estos se obtuvieron aplicando el procedimiento descrito previamente. La separación cromatográfica se realizó utilizando la columna DB-5 con el siguiente programa de temperatura: T inicial 220 °C (1 min.), seguido de una rampa de 5 °C/min hasta 290 °C (11 min.), seguido de una rampa de 3 °C/min, hasta 310 °C (28 min.). Se utilizó un inyector split-splitless a 310 °C a una relación de 10:1 y He como gas portador a un flujo de 1 mL/min. La fragmentación se realizó a 70 eV, se obtuvieron los espectros en forma scan y se llevaron a cabo las respectivas identificaciones de las estructuras moleculares mediante la librería de espectros de masas del NIST [39].
Resultados y discusión
Cromatografía líquida de columna (LC)
En el experimento A de la Tabla 2, la Tabla 4 y la Figura 1, se muestra que los compuestos 7 β-OH, β-epóxido y α-epóxido eluyen después de agregar entre 2,0 y 5,0 mL de eluyente, respectivamente.
Tabla 4 Recuperación de COP en cromatografía líquida en columna en fase normal. Disolvente inicial: 5,0 mL COP (2 ppm) en hexano. Fase estacionaria: sílica. Acondicionamiento del cartucho: hexano (5 mL). Lavado del cartucho: 15,0 mL Hexano:Eter (80:20). Fase móvil: 15,0 mL, hexano: acetona 70:30.
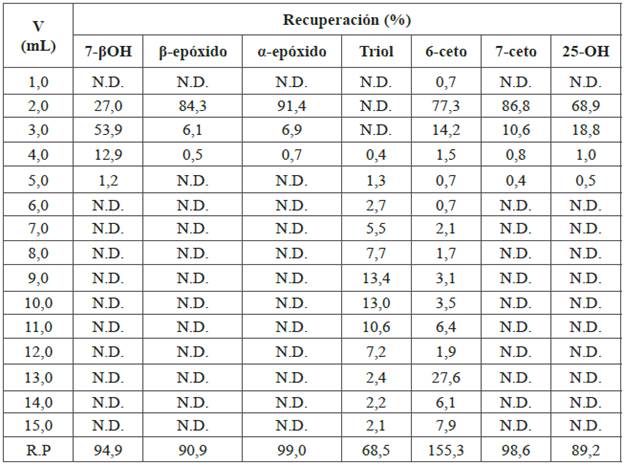
N.D. no detectado; R.P: sumatoria de las recuperaciones parciales de COP.
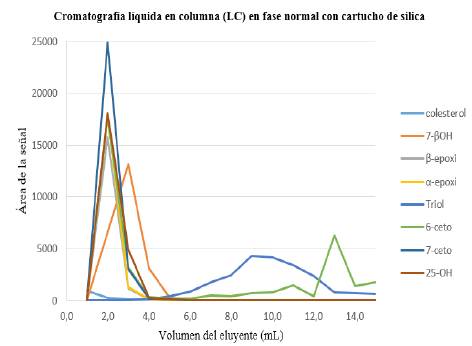
Figura 1 Perfil de elusión de los COP en cromatografía líquida en columna en fase normal. Disolvente inicial: 5,0 mL COP (2 ppm) en hexano. Fase estacionaria: sílica. Acondicionamiento del cartucho: hexano (5 mL). Lavado del cartucho: 15,0 mL hexano:éter (80:20). Fase móvil: 15,0 mL, hexano:acetona 70:30.
Los perfiles de elución tienen forma gaussiana; las recuperaciones son de 94,9%, 90,9 y 99,0% respectivamente (Tabla 4), indicando que la extracción y la limpieza son adecuadas para estos compuestos (Figura 1).
El proceso de elución del triol no es gaussiano, pues la recuperación fue muy baja (68,5%). En la Figura 1 también se observa que el 6-ceto eluye completamente entre 1,0 y 5,0 mL y vuelve a aparecer en fracciones posteriores, indicando posibles transformaciones de triol a 6-ceto, ya que este tiene porcentajes de recuperación mayores al 100% (Figura 1). El colesterol eluye, junto con el solvente inicial y los lavados del cartucho, en las primeras fracciones por ser el compuesto menos polar de la mezcla.
La Figura 2 explica las siguientes transformaciones: los compuestos 7-ceto y 25-OH muestran una forma gaussiana clara debido a que eluyen entre 2,0 y 5,0 mL de la fase móvil y sus recuperaciones son altas (89,18% y 98,58% respectivamente). Es importante resaltar que los errores en estos experimentos son aditivos entre fracción y fracción. Sin embargo, fue necesario hacer la suma de las áreas para cada compuesto presente en las diferentes fracciones, para compararlas con las áreas generadas por la cantidad de patrones adicionados inicialmente. Este fenómeno confirma que el colesterol no es oxidado en el proceso analítico, siendo el único precursor de los COP.
Al revisar los resultados del experimento B (Tabla 2) en la Tabla 5 y Figura 3, con el cartucho de amino propil, se observó que los COP 7β-OH, β-epóxido, α-epóxido 7-ceto y 25-OH eluyeron entre 0,0 and 5,0 mL de fase móvil. Estos compuestos presentan forma gaussiana y bajas recuperaciones: entre 73,3 % y 85,0 %. El comportamiento del triol y el 6-ceto se observa de forma similar al comportamiento observado con cartuchos de sílica (Tabla 4 y Figura 1).
Tabla 5 Recuperación de COP en cromatografía líquida en columna en fase normal. Disolvente inicial: 5,0 mL COP (2 ppm) en hexano. Fase estacionaria: amino propil. Acondicionamiento del cartucho: hexano (5 mL). Lavado del cartucho: 15,0 mL hexano:acetato de etilo (90:10). Fase móvil: 10,0 mL, acetona.
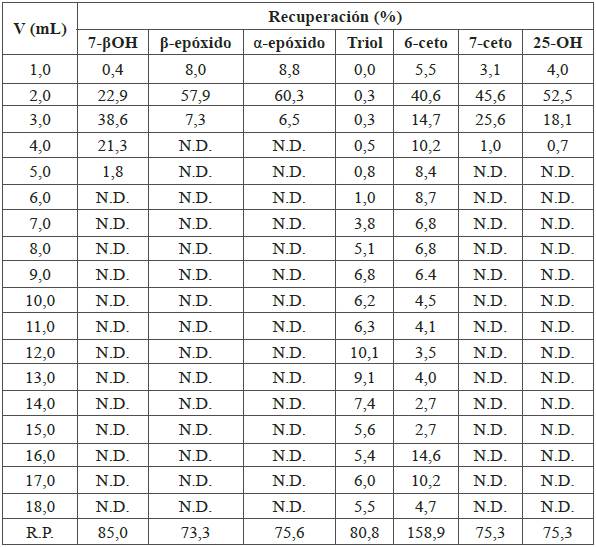
N.D.: No detectable; R.P.: Sumatoria de las recuperaciones parciales
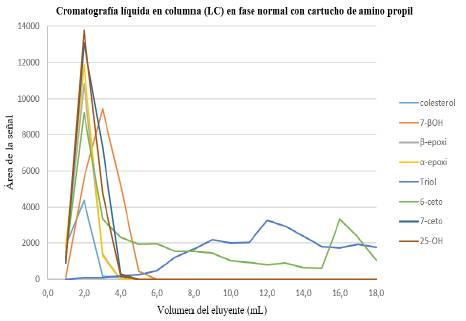
Figura 3 Perfil de elusión de los COP en cromatografía líquida en columna en fase normal. Disolvente inicial: 5,0 mL COP (2 ppm) en hexano. Fase estacionaria: amino propil. Acondicionamiento del cartucho: hexano (5 mL). Lavado del cartucho: 15,0 mL hexano:acetato de etilo (90:10). Fase móvil: 10,0 mL, acetona.
De acuerdo con el experimento C de la Tabla 2, cuyos resultados se presentan en la Tabla 6 y la Figura 4, al usar cartuchos C8, los COP presentan un comportamiento gaussiano. Bajo esas condiciones, los compuestos eluyen de manera regular de acuerdo con las polaridades de cada uno. No se observó colesterol en ninguna fracción y las recuperaciones tuvieron un rango óptimo (81,8% a 94,9%). Además, no se observaron reacciones de transformación. Este sistema presenta la desventaja de tener una alta capacidad de retención, por tanto, se requiere aplicar cantidades elevadas de solvente de lavado para eliminar compuestos polares de muestras complejas (como los alimentos).
Tabla 6 Recuperación de COP en cromatografía líquida en columna en fase reversa. Disolvente inicial: 1,0 mL de COP en acetonitrilo:agua (70:30). Fase estacionaria: cartuchos de C8. Acondicionamiento del cartucho: 3,0 mL acetonitrilo:agua (50:50). Lavado del cartucho: 2,0 mL acetonitrilo:agua (70:30). Fase móvil: 8,0 mL, acetonitrilo:agua (80:20).
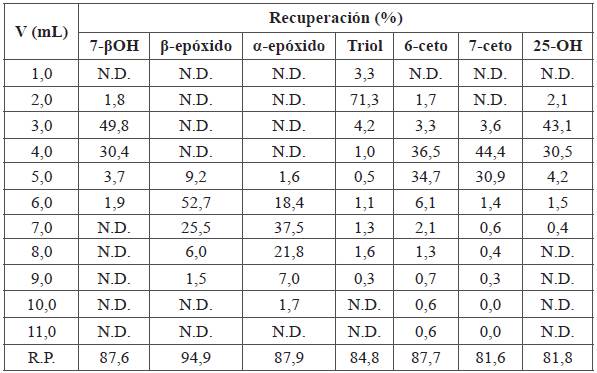
N.D.: no detectable; R.P. : Sumatoria de las recuperaciones parciales
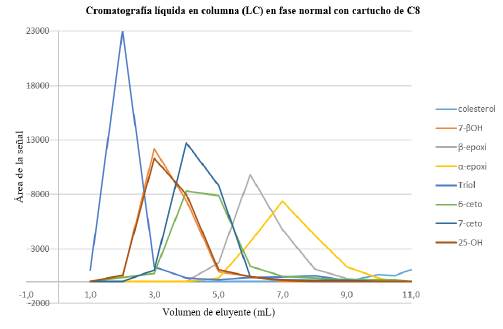
Figura 4 Perfil de elusión de los COP en cromatografía líquida en columna en fase reversa. Disolvente inicial: 1,0 mL de COP en acetonitrilo:agua (70:30). Fase estacionaria: cartuchos de C8. Acondicionamiento del cartucho: 3,0 mL acetonitrilo:agua (50:50). Lavado del cartucho: 2,0 mL acetonitrilo:agua (70:30). Fase móvil: 8,0 mL, acetonitrilo:agua (80:20).
En el experimento D de la Tabla 2 con cartuchos C18 (Figura 5 y Tabla 7) se muestra que el comportamiento de elución de los COP, bajo estas condiciones, es muy irregular (no-gaussiano), debido a que estos compuestos son fuertemente retenidos por esta fase. En este sistema la separación de los COP involucra una nueva variable: el peso molecular. Sin embargo, esta variable no se estudió porque la prioridad fue revisar la polaridad de los compuestos.
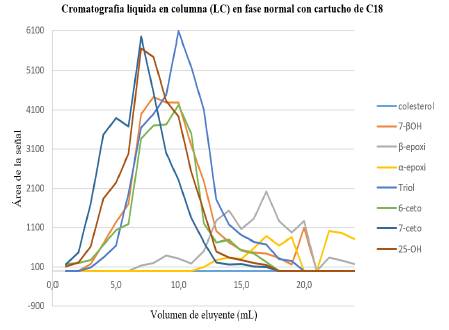
Figura 5 Perfil de elusión de los COP en cromatografía líquida en columna en fase reversa. Disolvente inicial: 5,0 mL de COP en acetonitrilo:agua (80:20). Fase estacionaria: cartuchos de C. Acondicionamiento del cartucho: 3,0 mL acetonitrilo. Lavado del cartucho: 5,0 mL acetonitrilo. Fase móvil: 25,0 mL, acetonitrilo:metanol (95:05).
Tabla 7 Recuperación de COP en cromatografía líquida en columna en fase reversa. Disolvente inicial: 5,0 mL de COP en acetonitrilo:agua (80:20). Fase estacionaria: cartuchos de C18. Acondicionamiento del cartucho: 3,0 mL acetonitrilo. Lavado del cartucho: 5,0 mL acetonitrilo. Fase móvil: 25,0 mL, acetonitrilo:metanol (95:05).
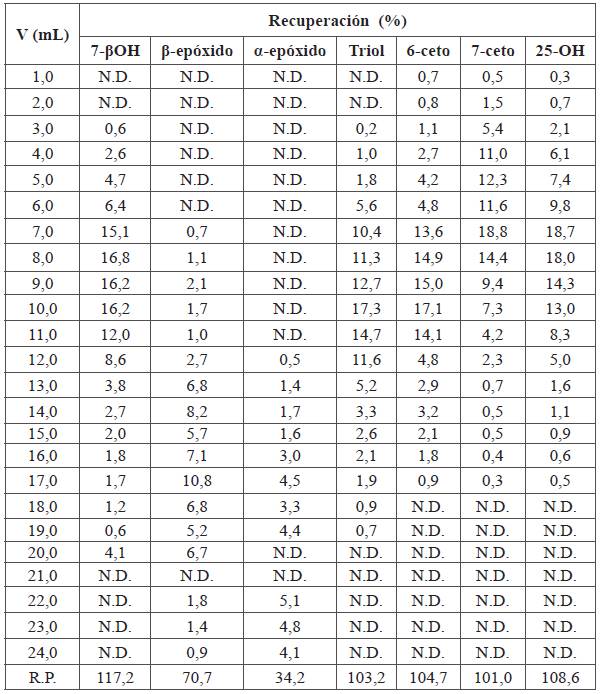
N.D: No detectable; R.P.: Sumatoria de las recuperaciones parciales
A pesar de que el triol es el compuesto más polar, no eluyó en las primeras fracciones. Este compuesto apareció después de agregar 3,0 mL de la fase móvil, probablemente por su alto peso molecular. Por el contrario, el 6-ceto eluyó en las primeras fracciones por su menor peso molecular, a pesar de ser uno de los compuestos menos polares.
Se observó que los compuestos β-epóxidos y α-epóxidos requieren mayores cantidades de eluyente que el 6-ceto, aunque tengan un peso molecular bajo. Esto indica que la elución depende no solo de la polaridad, sino del peso molecular del compuesto al usar los cartuchos de C18.
Modo Extracción fase sólida (SPE)
Después de aplicar los métodos de la Tabla 3, se obtuvieron las recuperaciones de la Tabla 8.
Tabla 8 Porcentajes de recuperación de COP usando SPE con mezcla estándar (25 mg).
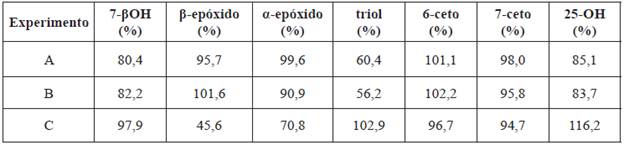
Ver Tabla 3 para más información sobre las condiciones de cada experimento.
Se observa en los experimentos A y B que las recuperaciones de compuestos polares son relativamente pequeñas, por ejemplo, las recuperaciones de triol en los experimentos A y B son muy bajas (60 y 56%).
Teniendo en cuenta que solo se evalúan las pérdidas que ocurren en la limpieza de muestras mediante SPE, en el experimento C hay valores de recuperación relativamente pequeños para los compuestos β y α-epóxido. Estas pérdidas por reacciones de hidrólisis ocurren en el momento de eliminar el solvente. El experimento D muestra los mejores resultados de recuperación. Por lo anterior, se seleccionaron los métodos C y D de la Tabla 3 y se aplicaron a muestras reales.
Después de revisar los resultados obtenidos en los experimentos de la Tabla 2, se descartaron los sistemas de limpieza de los experimentos A y B, ya que se evidencian las transformaciones de triol a 6-ceto. Con base en la Tabla 2, se resalta que el mejor comportamiento lo presentó el sistema del cartucho C8 (experimento C), probado para muestras de alimentos, aunque presentó la desventaja de tener muy baja retención. Adicionalmente, el cartucho C8 con muestras enriquecidas proporcionó valores de recuperación muy bajos con los dos eluyentes mencionados. Tampoco permitió la limpieza adecuada de las muestras y presentó mucha suciedad en los cromatogramas.
Es importante resaltar que los valores de recuperación fueron muy dispersos y que estos resultados se deben a la poca retención observada en el cartucho C8. Usando el cartucho C18 y MeOH como eluyente, se aplicó la metodología D (Tabla 3) con muestras enriquecidas. Se observaron recuperaciones cercanas al 100% para la mayoría de los COP, excepto para los epóxidos α y β cuyas recuperaciones fueron inferiores al 50%. La recuperación del triol fue mayor al 100%, probablemente porque la transformación de los COP en triol en las muestras de alimentos se presentó durante la evaporación del eluyente por cambios del pH y debido a la aparición de reacciones de hidrólisis ácida según soportan estudios previos [27].
Ulberth y Rössler [35] compararon diferentes sistemas SPE, combinando fases estacionarias (NH2, Silica y C18), disolventes de lavado (Acetato de etilo, hexano, dietil éter, diclorometano, 2-propanol, metilterbutil éter, acetonitrilo, metil tert-butil éter y agua) y disolventes de elución (acetona y metanol) para limpiar las muestras después de realizar la extracción lipídica. Estos autores encontraron que la mejor combinación consistía en hacer dos limpiezas mediante SPE en serie, con cartuchos de sílica y NH2, usando como disolvente de lavado mezclas de hexano-dietil éter y hexano-acetato de etilo y, como disolvente de elución, acetona en ambos casos, descartando los cartuchos apolares C18.
Es importante resaltar que en este trabajo, contrario a Ulberth y Rössler [35], se realizó el estudio aplicando el modo LC, sin identificar las transformaciones que se presentaron en los COP por cambios en el pH.
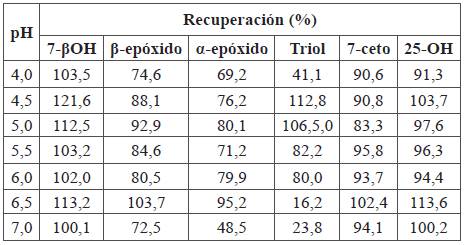
Para verificar si el pH era el factor responsable de las transformaciones al usar el cartucho C18, se aplicó una mezcla de COP y estándares de colesterol con el método SPE (Tabla 9). La elución de COP se llevó a cabo usando un volumen equivalente al volumen de elución empleado en el experimento D de LC (Tabla 3). Los COP eluidos se recogieron en viales que contenían 100 μL de tampón a pH en el rango 4,0 a 7,0 antes de evaporar el disolvente de elución; las recuperaciones obtenidas se presentan en la Tabla 9. Se observa que los amortiguadores con valores de pH entre 4,5 y 6,0 permiten obtener mejores recuperaciones. Las observaciones encontradas en este estudio permitieron diseñar una nueva metodología que disminuye las transformaciones de los COP, detallada a continuación.
Tabla 9 Influencia del pH de la solución tampón de fosfato usada en el proceso de evaporación del solvente de los COP en muestras enriquecidas con 25 ppm de salmón ahumado. Extracción: SPE. Solvente: 5 mL de COP en acetonitrilo:agua (80:20) Fase estacionaria: cartuchos de C (fase reversa). Acondicionamiento del cartucho: 3,0 mL acetonitrilo. Lavado del cartucho: 5,0 mL acetonitrilo. Fase móvil: 10,0 mL, metanol.
Metodología propuesta para la determinación de COP en muestras de alimentos por cromatografía con minimización de transformaciones
Se propone la siguiente metodología: obtener el extracto lipídico aplicando la extracción acelerada de solventes (ASE); eliminar el solvente con flujo de argón a 40 °C; disolver el residuo con 5 mL de una mezcla 80:20 de acetonitrilo:agua (v/v).
Así mismo, pasar la muestra a través de un cartucho C18 previamente acondicionado con acetonitrilo; limpiar el cartucho con 5 mL de acetonitrilo; eliminar el acetonitrilo con flujo de argón; eluir los COP con 10 mL de MeOH; recoger el eluato en un vial que contenga 100 μL de un tampón fosfato a pH 6,00; eliminar el disolvente a sequedad con flujo de argón a 40 °C; realizar el proceso de derivatización con Tri-Sil; disolver el residuo con 500 μL de hexano; filtrar con membrana de teflón e inyectar en el cromatógrafo de gases.
Conclusiones
Los COP triol, α-epóxido y β-epóxido son inestables en condiciones normales de limpieza de la SPE usando cartuchos de sílice y aminopropilo. Se verificaron las transformaciones de COP mediante perfiles de elución usando el modo de colección de fracción. El triol se transformó en 6-ceto y α-epóxido y β-epóxido debido a los cambios de pH. Los cartuchos apolares no mostraron transformación de COP durante el tratamiento de muestra de alimentos. Aunque el modo de recolección de fracciones usando cartuchos C8 es adecuado para separar el colesterol de los estándares de los COP, su capacidad limitada para retener COP presentó dificultades para su determinación en muestras de alimentos. Debido a que la limpieza del cartucho es deficiente, se genera coelución de compuestos.
Se obtuvieron resultados más adecuados aplicando la metodología propuesta para la determinación de los COP en muestras de alimentos en las condiciones óptimas: limpieza SPE usando cartuchos C18, ajustando cuidadosamente el pH (rango entre 4 y 6) y optimizando el volumen de elución de MeOH (10 mL). Bajo estas condiciones, se evitaron las transformaciones. En consecuencia, no se detectó 6-ceto en muestras de alimentos y pudo usarse como estándar interno para la determinación de COP. El volumen total de solvente usado fue de aproximadamente 20% del volumen utilizado por métodos convencionales. Adicionalmente, el método propuesto necesita menos pasos en la limpieza de las muestras. Aplicando este método se obtuvieron recuperaciones superiores al 73% en las muestras de alimentos estudiadas.