Introducción
Perú cuenta con 18 regiones que cultivan chirimoya: en el 2016, las principales regiones productoras fueron Lima (58,81%), Cajamarca (16,74%) y Piura (6,75%) [1]. En el 2015, 2016 y 2017 la producción de chirimoya fue de 18,9; 24,77 y 25,57 miles de toneladas respectivamente [1,2].
El árbol de chirimoya es una planta semicaducifolia, puesto que, luego de la cosecha, libera sus hojas e inicia una nueva brotación para el crecimiento de las flores y, posteriormente, frutos [3], esto ocasiona que en las zonas donde existe producción de chirimoya se acumule un gran volumen de hojas. Actualmente, las hojas de chirimoya en el Perú no tienen aplicación alguna, siendo la quema la manera más fácil y económica de eliminarlas, lo cual causa contaminación ambiental en las zonas de cultivo.
Se estima que la quema de biomasa de los residuos agrícolas produce 40% del dióxido de carbono (CO2), 32% del monóxido de carbono (CO), 20% de material particulado y 50% de los hidrocarburos aromáticos policíclicos emitidos al ambiente a escala mundial [4].
Existen estudios de la familia Annonaceae que han demostrado la presencia de compuestos fenólicos y de otros compuestos bioactivos con características antioxidantes [5]. Las hojas de la especie Annona muricata, conocida como guanábana o graviola, contienen compuestos fenólicos con capacidad antioxidante [6]. La chirimoya es una importante fuente de compuestos bioactivos, las procianidinas fueron la principal familia de compuestos fenólicos identificadas en la pulpa y la cáscara de los dos cultivares de Annona cherimola [ 7]. En un estudio en hojas de Annona cherimola, realizado en España, se logró extraer la mayor cantidad de compuestos fenólicos totales con el solvente etanol/agua a una relación de 80/20 (v/v), el contenido de flavonoides en estos extractos estuvo entre el 63 y el 76% de los fenólicos totales [8].
Por otro lado, un solvente amigable con el medio ambiente es el agua subcrítica, la cual tiene una presión entre 1 y 221 bar y una temperatura entre 100 y 374 °C [9]; a medida que aumenta la temperatura, las propiedades fisicoquímicas del agua se asemejan a las propiedades de disolventes orgánicos, lo cual aumenta la solubilidad de diversas moléculas orgánicas [10], resultando importante realizar estudios relacionados con la medición de la capacidad antioxidante en extractos obtenidos con un solvente amigable con el medio ambiente (agua subcrítica) de la hoja de chirimoya. Así pues, el objetivo del presente estudio es determinar la actividad antioxidante de los extractos de la hoja de Annona cherimola Mill (Chirimoya).
Materiales y métodos
Reactivos
Metanol grado cromatográfico (J.T. Baker, USA), ácido gálico monohidratado ≥ 98,5% ACS (Sigma-Aldrich, China), carbonato de sodio grado > 99,9% (Merck, USA), reactivo Dragendorff (Merck, Alemania), cloruro férrico hexahidratado (Fisher scientific, USA), reactivo Shiff (Merck, Alemania), reactivo de Folin Ciocalteu de concentración 2,0 N (Sigma-Aldrich, USA), 2,2-difenil-1-picrilhidrazilo (DPPH) 95% (Alfa Aesar, Alemania), ácido 6-hidroxi-2,5,7,8-tetrametilcromo-2-ácido carboxílico (Trolox) 97% (Sigma-Aldrich, China), ácido ascórbico (Fisher Chemical, China), TPTZ (Alfa Aesar, Inglaterra), ácido clorhídrico (J.T. Baker, Canadá), bicloruro de hierro hexahidratado (Merck, Alemania), arena purificada grado USP/ NF (J.T. Baker, USA), agua ultrapura, obtenida con el purificador de agua Barnstead, modelo D 11911, Alemania.
Colección y secado de las hojas de chirimoya
Las hojas frescas de chirimoya fueron recolectadas de 50 árboles del fundo Lúcuma seca de la Comunidad de Santa Cruz de Ucro, Lima - Perú, la cual está ubicada a 2130 msnm (latitud: -11,872675 y longitud: -76,525470). Las hojas se colocaron en la caja isotérmica (4-5 °C) con gel pack y fueron llevadas al Instituto Tecnológico de la Producción (ITP), en el Callao. Las hojas se lavaron y fueron colocadas en un secador de aire caliente (Autonics, Japón) a 33 °C durante 9 h hasta alcanzar 12% de humedad. Se continuó el secado en una estufa de convección forzada (MMM Medcenter Einrichtungen GmbH, MMM, LSIS-B2V/VC 222, Alemania) a 45 °C por 2 h hasta 8,0% de humedad. Las hojas secas fueron trituradas en un molino de cuchillas (Retsch, Retsch®, Grindomix GM 200 Alemania) y pasadas a través del tamiz de malla de 1 mm (Retsch, Retsch®, S/M, Alemania). Las muestras se envasaron en bolsas de polietileno selladas al vacío (Test Multivac, Multivac, C-100, Alemania) y se guardaron en la refrigeradora (Thermo Fisher Scientific, Thermo Fisher Scientific, RCRF 252A14, USA) a temperatura de 5 ± 1 °C hasta su posterior análisis.
Análisis estadístico
Se realizó el diseño y análisis factorial con el programa Minitab Versión 17. Factor A: solventes de extracción (5 niveles: etanol, agua a 80 °C y AS a 110 °C, 120 °C y 130 °C) y Factor B: tiempo de extracción (4 niveles: 1, 2, 3 y 4 h), con 4 réplicas, haciendo un total de 80 tratamientos. Además, se realizó el análisis del diseño factorial y la prueba de comparaciones de Tukey a los valores de los compuestos fenólicos y actividad antioxidante a un nivel de significancia α=0,05.
Extracción con equipo multisolvente
Se usó la celda de extracción con un diámetro interno de 6,35 cm y una altura de 14,8 cm, y se añadieron a esta, de forma intercalada, perlas de vidrio y hojas en polvo hasta completar la cantidad de muestra deseada (55 ± 2 g). La celda fue colocada dentro del reactor del equipo extractor multisolvente (Top Industrie, serie 2802.0000, Francia) y se programó la temperatura del precalentador (serpentín) y del reactor. Se usó agua ultrapura en el sonicador (VWR International, Symphony™, 97043-942, China) durante 45 min y se inició el proceso de extracción con la bomba cosolvente con un flujo de agua de 15 mL/min hasta alcanzar una presión de 50 ± 1 bar. Las extracciones fueron realizadas a 110, 120 y 130°C, luego de 1, 2, 3 y 4 h.
Extracción convencional
Se siguió la metodología de K. Lee [11], con la modificación en la proporción de hojas secas: solvente de 1:12 (p/v) con etanol 70% v/v y con agua. En una balanza analítica (Ohaus, Ohaus®, Discovery DV 214C, Suiza) se pesaron 4,00 g de hojas en polvo en 32 frascos de vidrio con tapa y se añadieron 48 mL del solvente (16 frascos con etanol al 70% v/v y 16 frascos con agua). Estos frascos se llevaron al baño termostático (la extracción etanólica a 60 °C y la acuosa a 80 °C) con agitación, retirando cada hora los frascos correspondientes y enfriándolos en baño de agua a 5 °C, para luego, filtrar los extractos con papel Whatman N° 4.
Marcha fitoquímica
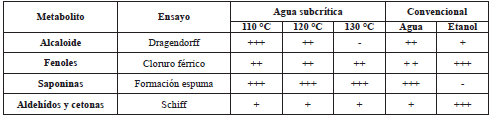
Se siguió la metodología de Lock [12] para determinar de forma cualitativa algunos metabolitos secundarios, tales como alcaloides, fenoles, saponinas, aldehídos y cetonas. Para ello, se utilizó el reactivo de Dragendorff, cloruro férrico y reactivo de Shiff.
Determinación de compuestos fenólicos (CF)
Se siguió la metodología de Singleton et al . [ 13] con la proporción de 1:1 muestra o estándar (estándar = reactivo de Folin Ciocalteu y carbonato sódico al 6% p/v). Se preparó una curva de calibración de ácido gálico con concentraciones de 50, 100, 150, 200 y 400 mg/L. Se diluyó el extracto a una concentración en la cual el contenido de fenoles se encontrara dentro del intervalo de la curva de calibración. Los resultados se expresaron en gramos de equivalente de ácido gálico (EAG)/100g hoja seca. La lectura se realizó en el espectrofotómetro UV-VIS (Perkin Elmer, Perkin Elmer®, LAMBDA 950, USA) a 750 nm.
Determinación de la capacidad antioxidante 2,2-difenil-1-picrilhidrazril (DPPH)
Se siguió la metodología de Brand-Williams et al. [ 14], modificada por Kim et al. [ 15]. Se preparó una curva de calibración de Trolox con concentraciones de 50, 100, 250, 500, 750 y 1000 μM. Se preparó una solución de 1,1-difenil-2-picrilhidrazil (DPPH) en metanol cromatográfico al 80% v/v y se midió el porcentaje de reducción frente a los extractos de hoja de chirimoya con Trolox. La lectura se realizó en el espectrofotómetro UV-VIS (Perkin Elmer, Perkin Elmer®, LAMBDA 950, USA) a 518 nm. Los resultados se expresaron como la concentración mínima del extracto de la hoja necesaria para inhibir el 50% de radicales libres en unidades de mg extracto/mL (IC50).
Los valores menores indican mayor capacidad antioxidante. La capacidad antioxidante fue expresada en mg de equivalente Trolox por mg de extracto seco (mg ET/mg extracto seco) realizándose la comparación de la capacidad antioxidante del Trolox con respecto a la capacidad antioxidante del extracto de la hoja.
Determinación de la capacidad antioxidante-Ensayo Ferric Reducing Antioxidant Power (FRAP)
Se siguió la metodología de Benzie y Strain [16]. Los resultados fueron expresados como μmol ET/g extracto.
Resultados y discusión
Marcha fitoquímica
Los resultados de la marcha fitoquímica (Tabla 1) indican la presencia de alcaloides, fenoles, saponinas, aldehídos y cetonas en los extractos de la hoja de chirimoya.
Contenido de fenoles totales
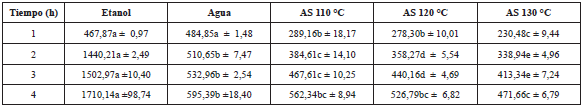
El análisis factorial indica un efecto significativo del tipo de solvente de extracción y tiempo de extracción, además de un efecto combinado de los dos factores sobre el contenido de CF (p<0,05). Los valores de CF aumentan a medida que aumenta el tiempo de extracción (Tabla 2), no obstante, en la extracción con el equipo extractor multisolvente, el contacto de las hojas y el agua subcrítica requiere mayor tiempo para la solubilización de los compuestos fenólicos.
Tabla 2 Contenidos de compuestos fenólicos (g EAG/100 g hoja seca) de los extractos con agua subcrítica, etanol y agua a 80 °C.
Las letras diferentes en una fila indican diferencia significativa (p≤0,05). La letra igual en una fila indica que no hay diferencia significativa p>0,05.
A las 3 y 4 h de extracción, los contenidos de CF del extracto etanólico y de AS 120 °C no presentaron diferencia significativa. El extracto con mayor contenido de CF fue el AS 130 °C. El efecto de alta temperatura dio paso a la reacción de Maillard, caramelización y/o termo-oxidación, formándose nuevos compuestos antioxidantes [9,17], los cuales probablemente fueron los causantes de la mayor cuantificación de CF. Sin embargo, el valor del contenido de CF del extracto de AS 130 °C fue menor que los CF encontrados en los extractos de hojas del híbrido de Annona cherimola. x Annona squamosa, obtenidos por Vieira et al. [ 18] con hexano y metanol (7,45 y 7,58 g EAG/100 g de hoja seca respectivamente), y fue mayor que los obtenidos por Tauchen et al. [ 19] en el extracto etanólico de hojas de Annona montana de Pucallpa-Perú (3,94 g EAG/100 g de hoja seca). Estas diferencias podrían deberse a la diferente variedad, lugar de cultivo y/o el clima, entre otros factores.
Díaz de Cerio et al. [ 8], al identificar los compuestos fenólicos de los extractos de hojas de chirimoya, encontraron que entre el 63 y 76% de los compuestos fenólicos totales eran derivados de flavonoides.
Capacidad antioxidante
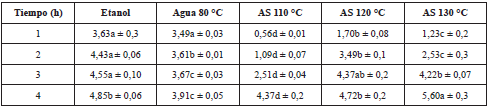
De igual manera que el contenido de CF, existe un efecto (P<0,05) del tipo de solvente y tiempo de extracción, sobre el valor de la capacidad antioxidante. La capacidad antioxidante (expresado en IC50) del extracto obtenido a la hora de extracción presentó valores numéricos mayores que se interpretan como menor capacidad antioxidante. Sin embargo a las 4 h de extracción, los valores de IC50 y de mg de ET/mg extracto seco mostraron mayor capacidad antioxidante. En relación al tipo de solvente, a las 4 h se observa el siguiente orden de mayor a menor capacidad antioxidante de los extractos: etanol, AS 110 °C, AS 120 °C, AS 130 °C y agua 80 °C (Tabla 3 y 4).
Tabla 3 Valores de capacidad antioxidante expresado en IC50 (mg extracto/mL).
Las letras diferentes en una fila indican diferencia significativa (p≤0,05). La letra igual en una fila indica que no hay diferencia significativa p>0,05.
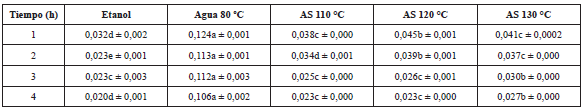
Tabla 4 Valores de capacidad antioxidante obtenidos mediante la técnica de DPPH (mg ET/mg extracto seco).
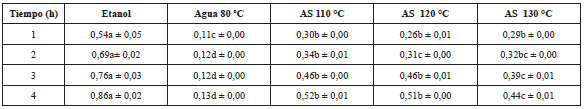
Las letras diferentes en una fila indican diferencia significativa (p≤0,05). La letra igual en una fila indica que no hay diferencia significativa p>0,05.
De manera general los valores de FRAP aumentaron a medida que aumentó el tiempo de extracción (Tabla 4). El orden de mayor a menor actividad antioxidante fue: etanol, agua 80 °C, AS 110 °C, AS 120 °C y AS 130 °C.
Al respecto, Vieira et al. [ 18] obtuvieron extractos de hojas de un híbrido de Annona cherimola Mill. x Annona squamosa con hexano y metanol con IC50=0,186 mg/mL y IC50=0,0299 mg/mL, respectivamente. Este último es similar a los valores obtenidos en este estudio.
En este trabajo, la capacidad antioxidante del extracto etanólico fue 10 veces mayor (IC50=0,020 mg/mL) y el extracto de AS 110 °C fue 9 veces mayor (IC50=0,023 mg/mL) que la capacidad antioxidante encontrada por Gomes et al. [ 20] en el extracto metanólico de las hojas de Annona muricata (IC50=0,2215 ± 0,0161 mg/mL).
Estos resultados permiten proponer procedimientos potencialmente empleados para el aprovechamiento de material vegetal gracias a la obtención de extractos enriquecidos.
Conclusiones
El extracto acuoso de las hojas de chirimoya obtenido a 130 °C presentó, por una parte, el mayor contenido de compuestos fenólicos, posiblemente, por las reacciones de Maillard, caramelización y/o termooxidación; y, por otra parte, la menor capacidad antioxidante, debido a la exposición a altas temperaturas. De todos los extractos evaluados, el extracto etanólico fue el que presentó mayor capacidad antioxidante. Así pues, los resultados indican que la hoja de chirimoya tiene actividad antioxidante, lo cual puede permitir su aprovechamiento en la industria alimentaria y farmacéutica, en lugar de ser quemadas en las zonas agrícolas en las cuales se cultiva.