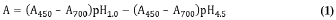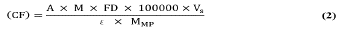Introducción
La gulupa (Passiflora edulis f. edulis Sims) es una fruta originaria de la región amazónica que se adapta muy bien a las montañas de los Andes y crece por encima de los 1500 msnm [1]. En Colombia, entre 2010 y 2015, la producción de gulupa se ha mantenido entre los 6110000 y 8231000 kg anuales, siendo los departamentos de Cundinamarca, Boyacá, Antioquia y Tolima los principales productores. Dichos volúmenes de producción, además de suplir el mercado nacional, también son objeto de exportación; los principales importadores son: Países Bajos, Alemania, Canadá y Reino Unido [2].
Estudios de la Organización de las Naciones Unidas para la Alimentación (FAO) [3] muestran que cerca del 40% de las pérdidas de alimentos ocurren en las etapas de postcosecha y procesamiento, en el caso de la gulupa, dicho porcentaje está sobre el 10% [4]. La cosecha de la gulupa está destinada casi exclusivamente al beneficio de la pulpa, la cual, junto con las semillas, componen entre el 34 y 61% (p/p) de la masa total del fruto [1]. Por lo anterior, durante la cadena de producción y consumo de esta fruta se da un gran desperdicio del epicarpio, lo que resulta ser poco beneficioso en la medida en que la gulupa tiene compuestos flavonoides y fitoprostanos [5,6] caracterizados por un alto potencial de aprovechamiento en la obtención de productos como concentrados de antioxidantes o flavonoides como las antocianinas.
Las antocianinas son pigmentos comúnmente encontrados en flores y frutos de muchas plantas [7]. Estas plantas tienen potencial uso terapéutico en el tratamiento de enfermedades coronarias [8], diabetes tipo 2 [9], e incluso, cáncer metastásico óseo [10]. Por tal razón, se ha despertado un creciente interés en su utilización como colorante natural [11,12]. Sin embargo, dichos compuestos son susceptibles al deterioro por factores como el pH y la temperatura [7], [13,14], los cuales causan que los productos que contengan estos pigmentos sean sometidos a condiciones especiales de procesamiento y almacenamiento, para evitar la degradación del colorante y prolongar su vida de anaquel. Por consiguiente, conocer las condiciones de almacenamiento en las cuales el pigmento es estable, durante un periodo de tiempo, podría abrir las posibilidades de su utilización en productos que tengan un tiempo de vida útil similar.
A pesar de que se ha cuantificado el contenido de antocianinas y antioxidantes en la gulupa [5,6], [15], no hay suficiente información sobre la capacidad antioxidante y la estabilidad térmica de ningún extracto rico en antocianinas, obtenido a partir del epicarpio. Por ello, el objetivo de este estudio fue realizar una extracción por solvente, para determinar la capacidad antioxidante y el contenido de vitamina C de un extracto de epicarpio de gulupa seco. Asimismo, cuantificar la cinética de degradación térmica de los pigmentos durante su almacenamiento a tres temperaturas (-14 ± 2 °C, 5 ± 1 °C y 21 ± 0,7°C) y calcular su energía de activación de acuerdo con la expresión de Arrhenius [16]. Lo anterior, se realizó con el fin de valorizar el empleo de los residuos de gulupa como fuente de compuestos bioactivos, como las antocianinas, y determinar el comportamiento del extracto durante el almacenamiento, proporcionando información acerca de la estabilidad del pigmento a diferentes temperaturas.
Materiales y métodos
Productos químicos y reactivos
Los reactivos empleados para el desarrollo experimental del estudio fueron mayoritariamente de grado analítico, a excepción del etanol 96% (v/v), el cual fue suministrado por Ciacomeq (Bogotá, Colombia), siendo este de grado industrial. El ácido cítrico, ácido clorhídrico 37% (p/v), ácido ascórbico, ácido acético glacial, acetato de sodio, acetato de sodio trihidratado, aceite mineral, nitrito de sodio, hidróxido de sodio, cloruro de potasio y cloruro férrico hexahidratado se obtuvieron de Merck S.A. (Bogotá, Colombia).
El Trolox (Ácido-6-hidroxi-2,5,7,8-tetrametilcroman-2-carboxílico), TPTZ (2,4,6-Tripiridil-s-Triazina), DPPH (2,2-Difenil-1-picrilhidracilo) y 2-nitroanilina fueron proporcionados por Auros Químicos Ltda. (Bogotá, Colombia) y el ácido oxálico por Carlo Erba Reagents S.A. (Sabadell, España).
Material vegetal
La gulupa estudiada, procedente de la localidad de Aránzazu, Caldas, fue proporcionada por la comercializadora Productos del Campo San Gregorio S.A.S. Las muestras se transportaron hasta el laboratorio de la Universidad Jorge Tadeo Lozano (UJTL) de Bogotá y se mantuvieron a 8 °C por 12 h hasta su debido procesamiento.
Pretratamiento de la materia prima
Las frutas se lavaron con agua potable y se secaron con papel absorbente. Posteriormente, fueron escogidas aquellas que evidenciaron un estado de madurez entre 5 y 6, según la tabla de color dada por Pinzón et al. [ 17]. Luego, se separó la pulpa, con la cual se determinó un índice de madurez (sólidos solubles totales (°Brix)/acidez titulable (% ácido cítrico)) de 4,96 ± 0,23 (n=10). Por otra parte, el epicarpio troceado en secciones de 3 cm2 se congeló (-34 °C por 24 h) y después, se liofilizó (22 °C y 4300 Pa por 7 días) hasta obtener una humedad de 4,84 ± 2,23% (p/p) (Liofilizador Drycol, Bogotá, Colombia). Finalmente, se molió y tamizó en un molino de impacto de palas (Retsch SK 100, Hann, Alemania) con un tamiz de 0,75 mm. La muestra pulverizada fue empacada al vacío (Multivac chamber machine C200, Bremen, Alemania) y almacenada en un ambiente seco y oscuro a temperatura ambiente (20 ± 2 °C).
Extracción de la muestra
Se realizó una extracción por solvente de acuerdo al método usado por Fan, Han, Gu & Chen [18], ajustado a las condiciones del laboratorio. El montaje constó de un matraz de fondo redondo, el cual estaba inmerso en un baño de aceite mineral y ubicado sobre una plancha de calentamiento con agitación a 1150 rpm (Corning PC 420D, Pittsburgh, PA, Estados Unidos). El sistema se conectó a un condensador en espiral con circulación de agua a 15 °C a contracorriente por medio de una bomba con un caudal de 800 L/h (Sunsun HJ-931, Tibet, China), empleando como solvente etanol al 96% (p/v) con pH neutro, el cual se acidificó con ácido cítrico. Las condiciones de operación, las cuales fueron determinadas por experimentos previos, fueron: tiempo de extracción de 105 min, pH de 2,0, temperatura de 52 °C y relación solvente-soluto de 25 g de solvente por 1 g de materia prima. Finalmente, se centrifugó la muestra (4000 rpm por 15 min) en una centrífuga (Hettich Rotofix 32 Zentrifugen, Schwerin, Alemania), y se tomó el sobrenadante.
Caracterización del extracto
Cuantificación de antocianinas monoméricas por el método de pH-diferencial
El extracto de antocianinas se caracterizó mediante la cuantificación de antocianinas monoméricas totales por espectrofotometría UV-visible, de acuerdo al método de pH diferencial de Giusti & Wrolstad [19]. Dos alícuotas del mismo volumen de extracto fueron sometidas a los buffers KCl 0,025 M pH 1,0 y acetato de sodio 0,4 M pH 4,5, calculando su absorbancia neta (ecuación 1) Donde A450 y A700 es la lectura de la absorbancia a 450 y 700 nm respectivamente.
Las lecturas de absorbancia se realizaron en un espectrofotómetro (Evolution 300 Thermo Scientific, Matlock, Inglaterra), usando como blanco agua desionizada y celdas UV de 1,5-3mL de capacidad de material polietileno.
Se determinó el rendimiento de extracción de antocianinas totales monoméricas, el cual se expresó como mg cianidina-3-glucósido/100 g de epicarpio de gulupa seco (ecuación 2). La cuantificación se hizo por triplicado.
Donde CF corresponde al rendimiento de extracción de antocianinas (mg cianidina-3-glucósido/100 g de epicarpio de gulupa seco), M al peso molecular (449,2 g/mol), FD al factor de dilución (razón entre el volumen total (alícuota y buffer) y el volumen de la alícuota), Vs al volumen de solvente (L), ε al coeficiente de extinción molar (29600 L/(mol'cm) de cianidina-3-glucósido) y MMP a la masa de la materia prima seca.
Determinación de la capacidad reductora de Fe+2, ensayo FRAP
Esta se realizó por triplicado, de acuerdo al método descrito por Benzie & Strain [20]. Para ello, se mezclaron 150 μL de extracto con 1350 μL de etanol 96% (v/v), de los cuales se tomaron 30 μL con 30 μL de etanol-agua (80:20) y 940 μL de reactivo FRAP (compuesto por buffer acetato de sodio pH 3,6 300 mM, TPTZ 0,01 M y cloruro férrico 20 mM (10:1:1)) en un tubo Eppendorf. Esta disolución se incubó a 37 °C durante 1 h en la oscuridad y luego, se homogenizó en un agitador tipo Vortex. Posteriormente, se midió la absorbancia a 593 nm en el espectrofotómetro (Evolution 300 Thermo Scientific, Matlock, Inglaterra) y se comparó con una curva de calibración de Trolox (R2=0,9997 entre 0,10-1,05 mM Trolox).
Determinación de la capacidad reductora, ensayo DPPH
Esta se realizó por triplicado con base en el método descrito por BrandWilliams, Cuvelier & Berset [21]. Para ello, se mezclaron 150 μL de extracto con 1350 μL de etanol 96% (v/v), de los cuales se tomaron 75 μL con 1425 μL de reactivo DPPH (6,29 x 10-5 M en etanol 96% (v/v)) en un tubo Eppendorf. Esta disolución se incubó a 37 °C durante 1 h en la oscuridad y después, se homogenizó en un agitador tipo Vortex. Posteriormente, se midió la absorbancia a 515 nm en el espectrofotómetro (Evolution 300 Thermo Scientific, Matlock, Inglaterra) y se comparó con una curva de calibración de Trolox (R2=0,990 entre 0,20-0,60 mM Trolox).
Determinación de ácido ascórbico, método colorimétrico 2-nitroanilina
Esta se efectuó por triplicado siguiendo el método descrito por Bernal de Ramírez [22]. Aquí, se mezclaron 500 μL de extracto con 1000 μL de solución de ácido oxálico 0,15% (p/v). Por otra parte, en un tubo Eppendorf, se agregaron 10 μL de 2-nitroanilina 0,16% (p/v), 20 μL de nitrito de sodio 0,08% (p/v), 380 μL de etanol 96% (v/v), 50 μL de extracto diluido preparado previamente, 50 μL de ácido oxálico 0,15% (p/v), 120 μL de NaOH 10% (p/v) y 380 μL de agua destilada.
Tras ello, se homogenizó la mezcla en un agitador tipo Vortex. Posteriormente, se midió la absorbancia a 540 nm en el espectrofotómetro (Evolution 300 Thermo Scientific, Matlock, Inglaterra) y se comparó con una curva de calibración de ácido ascórbico (R2=0,9985 entre 1,98-19,80 mg ácido ascórbico/L).
Cinética de degradación de antocianinas en el extracto
Se almacenaron 78 viales de color ámbar con el extracto a -14 ± 2 °C, 5 ± 1 °C y 21 ± 0,7 °C (26 por cada temperatura de almacenamiento), durante 29 días en ausencia de luz. A intervalos regulares de tiempo se tomaron dos muestras de cada condición establecida. Para ello, se realizó la toma tres veces a la semana para las temperaturas 5 ± 1 °C (refrigeración) y 21 ± 0,7 °C (ambiente) y una vez por semana para la temperatura -14 ± 2 °C (congelación), evaluando el efecto de la temperatura sobre el contenido de antocianinas monoméricas totales. Lo anterior, se cuantificó por triplicado, según Giusti & Wrolstad [19].
Se determinó el orden de reacción de la degradación de las antocianinas para las cinéticas de orden cero y uno, con un ANAVA (p<0,05), siendo el R2 el factor determinante para la selección del modelo cinético. Además, se calculó el tiempo de vida media (t1/2), el tiempo de vida útil para la degradación del 10% de la concentración de antocianinas (t10%) y el factor de calidad (%). Este último se definió como el porcentaje de la relación entre la concentración en el tiempo (t) y la concentración en el tiempo cero. Así, se generaron los valores de tasa de degradación (K), lo cual permitió calcular, por medio de la expresión de Arrhenius, la energía de activación (Ea) con la constante universal de los gases (R=8,314 J/mol·K). El modelo de Arrhenius se utilizó para describir la dependencia de la tasa de degradación de antocianinas con respecto a la temperatura [16].
Resultados
Caracterización del extracto
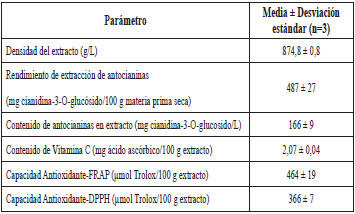
La Tabla 1 muestra la capacidad antioxidante y el contenido de antocianinas del extracto extraído.
Cinética de degradación
El orden de la cinética de degradación de las antocianinas durante el almacenamiento se definió por la cinética de orden uno (Tabla 2). Para esto, se graficó, en función del tiempo, el logaritmo en base Euler de la razón entre la concentración de antocianinas del tiempo dado y la concentración inicial del extracto (Figura 1A). El ensayo sometido a temperatura de congelación no fue significativo para ningún orden de reacción según ANAVA (p<0,05), lo cual muestra que el extracto bajo tales condiciones de almacenamiento no sufrió cambios durante el tiempo de experimentación.
Tabla 2 Cinética de degradación de orden 0 y 1 para las antocianinas contenidas en el extracto de epicarpio de gulupa a diferentes temperaturas de almacenamiento.
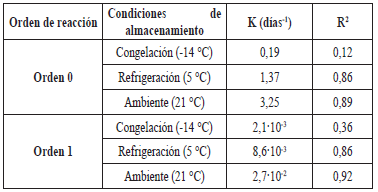
Las antocianinas monoméricas presentes en el extracto se degradaron respecto al tiempo de almacenamiento, presentando la mayor tasa de degradación a altas temperaturas (Tabla 2) (Figura 1 A), siendo mayor a temperatura ambiente, luego, a refrigeración y, por último, a congelación. Loypimai et al. [ 13] señalan que cuanto menor sea el valor de la tasa de degradación, mejor será la estabilidad de la antocianina. Al respecto, se destaca que el estudio mostró que, a temperatura de congelación, las antocianinas fueron más estables en contraste con las demás condiciones. En consecuencia, a los 29 días de almacenamiento, la degradación de antocianinas, medida por el factor de calidad, estuvo entre 43,61 y 93% (Tabla 3). Asimismo, se determinó el tiempo necesario para que el 10 y 50% de las antocianinas del extracto se degraden, lo cual sirvió para estimar su comportamiento en matrices similares y determinar las condiciones necesarias de almacenamiento según la vida de anaquel del producto.
Tabla 3 Parámetros cinéticos de la degradación de las antocianinas contenidas en el epicarpio de gulupa.
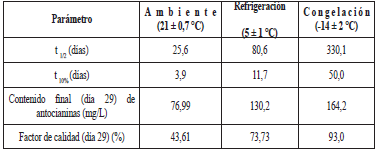
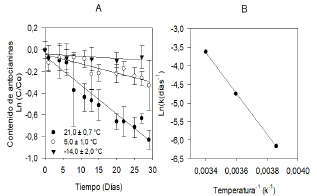
Figura 1A Degradación de antocianinas del extracto de epicarpio de gulupa a 21,0 ± 0,7 °C, 5,0 ± 1,0 °C y -14,0 ± 2,0 °C, 1B. Linealización de Arrhenius entre la temperatura de almacenamiento y la tasa de degradación del extracto de epicarpio de gulupa.
Según Arrhenius (Figura 1B) (R2=0,999 y ANAVA con p<0,05) serán necesarios 46,0·103 J para que una mol de cianidina-3-O-glucosido del extracto pueda empezar el proceso de degradación (Ea=46,0·103 J/mol) [16].
Lo anterior permite estimar la tasa de degradación de antocianinas del extracto a cualquier temperatura entre -14 y 21 °C, y con ella, parámetros como el tiempo de vida media.
Discusión
Caracterización del extracto
El contenido de antocianinas medido en el extracto supera lo registrado para la batata morada seca (158 mg antocianina/100 g peso [18]), el polvo de arándano microencapsulado (78,49 mg cianidina-3-O-glucosido/100g polvo) [23] y la corteza de gulupa (103,70 mg antocianina/100g seco) según Reis et al. [ 24]. Los resultados para la gulupa en estado de madurez dos son similares a lo determinado por Jiménez et al. [6] (450 ± 4 mg cianidina-3-O-glucosido/100g de fruta). No obstante, con el uso de otros solventes más afines a las antocianinas, como el metanol, Lee, Park, Choi & Jung [25] lograron extraer cerca del doble de antocianinas a las reportadas en este estudio para la batata morada seca variedad Zami (1190,2 ± 17,4 mg antocianina/100 g peso seco), pero solo 383 ± 5 mg antocianina/100 g peso seco para la variedad Mokpo. Lo anterior muestra que el epicarpio de gulupa es buena fuente de antocianinas, las cuales podrían llegar a ser utilizadas en extractos para el enriquecimiento de diversos productos.
El contenido de vitamina C (Tabla 1) cuantificado en el extracto es inferior a lo mencionado para la corteza de limón (129 mg ácido ascórbico/100 g) [26] y el jugo de gulupa (32,4 mg ácido ascórbico/100g) [15]. Las altas temperaturas de extracción [27] y el tiempo de operación pudieron causar la descomposición del ácido ascórbico; sin embargo, esto podría ser un factor favorable para la estabilidad de las antocianinas del extracto, ya que la presencia de vitamina C ha sido relacionada con la degradación de este tipo de pigmentos [28].
La capacidad antioxidante del extracto determinado por los ensayos de DPPH y FRAP (Tabla 1) supera lo establecido en estudios similares realizados para el extracto de aguacate (165 ± 4 μmol Trolox/100 g muestra B.H. por DPPH) [29], los vinos blancos (la mayor concentración fue de 2,14 ± 0,01 mmol Trolox/L y 1,78 ± 0,03 mmol Trolox/L por FRAP y DPPH respectivamente) y el vino tinto Modry Portugal (2,91 ± 0,01 mmol Trolox/L con el ensayo DPPH) [30]. Adicionalmente, la capacidad antioxidante, determinada en este estudio, supera lo reportado por Carvajal et al. [ 31] para extractos de frutas del género Passiflora tales como badea, cholupa, granadilla y maracuyá, siendo el extracto de gulupa (5 mg Trolox/100 g de extracto seco) el de mayor poder antioxidante en dicho estudio.
Sin embargo, otros datos disponibles para el epicarpio de la manzana (345,32 mg ácido ascórbico equivalente/g muestra B.H. por DPPH [29] indican que este es superior a los aquí informados.
El extracto presentó una alta capacidad antioxidante a comparación de otros productos de extracción. En términos de la materia prima, la capacidad antioxidante del epicarpio de gulupa (100 ± 4 y 79,10 ± 1,45 μmol Trolox/100 g de epicarpio seco) fue inferior a lo determinado para Passiflora mollissima Baley (15228 y 2132 mg Trolox/100 g fruta seca según DPPH y FRAP) [32] y para la harina de corteza de Passiflora edulis (874,76 mg Trolox/100 g harina por método FRAP) [33]. No obstante, el presente estudio muestra al epicarpio de gulupa como una fuente rica en compuestos con capacidad antioxidante y útil para la producción de extractos ricos en tales componentes.
Cinética de degradación
El tiempo de vida media para el extracto almacenado en temperatura de refrigeración (Tabla 3) fue similar al del jugo de arándanos (Vaccinium corymbosum L. "Snowchaser") sin pasteurizar a 5 °C (75 días) [34], mientras que con jugo y concentrado de agraz (Vaccinuim meridionale Sw.) a 17 °C se reportó un t1/2 entre 1,8 y 6,4 semanas [35]. Lo anterior responde al carácter termolábil de las antocianinas [36], reflejando tiempos de vida inferiores para temperaturas superiores. La energía de activación determinada en este estudio se asemeja a la señalada por Zapata et al. [34] para el jugo de arándanos (Vaccinium corymbosum L. "Snowchaser") (44,66·103 J/mol) y a lo manifestado por Hillmann, Burin & Bordignon-Luiz [37] para el jugo de uva (Vitis labrusca) de 45 °Brix (54,78·103 J/mol). Sin embargo, Martínez et al. [ 35] evidenciaron una mayor energía de activación a pH 3 en concentrado de agraz (Vaccinuim meridionale Sw.) (76,43·103 J/mol).
Conclusiones
A partir del epicarpio liofilizado de gulupa, es posible obtener un extracto rico de antocianinas, el cual presenta una alta capacidad antioxidante conforme con los ensayos FRAP y DPPH, pero un bajo contenido de vitamina C. Adicionalmente, el extracto es afectado por la temperatura de almacenamiento, siendo la condición de congelación la que no presentó deterioro de antocianinas; pese a ello, la energía de activación es capaz de determinar la tasa de degradación de las antocianinas del pigmento durante el almacenamiento a una temperatura dada, así como otros parámetros como el tiempo de vida media. Por consiguiente, lo anterior abre la posibilidad de la utilización del epicarpio de gulupa para la obtención de extractos con capacidad antioxidante, así como antocianinas, agregando valor a un subproducto que actualmente se desecha.