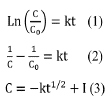Introducción
A lo largo de los últimos años, el desarrollo del sector agrícola ha llevado a la utilización de pesticidas, lo cual se ha manifestado en una problemática de tipo ambiental y sanitaria, relacionada con la variedad de contaminantes orgánicos en fuentes hídricas [1]. Allí, se encuentran contaminantes como los herbicidas, debido a que estos se introducen en el sistema de agua por varias fuentes: efluentes industriales, derrames químicos y escorrentía agrícola [2]. El glifosato, al ser un herbicida de tipo no selectivo de acción sistémica, es decir, que actúa sobre la raíz y es capaz de controlar en su totalidad la maleza, es aplicado sobre el follaje y absorbido por las hojas. Su mecanismo de acción se basa en suprimir la capacidad de generar aminoácidos aromáticos como el triptófano-tirosina y fenilalanina en las plantas [3] que, al degradarse, producen compuestos más simples como el ácido aminometilfosfónico (AMPA), generando así altos niveles de toxicidad y problemas sobre la salud en humanos y animales [4].
Colombia se ha visto muy afectada por cultivos ilícitos, en especial los cultivos de coca, lo cual ha llevado al gobierno nacional a implementar, a través del Ministerio de Justicia y del Derecho desde el año 2001, el programa de erradicación de cultivos ilícitos mediante aspersión aérea con glifosato (PECIG). Esto con el objetivo de controlar y eliminar las plantaciones de cultivos de coca de forma rápida y segura, evitando así la producción de cocaína [5]. Una de las problemáticas, en torno a los cultivos ilícitos de coca, se puede observar en el departamento del Putumayo, donde el uso del glifosato por aspersión aérea en el año 2015 afectó zonas de ganadería y piscicultura, provocando el desplazamiento de la población y la muerte indiscriminada de animales [6].
La agricultura extensiva ha vuelto fundamental el uso de agroquímicos a nivel mundial, particularmente en países desarrollados en América del Norte, Europa, Japón, entre otros [7]. Dentro de los agroquímicos, se destaca en especial el herbicida glifosato, representando la comercialización del 61 y 66% [8] del mercado de los productos agroquímicos en compañías como Syngenta, Monsato, BASF, entre otros. Uno de los mayores consumidores de este herbicida es Argentina. En este país, se han encontrado restos de glifosato en cultivos de algodón, producto a partir del cual se obtienen derivados como gasas, algodones y artículos de higiene personal [9].
La persistencia de los herbicidas, en especial del glifosato en el medio ambiente, ha sido motivo para buscar tecnologías y/o alternativas que permitan la degradación de pesticidas en agua, y así, lograr la reducción de los riesgos asociados al consumo de aguas contaminadas por estos [4]. Algunas alternativas, relacionadas con los procesos de oxidación avanzada (POA's), son: la ozonización, la fotólisis y la fotocatálisis heterogénea, en las cuales se da una destrucción total o parcial de la molécula del glifosato con el fin de mineralizarla o hacerla biodegradable [3].
La remoción de sustancias como pesticidas y herbicidas en el agua ha sido estudiada por diferentes investigadores, empleando procesos de oxidación avanzada, ya sea solos o en combinación con otros procesos como adsorción, ozonólisis, entre otros. Los sistemas híbridos de adsorción mediante carbón activado y fotocatálisis han sido empleados de manera satisfactoria para la remoción de metilsulfonilmetano del agua, llegando a remociones del 90% a través del proceso combinado [10]. El herbicida clopiralid tiene la característica de ser fotoestable en condiciones ambientales, sin embargo, su degradación mediante el uso de Degussa P25 y radiación UV mostró remociones de cinco veces las obtenidas por la fotólisis directa [11]. El glifosato también ha sido estudiado previamente, encontrando que algunos iones metálicos al ser impregnados al TiO2 favorecen la velocidad de remoción de esta sustancia del agua [12].
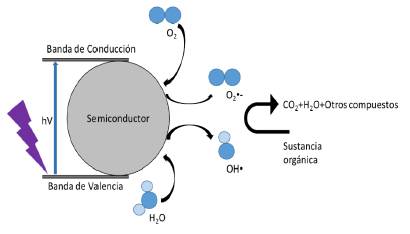
Dentro de los POA's, el más prometedor es la fotocatálisis heterogénea, la cual produce la degradación, e incluso, la mineralización de contaminantes orgánicos por las reacciones de óxido-reducción generadas [13]. El mecanismo de degradación de la fotocatálisis heterogénea se ilustra en la figura 1.
Uno de los catalizadores más ampliamente usado es el TiO2, sin embargo, este solo puede realizar su actividad fotocatalítica a través del uso de la radiación en el espectro UV.
Para iniciar la actividad fotocatalítica es necesario un fotón con una energía igual o superior al valor de band gap, o banda prohibida, el cual es de 3,2 eV. No obstante, estudios recientes han encontrado que, al dopar el TiO2 con algún elemento metal o no metal, este puede cambiar la respuesta fotocatalítica del catalizador, es decir, puede pasar de realizar su actividad con la región de luz UV a hacerla con luz de la región del espectro visible [14]. Previamente, se han realizado estudios con catalizadores basados en TiO2 dopado con iones metálicos de manganeso (Mn), cerio (Ce) y lantano (La), en donde se varió la concentración de los iones metálicos (0,15 -0,6%) presentes en el fotocatalizador, encontrando que el TiO2 con una concentración del 0,45% de todos los iones metálicos presenta la mayor actividad fotocatalítica. Sin embargo, el TiO2 dopado con Mn es el que más se destaca por presentar la mejor actividad de degradación del glifosato, también utilizando el espectro de luz visible [14].
Si bien, los procesos fotocatalíticos han sido ampliamente estudiados durante los últimos años, el soporte de catalizadores y su uso en reactores continuos no han sido estudiados de manera intensiva [14, 15]. El estudio de la degradación de sustancias de interés ambiental, mediante este tipo de sistemas, permitirá la futura implementación de sistemas de tratamiento a escala industrial que usen energía solar como fuente de radiación [16, 17].
En el presente estudio se evaluó un catalizador soportado basado en dióxido de titanio e impregnado con manganeso soportado en anillos de borosilicato para la remoción de glifosato en solución acuosa. Para evaluar la actividad del catalizador se realizó el montaje de un reactor continuo enchaquetado, el cual operó en modo de recirculación o totalmente en continuo para la evaluación de los parámetros cinéticos de la degradación del glifosato, empleando un catalizador soportado con una mayor facilidad de recuperación.
Materiales y métodos
Se disolvió cloruro de manganeso tetrahidratado (MnCL/4H2O) 99% (Carlo Erba RPE-ACS) en 27,6 mL de agua destilada para obtener el 1.0% en peso de Mn. La solución fue puesta en un baño de ultrasonido para asegurar la disociación del cloruro de manganeso. El sol-gel fue preparado agregando 100 g de isopropóxido de titanio (IV) 95% (Alfa Aesar) gota a gota, 53 mL de n-butanol 99,5% (Panreac PS), 28,3 g de dióxido de titanio 99.5% (Degussa P25) y la solución de manganeso, anteriormente preparada, a un balón de reacción de tres cuellos en el que se tenía una solución de 53 mL de n-butanol y 27,6 mL de agua con un agitación constante a 220 rpm y un termómetro. La solución obtenida se mantuvo en oscuridad durante un tiempo de 4 h a una temperatura de 80 °C.
Los anillos fueron inmersos en el producto obtenido por un tiempo de 72 h, luego, se secaron en el horno a 100 °C y, finalmente, se calcinaron a 450 °C por 4 h. Los soportes utilizados para los catalizadores fueron anillos de vidrio borosilicato de una longitud de 9,43 mm, un diámetro interno de 6,52 mm y externo de 7,59 mm, los cuales fueron cubiertos con el catalizador mediante la técnica dip coating [19].
Al catalizador sintetizado se le realizaron una serie de caracterizaciones físicas y químicas por medio de microscopía electrónica de barrido -espectrometría de dispersión de energía de rayos X (SEM-EDS) en un microscopio electrónico de barrido JEOL, modelo JSM 6490-LV. La espectroscopía de infrarrojo por transformada de Fourier (FTIR) en un espectrofotómetro Thermo Nicolet, modelo 6700 y microscopía de fuerza atómica (AFM) en un microscopio CYPHER ES de Asylum Reseach.
Los ensayos de fotodegradación se hicieron en un reactor diseñado para trabajar en operación continua. El reactor se mantuvo con recirculación total, como se muestra en la figura 3. Para cada ensayo, se prepararon 500 mL de solución acuosa de glifosato a una concentración de 500 mg L-1, a partir de una papeleta de glifosato granulado de nombre comercial Roundup 747 de 50 g de contenido neto de la marca Monsanto, la cual contiene 679 g de glifosato por kg de producto. Cada uno de los ensayos fue llevado a cabo por un tiempo total de 2,5 h, haciendo muestreo cada 15 min. La fuente de radiación utilizada fue una lámpara de luz UV de 70 W de potencia con una longitud de onda máxima entre 370 y 410 nm. El reactor empleado, que incluye una entrada y salida de muestra y una derivación para ingresar aire de ser necesario, consistió en un tubo de cuarzo con un anillo de vidrio de borosilicato y un volumen total de 320 mL.
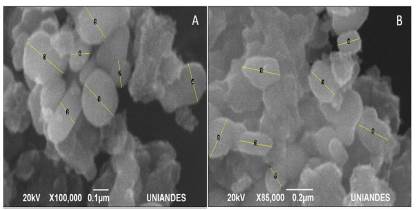
Figura 3 Microscopia Electrónica de Barrido. A) TiO2-Mn en polvo B) TiO2-Mn soportado en los anillos.
Las muestras tomadas del reactor fueron analizadas para evidenciar el grado de avance de la reacción mediante el método de derivatización de la molécula de glifosato para poder ser cuantificado colorimétricamente, haciendo uso de la técnica espectrofotométrica con una curva de calibración elaborada con soluciones estándar preparadas con glifosato analítico Sigma Aldrich > 99%. El método aplicado consistió en la reacción del grupo amino de la molécula de glifosato con la ninhidrina en presencia de molibdato de sodio como catalizador, en la cual se elimina una molécula de agua para dar origen a un complejo coloreado púrpura en medio acuoso neutro que absorbe a 570 nm [2].
Los datos de concentración versus tiempo fueron ajustados a ecuaciones de pseudo primer orden, Ec. 1 y pseudo segundo orden, Ec. 2, y un modelo de difusión intrapartícula, Ec. 3, como se muestra a continuación:
Donde C y C0 son las concentraciones para el tiempo t y tiempo 0, respectivamente; k es la constante cinética de la ecuación, la cual tiene unidades de min-1, para pseudo primer orden, de L mol-1-min-1 para la de pseudo segundo orden y de mol.L-1-min-1/2 para la intrapartícula.
Resultados y discusión
Caracterización del catalizador
En la figura 3 se presentan las micrografias aportadas por el SEM para el catalizador sintetizado en polvo y el catalizador que se encontraba soportado en los anillos de vidrio borosilicato. Como se observa, la distribución de partículas obtenida es homogénea.
De cada una de las micrografías se extrajeron los diámetros de las partículas más definidas, teniendo que el diámetro promedio de las partículas del TiO2-Mn que quedaron adheridas a los anillos de borosilicato es de 0,22 µm.
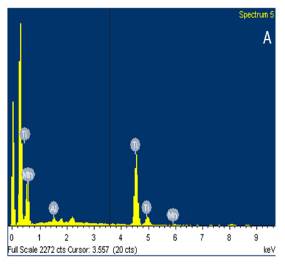
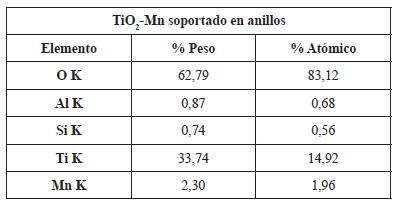
Adicionalmente, se llevó a cabo un análisis EDS para conocer los elementos presentes en el catalizador. El análisis presentado en la figura 4 permitió concluir que tanto en el catalizador en polvo, como en el que se encuentra soportado en los anillos hay presencia de TiO2 y Mn como se observa en la tabla 1.
Dentro de las composiciones se puede encontrar un porcentaje pequeño de aluminio, el cual puede estar presente debido algún tipo de impureza o contaminación en los reactivos o en el material utilizado para la síntesis del catalizador. A pesar de que el porcentaje esperado de manganeso en el catalizador (1%) fue tan bajo, este se logró evidenciar en los EDS de la figura 4. El silicio presente en el EDS del catalizador soportado en los anillos se debe al presente en la composición de los anillos de vidrio.
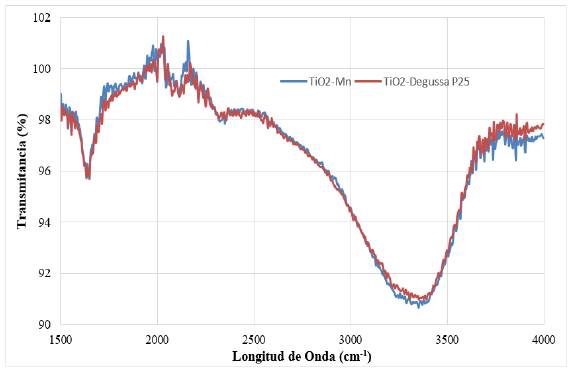
Tanto la caracterización química del TiO2 comercial (Degussa P-25) como la del catalizador sintetizado TiO2-Mn se realizó utilizando el espectro de infrarrojo (FTIR), presentado en la figura 5. En esta se observan las bandas correspondientes a los bordes Ti-OH, que se encuentran en el rango entre 3391 - 3438 cm-1 y corresponden a estiramientos simétricos y asimétricos del grupo hidroxilo [20, 21]. Además, se observa una banda amplia alrededor de 3400 cm-1 y un pico en 1640 cm-1, que han sido reportados como agua adsorbida en la superficie, [22]. Finalmente, se encuentra en el espectro una banda de absorción débil en 2300 - 2400 cm-1 correspondiente al enlace Ti-O del dióxido de titanio [21]. Existen algunas bandas débiles al final de la caracterización, las cuales podría pertenecer a modos de vibración de especies orgánicas residuales que no se eliminaron por completo, por ejemplo, con el butanol [23].
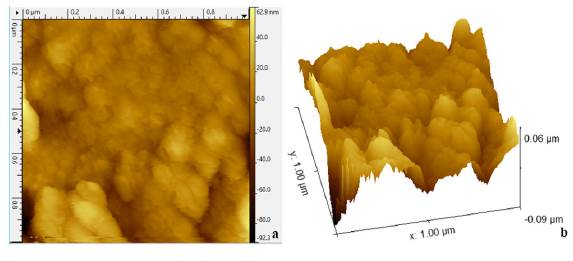
La microscopía de fuerza atómica arroja los perfiles del catalizador soportado en los anillos. En la figura 6a se pueden observar granos esféricos uniformes y aglomerados, con algunos vacíos en su superficie; en la figura 6b, la superficie del TiO2 dopado muestra microestructuras granulares compuestas de partículas irregulares con altura del pico más alto de 0,06 Lm y una profundidad de valle más bajo de -0,09 Lm, teniendo en cuenta un área de barrido de 1,0 X 1,0 µm. Además, el análisis proporciona parámetros de rugosidad superficial, la cual en promedio tiene un valor de 10,7145 nm, indicando esto que la superficie no es ópticamente lisa.
Experimentos de degradación fotocatalítica
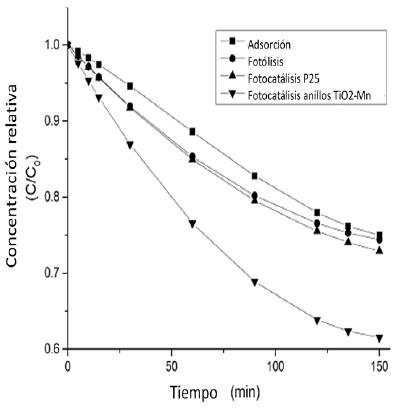
De acuerdo con la figura 7, para la fotólisis, después de 150 min de tratamiento se alcanza un porcentaje de 25,3% de degradación. Para los ensayos de adsorción, se observa un 24,9% de remoción de glifosato. Después del mismo periodo de tiempo, los ensayos de degradación fotocatalítica con dióxido de titanio Degussa P25 dieron como resultado una remoción de 28,6%, bastante cercano a lo removido por la adsorción, lo cual significa que el aporte de la fotocatálisis con el dióxido de titanio P25 es poco.
Degussa P25 dieron como resultado una remoción de 28,6%, bastante cercano a lo removido por la adsorción, lo cual significa que el aporte de la fotocatálisis con el dióxido de titanio P25 es poco.
Los ensayos con los anillos de vidrio borosilicato dieron como resultado una remoción de 39,2% del glifosato presente en la muestra inicial, lo cual indica una mejora del proceso de remoción, el cual puede deberse a la mayor área de contacto del glifosato con la superficie del catalizador, además del mejoramiento del desempeño del mismo mediante la reducción de los fenómenos de recombinación y disminución del band gap asociados a la inclusión del manganeso en la estructura del catalizador, con lo cual hay un mejor aprovechamiento de la radiación inducida por la lámpara UV Después de 150 min de exposición a la radiación ultravioleta, no se presenta una disminución apreciable para el catalizador con manganeso, con lo cual podría diseñarse un reactor continuo con un tiempo de retención equivalente. También se pudo evidenciar que el catalizador quedó fuertemente adherido a los anillos, lo cual indica que el método de impregnación fue el adecuado.
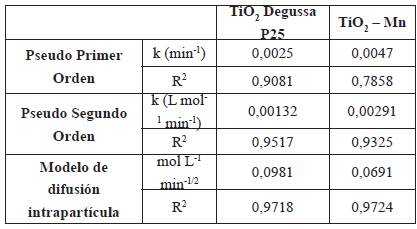
De acuerdo con la tabla 2, el modelo cinético de difusión intrapartícula es el que mejor se ajusta a la reacción de fotocatálisis de la molécula de glifosato en solución acuosa con los catalizadores soportados, seguido de cerca por el modelo de pseudo segundo orden. El ajuste de todos los ensayos llevados a cabo sugiere que los procesos de difusión intrapartícula son los limitantes de la velocidad de la reacción [23, 24].
Conclusiones
La actividad fotocatalítica del dióxido de titanio se logró mejorar mediante el dopaje con manganeso, los resultados de degradación evidenciaron que con el TiO2 Degussa P25 se presenta una degradación del 28,6%, mientras que con el TiO2-Mn se da una remoción de 39,2%. La inclusión del manganeso en la estructura del catalizador permitió que la actividad fotocatalítica del mismo mejorara. También, se observó que la impregnación del catalizador en el soporte de vidrio borosilicato fue la adecuada al no presenciarse lixiviación del catalizador en el medio, además de obtener una superficie rugosa como se muestra en la microscopía AFM.
Al obtener una cinética de reacción ajustada a un modelo de difusión, se concluye que el fenómeno que ocurre en la degradación fotocatalítica de la molécula de glifosato es el fenómeno de difusión intrapartícula en los poros del fotocatalizador.