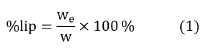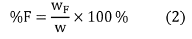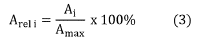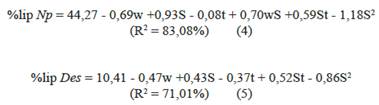Introducción
Las microalgas, un grupo diverso de microorganismos fotosintéticos, tienen estructura simple, rápido crecimiento celular y alta producción de biomasa. Además, representan una gran reserva de biocompuestos, constituida principalmente por carbohidratos, proteínas y lípidos. También, son capaces de producir otros biocompuestos de interés, por ejemplo, el antioxidante astaxantina, a partir de Haematococcus pluvialis; el ácido graso esencial ácido docosahexaenoico (DHA), a partir de Schizochytrium spp; y la biotoxina marina ácido okadaico, a partir de Dinophysis spp. [1].
Los lípidos más abundantes en las microalgas pueden clasificarse en dos tipos: por un lado, los lípidos neutros, como los fitoesteroles, ácidos grasos y glicerolípidos neutros (monoacilglicerol, diacilglicerol y triacilglicerol) y, por otro, los lípidos polares, como los glicolípidos (GL), fosfolípidos (PL) y lípidos de betaína (BL). Estos últimos han sido ampliamente estudiados, debido a sus propiedades farmacológicas: los glicolípidos poseen actividad antitumoral, antiinflamatoria y antimicrobiana; mientras que los fosfolípidos poseen propiedad antiviral, antitumoral y antimicrobiana. Además, se utilizan como emulsificantes en la industria alimenticia [2]. En la cosmética, se emplean por sus propiedades como humectantes, antiarrugas, regeneradores y blanqueadores de la piel [3].
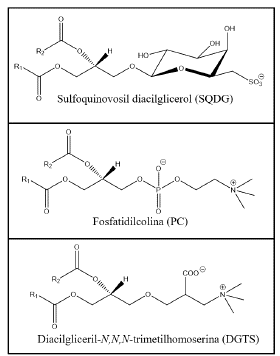
Dentro de la gran variedad de GL, los lípidos más característicos en las microalgas son el monogalactosil diacilglicerol (MGDG) y el digalactosil diacilglicerol (DGDG). Estos contienen una y dos moléculas de galactosa, respectivamente, las cuales no están ionizadas a pH fisiológico. También, es importante el sulfoquinovosil diacilglicerol (SQDG), cargado negativamente debido al grupo ácido sulfónico de la posición 6 del grupo monosacárido [4]. Los PL están constituidos por dos cadenas de ácidos grasos unidas a un glicerol y un grupo fosfato, generalmente este grupo fosfato se encuentra unido a grupos polares como colina, etanolamina, inositol y serina. Por su parte, los BL contienen un grupo betaína como grupo polar unido a la posición sn-3 del glicerol, mediante un enlace éter con los ácidos grasos esterificados en las posiciones sn-1 y sn-2 (Figura 1).
Los métodos de extracción de lípidos más empleados en la actualidad consisten en utilizar solventes y aplicar métodos de disrupción celular, como el bead-beating, las microondas, el ultrasonido y la disrupción enzimática, entre otros [5]; los cuales, combinados con modernas técnicas analíticas, como la espectrometría de masas, permiten determinar la cantidad y la estructura química de cualquier clase de lípido presente en la muestra, lo que se conoce como "lipidómica" [6].
El Instituto del Mar del Perú, IMARPE, cuenta con una colección de más de 500 cepas de microalgas, mantenidas en el Banco de Germoplasma de Organismos Acuáticos (BGOA) y aún no se ha explorado el potencial de sus lípidos polares como ingredientes naturales para la industria cosmética, nutricional o farmacéutica. Con la reciente adquisición del espectrómetro de masas Waters Xevo G2-XS QTOF, por parte del IMARPE se planteó el interés en determinar el efecto de los principales factores en la extracción e identificación de los lípidos polares de las microalgas Nannochloropsis oceanica y Desmodesmus asymmetricus para que sirva de referencia en una bioprospección química futura.
Por tanto, se determinaron los valores óptimos para la extracción de los lípidos totales, analizando la masa de la muestra, composición del solvente de extracción y tiempo del baño de ultrasonido. Además, se evaluaron los factores para la identificación de los lípidos polares, analizando el pH de la fase móvil, el modo de ionización y la energía de colisión del espectrómetro de masas.
Materiales y métodos
Muestra
Las microalgas Nannochloropsis oceánica (Np), código IMP-BG-Np, y Desmodesmus asymmetricus (Des), código IMP-BG-249, mantenidas en el BGOA-IMARPE, fueron cultivadas en el Laboratorio de Invernadero y Sala de Procesos - IMARPE, en biorreactores tubulares de polietileno de 30 litros, bajo las siguientes condiciones:
-La microalga Np fue cultivada con agua de mar, tratada por un periodo de 15 días, sin nutriente, a pH 8,19 ± 0,53, salinidad de 35,0 ± 0,2 ppm, temperatura de 23,8 ± 2,0 °C y luminosidad de 165 ± 57x102 lux.
-La microalga Des fue cultivada con agua potable tratada, por un periodo de 7 días, con 0,28 mL/L de Bayfolan® (Düsseldorf, Alemania), a pH 6,82 ± 0,45, salinidad de 0,31 ± 0,03 ppm, temperatura de 24,1 ± 1,4 °C y luminosidad de 212 ± 164x102 lux.
Luego, ambas especies fueron centrifugadas en la separadora Westfalia, modelo OTC 3 (Oelde, Alemania), a 10 000 rpm y flujo de salida entre 120 y 200 L/h. La biomasa obtenida fue congelada a -20 °C y secada en el liofilizador Labconco, modelo 18L (Kansas, USA), a una presión de vacío entre 0,022-0,070 mbar. La temperatura del colector fue -56 °C.
La biomasa fue secada mediante la siguiente rampa de temperatura: -15 °C, por 8 h; luego 0,5 °C/min, hasta 5 °C, por 15 h; finalmente, 0,5 °C/ min hasta 25 °C, por 7 h. Las muestras liofilizadas fueron transportadas al Laboratorio de Análisis Instrumental - IMARPE, para los análisis químicos de extracción e identificación de lípidos.
Reactivos
Acetonitrilo grado LC-MS Honeywell Riedel-de- Haën™ (San Luis, EE. UU.); 2-propanol grado LC-MS y cloroformo grado PA J. T. Baker ( EE. UU.); ácido fórmico 98-100% grado LC-MS; amoniaco 25% grado PA; metanol grado LC-MS; agua grado LC-MS y diclorometano grado PA Merck (Darmstadt, Alemania); acetato de leucina encefalina Sigma-Aldrich® (San Luis, EE. UU.) y cloruro de potasio grado PA Scharlab (Senmanat, España).
Equipos
Cromatógrafo líquido acoplado a detector de masas cuadrupolo y tiempo de vuelo Waters Xevo G2-XS QTOF (Wilmslow, Reino Unido); balanza analítica Sartorius MSU225S-000-DU (Gotinga, Alemania); centrífuga refrigerada Eppendorf Centrifuge 5702R (Hamburgo, Alemania); evaporador GlassCol 099A-EV2024S (Terre Haute, EE. UU.); baño de ultrasonido Branson 2510 (Danbury, EE. UU.) y campana extractora de gases LABCONCO 487140016094 (Kansas, EE. UU.).
Extracción de los lípidos totales
Se realizó de acuerdo con la metodología de Folch [7], con modificaciones. Se pesaron 25 mg de la microalga liofilizada y se extrajeron los lípidos con 3 mL de la mezcla de solventes cloroformo-metanol (1:1), la extracción se realizó dos veces. Se utilizó el baño de ultrasonido con hielo, a temperatura aproximada de 4 °C, por 30 min, para mejorar la extracción. Luego, se añadieron 2,1 mL de cloruro de potasio 0,88% (p/v) al extracto. La fase orgánica fue separada y evaporada con nitrógeno gaseoso para obtener el extracto seco de lípidos. Los extractos se almacenaron en vacío y oscuridad durante 14 h y luego fueron pesados para obtener el porcentaje de lípidos totales (%lip) mediante la Ecuación 1.
Donde w es la masa de la muestra (mg) y we es la masa del extracto lipídico seco (mg).
Optimización de los factores de extracción de los lípidos totales
El método estadístico utilizado para la optimización fue el diseño de superficie de respuesta de Box-Behnken con dos réplicas, completamente aleatorizado. Se maximizó la variable respuesta porcentaje de lípidos totales (%lip), con los siguientes factores: masa de la muestra (w), composición del solvente de extracción (S) y tiempo del baño de ultrasonido (t). Los niveles de los factores se muestran en la Tabla 1. Los resultados fueron procesados con el software Minitab 16 y se estableció un nivel de significancia estadística α = 0,05.
Fraccionamiento del extracto de lípidos totales
Los extractos de lípidos se fraccionaron usando la técnica de extracción en fase sólida (SPE), con el cartucho HyperSep C18 de 200 mg. Se acondicionaron los cartuchos con 3 mL de diclorometano, metanol y agua, respectivamente. Se cargaron los cartuchos con el extracto de lípidos y se fraccionaron con 3 mL de agua, metanol-agua (1:1), metanol y diclorometano-metanol (1:1), de modo que se obtuvieron las fracciones F1, F2, F3 y F4, respectivamente.
Las fracciones acuosas F1 y F2 fueron secadas en una estufa de vacío, a 60 °C durante 14 h; mientras las fracciones orgánicas F3 y F4 fueron secadas con nitrógeno gaseoso. Las masas de las fracciones secas fueron utilizadas para calcular el porcentaje de las fracciones lipídicas (%F), utilizando la Ecuación (2).
Donde w es la masa de la muestra (mg) y wF es la masa de la fracción seca (mg).
Identificación de los lípidos polares
Los lípidos polares presentes en la fracción F3 fueron disueltos con 2 mL de 2-propanol, acetonitrilo y agua (2:1:1) y analizados por espectrometría de masas bajo previas condiciones reportadas en la literatura [8], con algunas modificaciones: columna Waters Acquity UPLC BEH C18 2,1 mm x 150 mm, 1,7 µm a temperatura de 55 °C y un flujo de 0,2 mL/min. La fase móvil A: Acetonitrilo-agua (60:40), con 10 mM de formiato de amonio y 0,1% (v/v) de ácido fórmico; la fase móvil B: 2-propanol y acetonitrilo (90:10), con 10 mM de formiato de amonio y 0,1% (v/v) de ácido fórmico. El gradiente de la fase móvil fue 0-2 min, 40-43% (B); 2-2,1 min, 43-50% (B); 2,1-12 min, 50-54% (B); 12-12,1 min, 54-70% (B); 12,1-18 min, 7099% (B); 18-20 min, 99-40% (B) y 20-23 min, 40% (B).
Se utilizaron los modos de ionización ESI(+) y ESI(-) en un rango de masa de 100-1200 m/z (calibrado con formiato de sodio 0,5 mM). Los parámetros de la fuente de ionización fueron: voltaje capilar 2 kV ESI(+) y 1 kV ESI(-), voltaje del cono de 30 V, temperatura de la fuente de 120 °C, temperatura de desolvatación de 550 °C y el flujo de gas de desolvatación de 900 L/h.
El modo de adquisición de los datos fue MSE con energías de colisión de baja energía de 0 V y de alta energía, de 20-40 V. Se utilizó acetato de leucina encefalina 300 ppb para la corrección de la masa: 556,2771 m/z para ESI(+) y 554,2615 m/z para ESI(-). Las masas exactas obtenidas fueron comparadas con las bases de datos de LipidMatch, Lipid Maps, ChemSpider y PubChem para identificar los lípidos. No se hizo distinción en las posiciones sn-1 y sn-2 de los ácidos grasos identificados.
Efecto de los factores del espectrómetro de masas y análisis estadístico
El método estadístico utilizado para la evaluación de los efectos fue el diseño factorial completo 23, con dos réplicas, completamente aleatorizado. Se evaluaron las variables respuestas: área relativa del ion molecular (Arel) y tiempo de retención del ion molecular (tR), con los siguientes factores: pH de la fase móvil (pH), modo de ionización (ESI) y energía de colisión (CE). El área relativa del ion molecular de cada lípido identificado se calculó utilizando la Ecuación 3.
Donde Ai es el área del ion molecular del i-ésimo tratamiento del diseño factorial completo y Aimax. es el área del ion molecular máxima de los tratamientos del diseño factorial completo.
Los niveles de los factores se muestran en la Tabla 2. Los resultados fueron procesados con el software Minitab 16 y se estableció un nivel de significancia estadística α = 0,05.
Resultados y discusión
Optimización de los factores de extracción de los lípidos totales
Los resultados promedio del diseño de superficie de Box-Behnken muestran que los valores del %lip para Np se encuentran entre 41 y 46% (p/p), como se muestra en la Tabla 3. Estos resultados son consistentes con los reportes de la literatura, por ejemplo, el de Xiao-Nian y colaboradores [9]. Lo mismo ocurre para el %lip para Des, que se encuentran entre 8 y 11% (p/p), resultado consistente con los reportes de Ferreira y su equipo [10].
Tabla 3 Diseño de superficie de respuesta de Box-Behnken y resultados del porcentaje de lípidos totales (%lip) de las microalgas N. oceánica (Np) y D. asymmetricus (Des).
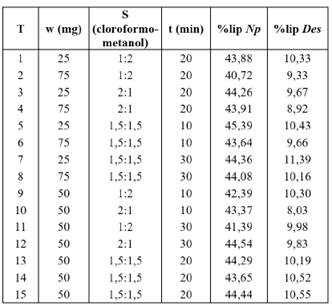
T: Tratamiento, w: masa de la muestra, S: composición del solvente de extracción y t: tiempo del baño de ultrasonido.
La gráfica del porcentaje de lípidos frente a masa de la muestra y composición del solvente de extracción revela una tendencia cuadrática en la superficie, debido a la curvatura formada por los niveles del factor composición del solvente para ambas microalgas analizadas (Figura 2).
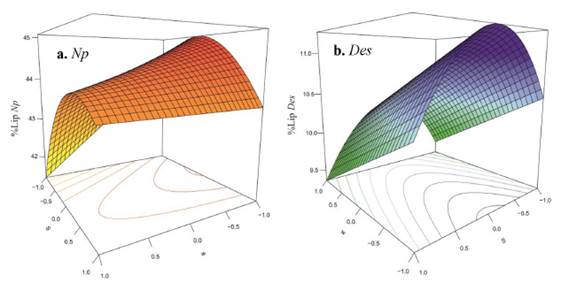
Figura 2 Gráfica de superficie de respuesta del porcentaje de lípidos totales (%lip) de las microalgas N. oceanica (Np) y D. asymmetricus (Des) frente a la masa de la muestra (w), composición del solvente de extracción (S) y el tiempo de baño de ultrasonido (t = 10 min).
La falta de ajuste del análisis de varianza (ANOVA) y los valores de los coeficientes de determinación (R2) para los modelos de regresión propuestos en las Ecuaciones 4 y 5, indican que estas describen adecuadamente la relación funcional entre los factores experimentales y la variable respuesta, valorp > α = 0,05 y R2 > 70%, respectivamente (Tablas 4 y 5).
Tabla 4 ANOVA del diseño de superficie de la microalga N. oceanica (Np).
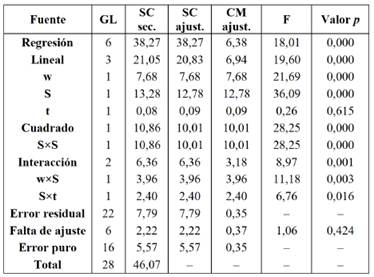
w: masa de la muestra, S: composición del solvente de extracción, t: tiempo del baño de ultrasonido, gl: grados de libertad, SC Sec: suma de cuadrados secuenciales, SC Ajust: suma de cuadrados ajustados, CM Ajust: Cuadrado medio ajustado y F: estadístico F.
Tabla 5 ANOVA del diseño de superficie de la microalga D. asymmetricus (Des).
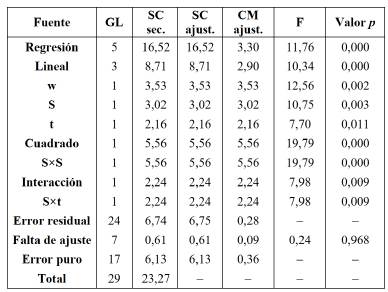
w: masa de la muestra, S: composición del solvente de extracción, t: tiempo del baño de ultrasonido, gl: grados de libertad, SC Sec: suma de cuadrados secuenciales, SC Ajust: suma de cuadrados ajustados, CM Ajust: Cuadrado medio ajustado y F: estadístico F.
Además, los efectos de los términos cuadráticos fueron significativos solo en el caso de la composición del solvente de extracción (valor p < α = 0,05). Los efectos de las interacciones y los términos lineales también fueron significativos (valorp < α = 0,05).
Al optimizar los modelos de regresión se obtuvieron las condiciones máximas de extracción de lípidos totales para las microalgas Np y Des (Tabla 6).
Tabla 6 Valores maximizados de los factores del diseño de superficie de Box-Behnken.
w: masa de la muestra, S: composición del solvente de extracción y t: tiempo del baño de ultrasonido.
La masa de la muestra optimizada corresponde al menor valor del rango seleccionado, posiblemente, debido a que la mayor proporción entre solvente y masa produciría mayor fuerza impulsora de transferencia de masa y, por tanto, mayor difusión de los lípidos [11]. Por otro lado, la composición del solvente de extracción optimizada corresponde, aproximadamente, al valor central del rango seleccionado, que contiene igual cantidad de solvente polar (metanol) y solvente no polar (cloroformo) para ambas microalgas. Este resultado es equivalente al de Ryckebosch y colaboradores [12], donde la composición del solvente que obtuvo el mejor rendimiento de extracción fue la mezcla cloroformo-metanol (1:1). Según este artículo, la mezcla de solventes es más eficiente debido a que la función del solvente polar es liberar los lípidos de los complejos proteínas-lípidos y consecuentemente los lípidos liberados se disuelven en el solvente no polar.
Finalmente, el tiempo del baño de ultrasonido optimizado para la microalga Np fue menor que para la microalga Des, posiblemente, debido a diferencias tanto en la pared celular como en la cantidad de gotas lipídicas. La microalga Des presenta una pared celular gruesa y contiene ornamentaciones (espinas) formadas por la capa más externa, además de los cenobios que se encuentran dispuestos en línea alternada y de cuatro unidades por colonia (Figura 3b).

Figura 3 Microalgas N. oceanica (a) código IMP-BG-Np y D. asymmetricus (b) código IMP-BG-249. BGOA-IMARPE.
Por su parte, la microalga Np solo posee una pared celular lisa, recubierta por una capa exterior consistente en el polímero alifático "algaenan" (Figura 3a) y sería más fácil la ruptura celular en comparación con la primera. Además, los lípidos en la microalga Np se concentran en pocas gotas lipídicas [13], en comparación con la microalga Des, que se encuentran en mayor número [14], lo cual dificulta la extracción, resultado similar a [15], donde explican que al haber mayor cantidad de gotas lipídicas, las interacciones de los complejos proteínas-lípidos serán mayores, lo cual, en últimas, dificulta la extracción.
Fraccionamiento del extracto de lípidos totales
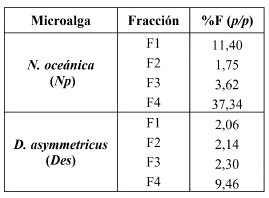
La Tabla 7 muestra que, para Np, los porcentajes de lípidos neutros (F4) y lípidos polares (F3) son aproximadamente 37 y 3%. Al comparar estos resultados con los de Y. Ma y colaboradores [16], en estudios realizados de tres cepas de microalgas Nannochloropsis oceanica, en condiciones controladas de laboratorio, cuyos resultados de lípidos neutros y polares fueron 23-32 y 21-26%, respectivamente, puede inferirse que la microalga Np estudiada ha sufrido estrés por las condiciones de cultivo en el invernadero, pues incrementaron sus niveles de lípidos neutros y disminuyeron los niveles de lípidos polares, efecto similar al reportado por Wei y su equipo [17].
Para la microalga Des, los porcentajes de lípidos neutros y lípidos polares fueron aproximadamente 9 y 2% (Tabla 7). Estos valores son similares a los reportados por Choi y colaboradores [18], en cultivos de la microalga Scenedesmus obliquus, en condiciones de laboratorio, lo cual indica que la microalga estudiada no ha sufrido estrés relevante por las condiciones de cultivo en el invernadero.
Identificación de los lípidos polares
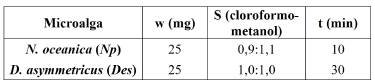
Las comparaciones de las masas exactas de los cromatogramas con las bases de datos en línea permitieron identificar más de 40 lípidos para cada microalga (Tabla 8). Los lípidos identificados fueron: monogalactosil diacilglicerol (MGDG), digalactosil diacilglicerol (DGDG), sulfoquinovosil diacilglicerol (SQDG), monogalactosil monoacilglicerol (MGMG), fosfatidilcolina (PC), fosfatidilinositol (PI), fosfatidilglicerol (Pg), lisofosfatidilcolina (LPC), lisodiacilgliceril-N,N,N-trimetilhomoserina (LDGTS) y diacilgliceril-N,N,N-trimetilhomoserina (DGTS).
Tabla 8 Lípidos polares identificados de las microalgas N. oceanica (Np) y D. asymmetricus (Des), en modo ESI(-).
*Las relaciones masa-carga (m/z) de los lípidos LDGTS y DGTS están en modo ESI(+). N es el número de orden del lípido identificado y tR es su tiempo de retención.
Estos lípidos polares se forman en la ruta bioquímica cuyo intermediario común es el ácido fosfatídico. En el cloroplasto existen dos rutas bioquímicas: una para la formación de los lípidos neutros y otra para la formación de los lípidos polares SQDG, MGDG y DGDG. Caso similar ocurre en el retículo endoplasmático, pero esta vez los lípidos polares formados son los PC, PE, PI y DGTS [2].
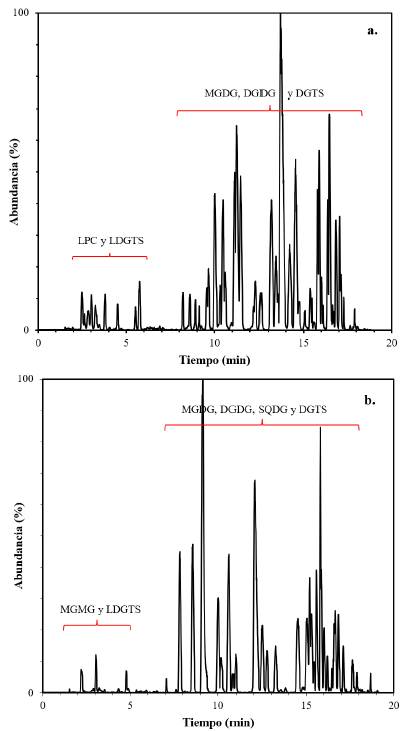
La microalga Des, perteneciente al Phylum Chlorophyta, presentó en su mayoría las clases de lípidos DGDG, MGDG, SQDG, DGTS y LDGTS, con los ácidos grasos 16:0, 16:1, 16:2, 16:3, 16:4, 18:1, 18:2, 18:3 y 18:4. Estos resultados son similares a los encontrados para Dunaliella tertiolecta [21], mientras que no reportaron los lípidos DGTS ni los lípidos que contienen al ácido graso 18:4, para Desmodesmus sp. [22]. Este ácido graso está presente en una amplia variedad de microalgas de este phylum [23] y el lípido DGTS también es abundante en este mismo phylum [24]. Los cromatogramas típicos muestran una adecuada separación de los picos cromatográficos de los lípidos polares y puede apreciarse su intensidad (Figura 4).
Efecto de factores del espectrómetro de masas
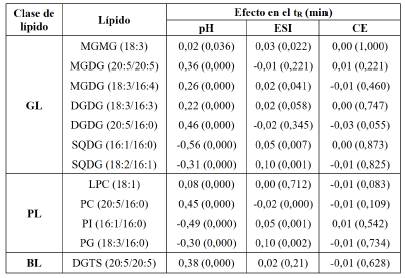
De acuerdo con los resultados de la Tabla 9, al incrementar la energía de colisión se reduce el área relativa del ion molecular, de modo que los lípidos MGMG, MGDG, DGDG, PC y LPC fueron los más fragmentados: su área se redujo entre un 46 y un 77%, aproximadamente; mientras que los lípidos SQDG, DGTS, PI y PG fueron los menos fragmentados: su área se redujo entre un 22 y un 38%. De acuerdo con la jerarquía de estabilidad de los iones moleculares mostrada por Biemann [25], este efecto se debe a los grupos funcionales, en la clase GL y a la presencia del ácido sulfónico del lípido SQDG, con capacidad de formar estructuras resonantes que proporcionan mayor estabilidad al ion molecular, en comparación, por ejemplo, con los lípidos MGMG, MGDG y DGDG, donde el grupo galactosa no tiene esa capacidad. En la clase PL, los lípidos PC y LPC tienen menor estabilidad, debido a la presencia de la amina cuaternaria, en comparación con los lípidos PI y PG que no la tienen. En la clase BL, a pesar de presentar una amina cuaternaria, su mayor estabilidad molecular se debe al grupo éter.
Tabla 9 Efectos principales y valor p del área relativa del ion molecular (Arel) de los lípidos más intensos de cada clase de la fracción F3.
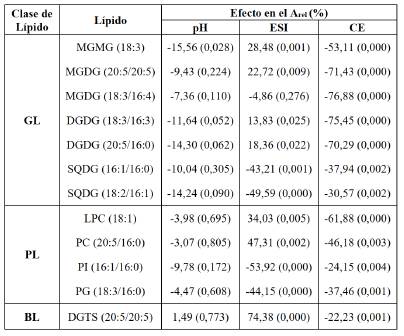
GL: glicolípido, PL: fosfolípido, BL: lípido de betaína, pH: pH de la fase móvil, ESI: modo de ionización y CE: energía de colisión.
El modo de ionización (ESI) presentó efectos en el área relativa del ion molecular de acuerdo con la clase de lípidos. Para la clase GL, el modo ESI(+) incrementa el área relativa del ion molecular de los lípidos neutros MGDG, MGMG y DGDG, debido a que los átomos de oxígeno del grupo galactosil prefieren formar moléculas protonadas [M+H]+, aductos de sodio [M+Na]+, aductos de amonio [M+NH4]+ u otros cationes [4]. Mientras que, en el modo ESI(-), se observa un incremento del área relativa del ion molecular de los lípidos SQDG, debido a la presencia del grupo sulfoquinovosil, cargado negativamente, que forma iones negativos [M-H]-.
De otro lado, para la clase PL, el modo ESI(+) incrementa el área relativa del ion molecular de los lípidos LPC y PC debido a que, durante el proceso de ionización, la amina cuaternaria del grupo colina forma fácilmente la especie [M+H]+, mientras que el anión fosfato puede protonarse [26]. Asimismo, el modo ESI(-) incrementa el área relativa del ion molecular de los lípidos PI y PG, debido a la habilidad del grupo fosfato de cargarse negativamente. Para la clase BL, el modo ESI(+) incrementa el área relativa del ion molecular del lípido DGTS, en un proceso similar al que ocurre para los lípidos LPC y PC.
En todo caso, es importante mencionar que el modo de ionización ESI(-), en conjunto con una energía de colisión alta, permitió identificar los fragmentos de los ácidos grasos liberados. Finalmente, de acuerdo con los resultados, en su mayoría, el efecto del pH sobre el área relativa del ion molecular no fue estadísticamente significativo (valor p > α = 0,05). Estos resultados se muestran en la Tabla 9.
De acuerdo con los resultados de la Tabla 10, el pH tuvo un efecto significativo en el tiempo de retención (valor p < α = 0,05), el mayor efecto positivo fue para el DGDG (20:5/16:0) con 0,46 min y el mayor efecto negativo fue para el SQDG (16:1/16:0) con -0,56 min. Este efecto se debe al carácter ácido y básico de los analitos, considerando que, en cromatografía de fase reversa, al aumentar el pH en la fase móvil, la especie ácida estará más ionizada y, por tanto, su tiempo de retención será menor; mientras que la especie básica estará menos ionizada y su tiempo de retención será mayor [27]. Estas desviaciones concuerdan con nuestros resultados, ya que los lípidos SQDG, PI y PG tienen carácter ácido y los lípidos MGMG, MGDG, DGDG, LPC, PC y DGTS tienen carácter básico [28]. Con respecto al efecto del ESI y el CE, puede apreciarse que son de un orden de magnitud menor que el efecto del pH y, por tanto, no se consideraron relevantes.
Conclusiones
De acuerdo con nuestros resultados, los factores más relevantes en la extracción de lípidos totales fueron la masa de la muestra y la composición del solvente de extracción; mientras el tiempo del baño de ultrasonido estuvo influenciado por el tipo de microalga y, por tanto, se recomienda utilizar los siguientes factores maximizados: 25 mg / 3 mL de solvente, cloroformo-metanol (1:1) y 30 min para la microalga Desmodesmus asymmetricus; y 25 mg/3 mL de solvente, cloroformo-metanol (0,9:1,1) y 10 min para la microalga Nannochloropsis oceanica.
Finalmente, los factores más relevantes para la detección del ion molecular de los lípidos polares fueron la energía de colisión y el modo de ionización. El tiempo de retención estuvo influenciado principalmente por el pH de la fase móvil, con un efecto máximo de ± 0,6 min. Los factores óptimos para la identificación de los lípidos polares dependen de la clase de lípido y deben ser establecidos antes de su estudio.