Introducción
La estrategia primaria de las plantas para sobrevivir a sus cambios fisiológicos y a las condiciones estresantes del medio ambiente en el que se encuentran es la síntesis de proteínas y azúcares protectores [1]. Entre estos azúcares se encuentran los fructanos, polímeros de fructosa que se construyen a partir de una molécula de sacarosa inicial, donde el residuo de glucosa puede ser terminal o interno [2]. Los fructanos de las plantas son sintetizados a nivel vacuolar, en diferentes tejidos de la planta, y, normalmente son almacenados en estructuras especializadas para funcionar como reserva de carbono Estos carbohidratos asociados con la tolerancia a diferentes tipos de estrés, actúan como osmoprotectores ante condiciones adversas por calor, frío, o estrés hídrico, entre otros [3,4].
Los fructanos se encuentran en numerosas especies mono y dicotiledóneas de importancia económica tales como la cebolla, el ajo, el trigo, la caña de azúcar, y, los agaves, entre otras. Se han propuesto como un elemento con potencial biotecnológico en la utilización de fibras dietéticas solubles y edulcorantes de bajo contenido calórico, lo cual es de alta importancia para la salud humana [5,6].
La hidrólisis de estos carbohidratos se realiza con exohidrolasas fructosílicas (FEH), las cuales son enzimas que retiran los residuos de fructosa terminales [7,8]. El estudio de estas enzimas en la planta Agave tequilana Weber var. azul, una planta de uso tradicional en México en la producción de tequila, ha sido muy escaso [9]. Las FEH intervienen en el metabolismo de plantas cuando estas requieren grandes cantidades de energía durante diferentes procesos fisiológicos bajo condiciones de estrés [10] o para defenderse [11].
Las hidrolasas glicosídicas (GH 32) constituyen la familia a la que pertenecen las exohidrolasas fructosílicas, enzimas que contienen secuencias de aminoácidos altamente conservadas [12]. Algunas investigaciones han profundizado en la presencia de secuencias de aminoácidos similares, así como la conservación de patrones de expresión para distintas enzimas de la familia. Por ejemplo, la elucidación de las estructuras 3D de una exohidrolasa fructosílica de Cichorium intybus (Asteraceae) [13], una invertasa de pared celular de Arabidopsis thaliana (Brassicaceae) [14] y una fructosiltransferasa de Pachysandra terminalis (Buxaceae) [15], han demostrado poca variación entre las secuencias codificantes para dichas enzimas. Esto resulta interesante porque se podría extrapolar a las exohidrolasas fructosílicas de Agave tequilana (Asparagaceae).
Esta revisión describe características del metabolismo de los fructanos, las enzimas implicadas en el proceso y la importancia en el A. tequilana Weber var. azul, uno de los cultivos más importantes en México. Asimismo, se expone el aporte que tiene la caracterización de las exohidrolasas fructosílicas de agave como un elemento, que puede ser usado como marcador fisiológico de la planta y como elemento potencial para fines biotecnológicos.
Características del género Agave
La subfamilia Agavaidae de la familia Asparagaceae, endémica de América, está constituida por plantas monocotiledóneas, con hojas dispuestas en roseta a lo largo del tallo, que en la mayoría de las especies es un tallo acaule [16]. Se distribuye desde el sur de los Estados Unidos hasta Venezuela y Colombia. Está conformada por nueve géneros y 340 especies [17]. La mayor diversidad y riqueza de esta subfamilia se encuentra en México, donde se han reportado hasta 261 especies (75% del total), 177 son endémicas (70%) [18]. El género más grande y diverso dentro de este grupo es el Agave, con 159 especies, de las cuales 119 son endémicas de Méxicon (74% de las especies) [19].
La capacidad de acumular agua en las hojas gruesas y suculentas hace que el género Agave sea especialmente adecuado para la aridez [20]. Los agaves, o magueyes, como también se los conoce, son plantas perennes. Las hojas tienen la base dilatada y carnosa. Las hojas de los magueyes pulqueros llegan a pesar hasta treinta kilogramos. En A. tequilana se ha reportado un valor medio para el agregado de bases de las hojas (piña) de 50 kg registrando un valor mínimo de 41 kg y un valor máximo de 60 kg con una desviación media de 6,6 kg [21]. Con respecto a algunas propiedades medicinales del género, se han aislado esteroles, sapogeninas esteroidales, alcaloides esteroideos, aminas alcaloideas y flavonoides de algunas especies de agave, como en A. sisalana [22] de las que se han demostrado efectos antiinflamatorios, antioxidantes, antimicóticos, antibacterianos, antivirales y con actividades gastroprotectoras [23,24].
Se sabe que estas plantas acumulan cantidades de carbohidratos como los fructanos (13% y 17% del peso fresco total) y tienen aplicaciones comercialmente importantes como material de refuerzo para matrices poliméricas, componente de placas para reforzar las construcciones y evitar el ataque por termitas; también se estima su posible uso como sustrato en la producción de hortalizas en invernadero. El residuo de materia de agave, después de extraído su jugo, contiene una abundante biomasa lignocelulósica e hidratos de carbono y suele ser una materia prima potencial para la producción de biocombustibles [25,26]. Además, el bagazo de A. tequilana, también se ha utilizado en la recuperación de compuestos de interés para las industrias farmacéutica y alimentaria, incluidos excipientes como emulsionantes, estabilizantes y diluyentes, entre otros [27,28].
Por otro lado, el género ofrece el mayor potencial para ser utilizado más ampliamente como cultivo en ambientes secos y muy calientes [29]. En el suroeste de los EE.UU., México y América Central sobre todo en climas secos y cálidos, varios grupos indígenas precolombinos obtuvieron alimentos, bebidas, fibra, medicamentos y otros productos vitales de varias especies del género Agave, como estrategia para persistir a pesar de vivir bajo condiciones ambientales extremas [30]. En México, los agaves han brindado una serie de recursos para la población durante años, y constituyen un elemento importante de la diversidad biocultural del país [31,32].
Diferentes especies del género Agave tienen diversos usos [33], sobre todo en la producción de bebidas [34] tales como el tequila (A. tequilana Weber var. azul) [30], el mezcal [35] y el pulque (A. salmiana var. salmiana) [36]. El aguamiel (savia que contiene el cogollo de la planta) se ha utilizado como edulcorante; cuando se fermenta, esta savia se convierte en el pulque, aceptado copiosamente debido a sus beneficios nutritivos, porque presenta varios aminoácidos esenciales, vitaminas y mineral [37].
Importancia industrial de Agave tequilana Weber var. azul
El tequila es una de las bebidas alcohólicas más consumidas en México. En el siglo XX, la producción industrial tequilera creció y, con ello, una marcada preferencia por su elaboración con el agave azul (A. tequilana var. azul). El tequila es el producto industrial de mayor fabricación, que se obtiene a partir de esta variedad en México. La ventaja del uso de esta especie está dada porque tiene un ciclo de vida más corto y contiene mayor contenido de azúcares, en comparación con otras variedades tradicionales como "Sigüín", "Chato", "Bermejo", "Pata de Mula", "Zopilote" y "Mano Larga", entre otros [30]. Desde 1974, se estableció la denominación de origen del tequila [38], según la cual solo se puede producir a partir de la variedad "azul" y en una determinada área geográfica, que actualmente comprende cinco estados de la República Mexicana: Jalisco (primer productor de agave), Guanajuato, Michoacán, Nayarit y Tamaulipas [39]. El mercado del tequila ha tenido un crecimiento paulatino (de 104 a 253 millones de litros) de 1995 a 2012 [40].
Durante la fermentación del tequila, a partir de los azúcares del agave, los jugos se convierten, principalmente, en etanol, biomasa y bajas cantidades de metabolitos del aroma, responsables de las cualidades sensoriales del producto. En la fermentación, los cultivos por lotes son, tradicionalmente, los más utilizados para obtener tequila [41]. En el estado de Jalisco, el "agave azul" también se ha empleado comercialmente para producir inulina (prebiótico, proveniente de la fructosa) y para la producción de jarabe de agave [42]. En la madurez de la planta, el contenido de inulina del tallo y de la piña, es más elevado que en otras etapas de su desarrollo [43].
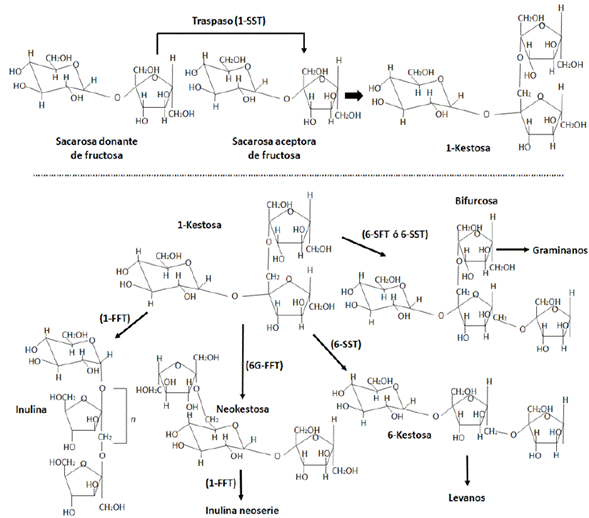
Figura 1 Síntesis de fructanos. La 1-kestosa es formada cuando una molécula de sacarosa (donante) traspasa su residuo de fructosa al residuo de fructosa de otra sacarosa (aceptora) mediante la enzima 1-SST. Luego, a partir de la 1-kestosa se pueden formar los siguientes fructanos: inulina con mayor grado de polimerización por la enzima 1-FFT; neokestosa por la enzima 6G-FFT, la cual es polimerizada seguidamente por la enzima 1-FFT para formar fructanos del tipo inulina neoserie; 6-kestosa por la enzima 6-SST, trisacárido precursor de los levanos; y la bifurcosa con la participación de las enzimas 6-SFT o 6-SST, trisacárido precursor de los fructanos tipo graminanos.
La presencia de fructanos en el agave fue registrada por primera vez en 1888 [44], fueron descritos inicialmente como "inulinas". Además, debido a su similitud con los fructanos β(2-1), a su complejidad estructural y heterogeneidad, se propuso que a las inulinas se les denominara agavinas [45]. La elucidación de la estructura de las agavinas, así como el análisis de los fructanos y oligo-fructanos como fibras solubles y prebióticas presentes en agaves, les confiere propiedades alimentarias aprovechadas por el hombre. Lo anterior explica también, porqué el pulque, a pesar de su alto contenido alcohólico, se ha conservado a través de los años como una bebida nutricional [36].
Hasta ahora no han sido exploradas las características moleculares de las enzimas degradadoras de fructanos en el agave, lo cual facilitaría un mayor aprovechamiento de este recurso y, a su vez, se obtvendrían beneficios en la industria tequilera.
Síntesis y características moleculares de los fructanos
Los fructanos tienen función biológica como reserva de carbohidratos, participan en la osmoprotección, en la tolerancia al frío, y evitan la afectación por sequía y salinidad en la planta [46,47]. Además, se clasifican como fibras dietéticas solubles que pueden ser altamente aprovechadas por el ser humano [48]. Se ha demostrado que la oligofructosa, un producto de la hidrólisis enzimática parcial del fructano, contribuye al control del peso corporal, favorece la reducción del colesterol sérico total y la glucosa en modelos animales y promueve la saciedad [45].
Los fructanos se sintetizan y almacenan en las vacuolas celulares [49,50] con la participación de al menos dos fructosiltransferasas diferentes. La síntesis de 1-kestosa (Figura 1), el fructano tipo inulina más simple, resulta del traspaso del residuo de fructosa de una molécula de sacarosa (donante) al residuo de fructosa de otra sacarosa (aceptora) mediante la formación de un enlace β(2-1) entre ambos residuos. Tal actividad es realizada por la enzima sacarosa:sacarosa 1-fructosiltransferasa (1-SST) [51], responsable de este paso inicial. La 1-kestosa formada puede seguir diferentes vías; puede elongarse en el sentido β(2-1), por la acción de la fructano:fructano 1-fructosiltransferasa (1-FFT) [52] para dar origen a fructanos tipo inulina de mayor grado de polimerización (Figura 1). La enzima 1-FFT transfiere el residuo de fructosa de un fructano y lo pasa a otro fructano.
Por otra parte, la 1-kestosa puede ser convertida en otro trisacárido, la neokestosa, la cual es formada por la participación de una segunda enzima fructano:fructano 6G-fructosiltransferasa (6G-FFT) [53]. Esta enzima cataliza la hidrólisis de un residuo fructosílico de la 1-kestosa, para transferirlo al carbono 6 de la glucosa de la molécula de sacarosa. Posteriormente, la neokestosa puede ser polimerizada por la enzima 1-FFT para dar origen a los fructanos de tipo inulinas neoseries.
La enzima sacarosa:fructano 6-frutosiltransferasa (6-SFT) [47] o posiblemente una enzima del tipo sacarosa:sacarosa 6-fructosiltransferasa (6-SST) [54] pueden dar un camino diferente a la 1-kestosa formada, ya que estas pueden transferir el grupo fructosilo de 1-kestosa a otra 1-kestosa, mediante la formación de un enlace 3(2-6) entre residuos de fructosa para formar el tetrasacárido bifurcosa, el cual es el precursor de los fructanos graminanos o mixtos. La 6-kestosa es otro de los trisacáridos de menor peso molecular, este es el precursor de los fructanos tipo levanos o fleinas, y es formado por la enzima 6-SST, la cual se cree que funciona como elongadora de la cadena fructosílica (Figura 1).
Las investigaciones recientes demuestran que para la síntesis de fructanos de tipo inulinas son suficientes las enzimas 1-SST y 1-FFT [55], en tanto que para la síntesis de levanos, sería necesaria la participación de las 6-SST o 6-SFT [51]. Para formar fructanos más complejos, como los graminanos o las inulinas neoseries, es necesaria la participación de al menos tres enzimas, en tanto que para fructanos como los de agave (agavinas) que contienen una mezcla de estructuras con cadenas lineales y ramificadas β(2-1) y β(2-6), sería de esperarse que participe un número mayor de enzima. Se ha considerado que serían necesarias las enzimas 1-SST, 6G-FFT, 1-FFT, 6-SST [55]. Sin embargo, solo se han caracterizado a nivel funcional las dos primeras, se ha reportado en bases de datos la secuencia codificante para 1-FFT y aún está pendiente determinar la presencia de la enzima tipo 6-FFT.
En la Figura 2 se muestra la representación molecular de las diferentes bases de los fructanos. Estos se clasifican según el enlace entre los residuos de fructosilo y la glucosa en el grupo seis. Se denominan del siguiente modo:
a) Inulina es el polímero lineal de unidades D-fructosa con enlaces β(2-1) y una glucosa en el extremo, característicos de las asteráceas, como Cichorium sp. (achicoria) y Helianthus tuberosus L. (alcachofa de Jerusalén) [56,57].
b) Levanos, son los que presentan residuos de fructosilo unidos por enlaces β(2-6), su unidad estructural es la 6-Kestotriosa, abundantes en las Poaceae (pastos), como Phleum pretense L. (timothy grass) y Lolium perenne L. (ryegrass perenne) [2,58,59].
c) Graminanos, son los fructanos con estructuras ramificadas con bifurcosa como unidad básica, contienen enlaces tanto β(2-1) como β(2-6), que se encuentran en el trigo y la cebada, y en algunos miembros del orden Asparagales [60,61].
d) Neoseries de inulina que se forman por adiciones de fructosa a uno o ambos extremos de la 6G-kestotriosa mediante enlaces β(2-1), características de la cebolla y el espárrago [62].
e) Neoseries de levanos con enlaces tanto β(2-1) como β (2-6), que se encuentran en la avena y algunas especies de Poales. Las neoseries de levanos también se definen como unidades de fructosa lineales o ramificadas con enlaces β(2-1) y β(2-6) (Figuras 1 y 2) [2].
f) Agavinas que tienen enlaces β(2-1) y β(2-6) en fructanos y neofructanos graminales ramificados, característicos de los géneros Agave sp. y Dasylirion Zucc [58].
Se estima que varios tipos de fructanos representan más del 80% del peso seco de las plantas de agave [64], incluyendo inulinas [25] y fructo-oligosacáridos [65]. Se han encontrado fructanos con enlaces β(2-1) y β(2-6) con valores promedio de grado de polimerización (DP) que dependen de la especie de Agave [66] que van desde DP 3 a DP 30 [67]. Los que presentan un DP 3 hasta DP 6, se utilizan como prebióticos, mientras que los que poseen un DP superior a 15, se requieren para varios procesos de fermentación para la producción de bebidas alcohólicas y bioetanol a partir de mosto de varias especies de Agave [67,68]. De ahí que los fructanos sean demandados por la industria alimentaria como mejoradores de la consistencia y textura de los alimentos, por su valor prebiótico y como estimuladores del sistema inmunológico [69].
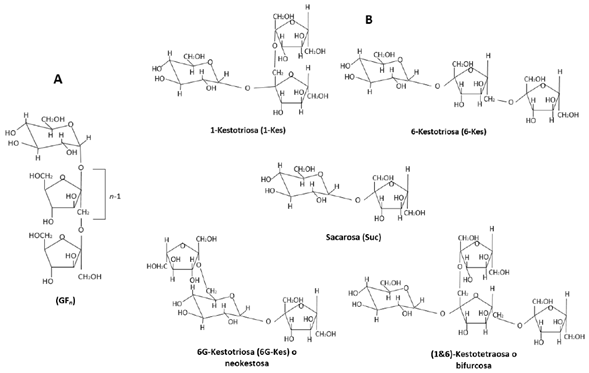
Figura 2 Representación molecular de las bases de los fructanos. (a) con una molécula terminal de glucosa (3-D glucopiranosil), GFn: Glucosa-Fructosa (modificado de [63]). (b) Unidades estructurales: Las kestotriosas se forman por la transferencia de una b-fructosil-transferencia a cualquiera de los hidroxilos primarios de la sacarosa. El tetrasacárido ramificado, bifurcosa, se genera por transferir una fructosa a una kestotriosa (modificado de [57]).
Aunque hay pocos estudios disponibles sobre los factores responsables de la acumulación de fructanos en el agave, algunos trabajos sugieren que podría estar relacionado con la edad de la planta, el estrés hídrico y las hormonas vegetales asociadas a las respuestas al estrés [70]. Se ha documentado que los valores de DP de los fructanos producidos por A. tequilana están relacionados con la edad de la planta, por ejemplo, los fructanos de peso molecular más bajo (DP 3 - DP 6) se producen antes de los 2 años y después, entre los 4 y 6 años, los valores de DP comienzan a aumentar. A los 6 años de la planta los valores se comportan en el rango de DP 3 a DP 30 [67].
Sumado a los intentos realizados para mejorar la concentración y el DP de fructanos en las plantas de agave mediante la optimización de las condiciones de cultivo, existe un interés creciente en la aplicación de estrategias desarrolladas por la ingeniería genética. Por otro lado, se han realizado avances en el conocimiento de las vías metabólicas de síntesis de fructanos en las plantas a partir del estudio de determinadas enzimas, como las hidrolasas glicosídicas [8,71].
Enzimas hidrolasas glicosídicas en plantas
Las hidrolasas glicosídicas son enzimas que se dividen en más de 100 familias según su estructura general. La familia 32 de las enzimas hidrolasas glicosídicas (GH 32) en plantas incluye diferentes hidrolasas (invertasas de la pared celular, exohidrolasas fructosílicas e invertasas vacuolares) y fructosiltransferasas, entre otras [72]. Se ha demostrado que estas enzimas desempeñan funciones únicas en diversos procesos biológicos en las plantas, como la biosíntesis de glucanos, el metabolismo de la pared celular, la defensa, la señalización y la movilización de las reservas de almacenamiento. Los análisis bioquímicos y moleculares han indicado que estas enzimas son muy similares a nivel estructural, sin embargo, son funcionalmente diferentes.
Diferentes estudios demuestran que dentro de la familia GH 32, unas enzimas evolucionaron a partir de otras [73]. En ese sentido, se ha propuesto que las invertasas vacuolares tuvieron un proceso evolutivo hacia fructosiltransferasas, mientras que las invertasas de la pared celular dieron origen a las exohidrolasas fructosílicas [74]. La familia de las hidrolasas glicosídicas presentan secuencias aminoacídicas altamente conservadas, entre éstas se encuentran aquellas que forman parte del sitio catalítico, la caja de unión a la sacarosa, el motivo FRD y el motivo WECVD (Figura 3A). Cabe mencionar que existe poca variación entre estos; en invertasas la caja de unión a sacarosa está generalmente conservado con el consenso DPNG, en tanto que la mayor variación de este sitio se presenta en fructosiltransferasas (N/S/A/GDPNG/A) [70] (Figura 3A). Estructuralmente, la conformación tridimensional de las enzimas de la familia GH 32 constan principalmente de láminas beta que engloban dos grandes dominios; uno de barril, en el que coinciden los tres motivos mencionados y que conforman el sitio catalítico y un dominio de propela (Figura 3B).
Las exohidrolasas fructosílicas (FEH), en la planta de Cichorium intybus (achicoria) por ejemplo, están involucradas en la degradación de los fructanos [43]. Por otra parte, se ha reportado la expresión de los genes para las enzimas 1-FFT y FEH en A. tequilana Weber var. azul en plantas de 2 años porque hay una menor producción de fructanos. Se ha demostrado la función activa de las enzimas 1-SST y de 1-FTH cuando la planta entra a su etapa más madura de desarrollo (entre los 5 y 7 años de edad), lo cual está relacionado con el incremento posterior de carbohidratos [71]. Esta última afirmación sugiere que la edad de la planta está relacionada con la expresión de los genes involucrados en la síntesis de las enzimas 1-FTH y FEH. Entonces, si se requiere conocer los genes relacionados con las enzimas degradadoras de fructanos en A. tequilana, datos que hasta la fecha no se conocen, se debe considerar el período más adecuado durante el crecimiento y desarrollo de la planta para tomar muestras de tejidos y proceder al aislamiento y expresión del ARN.
Las especies de gramíneas mencionadas anteriormente (Poales) y A. tequilana (Asparagales) no son especies hermanas, pero ambas son monocotiledóneas; también se sabe que, evolutivamente, especies o grupos cercanamente relacionados tienden a poseer similares formas de expresión de los genes y, por ende, codificar para las mismas enzimas o enzimas altamente similares. Lo anterior sugiere que de alguna manera debe haber enzimas involucradas en la degradación de los fructanos de A. tequilana, de modo similar a como ocurre en el resto de las monocotiledóneas. Hasta el momento pocos estudios en el género Agave hablan sobre el funcionamiento de estos mecanismos y, por lo tanto, se requiere posterior investigación en este ámbito.
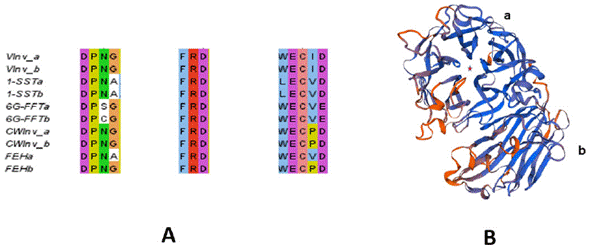
Figura 3 Alineamiento de algunas enzimas de la familia GH 32 de A. tequilana y modelado estructural de una putativa exohidrolasas fructosílicas de A. tequilana (Acc. KR138454) utilizando como templado una estructura de una invertasa de pared celular (2qqw. 1A) reconstruida mediante la plataforma Swiss-model (https://swissmodel.expasy.org/). (A) Alineamiento de las regiones que conforman el sitio catalítico, la caja de unión a sacarosa está constituida por la firma DPNG (AFJ21581.1 VInv_a, AFJ21580.1 CWInva, AFJ21579.1 6G-FFTa, AFJ21578.1 6G-FFTb, AFJ21577.1 1-SSTa, AFJ21576.1 1-SSTb, AFJ21575.1 VInv_b, AFJ21574.1 CWInvb, KR138455.1 FEHa, KR138454.1 FEHb). (B) a) dominio de barril donde se encuentra ubicado el sitio catalítico (representado por una estrella roja al centro) y b) dominio de propela.
Exohidrolasas fructosílicas y su relación con A. tequilana Weber var. azul
En bacterias y hongos, las FEH pueden dividirse en dos tipos, considerando la degradación de fructanos: exohidrolasas o endohidrolasas. Las exohidrolasas rompen el enlace terminal en los fructanos para liberar fructosa, mientras que las endohidrolasas producen oligosacáridos más pequeños al realizar cortes dentro de los fructanos [75]. Esto quiere decir que las exohidrolasas escinden el extremo β(2-1) no reductor del fructano, liberando fructosa, mientras que las endohidrolasas rompen aleatoriamente los enlaces internos del fructano [76]. Sin embargo, en plantas no hay reportes de endohidrolasas fructosílicas. La fructosa liberada es importante, así como los oligosacáridos, ya que tienen diversas aplicaciones en la medicina, la elaboración de alimentos o bebidas procesadas, y la producción de bioetanol [61,77,78].
Las FEH de las plantas liberan secuencialmente los residuos de fructosa terminal a partir del fructano, hasta dejar fructanos de bajo DP, o bien, la sacarosa inicial [79]. En las monocotiledóneas de la familia Poaceae se han descrito dos isoformas de FEH; la 1-FEH (EC 3.2.1.153) [80] y la 6-FEH (EC 3.2.1.154) [81] que se sabe que hidrolizan los fructanos con enlaces β(2-1) y β(2-6) respectivamente [82]. En la achicoria, una especie dicotiledónea, se han clonado y caracterizado a nivel funcional tres diferentes enzimas de FEH (Ci1-FEH, CI1-FEHIIA y Ci1-FEHIIB) [21], [83], todas encargadas de la hidrólisis de enlaces tipo β(2-1).
Asimismo, en la alcachofa de Jerusalén, otra dicotiledónea, se han caracterizado dos isoformas que hidrolizan enlaces del mismo tipo: Ht1-FEH (Ht1-FEH I y Ht1-FEH II) [61] cabe mencionar que en estas dos especies se producen fructanos del tipo inulina, por lo que tales polímeros solo contienen enlaces de tipo β(2-1). En algunas especies como Arabidopsis thaliana y Beta vulgaris L. (remolacha) se han clonado enzimas con actividad FEH, pero resulta interesante que ninguna de estas especies produce ni almacena fructanos, por lo que se sugiere que se presenta como una posible respuesta al ataque de patógenos como hongos, que pudieran producir fructanos durante el proceso infectivo [61,81].
El estudio y análisis a nivel molecular y bioquímico de las FEH de plantas tuvo un repunte en los últimos 20 años, con el que fue posible la identificación y clonación de algunos componentes del trigo, achicoria y alcachofa, por mencionar algunos. A partir de estos estudios, se analizó la capacidad de despolimerización de estas, así como su posible función ante diferentes condiciones ambientales [84]. En las especies del género Agave, en A. tequilana principalmente, los esfuerzos de búsqueda de estos genes fueron fallidos por muchos años. No fue sino hasta la aplicación de las tecnologías de secuenciación masiva mediante análisis transcriptómicos en esta y otras especies del género cuando se identificaron los primeros elementos génicos putativos codificantes para este tipo de enzimas (KR138454 y KR138455) (NCBI: National Center for Biotechnology Information). Debe mencionarse que la actividad de FEH en A. tequilana ya había sido identificada previamente a nivel bioquímico [51]. Se sabe, por ejemplo, que los genes de síntesis y de hidrólisis de carbohidratos tienen expresión un tanto antagónica, mientras los primeros se expresan durante las fases de desarrollo, los segundos son expresados durante la fase de consumo; mientras los de síntesis se expresan bajo condiciones óptimas y los segundos se expresan bajo condiciones de estrés [9].
Los fructanos en A. tequilana presentan diferentes grados de polimerización en función de las etapas de desarrollo. Durante los primeros dos años de cultivo, la mayor proporción de fructanos presentes en sus tejidos son de bajo DP, mientras que éste aumenta conforme la edad de la planta [67]. Asimismo, la actividad hidrolítica aumenta cuando se hace más necesario el uso de energía. En la etapa de floración es de esperarse el máximo consumo de los fructanos almacenados por los agaves, y por ende cuando se precisa la mayor actividad de las FEHs; de acuerdo con Mellado-Mojica y colaboradores [51] existe un incremento en la degradación de los fructanos entre los 6 años, disminuyendo a los 7 años, de acuerdo con los estados de madurez de la planta.
Bajo condiciones de estrés ambiental, se sabe que las FEH desempeñan un papel primordial en el suministro rápido de los carbohidratos necesarios para el ajuste endosmótico de crecimiento. Se ha sugerido que las FEHs podrían intervenir en el DP, la estructura molecular y los patrones de distribución de los fructanos en respuesta a la demanda de energía para el desarrollo vegetativo o para modular la acumulación de fructanos en las vacuolas de las plantas maduras [81], [85]. Estudios han demostrado que las FEHs en la planta de A. tequilana podrían cumplir funciones fundamentales en su desarrollo [51], ya que las FEHs en otras monocotiledóneas rápidamente liberan cantidades masivas de fructosa, lo que reduce el potencial osmótico y contribuye a la entrada de agua y la apertura de las flores [83].
Los componentes genéticos moduladores del metabolismo de los fructanos en los agaves podrían ser muy diversos. Al ser los agaves elementos especializados en la síntesis de estos carbohidratos no es raro que se identifiquen elementos génicos duplicados o isoformas de este tipo de enzimas como ha ocurrido para fructosiltransferasas de A. tequilana, se considera que en promedio, entre tres a cuatro enzimas están involucradas en su metabolismo. La vía catalítica, por su parte, también podría contener al menos dos elementos, 1-FEH y 6-FEH, y aunque hay evidencias informáticas de su existencia, aún falta corroborar su función mediante algún sistema de expresión heterólogo.
Como se comentó, los fructanos pueden localizarse en los órganos de la superficie como las hojas y las flores abiertas [61]. También pueden encontrarse en las vacuolas [11,61]. Lo anterior sugiere que, en las hojas de la planta de agave y durante la floración, podrían clonarse genes que codifican para exohidrolasas fructosílicas, posiblemente, por la alta actividad fotosintética que estas realizan y la constante división celular, respectivamente.
Los genes de síntesis para la hidrólisis de fructanos son susceptibles de aplicaciones biotecnológicas, algunas alternativas han sido abordadas por [86]. En particular, estos últimos representan un área de oportunidad en diferentes sectores de la industria, principalmente, en la producción de tequila, puesto que la adición de FEHs de agave, generadas a través de las tecnologías de ADN recombinante, podrían actuar como un optimizador de los procesos de fermentación de aquellos polímeros que no son degradados mediante hidrólisis ácida, y, con ello, aumentar los rendimientos de producción de etanol, de manera similar a la ya abordada por [87]. Cada orden taxonómico en las plantas muestra sustituciones únicas de aminoácidos en las hidrolasas glicosídicas que pueden estar relacionadas con la cantidad y el tipo de fructanos que podrían extraerse de ellos y el agave no es la excepción.
Existe la posibilidad de realizar estudios enfocados en la optimización de codones como una herramienta poderosa para la transformación heteróloga de los genes en vectores (bacteria o levadura), que codifican para dichas enzimas en plantas, lo que sería muy aprovechado en cultivos económicamente importantes como el agave. Por otra parte, el análisis adecuado de los patrones de expresión de las FEH de las plantas de agave, podría ser un indicador de madurez fisiológica, que podría apoyar en un mejor manejo agronómico de las plantaciones.
Perspectivas
En la literatura hemos encontrado datos significativos para la investigación de las exohidrolasas fructosílicas en la planta modelo A. tequilana, y siguiendo el planteamiento de algunos autores para otras plantas monocotiledóneas, lo que da pauta para investigar el tiempo más idóneo durante el desarrollo y crecimiento de la planta de agave para realizar estudios de los genes relacionados con las exohidrolasas y su expresión, así como los tejidos en los que pueden encontrarse con mayor facilidad. A pesar de que se ha demostrado experimentalmente la presencia de estas enzimas como degradadoras de fructanos en otras especies de monocotiledóneas de interés económico, no hay evidencias de que las exohidrolasas sean capaces de degradar los fructanos en los estudios en A. tequilana Weber var. azul.
Esto representa un punto de partida para futuras investigaciones, en las que se requiera caracterizar molecular, estructural y funcionalmente, al menos una posible exohidrolasa en dicha planta, lo cual traería muchos beneficios biotecnológicos a diferentes niveles.
El estudio de las exohidrolasas fructosílicas en el género Agave podría ser de utilidad y derivar en varias aplicaciones biotecnológicas, por ejemplo, en la hidrólisis de estructuras de fructanos no digeridos durante la etapa de cocción del agave en la producción de tequila, lo que incrementaría y facilitaría su producción. Por otro lado, el uso de las tecnologías del ADN recombinante es una herramienta excelente para este propósito, sin embargo, el primer paso es comprender la funcionalidad de estas enzimas, lo que podría facilitar la incorporación de estas en diferentes procesos industriales.
Conclusiones
Las exohidrolasas fructosílicas son enzimas que están presentes en diversas monocotiledóneas como las pertenecientes al género Agave. Tienen importante función en la ruptura de los enlaces que los fructanos presentan, ya que se encargan de liberar secuencialmente residuos de fructosa terminales, los que pudiera beneficiar la obtención de energía durante la reproducción y los cambios climáticos a los que se enfrentan las plantas, entre algunos otros. Estas enzimas podrían ser aprovechadas por la industria, por ejemplo, en la planta de A. tequilana Weber var. azul, durante la fermentación para la producción de tequila, donde ocurre una hidrólisis de fructanos no desnaturalizados por cocción. Lo anterior cobra importancia ya que al conocer las características y cómo intervienen tales enzimas en el metabolismo de la planta, se facilitaría un mejor aprovechamiento de los fructanos en la fermentación durante la producción industrial de tequila. Sin embargo, el reto actual más importante es investigar si las exohidrolasas son capaces de degradar los fructanos del agave o no.














