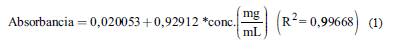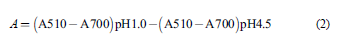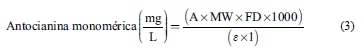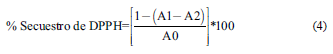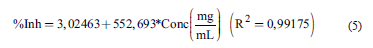Introducción
Las plantas han jugado un importante rol como parte de la atención primaria de salud, sobre todo, en los países en vía de desarrollo. Dentro de las que han sido ampliamente utilizadas se encuentra la especie H. sabdariffa (flor de Jamaica), planta con atractivas flores que se distribuye en regiones tropicales y subtropicales de todo el mundo y es oriunda de Malasia e India [1]. Los cálices de H. sabdariffa destacan por su contenido en compuestos fenólicos tales como flavonoides (quercetina y kaempferol), antocianinas (delfinidina y cianidina) y ácidos fenólicos (ácido protocatéquico, ácido clorogénico, ácido hibiscus) [1, 2]. Las antocianinas son compuestos químicos que se encuentran incluidos en la familia de los flavonoides; son pigmentos solubles en agua que reflejan la luz del rojo al azul en el espectro visible [3]. En la actualidad ha crecido el interés por el estudio de los compuestos fenólicos, debido a las propiedades farmacológicas y terapéuticas que se les adjudica, tales como la reducción de problemas cardíacos, efectos anticancerígenos, antiinflamatorios, antioxidante, antidiabéticos, contra la obesidad, entre otros [1, 4].
Los métodos más citados en la literatura para la extracción de los compuestos fenólicos y en particular de las antocianinas presentes en los cálices de H. sabdariffa han sido maceración, infusión, decocción y extracción asistida por ultrasonido; utilizando como disolventes, fundamentalmente, agua, alcoholes de bajo peso molecular (etanol y metanol), mezclas hidroalcohólicas y disolventes acidificados [5, 6, 7, 8, 9]. La extracción asistida por ultrasonido aporta beneficios significativos sobre los métodos que emplean calor, sobre todo, en términos de tiempo, consumo de disolventes y rendimiento de extracción [7, 10]. Debido a que las antocianinas son compuestos de estabilidad reducida y muy sensibles a factores externos como pH, temperatura, luz y oxígeno, se requiere una adecuada selección de las condiciones de extracción, para evitar su degradación [5].
El secado por aspersión, también llamado secado por atomización o Spray Drying, es un procedimiento en el cual se ingresa un producto en estado líquido y se hace pasar por un atomizador, transformándose en finas gotas que son secadas por una corriente de aire a temperaturas elevadas, obteniéndose de manera inmediata el extracto seco en forma de polvo. Esta técnica es comúnmente utilizada, de hecho cerca del 80-90% de la encapsulación de antocianinas se realiza mediante secado por atomización, ya que constituye una alternativa útil para proteger a compuestos inestables, evitando su degradación [11]. Mediante la microencapsulación, la sustancia que se desea conservar es revestida y forma una micropartícula que alcanza un tamaño comprendido entre 5 y 300 um [5, 12, 13].
La encapsulación de extractos de H. sabdariffa, mediante secado por atomización, ha sido estudiada con anterioridad, evaluándose la influencia de factores tales como temperatura de secado (93-210 °C) y agentes encapsulantes (goma mezquita, maltodextrina, goma arábica, maltodextrina: goma arábica; almidón:alginato y almidón de Canna indica L.), sobre las propiedades fisicoquímicas y biológicas de las microesferas. La maltodextrina es un carbohidrato muy usado en el secado por atomización, de bajo costo, baja viscosidad y alta solubilidad, al igual que la goma arábiga. La maltodextrina en mezcla con la goma arábiga se ha utilizado para la encapsulación de extractos de H. sabdariffa, obteniéndose buena eficiencia de encapsulación [2, 5, 14, 15, 16].
Evidentemente, aunque los cálices de H. sabdariffa ya han sido objeto de investigación en temas de extracción, composición química y propiedades biológicas; la materia prima utilizada en el actual trabajo, cultivada en la provincia de El Oro, Machala, nunca antes había sido sometida a estudios fitoquímicos. Resulta conocido que las especies vegetales pueden ser sensiblemente afectadas desde el punto de vista químico, por factores intrínsecos y extrínsecos, lo cual incide en sus propiedades biológicas [17].
De igual manera, las condiciones de extracción a utilizar en los cálices de H. sabdariffa, así como las establecidas para efectuar el secado por atomización, no han sido antes ensayadas. Todo lo antes expuesto permitió direccionar el objetivo de la investigación a definir las mejores condiciones de extracción asistida por ultrasonido de los cálices de H. sabdariffa cosechados en la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Machala, y la obtención de polvos microencapsulados, mediante secado por aspersión, del extracto seleccionado.
Materiales y métodos
Los cálices de H. sabdariffa fueron recolectados a partir de cultivos implementados en la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Machala, realizándose las colectas entre febrero y junio de 2019. La especie fue identificada y clasificada taxonómicamente en dicho centro de estudio.
La droga vegetal fue lavada con una disolución de hipoclorito de sodio (2% v/v), posteriormente, se eliminaron las semillas de los cálices y se sometieron a deshidratación en una estufa (MEMMERT UF 55, Alemania) a una temperatura de 45 ± 2 °C, con circulación de aire forzado (100%) y trampilla abierta (100%). El secado fue monitoreado a través de la humedad residual (Hr) del producto, la que se determinó en una balanza digital con fuente de calentamiento halógeno (Ohaus, modelo MB90, USA), garantizando que fuera inferior al 12%, según lo establecido por la Norma Técnica Ecuatoriana, del Instituto Nacional Ecuatoriano de Normalización (NTE INEN 2392:2013) [18].
La molienda de la droga cruda (DC) se llevó a cabo en un molino artesanal (MAGRICO, Ecuador), utilizando una criba de 1 mm de grosor. El polvo resultante se embaló en fundas de nylon con cierre hermético, para su posterior almacenamiento a temperatura ambiente (20-25 °C) y protegidos de la luz.
Procedimiento de extracción de polifenoles
La extracción de polifenoles se realizó mediante extracción asistida por ultrasonido, aplicando un diseño experimental de tipo factorial 22 por cada punto. Se consideraron como factores de estudio los disolventes: agua y agua/etanol (80:20) y la relación temperatura/tiempo de extracción: 25 °C/60 min y 60 °C/30 min. Este diseño se desarrolló con la ayuda del paquete estadístico STATGRAPHICS Centurion XVI. II.
Se realizaron un total de 12 corridas experimentales, las cuales se muestran en tabla 1.
Tabla 1 Diseño experimental factorial 22 para la extracción de polifenoles asistida por ultrasonido desde cálices de H. .sabdariffa secas.
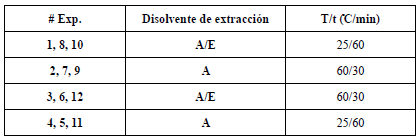
Exp: Experimento; A: agua; A/E: agua/etanol (80:20); T (C)/t (min): relación temperatura/tiempo.
Se empleó la extracción asistida por ultrasonido (ULTRASONIC BATH 5.7 L, FISCHER SCIENTIFIC, 40 Hz) utilizando una relación del 2% (g DC/mL disolvente). Los extractos de cálices de H. sabdariffa se llevaron a sequedad (ES) utilizando un rotoevaporador (HEIDOLPH LABOROTA 4001 efficient) acoplado a un criostato (LAUDA/ALPHA RA-8) y a una bomba de vacío (VACUUBRAND PC 600, Alemania). Los ES se almacenaron en frascos de vidrio, protegidos de la luz, a temperatura ambiente y en una desecadora, para posteriormente ser evaluados según diferentes parámetros físico-químicos.
Parámetros para evaluar el procedimiento de extracción de polifenoles
Rendimiento
Los resultados fueron referidos en porcentaje (%), considerando la relación entre la masa de DC que se somete al proceso de extracción (100%) y la masa de ES obtenido.
Determinación de pH
El análisis se realizó utilizando un pH-metro digital (FISHER SCIENTIFIC ACCUMET AE150). Las disoluciones acuosas se prepararon a partir del ES, a una concentración de 0,3 mg/mL.
Determinación de grados Brix (°Bx)
La prueba se realizó por triplicado en disoluciones acuosas (0,1 mg/mL), preparadas a partir de los ES, empleando un refractómetro (Anton Paar).
Determinación de fenoles totales mediante el método de Folin-Ciocalteu
Se empleó la metodología descrita por Campo et al. [19], con pequeñas modificaciones. Las absorbancias de las disoluciones acuosas obtenidas desde los ES (7 mg/mL) fueron leídas a 765 nm, utilizando microceldas de 2 mL y un espectrofotómetro UV-Visible (Spectrophotometer Evolution 201 Thermo Scientific, USA). La cuantificación de fenoles totales se realizó mediante una curva de calibración con ácido gálico (Sigma Aldrich) a concentraciones de 0,1; 0,3; 0,5; 0,7 y 0,9 mg/mL, para la cual, mediante un análisis de regresión lineal, se obtuvo la Ec. (1):
Todas las muestras fueron analizadas por triplicado y el resultado fue reportado como miligramos equivalentes de ácido gálico por cada gramo de ES (mg EAG/g ES).
Cuantificación de antocianinas totales mediante el método de pH diferencial
El ensayo se realizó por triplicado para cada muestra, según la metodología descrita por Giusti y Wrolstad [20]. Se partió de disoluciones acuosas a concentración de 1 mg/mL y las lecturas se realizaron utilizando el espectrofotómetro UV/Vis y microceldas de 2 mL. La absorbancia (A) de las muestras fue calculada mediante la Ec. (2):
La concentración total de antocianina monomérica en cada muestra fue determinada a través de la Ec. (3):
Dónde:
A= absorbancia de las muestras (calculada mediante Ec. 2)
MW= peso molecular (cianidina-3-glucósido = 449,2 g/mol)
FD= factor de dilución
ε= capacidad de absorción molar de la cianidina-3-glucósido: 26900 Los resultados fueron expresados como miligramos de antocianinas equivalentes a cianidina-3-glucósido por cada gramo de ES (mg ECG/g ES).
Análisis químico mediante cromatografía líquida de alta eficacia acoplada a espectrometría de masas (CLAE-EM)
Las disoluciones metanólicas de los ES fueron preparadas en concentraciones de 2 mg/mL y filtradas a través de filtros de 0,20 μm de tamaño de poro. Se empleó un sistema UHPLC (Thermo Scientific, Ultímate 3000), compuesto por una bomba cuaternaria, un automuestreador, un compartimento de columna, un sistema DAD (detector de arreglo de diodos), acoplado a un espectrómetro de masas Thermo Scientific LTQ XL controlado por el programa Xcalibur. Se utilizó una columna Accucore RP-MS C18 (100 mm largo x 2,1 mm diámetro interno; 2,6 μm de tamaño de partícula, Thermo Fisher), acondicionada a 35 °C y un flujo de 0,4 mL/min. El volumen de inyección de la muestra fue 2 μL. La fase móvil utilizada fue acetonitrilo (A) y ácido fórmico al 0,1% (v/v) (B) con elución en gradiente, que comenzó con 2% (A) durante los primeros 5 min, se incrementó a 20% (A) de 5-10 min, 50% (A) de 10-15 min, 95% (A) hasta los 21 min. Posteriormente, se restablecieron las condiciones iniciales de la columna durante 10 min. El espectrómetro de masas operó con voltaje de Spray de 5,0 kV, voltaje capilar de -50,0 V, temperatura del capilar de 225,0 °C, gas principal: 34, gas auxiliar: 5 y gas de barrido: 3 en unidades arbitrarias (nitrógeno). Se estudiaron las fracciones de las muestras en modo ion positivo y en modo ion negativo, por medio del modo Full Scan con rangos de 100-1000 Da, en modo dependiente masa/masa (MS/MS). Se utilizó el modo SIM para escanear iones específicos de las fracciones contenidas en las muestras estudiadas. La detección UV-Vis se realizó con cuatro longitudes de onda: 250, 280, 330 y 520 nm.
Determinación de la capacidad secuestradora de radicales libres frente al 2,2-difenil-1-picrilhidracilo (DPPH)
Para el ensayo se siguió la metodología de Brand-Willians et al. [11]. El método se basó en medir, por triplicado, la capacidad secuestradora del radical libre DPPH, en disoluciones acuosas de concentración 0,3 mg/mL. Todas las muestras se mantuvieron protegidas de la luz y a temperatura ambiente durante 30 min para, posteriormente, realizar la lectura en el espectrofotómetro UV-Visible a 517 nm, empleando microceldas de 2 mL y metanol como blanco.
La determinación cuantitativa se efectuó a través de la Ec. (4)
Donde:
A0= Absorbancia de mezcla DPPH y metanol
A1= Absorbancia de DPPH con el extracto
A2= Absorbancia del extracto con metanol
Secado por atomización
Para el estudio de encapsulación del extracto de cálices de H. .abdariffa mediante secado por atomización (BÜCHI MINI SPRAY DRYER B-290, Suiza) se ensayaron cuatro condiciones diferentes, considerando dos variables como factores de estudio: temperatura de entrada al secador (TE) y mezcla de encapsulantes (ME) (tabla 2). En todos los experimentos realizados se mantuvo constante la concentración del encapsulante en la mezcla (3% p/v) y las condiciones de extracción, previamente determinadas. El equipo se ajustó con una velocidad de alimentación o caudal del 30% (9 mL/min), aspiración al 100% (35 m3/h), el rotámetro se mantuvo a una altura entre 40-45 mm y se utilizaron dos ciclos de limpieza por minuto.
Tabla 2 Experimentos para la encapsulación de un extracto de cálices de H. sabdariffa mediante secado por atomización con una mezcla de goma arábica (G) y maltodextrina (MD).
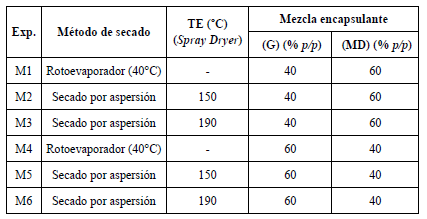
Exp.: Experimento; TE: temperatura de entrada al secador.
Para analizar la influencia del proceso de secado por atomización sobre las propiedades físico-químicas y la capacidad antioxidante de las micropartículas resultantes, se realizaron, paralelamente, dos experimentos. En ambos experimentos (M1 y M4), los extractos con sus correspondientes encapsulantes se llevaron a sequedad con el uso del rotoevaporador a 40 °C.
Se prepararon 300 mL de extracto al 2% (p/v) mediante sonicación, utilizando en todos los casos como disolvente agua: etanol (80:20) a 60 °C por 30 min (condiciones óptimas de acuerdo con el diseño de extracción). Los extractos, con sus correspondientes aditivos, fueron sometidos al proceso de secado, siguiendo las condiciones descritas en la tabla 2.
Una vez obtenidos los extractos secos microencapsulados, se almacenaron protegidos de la luz y en un desecador a temperatura ambiente para su correspondiente evaluación.
Parámetros físico-químicos evaluados en las muestras de la M1-M6
Las determinaciones de °Bx, Hr y fenoles totales se realizaron siguiendo las metodologías descritas anteriormente. Para la cuantificación de antocianinas mediante el método de pH diferencial, las muestras se prepararon a la concentración de 4 mg/mL y el procedimiento realizado correspondió al descrito anteriormente.
Respecto al análisis mediante CLAE-EM, las condiciones cromatográficas fueron similares a las ya definidas, solo que en esta ocasión las disoluciones metanólicas se prepararon a una concentración de 3 mg/mL.
Determinación de capacidad antioxidante equivalente a trolox frente al 2,2-difenil-l-picrilhidracilo (DPPH)
Para la determinación de la capacidad secuestradora de radicales libres frente al DPPH, se utilizó como disolvente agua: metanol (80:20) para preparar el reactivo de DPPH, debido a la solubilidad de los encapsulantes. Las muestras acuosas fueron analizadas a una concentración de 10 mg/mL, siguiendo el procedimiento descrito anteriormente. Las muestras se analizaron por triplicado.
Para informar la capacidad secuestradora equivalente a trolox (TEAC) se elaboró una curva de calibración con disoluciones metanólicas del ácido-6-hidroxi-2,5,7,8-tetrametilcroman-2-carboxílico (trolox), en el rango de concentraciones entre 0,025-0,175 mg/mL. Se realizó una regresión lineal (Ec. 5) para determinar los miligramos equivalentes a trolox por cada gramo de muestra analizada (mg trolox/g).
Análisis estadístico
El procesamiento estadístico de los datos del análisis de regresión lineal se llevó a cabo con el paquete estadístico Statgraphics Plus versión 5.0. Los análisis estadísticos realizados en los estudios de extracción y secado, se realizaron con el programa estadístico IBM SPSS Statistics versión 22.
Resultados y discusión
Procedimiento de extracción de polifenoles
Para la extracción de polifenoles, desde los cálices de H. sabdariffa, asistida con ultrasonido se evaluaron dos condiciones de disolvente de extracción (agua y la mezcla agua: etanol). Para definir el porcentaje del etanol en la mezcla se consideró que los compuestos polifenólicos y en especial las antocianinas, componentes mayoritarios en los cálices de H. sabdariffa, tienen un carácter polar, siendo los disolventes más comúnmente utilizados para su extracción, agua, mezclas hidroalcohólicas, etanol, metanol o acetona [7, 8, 22, 23, 24]. Además, se tuvo en cuenta que el Mini Spray Dryer operó con aire comprimido, sin el empleo del Inert Loop, por lo que el menstruo a evaporar no debía contener más de un 20% de disolventes orgánicos.
En relación con la temperatura empleada, se han publicado múltiples investigaciones donde se realizan las extracciones a temperatura ambiente o a mayor temperatura (60 °C) [24]. Bajo este contexto, se emplearon dos temperaturas de trabajo en esta investigación (25 y 60 °C), las cuales se seleccionaron tomando en consideración no solo las características del baño ultrasónico disponible, sino, además, garantizando la estabilidad de las antocianinas [25].
Parámetros para evaluar el procedimiento de extracción de polifenoles
Para evaluar la influencia de los factores disolvente y temperatura/tiempo de extracción, se determinaron algunos parámetros físico-químicos a los doce experimentos (cuatro condiciones y tres réplicas por cada condición evaluada), los que se muestran en la tabla 3.
Tabla 3 Resultados del diseño experimental factorial 22 para la extracción de polifenoles asistida por ultrasonido desde cálices de H. sabdariffa.
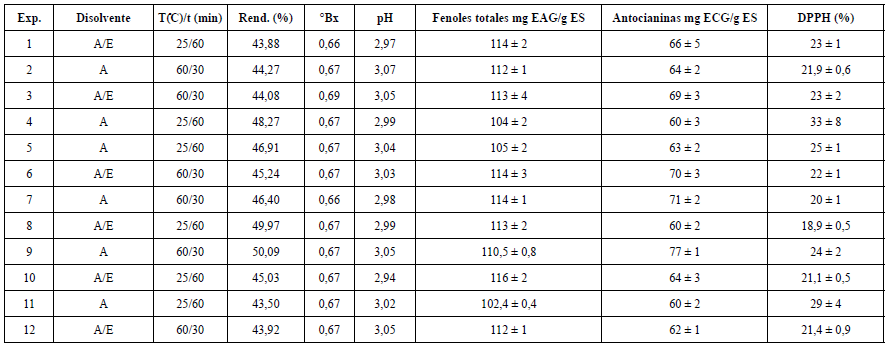
A: agua, A/E: agua/etanol (80:20); Exp: número de experimento; T/t (C/min): relación temperatura / tiempo; Rend.: rendimiento; ES: extracto seco; EAG: equivalente de ácido gálico; ECG: equivalente a cianidina-3-glucósido.
Como se puede apreciar, los valores de rendimiento oscilaron entre 43,50 y 50,09%. Al realizar la comparación estadística a través de la prueba t de student, se pudo demostrar, con un nivel de confiabilidad del 95%, que el factor disolvente de extracción y la relación temperatura/tiempo de extracción no tuvieron una influencia estadísticamente significativa en el rendimiento del proceso. Un comportamiento similar se pudo apreciar con respecto a los °Bx.
De acuerdo con la determinación de pH, se observó que estos valores no difirieron estadísticamente (nivel de confianza del 95%) respecto al disolvente de extracción, mientras que la relación temperatura/tiempo, presentó diferencias significativas. En este último caso cuando se aplica una temperatura de 60 °C por 30 min, el pH experimenta un ligero ascenso a valores de 3,05. Los valores de pH obtenidos oscilaron en el rango entre 2,88 y 3,07 (tabla 3), lo que guarda relación con los valores reportados en la literatura, pues los compuestos químicos mayoritarios de los extractos de H. sabdariffa, son ácidos orgánicos o metabolitos de naturaleza fenólica, lo que favorece dicha acidez. Estudios realizados en extractos acuosos de cálices de H. sabdariffa, empleando diversas condiciones de extracción (temperatura, materia prima fresca o seca, relación droga vegetal/disolvente, relación temperatura/tiempo), mostraron valores de pH que oscilaron entre 2,16 y 3,01 [26]. Morales-Luna etal. [6] identificaron un valor de pH superior en extractos metanólicos (3,49), en comparación con extractos acuosos (3,02). Según la literatura, valores de pH entre 2 y 4 suelen ser óptimos para una mejor conservación de las antocianinas, las mismas que otorgan la coloración púrpura y roja a los extractos de H. sabdariffa [27]. El pH puede influir en su estructura y consecuentemente en su estabilidad. Cuando los valores de pH en disoluciones acuosas resultan ser inferiores a 2, se favorece la forma estructural más estable (catión flavilio), apreciándose el color rojo intenso. Sin embargo, a valores de pH superiores a 7, se presentan las formas quinoidales que se degradan rápidamente por oxidación [28].
Otro de los parámetros determinados fue la cuantificación de fenoles totales equivalentes a ácido gálico (EAG). La cuantificación de fenoles totales de los extractos osciló entre 102 y 116 mg EAG/g ES. El análisis estadístico a través de la prueba t student (confiabilidad del 95%) demostró que el factor temperatura/tiempo no influyó significativamente en la extracción de compuestos fenólicos, sin embargo, el disolvente de extracción presentó una influencia estadísticamente significativa (p-valor ≤ 0,05), sobre la cantidad de fenoles que se puede extraer en cada procedimiento. Los resultados sugieren que la mayor extracción de polifenoles se logró utilizando el disolvente hidroalcohólico. Anokwuru et al. [29], indicaron que los alcoholes son mejores disolventes para la extracción de compuestos fenólicos de los cálices de H. sabdariffa, comparados con el agua y la acetona. Según Sotomayor y Vargas [5], al realizar extracciones con etanol/agua con proporción de etanol creciente aumenta la cantidad de antocianinas y compuestos fenólicos, encontrando como valor óptimo un 41,59% de etanol en la mezcla etanol/agua. La cuantificación de fenoles totales realizada en una infusión y en una decocción de cálices de H. sabdariffa constató que el método de infusión logró el mayor contenido de tales compuestos bioactivos (292,42 mg EAG/g extracto) [30]. La misma determinación realizada en un extracto metanólico de los cálices de dicha especie evidenció la presencia de 118,08 mg EAG/g extracto [31].
Respecto a la cuantificación de antocianinas monoméricas, los resultados obtenidos oscilaron entre 60 y 77 mg ECG/g ES. En este caso, se observó una influencia estadísticamente significativa (p-valor ≤ 0,05) con respecto a la relación tiempo/temperatura, lográndose extraer una mayor cantidad de antocianinas, cuando el proceso se desarrolla a 60 °C por un tiempo de 30 min. Si bien la variable disolvente no mostró influencia significativa sobre dicha determinación, existen estudios donde mezclas de etanol: agua mostraron una mayor capacidad extractiva de cianidina-3-glucósido a partir de los cálices H. sabdariffa, atribuible a la afinidad entre la antocianina y los disolventes hidroalcohólicos [23]. Según Morales-Luna et al. (2019) [6], extractos metanólicos de H. sabdariffa, obtenidos por maceración dinámica, mostraron valores de antocininas monoméricas totales superiores (539 mg ECG/100 g de cálices secos) a los obtenidos en los extractos acuosos (445 mg ECG/100 g de cálices secos).
Los valores que refiere la literatura para fenoles totales y antocianinas monoméricas totales pueden ser muy variables, dada la influencia que pueden ejercer factores como las condiciones de extracción, la técnica que se emplea para la cuantificación, así como aspectos inherentes a la materia prima vegetal (edad, condiciones climáticas de la zona de cultivo, suelo, entre otros).
Análisis cromatográfico mediante CLAE-EM de los extractos de los cálices de H. sabdariffa
Para evaluar si el proceso de extracción, con las variantes ensayadas, ejercía alguna influencia en la composición química cualitativa, se realizó un análisis en diferentes etapas:
En primer lugar, se compararon los cromatogramas correspondientes a cada longitud de onda ensayada (250, 280, 330 y 520 nm), de los experimentos que utilizaron las mismas condiciones de extracción. Debe acotarse que, al utilizar un detector de arreglo de diodos, las señales observadas son propias de compuestos con grupos cromóforos conjugados, tales como los ácidos fenólicos y flavonoides que se refieren para los cálices de H. sabdariffa, objeto de estudio [20]. A continuación, se eligió un experimento de cada una de las cuatro condiciones de extracción utilizadas y se realizó una superposición de los cromatogramas obtenidos a las cuatro longitudes de onda analizadas. Como lo muestra la figura 1, no se aprecian cambios químicos cualitativos entre los cuatro escenarios de extracción empleados, para una misma longitud de onda.
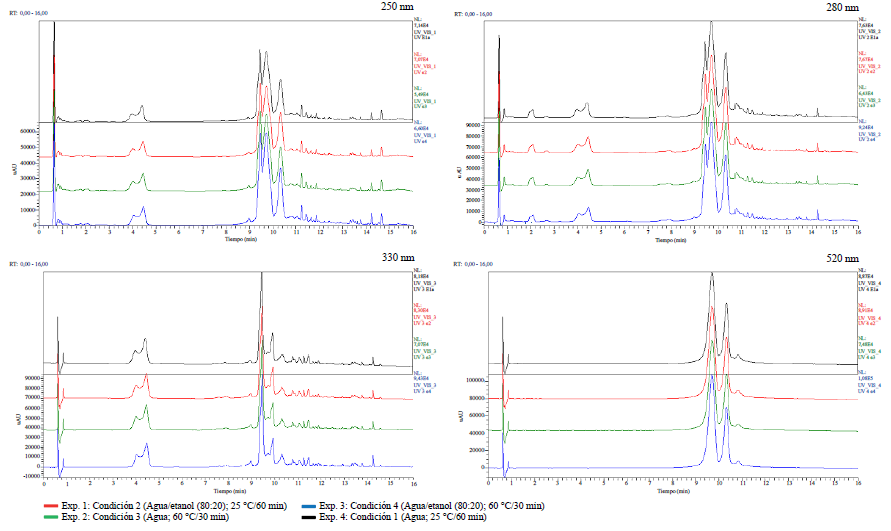
Figura 1 Superposición de los cromatogramas obtenidos para un experimento de cada una de las condiciones ensayadas (Exp. 1, Exp. 2, Exp. 3, Exp. 4) y para una misma X (250 nm, 280 nm, 330 nm y 520 nm).
Realizando un análisis más detallado de las señales presentes en los cromatogramas, en aquellos obtenidos para las longitudes de onda de 250, 280 y 330 nm, se puede apreciar que no existen grandes diferencias. En los tres casos se observan dos grupos de señales, uno entre 3,9 y 4,5 min y un segundo con mayores tiempos de retención y mayor intensidad, entre 9,4 y 11,5 min, aproximadamente. En el cromatograma obtenido a 520 nm se logran visualizar, casi exclusivamente, dichas señales a tiempos de retención entre 9,7 y 11,22 min. Según se refiere en la literatura, las antocianinas presentan máximos de absorción en el espectro UV-Vis a diferentes valores, los que oscilan entre 496 y 547 nm, dependiendo del disolvente en el que se encuentren [20].
Como sistema de detección adicional y para efectos de identificación estructural se procedió al análisis por espectrometría de masas de todos los experimentos realizados. Se pudo demostrar, a través de los cromatogramas de corriente iónica total (CIT), que presentan gran similitud, tanto en modo ion positivo, como en ion negativo. En ambos casos las señales de mayor interés e intensidad se presentan, aproximadamente, a tiempos de retención entre 9,4 y 11,0 min
La identificación de los compuestos presentes en los extractos se realizó mediante comparación de sus espectros UV-visibles, los espectros de masas y MS/MS respecto a los de la masa del ion molecular y de los iones fragmentos referidos en la literatura, para extractos de los cálices de H. sabdariffa, en donde se llevó a cabo un análisis espectrométrico similar. Luego de evidenciar la similitud entre todos los ensayos realizados, usando ambas técnicas de análisis, se efectuó el estudio de caracterización química tomando como modelo el experimento 4.
En el modo ion positivo (tabla 4) solo pudieron ser identificados cinco compuestos: un fenol simple (isómero del ácido-cafeoilquínico), las dos antocianinas más referidas para la especie (delfinidina-3-sambubiósido y cianidina-3-sambubiósido) y dos glicósidos de flavonoles (miricetina-3sambubiósido, quercetina-3-sambubiósido), estos últimos con señales de muy baja intensidad.
Tabla 4 Compuestos identificados utilizando la CLAE con detector de arreglo de diodos acoplada a espectrometría de masas en el modo de ion positivo.
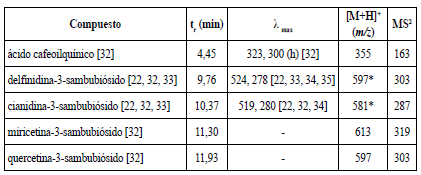
*: Para las antocianinas se obtiene el M+.
En el modo ion negativo (tabla 5) se identificaron mayor cantidad de metabolitos: una lactona del ácido hidroxicítrico (ácido hibiscus), ácidos fenólicos (ácido-5-cafeoilquínico y sus isómeros 3 y 4; ácido-5-O-coumaroilquínico y su isómero el ácido-3-O-coumaroilquínico y el ácido cafeoilshikímico, además de un isómero de este). En este modo también pudieron ser identificadas las antocianinas antes referidas y varios glicósidos de flavonoles derivados de miricetina, quercetina y kaempferol.
Tabla 5 Compuestos identificados en todos los experimentos utilizando CLAE con detector de arreglo de diodos acoplada a espectrometría de masas en el modo de ion negativo.
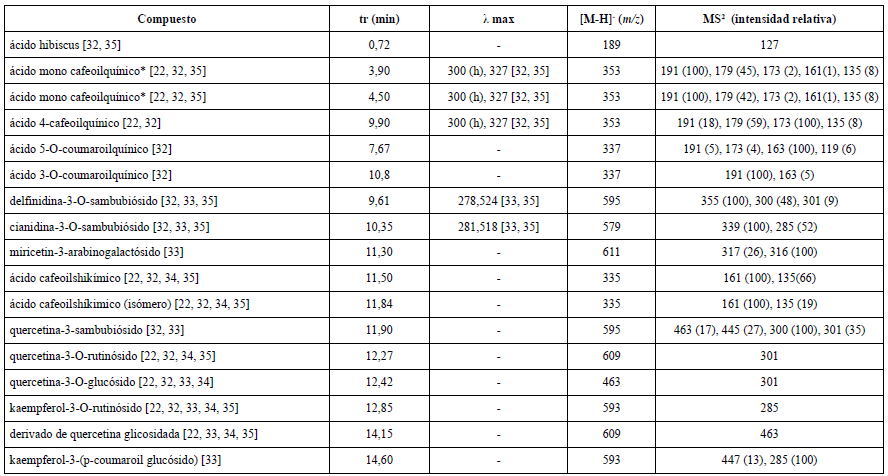
*: Podría ser ácido 3-cafeoilquínico o ácido 5-cafeoilquínico.
Como se pudo apreciar, las antocianinas pudieron ser identificadas en el modo ion positivo e ion negativo, siendo estos metabolitos los responsables de las señales de mayor intensidad en todos los cromatogramas UV (figura 1). Aunque no fue posible demostrar la existencia de ambos pigmentos por comparación con sus estándares de referencia, se pudo observar que sus dos máximos de absorción en el espectro UV-visible se encuentran alrededor de 280 y 520 nm, lo que concuerda con lo referido por la literatura, para tales flavonoides [22, 32, 33, 35, 36].
La mayor diversidad de metabolitos fue identificada en el modo ion negativo. El segundo grupo de señales que le continúa en intensidad, según los espectros UV (figura 1) se presentó a tiempos de retención inferiores (3,90; 4,50 y 9,90 min). De acuerdo con los patrones de fragmentación y espectros de absorción al UV, son consistentes con la existencia de isómeros del ácido cafeoilquínico, es decir, ásteres que se forman entre el ácido cafeico y el ácido quínico. Los isómeros referidos con mayor frecuencia son el ácido cis o trans 3-cafeoilquínico, ácido 5-cafeoilquínico y ácido 4-cafeoilquínico. La presencia de los primeros isómeros puede ser sustentada a travás de los iones fragmentos (MS2), ya que diversos autores refieren que el pico base es m/z 191, seguidos de las m/z 179, 135, 173 y 161. Uno de estos isómeros también fue identificado en el modo de ion positivo con un tiempo de retención de 4,45 min. La presencia del ácido 4-cafeoilquínico se respalda en que el pico de mayor intensidad, a diferencia de los compuestos anteriores, es el de m/z 173 [22, 35]. Para demostrar inequívocamente la presencia de dichos compuestos en ambos modos, positivo y negativo, y el orden de elución entre los isómeros del ácido cafeoilquínico, se sugiere realizar una comparación con los correspondientes estándares de referencia.
El resto de los metabolitos se muestran como señales mucho más débiles y fueron identificados, mayoritariamente, en el modo de ion negativo. Su identificación se realizó atendiendo a las características del espectro de masas y MS/MS. Para estos compuestos fenólicos que eluyeron por encima de los 11 min, las señales en los cromatogramas UV fueron de muy baja intensidad, lo cual no permitió la correcta apreciación de sus correspondientes espectros de absorción.
Todos los compuestos identificados en el presente estudio han sido referidos en la literatura para cálices de H. sabdariffa, utilizando igual método de separación y caracterización. El análisis de CLAE-EM pudo confirmar que entre todos los experimentos realizados existe una composición química cualitativamente similar, pudiendo sugerirse en todos los casos que las antocianinas delfinidina-3-sambubiósido y cianidina-3-sambubiósido son responsables de las señales de mayor intensidad en los cromatogramas, tanto en modo ion positivo como en negativo. Ambos metabolitos han sido reportados con anterioridad en extractos de H. sabdariffa y son responsables de la fuerte pigmentación de sus extractos [22, 32, 33, 35].
Determinación de la capacidad secuestradora de radicales libres frente al 2,2-difenil-l-picrilhidracilo (DPPH)
A continuación, se realizó la determinación de la capacidad antioxidante, a través del método del DPPH. Diversos estudios hacen alusión a la actividad antioxidante que presenta H. sabdariffa evaluada por el método del DPPH [24, 29, 37, 38]. Al realizar la comparación de medias para los valores de porcentaje de secuestro del radical DPPH, asociado a los factores temperatura/tiempo y disolvente, se pudo llegar a la conclusión de que, con un 95,0% de nivel de confianza, ningún p-valor es inferior a 0,05, por lo que ninguna de las condiciones tuvo un efecto estadísticamente significativo sobre la capacidad secuestradora de radicales libres.
Luego del análisis integral de las parámetros físico-químico realizados, además del estudio antioxidante, cromatográfico y espectrométrico expuesto, se tomó la decisión de elaborar los extractos que serían sometidos al secado por atomización, utilizando como disolvente la mezcla agua:etanol (80:20), una temperatura de 60 °C y por un tiempo de 30 min. Fundamentalmente, se consideró la capacidad extractiva de compuestos fenólicos y de antocianinas en particular, además del ahorro en tiempo cuando se emplea temperatura de 60 °C. Si bien la capacidad antioxidante es importante, los compuestos bioactivos podrían aportar otros beneficios desde un punto de vista terapéutico.
Secado por atomización
Después de someter los extractos a cada una de las condiciones de secado, se pudo apreciar que los extractos con encapsulantes secados mediante el rotoevaporador mostraron una textura viscosa, pegajosa y resultaron de coloración rojo-rosado intensa. Sin embargo, los extractos con agentes encapsulantes secados mediante atomización se presentaron como polvos de coloración rojo-rosado, pero de tonalidad más pálida. En la técnica de secado por atomización, la disolución que entra al secador experimenta una inmediata evaporación del disolvente. Aunque con frecuencia se considera un proceso de deshidratación, precisamente, su mayor utilidad es que logra encapsular o revestir al extracto con el material encapsulante. De esta manera, se crea una fina película que recubre a los compuestos bioactivos, brindándole no solo protección ante factores medioambientales, sino también impidiendo su aglomeración; a diferencia del secado por rotoevaporador que solo elimina el disolvente del extracto, sin que se genere la barrera protectora [16].
Parámetros físico-químicos evaluados en las muestras de la M1-M6
Los resultados de los análisis realizados a los diferentes experimentos se muestran en la tabla 6.
Tabla 6 Análisis físico-químicos realizados a los extractos obtenidos de H. sabdariffa, conteniendo la correspondiente mezcla encapsulante
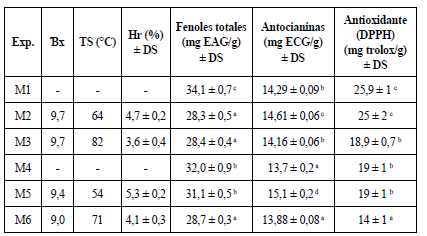
Exp.: experimento; TS: temperatura de salida; Hr: humedad residual; DS: desviación estándar, EAG: equivalente de ácido gálico; ECG: equivalente a cianidina-3-glucósido. Letras iguales para un mismo parámetro expresan que no existen diferencias estadísticamente significativas.
En relación con los °Bx los valores más altos de este parámetro corresponden a M-2 y M-3, los mismos que contenían la mezcla de encapsulantes G40/MD60, mientras que M-5 y M-6 mostraron valores menores. La cantidad de maltodextrina en la mezcla es proporcional a los °Bx, debido a que este encapsulante es un carbohidrato complejo soluble que provoca un aumento de los sólidos solubles. Precisamente, la maltodextrina se refiere como un aditivo para generar el aumento del rendimiento de las sustancias a secar [39].
La determinación de Hr, como se puede apreciar, solo se realizó en los extractos obtenidos a través del secado por atomización. El porcentaje de Hr resultó ser inferior, cuando se aplicó una temperatura de entrada del extracto de 190 °C. Lo anterior se atribuye a que cuando la temperatura es más elevada existe una mayor velocidad de transferencia de calor, conllevando un mayor porcentaje de evaporación de la humedad y, por consiguiente, a una eliminación de agua de forma más rápida [40]. Lógicamente, aunque en todos los casos los valores de Hr están en correspondencia con lo referido para polvos microencapsulados en sentido general, debe ser analizada la incidencia que pudiera tener sobre los metabolitos bioactivos el empleo de altas temperaturas. El porcentaje de Hr, preliminarmente, es más elevado en los experimentos realizados a la misma temperatura y donde existe mayor cantidad de goma arábiga, lo que debe ser optimizado en trabajos posteriores. Resultados similares fueron obtenidos por Páramo et al. [41], para el secado por aspersión de ajo, así como, Nadaff et al. [42], en el secado por aspersión de jugo de naranja, quienes obtuvieron mayor Hr en los experimentos trabajados con goma arábiga en comparación con los procesados con maltodextrina.
Colateralmente, cuando se aplicaron valores elevados de temperatura de entrada al secador, se observó un incremento de la temperatura de salida del producto seco, previniendo la adherencia del extracto en las paredes del secador. Como se puede observar en la tabla 6, la temperatura de salida en ambos experimentos cuando se utilizó 190 °C resultó ser más elevada (M3 y M6).
Las variables de mayor interés para evaluar la incidencia de la mezcla encapsulante y de la temperatura de entrada al secador fueron: fenoles totales, antocianinas y actividad antioxidante, con los cuales se realizó un análisis multifactorial a través del programa estadístico SPSS (versión 22). Dichos parámetros se consideraron como los de mayor impacto, sobre todo, desde el punto de vista biológico, ya que de ellos depende su uso terapéutico.
Para deducir cuáles fueron las condiciones más apropiadas para preservar la mayor cantidad de compuestos bioactivos y como consecuencia la actividad antioxidante, se realizó el análisis por Anova de un factor para una variable que combinaba todas las posibles opciones de agente encapsulante y la temperatura de entrada.
Al analizar la cantidad de fenoles presentes en los extractos secos, se pudo apreciar que los procesos en que se realizó la concentración con el rotoevaporador, independientemente de la matriz encapsulante utilizada, fueron los que presentaron mayor contenido de fenoles totales. Cuando el extracto se sometió a secado por atomización la combinación de 150 °C y G60/MD40 (M5) mostró el segundo mejor contenido de polifenoles, siendo estadísticamente diferente al experimento M1, pero similar al M4, habiéndose trabajado estos últimos a 40 °C. Lo anterior resultó de gran importancia, pues sugiere que al usar la matriz G60/MD40 no se afectó el contenido de polifenoles por efecto de la temperatura, lográndose una mezcla con mayor contenido de fenoles totales. Sin embargo, al emplear la temperatura más elevada (190 °C), se obtiene un producto final con menor contenido de compuestos fenólicos. Este resultado podría ser atribuido a la susceptibilidad de algunos compuestos fenólicos a elevadas temperaturas de secado [43]. Resultados similares reportaron Mishra et al. [40], donde el contenido de fenoles totales de Emblica officinalis, secado por atomización, disminuyó en la medida en que aumentó la temperatura de entrada al secador de 125°C a 175 °C. Jiménez-Aguilar et al. [44] plantearon una pérdida de compuestos fenólicos del 26% en extractos etanólicos de arándanos cuando la temperatura de entrada fue de 160 °C. Navidad-Murrieta et al. (2020) [2], luego de realizar el secado por atomización de extractos acuosos y etanólicos (etanol 20%) de H. sabdariffa, concluyeron que los extractos acuosos secados por atomización lograron un mayor contenido de polifenoles totales (32,12-21,23 mg EAG/g), utilizando la proporción extracto: material encapsulante (1:1), temperatura de entrada al secador de 150 °C, así como la mezcla MD80/G20.
En relación con la cuantificación de las antocianinas, se pudo observar que el mejor sistema también fue el experimento M5, el cual resultó significativamente mayor (p-valor ≤0,05) respecto a los otros experimentos. Resultados obtenidos por Zhang et al. [45] mostraron que la condición óptima para la microencapsulación de proantocianinas extraídas del jugo de uva fue una mezcla de 60% maltodextrina y 40% goma arábiga, lo que se atribuyó a las interacciones químicas entre maltodextrina y goma arábiga que facilitan la retención de las proantocianinas. Según Shahidi y Naczk [46], las antocianinas pueden formar complejos con polisacáridos cuando el catión flavilio interactúa con las dextrinas, previniendo de esta forma su transformación y formando enlaces no covalentes estables.
Al centrarse en el análisis considerando solamente el proceso de encapsulación, las mejores condiciones fueron aquellas donde se trabajó a 150 °C, lo cual coincide con la investigación realizada por Nayak y Rastogi [47], referida a la microencapsulación de antocianinas presentes en Garcinia indica Choisyen. Según Ersus y Yurdagel [43], una temperatura de entrada elevada (≥160-180 °C) causó una mayor pérdida de antocianinas en extractos de Daucus carota L. Arrazola et al. [48], mencionaron que el ascenso de la temperatura de entrada desde 150 a 202 °C produjo un incremento en la degradación de antocianinas. Sin embargo, en relación con el agente encapsulante, Archaina et al. [49] demostraron que en el secado por atomización de una decocción de los cálices de H. sabdariffa (15%p/v), empleando una temperatura de entrada al secador de 180 °C, se favorecen los niveles de antocianinas y polifenoles con el incremento del porcentaje de goma arábiga en la matriz encapsulante (70MD/30G). Este resultado coincide con el obtenido en esta investigación, ya que en el experimento M5 la goma arábiga se encuentra en mayor proporción (G60/MD40).
De manera análoga se realizó el estudio cromatográfico de los encapsulados obtenidos. En este caso, también se realizó una comparación entre el extracto con los correspondientes aditivos (secado en rotoevaporador) y los encapsulados obtenidos en el secado por atomización.
Los cromatogramas obtenidos, con las cuatro longitudes de ondas evaluadas, para el experimento M1, (extracto con G40/ MD60 secado por rotoevaporador) y los experimentos de secado por atomización con similar encapsulante (M2 y M3) fueron muy similares. Lo anterior sugiere que no ocurrieron cambios en la composición química cualitativa, aún después de someter las muestras a elevadas temperaturas. Un comportamiento similar mostró la mezcla de encapsulante (G60/MD40), correspondiente a los experimentos M4, M5 y M6.
En otro sentido se evaluó, de la misma manera, si las condiciones de secado por atomización influyeron sobre los componentes identificados, para lo cual se compararon los experimentos M2, M3, M5 y M6. Se apreció que bajo una misma longitud de onda los cromatogramas resultaron ser superponibles, sugiriendo que los parámetros utilizados en el secado no provocaron la pérdida cualitativa de los compuestos químicos presentes. En relación con los espectros de masas, tanto en modo ion positivo como ion negativo, el resultado mostró que no hubo cambios cualitativos apreciables. Los compuestos químicos identificados coinciden en todos los casos con los referidos en las tablas 4 y 5; por lo que al usar una temperatura de entrada del extracto de 150 o 190 °C no se afecta la composición química cualitativa de este; como tampoco se afecta con el uso de ambas matrices encapsulantes. Para trabajos posteriores se recomienda realizar una cuantificación que podría definir la influencia de las condiciones de secado, en la concentración de los compuestos bioactivos de mayor interés.
Determinación de capacidad antioxidante equivalente a trolox frente al 2,2-difenil-l-picrilhidracilo (DPPH)
Respecto a la capacidad antioxidante que mostraron los extractos, los mejores resultados fueron para los experimentos M1 y M2, entre los cuales no hubo diferencia estadística significativa. Los extractos con la mezcla encapsulante de mayor cantidad de maltodextrina, preliminarmente, resultaron ser los que presentaron mejor capacidad antioxidante. Seguido de estos se mostraron los experimentos M-3, M-4 y M-5, obteniéndose el resultado más bajo para el experimento M-6, donde la temperatura empleada fue de 190 °C. Este comportamiento no coincidió con el resultado obtenido para el contenido de fenoles totales, pues en este caso la mezcla con mayor cantidad de goma logró los mejores resultados; sin embargo, la temperatura de 150 °C favorece tal actividad, aspecto que sí resulta similar.
Estudios recientes realizados por Cid-Ortega y Guerrero-Beltrán (2020) [50] demostraron que las condiciones más favorables, en cuanto a capacidad antioxidante, en el secado por atomización de un extracto de los cálices de H. Sabdariffa, fueron logradas utilizando como encapsulante una combinación de G y MD (60/40). En este caso, la temperatura de entrada al secador fue fijada a 180 °C.
Resulta oportuno señalar que son múltiples los factores que pueden incidir en la variabilidad de los resultados referidos en la literatura (polifenoles totales, antocianinas monoméricas totales o capacidad antioxidante), ya sea por las condiciones de extracción, los parámetros utilizados en el secado por atomización o incluso por el genotipo de la especie utilizada [2, 26, 49, 50, 51].
Haciendo un análisis integral, con el secado mediante el rotoevaporador se apreció que, tanto en el contenido de fenoles como en la actividad antioxidante, este método resultó ser el mejor. Lógicamente, el sentido de este experimento fue solo comparar cuánto podría afectarse químicamente el extracto luego de ser sometido a las condiciones de secado por atomización. Organolépticamente, en este último, el polvo que se obtiene ofrece ventajas en cuanto a su posible utilización como ingrediente activo para la industria de alimentos y farmacéutica. Adicionalmente, la mayor ventaja estaría dada en la estabilidad que dicho encapsulado les podría propiciar a los compuestos bioactivos, sobre todo, de interés terapéutico, sin descartar su posible empleo como colorantes en la industria tanto farmacéutica como alimentaria.
Hay que señalar que, aunque el estudio realizado con una sola réplica por experimento es preliminar, las variables analizadas y los factores manipulados brindaron información valiosa para proseguir la investigación con un diseño experimental. Se sugiere optimizar parámetros tales como temperatura de entrada (nunca superior a 150 °C, según los resultados actuales) y proporción del encapsulante en el extracto a secar (valores superiores a 3%, porcentaje no manipulado en la investigación actual).
Conclusiones
Las mejores condiciones para realizar el proceso de extracción de polifenoles asistida por ultrasonido resultaron ser: agua: etanol (80:20), una temperatura de 60 °C y un tiempo de 30 min. Fundamentalmente, se consideró la capacidad extractiva de compuestos fenólicos y el ahorro en tiempo cuando se emplea una temperatura de 60 °C.
Analizando solo el proceso de secado por atomización, la mayor retención de polifenoles y antocianinas, así como la actividad antioxidante, se obtuvieron a una temperatura de entrada al secador de 150 °C. Sin embargo, un mayor contenido de goma arábica (G60/MD40) favoreció la presencia de compuestos fenólicos en general y de antocianinas en particular, mientras que con un menor contenido de goma arábica (G40/ MD60) se obtuvo la mejor capacidad antioxidante equivalente a Trolox.