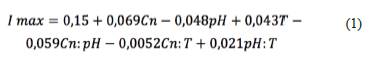Introducción
En Costa Rica, la producción de café es la actividad agroindustrial de mayor tradición. Según Estadísticas de Comercio Exterior Costa Rica (2017), esta cuenta con un valor aproximado de US$ 228 millones correspondientes a 1.451.100 fanegas (saco de 46 kg) exportadas [1]. El proceso de producción es altamente contaminante, ya que solo el 6% del peso total del grano se emplea para preparar la bebida y el resto son desechos sólidos como cascarilla, pulpa, mucílago y pergamino; y líquidos conocidos en la industria cafetalera como aguamiel [2, 3]. El agua residual del procesamiento del café está compuesta mayoritariamente por agua, fibra y pectinas; por cada kilogramo de café en grano se generan 8 L de agua residual, con una demanda química de oxígeno en un rango de 1.000100.000 mg/L y un pH entre tres y cinco, lo que clasifica este residuo como altamente contaminante para su vertido en cuerpos superficiales o alcantarillado sanitario.
El tratamiento usual del agua residual generada consiste en la disminución de la carga orgánica a través de lagunas anaerobias u otros tipos de reactores y filtros, lo que implica un consumo energético y económico importante para las procesadoras de la fruta [4-6]. Existe la necesidad de darle un mejor tratamiento a este residuo, así como de investigar nuevos modelos de energía sostenible que resulten en un impacto positivo sobre el medioambiente. Las celdas combustibles microbianas (CCM), dispositivos que emplean residuos agrícolas como sustrato para la generación de energía, podrían utilizarse en el tratamiento de las aguas mieles de café.
Este tipo de celdas son objeto de investigación debido a su funcionalidad dual: generadoras de potencia eléctrica y dispositivos para el tratamiento de agua residual [4, 7-10]. Se ha reportado la alimentación de estas celdas con agua residual de industria láctea, agrícola, así como aguas negras domésticas [5, 8, 11]. La generación eléctrica con estos sustratos se encuentra en un amplio rango según su naturaleza química, densidades de potencia reportadas en la literatura rondan desde los 50 W/m2 hasta 2.000 W/m2 [12-14]. Factores como la concentración y composición de las aguas residuales son conocidos por causar un impacto directo sobre el proceso bioelectroquímico; sin embargo, otros como producción de hidrógeno, metanogénesis, procesos degradativos aeróbicos y difusión de metabolitos neutros hacia la cámara catódica son también integrantes en la ecuación, que permite la generación máxima de potencia eléctrica y remoción de demanda química de oxígeno (DQO) [2, 4, 11, 15].
El concepto de CCM es posible debido a la transferencia de electrones exocelulares. Los electrones se transmiten desde el organismo a aceptores de electrones extracelulares insolubles, mediante diferentes mecanismos [16, 17]. La transferencia de electrones en ambientes anaerobios se puede realizar a través de compuestos solubles como ciertos antibióticos, quinonas, riboflavina, e incluso sustancias húmicas pueden funcionar como mediadores de electrones exocelulares [18]. Estos mediadores pueden ser artificiales o producidos por el propio microorganismo; algunos microorganismos pueden transferir electrones directamente por medio de estructuras proteicas especiales llamadas "nanocables" [19].
Las modificaciones de electrodos son clave para el aumento del rendimiento de la CCM. Los materiales necesarios para llevar a cabo el proceso electroquímico deben poseer ciertas características: buena conductividad eléctrica, estabilidad química y mecánica y bajo costo [20,23]. El uso de electrodos de grafito cumple con estos requisitos, además se encuentra disponible en múltiples presentaciones como placas (superficie bidimensional), o grânulos, fieltro, papel, espuma, fibras (superficies tridimensionales), entre otras [24-26].
Para incrementar la eficiencia de la transferencia electrónica, se proponen distintos tratamientos al grafito, estos permiten disminuir las pérdidas en la interfase bacteria-ánodo. Se recomienda mejorar la adhesión de la comunidad microbiana a la superficie del electrodo mediante el aumento del área superficial; por ejemplo, tratamiento térmico, con amoníaco gaseoso o con ácido sulfúrico. Para el cátodo se han propuesto recubrimientos con nanopartículas de carbono o de metales catalíticos, como el manganeso y el hierro [9, 12, 27-29].
Las CCM se perfilan como una opción novedosa y de interés nacional para la agroindustria cafetalera, razón por la cual en este trabajo se evalúa la generación eléctrica de una CCM al utilizar como sustrato agua residual del procesamiento de café, de modo que se pueda maximizar la producción eléctrica del dispositivo, con lo cual se generaría una solución sostenible y de valor económico agregado para este residuo en el país.
Materiales y métodos
Celda combustible microbiana
Se ensambló un sistema de doble cámara; para esto se utilizaron dos botellas de borosilicato con capacidad de 500 mL cada una [13, 19]. A cada botella se le hizo un corte circular, y se insertó un tubo de borosilicato del mismo diámetro. Las cámaras se separaron con una membrana de intercambio (FUMASEP F-14100) [30] que primero se sumergió en una disolución HNO3 (10% en volumen, 3 h a 90 °C), se trasvasó a un recipiente con agua grado 1 (90 °C durante 1 h) [31]. La membrana se almacenó en medio ácido y refrigeración a 4 °C. Se cerró el circuito con alambre de cobre hacia el recolector de datos (DataLogger Novus Automation) con resistencia de 100 ÍÍ. Las celdas operaron en lote por 120 h y se utilizó agua residual recolectada de un beneficio en San Marcos de Tarrazú, Costa Rica, como sustrato en la cámara anódica.
Electrodos
Se emplearon láminas de fieltro de grafito (3,50 cm x 7,00 cm) [25]. Los electrodos se colocaron en HNO3 concentrado (90 °C durante 4 h), seguidamente se enjuagaron con agua grado 1 hasta pH neutro [32]. Se colocaron en la estufa (60 °C durante 24 h). Posteriormente, se modificaron los electrodos con un recubrimiento de una disolución de 60 mg del compuesto catalítico ftalocianina de hierro (FePc) en etanol absoluto (750 μL) y Nafion (100 μL al 25%) y se dejó secar al aire 8 h [15].
Sustrato en la cámara anódica y disolución electrolito en el cátodo
Se emplearon 350 mL de agua residual en la cámara anódica y disolución amortiguadora de fosfatos (0,50 mol/L, pH = 7,00) para la cámara catódica [20, 24]. Se introdujeron los electrodos, se sellaron las cámaras y se purgó la cámara anódica (30 min) con una corriente de gas nitrógeno.
Caracterización del sustrato
Se utilizó agua residual del procesamiento del café de un beneficio en San Marcos de Tarrazú, Costa Rica, como sustrato en la cámara anódica. Este se caracterizó mediante un análisis de DQO, según el Standard Methods of Water and Wastewaters (5220D) [33]. Se realizó análisis de azúcares individuales, según procedimiento del Centro Nacional de Ciencia y Tecnología de Alimentos (CITA); fibra cruda, según métodos AOAC 2002,04 y AOAC 973,18 [34]; relación carbono total: nitrógeno total (C/N), según método Handbook of reference methods for plants analysis (1998) [35], y sólidos totales, disueltos y volátiles, y porcentaje de método 1684 de la EPA de los EE. UU. [36]. Finalizado el ciclo de operación, se tomaron muestras del agua residual para el análisis de azúcares y DQO, previo y posterior al funcionamiento del dispositivo.
Diseño experimental
Se estudió el efecto de tres variables sobre el funcionamiento de la CCM mediante un diseño factorial completo 23 para evaluar el pH (nativo o neutro), la temperatura (35 °C o ambiente a 22 °C) y la carga orgánica (nativa o diluida). En cada caso se prepararon sustratos diferentes; el pH neutro se reguló diariamente mediante la adición de NaOH (0,1 mol/L). La temperatura en baño termorregulado. Por último, se diluyeron 250 mL de agua residual en 1 L de agua desionizada.
Operación y evaluación de los electrodos modificados
Se evaluó el desempeño del electrodo modificado de grafito; para esto se registraron datos durante 5 días (120 h) y se analizó la DQO del sistema de agua residual antes y después del ciclo de operación de la celda. Para la obtención de las voltametrías cíclicas, se utilizó un potenciostato (AutoLab Metrohm) para todas las mediciones. Se empleó un electrodo auxiliar de alambre de platino y un electrodo de referencia de Ag/AgCl (3 mol/L) [32]. El electrodo de trabajo consistió en una lámina de fieltro de grafito modificado con distintos tratamientos; todas las láminas se humedecieron con disolución de electrolito soporte previo a la medición y se realizaron las siguientes mediciones: voltametría de electrodo de fieltro de grafito sin recubrimiento, voltametría de FePc en disolución y voltametría de electrodo de grafito modificado con FePc (condiciones inertes con N2 y O2 a una presión de 5 psi de cada gas). Todos los experimentos se hicieron por triplicado.
Caracterización de electrodos modificados
Los electrodos modificados con FePc se examinaron con microscopía de barrido electrónico (SEM, Hitachi S3700N). Las muestras se fijaron durante 24 h en solución Karnovsky, se lavaron tres veces con disolución amortiguadora de fosfato (0,1 mol/L, pH=7,2) y, por último, se deshidrataron mediante un gradiente ascendente de etanol (30, 50, 70, 80, 90, 100%). Se secaron en secador de punto crítico con dióxido de carbono. Las muestras se colocaron en bases metálicas utilizando cinta de carbono doble cara y se recubrieron en un cobertor iónico de oro antes de ser observadas en el microscopio electrónico de barrido.
Resultados y discusiones
Como se muestra en la Figura 1, la CCM consistió en un diseño de celda tipo H o de dos cámaras. En la imagen SEM del ánodo se observó la formación de una biopelícula, conformada por una comunidad microbiana que presentaba buena adhesión y diversidad (parte A). La imagen del cátodo (parte C) muestra las fibras del fieltro modificadas con ftalocianinas de hierro; el análisis de microscopía electrónica de barrido acoplada a rayos X de energía dispersiva (SEM- EDX) muestra que el hierro quedó disperso homogéneamente en el electrodo de fieltro de grafito (el hierro se muestra en color amarillo) y se encuentra adherido de forma adecuada.
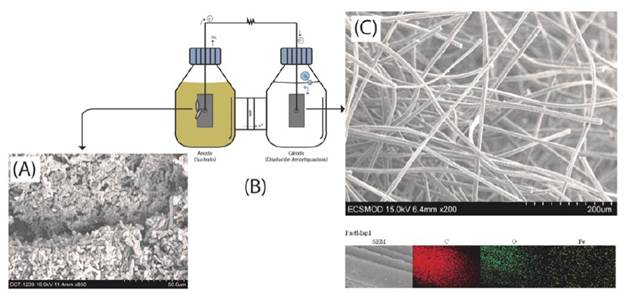
Figura 1 Celda microbiana utilizada en el desarrollo de los experimentos. (A) Imagen SEM de la biopelícula en el ánodo (850 aumentos). (B) Diagrama de celda. (C) Imagen SEM del electrodo modificado (200 aumentos) escaneo EDX.
Caracterización del sustrato
La caracterización fisicoquímica del agua residual permite cuantificar la composición del sustrato y estimar la fracción que puede ser degradada por los microorganismos presentes en la CCM, lo cual es de gran importancia para los procesos de transformación de la materia presente en el dispositivo, ya que están relacionados con la generación eléctrica a partir de la misma.
En la Tabla 1 se muestran los resultados de la caracterización fisicoquímica del sustrato que corresponde al agua residual del proceso húmedo con remoción mecánica de mucílago, mayoritariamente compuesto de agua de despulpado, restos de pulpa y mucílago (crudo o hidrolizado). Estos componentes corresponden, en general, a los azúcares sencillos como la fructuosa y glucosa provenientes de la pulpa, así como carbohidratos complejos como las pectinas y material lignocelulósico que forman parte del mucílago y restos de pulpa [37].
Tabla 1 Caracterización fisicoquímica del agua residual del procesamiento del café utilizada en la cámara anódica de la CCM.
La mayoría de estos carbohidratos presentan procesos de oxidación en el agua residual que generan varios tipos de ácidos orgánicos volátiles como el ácido acético, propiónico y butírico, responsables del pH ácido en el sustrato. El pH del sustrato es clave para determinar el tipo de microorganismo que es capaz de sobrevivir y alimentarse bajo estas condiciones ambientales, por ejemplo, miembros de las familias Lactobacillus, Streptococcus y Acetobacter [38].
En cuanto al material lignocelulósico, se observa que el sustrato es rico en celulosa y derivados; el análisis de fibras con detergente ácido y neutro permite diferenciar el tipo de polímero que lo conforma. Para el agua residual de café se encontró que 3,2 g/100 g corresponde a hemicelulosa, 4,8 g/100 g a celulosa y 11,5 g/100 g a lignina más cutina. En general, la degradación anaerobia de este tipo de material se puede llevar a cabo por una variedad de microorganismos con distintas características fisiológicas, por ejemplo, miembros de las familias Clostridium, Ruminococcus, Caldicellulosiruptor, Acetivibrio, Butyrivibrio, Halocella, Fibrobacter, Bacteroides y Spirochaeta [39].
Se observa que el sustrato es rico en lignina, lo que dificulta su degradación anaerobia [40]. Para el caso del sustrato empleado, esto representa una desventaja, pues las condiciones de degradación de la CCM se consideran compuestos químicos de baja degradabilidad en el sistema electroquímico de la CCM. Caso contrario sucede con los azúcares encontrados en la muestra, que se comportan como una fuente primaria de energía para los microorganismos, los cuales pueden ser totalmente degradados al final de cada ciclo de operación de la CCM.
El contenido de sólidos totales (ST) de la muestra es muy bajo. Es normal observar pocos sólidos en el agua residual del procesamiento del café, ya que la mayoría de la pulpa es removida y los restos de mucílago crudo o hidrolizado representan un bajo porcentaje en masa del grano en procesado. Usualmente, para sistemas de tratamiento de agua residual, se considera un digestor líquido (L-AD) si el sustrato contiene ST menor a 15% y digestor de tipo sólido (SS-AD) mayor a 25% [41]. Proporciones tan bajas de ST son prácticamente desfavorables en digestores anaerobios, pues la generación de metano requiere una alta carga orgánica sólida para llevar a cabo esta reacción; sin embargo, en una CCM el bajo contenido de sólidos no es una limitante, debido a que el producto de oxidación no es metano sino dióxido de carbono; a partir de los ácidos orgánicos producidos por la degradación microbiana [42].
La relación C:N del sustrato es baja con respecto a residuos similares de la agroindustria, que son altos en material lignocelulósico. Para sustratos biodegradables, la relación C:N óptima está en el rango de 25 a 35 [43]; sin embargo, para los materiales que son resistentes a la degradación microbiana, esta relación puede llegar a valores tan altos como 40. De hecho, una relación C:N excesivamente alta provoca un aumento en la formación de ácido que inhibe la producción de metano y ocasiona que el proceso de descomposición sea más lento. Se ha mostrado que esto influye en la tasa de descomposición de estos sustratos [43, 44].
La sumatoria de todos estos componentes oxidables en el aguamiel resulta en una alta demanda química de oxígeno, que engloba la principal problemática del residuo: una alta carga contaminante para cuerpos de agua superficial.
Influencia de variables sobre la generación de corriente eléctrica
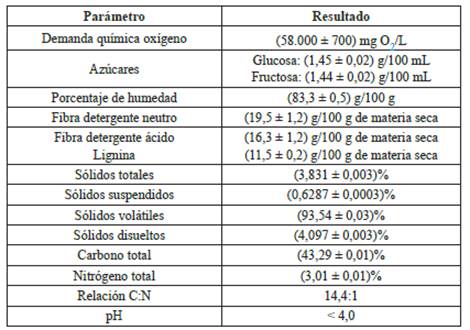
La ecuación (1) muestra el modelo obtenido para el diseño experimental planteado:
Donde I max corresponde a la corriente máxima. La interacción de variables en el modelo se denota con dos puntos.
Dado que la CCM empleada trabaja en modo de lote, el efecto de la cantidad de alimento que se le proporciona a los microorganismos es de gran relevancia para las respuestas de interés (corriente máxima y remoción de DQO).
De acuerdo con el modelo obtenido, la carga orgánica del sustrato mostró un efecto positivo en la corriente máxima generada (Tabla 2); conforme disminuye la concentración del sustrato, se observa una menor disponibilidad de alimento para las comunidades microbianas y, por ende, una clara disminución de la corriente máxima. Esto indica que el sustrato no necesitaría ser diluido para poder ser procesado por la CCM; altas concentraciones de materia orgánica en biodigestores son usualmente relacionadas con problemas de inactivación por floculación de los sólidos, inhibición directa, sobrecarga de ácidos libres [43], y en el caso de las CCM en específico, la inactivación de la membrana por la biopelícula.
Tabla 2 Resumen de resultados del valor de probabilidad p (α = 0,05) del análisis ANOVA, aplicado a las variables respuesta del diseño experimental.
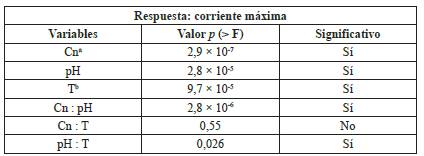
Cna corresponde a concentración, Tb corresponde a temperatura.
Además, se conoce que el pH es un factor determinante para el tipo de comunidades microbianas que pueden existir en el medio utilizado [45]. En el sustrato empleado como inóculo se pueden encontrar varios géneros de microorganismos capaces de sobrevivir o no bajo distintas condiciones de pH [46].
En este experimento se observó una correlación significativa positiva con el pH nativo del agua residual. La degradación de carbohidratos complejos lleva consigo una acidificación inherente del medio; en procesos de degradación anaerobia esto implica una problemática, ya que inhibe a los microorganismos metanogénicos si el medio no posee la capacidad amortiguadora suficiente. En el caso de las CCM, esto no representa un problema, pues es un proceso de una fase; una vez realizada la transferencia de electrones de la respiración celular, los electrones son transferidos intracelularmente para completar la hemirreacción en la cámara catódica con la reducción de oxígeno [47, 48].
Al utilizar pH neutro se observo una disminución de la corriente máxima generada; este comportamiento se puede explicar debido a que las comunidades microbianas tienen un pH óptimo de crecimiento. Miembros de las especies del género Lactobacillus son capaces de desarrollarse a pH bajo. El agua residual en el procesamiento del café tiene un pH inferior a 4,0, y se han identificado varias especies del género Lactobacillus spp en este tipo de sustrato [49, 50].
El utilizar dos temperaturas diferentes en el diseño, define el tipo de comunidad microbiana que crece en la CCM [5]. La variable de temperatura también fue significativa en el análisis ANOVA, lo que indica que es esencial el control de temperatura en el proceso de generación de energía, ya que regula la eficiencia de los procesos metabólicos microbianos y la comunidad microbiana que se desarrolla. En este caso, a mayor temperatura (35 °C) se observó una mayor corriente máxima en la CCM; este resultado es lo esperado para un sistema con una comunidad microbiana de tipo mesofílica en las condiciones del experimento.
Las bacterias y hongos mesofílicos poseen una temperatura óptima de metabolismo y crecimiento entre 20-40 °C, por lo cual la incubación de las celdas en este ámbito de temperatura resulta positiva [51, 52]. En términos prácticos, la operación de las celdas a una temperatura diferente a la temperatura ambiente requiere una inversión para mantener esta variable constante. El impacto de la temperatura sobre la corriente producida es menor, comparado con el de la concentración y el pH, por lo cual debe ser objeto de investigación si es realmente beneficioso, desde el punto de vista económico, mantener el sistema bajo temperatura de 35 °C.
El análisis planteado demostró la complejidad de las CCM como sistemas de generación eléctrica mediante el uso de microorganismos, además de la necesidad de controlar una serie de factores para mejorar el rendimiento de la celda.
Modificación del cátodo
La modificación a la superficie del electrodo de la cámara catódica con catalizador de ftalocianinas de hierro (II) (FePc) sobre nanotubos de carbonos de multipared (MWCNT), mostró una mejora en la eficiencia de producción de energía eléctrica; esta mejora de la actividad electroquímica se atribuye a la naturaleza química de los MWCNT y a las interacciones de tipo n entre el macrociclo aromático de las FePc y las paredes laterales de los nanotubos [53].
La superficie del electrodo se analizó con imágenes SEM y con espectrometría de energía dispersiva de rayos X. Se confirmó la deposición exitosa del recubrimiento catalítico sobre el electrodo con el método empleado, en una concentración de 1,6% en masa por área analizada. Además, se detectó oxígeno en la superficie proveniente del proceso de funcionalización/acondicionamiento de los MWCNT con ácido nítrico; estas observaciones se pueden confirmar en el perfil elemental obtenido mediante la misma técnica, en la Figura 1, el cual denota un recubrimiento uniforme sobre la superficie.
En la Figura 2 se observa el comportamiento de la corriente durante una corrida de la CCM con electrodo catódico modificado y sin modificar; la diferencia en el tiempo en el cual se observa un valor de corriente distinto a cero es muy clara. El electrodo de fieltro sin recubrimiento catalítico requiere cerca de 30 h para generar corriente, mientras que el electrodo modificado genera una corriente a pocas horas de cerrar el circuito e iniciar la medición, lo cual evidencia la acción del catalizador sobre la celda. Se observa que la celda con electrodo modificado presenta 60% más de eficiencia que la celda sin modificar, confirmando la acción del catalizador, al acelerar la cinética de reducción de oxígeno en la cámara catódica, por ende, mejorando la cantidad de electrones que se transfieren desde el sustrato hacia el ánodo.
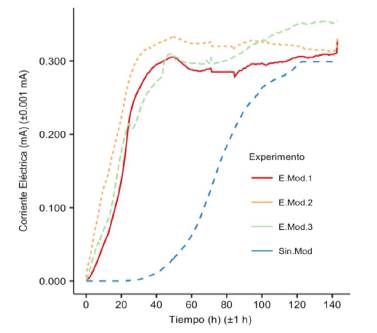
Figura 2 Comparación de la corriente en función del tiempo para una CCM con cátodo modificado con FePc/MWCNT y una CCM con cátodo de grafito sin modificar.
La actividad electrocatalítica del electrodo modificado con FePc/ MWCNT se examinó con una voltamperometría cíclica en 0,1 mol/L de amortiguador de fosfatos (pH = 7) saturado en aire o en nitrógeno. Como se observa en la Figura 3, en el experimento saturado con nitrógeno se aprecia la presencia de una señal de oxidación de la FePc (II); este valor es esperado para un catalítico que debe adsorber oxígeno reversiblemente. Se observa, además, en la misma figura, que la voltametría en nitrógeno no muestra signos de actividad catalítica del compuesto, con ausencia de señales en el rango de -0,100 V a +0,650 V vs. Ag/AgCl, en la voltametría correspondiente a la solución saturada en aire; la presencia de oxígeno permite dar paso a la ORR y dar su corriente de reducción catalítica; la señal se aprecia a un voltaje de +0,650 V vs. Ag/AgCl para este sistema; este potencial está dentro del ámbito esperado para la ORR a pH = 7 y confirma la actividad del compuesto. El análisis se llevó a cabo durante n ciclos (n = 200), y únicamente se observó actividad ORR durante los primeros dos, lo que muestra inestabilidad de la FePc en disolución.
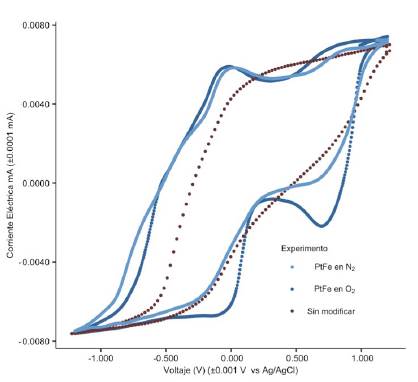
Figura 3 Voltametría cíclica vs. Ag/AgCl de un electrodo de grafito sin modificar, modificado con FePc/MWCNT con purga de nitrógeno y modificado FePc/MWCNT aireado, empleando 0,1 mol/L de amortiguador de fosfatos (pH = 7) como electrolito soporte y velocidad de escaneo de 10 mV/s.
Caracterización del ánodo
Un aspecto que afecta significativamente el rendimiento de la celda es la formación de una buena biopelícula; se busca la uniformidad en toda la superficie del electrodo para que disminuya la resistencia interna del dispositivo.
La corriente generada por las celdas es dependiente de las bacterias presentes en los electrodos; en el caso de las celdas alimentadas con el agua residual del procesamiento de café, se observa una comunidad microbiana presente en la biopelícula (Figura 4), que en estudios preliminares fueron determinados como pertenecientes a las bacterias acido-lácticas (BAL), del cual muchas especies han sido reportadas como bacterias electrogénicas [54-56]. Las especies predominantes, además de hongos y algunas levaduras, en las celdas microbianas con sustrato de aguamiel de café son Lactobacillus casei y Latobacillusparacasei [57], estos resultados concuerdan con el uso de bacterias de estas especies en celdas microbianas por otros autores [50].
Conclusiones
La investigación realizada permitió establecer la factibilidad de utilizar agua residual del procesamiento del café como sustrato en un dispositivo con funcionalidad dual: la disminución de la carga orgánica del agua residual que se produce en los beneficios de café y la generación de potencia eléctrica.
La caracterización fisicoquímica del agua residual permitió confirmar la naturaleza lignocelulósica del material, esto con base en el análisis de los residuos generados durante el beneficiado húmedo de café en cada una de sus etapas. El bajo contenido de sólidos totales (menor a 4%) es esperado para el tipo de residuo y clasifica a la cámara anódica como un digestor de tipo líquido; sin embargo, esto permite un ágil transporte de masa dentro de la cámara anódica y no es una limitante para la producción de dióxido de carbono en la CCM. La relación C:N es otro factor de importancia en la caracterización, ya que su valor (14,4:1) no se encuentra en el rango óptimo para un sustrato de alimentación de este tipo de celdas; sin embargo, los porcentajes de remoción de materia orgánica oscilaron entre 10% y 30%, esto amerita más investigación para mejorar este rendimiento, ya sea a partir de una cadena de celdas o de un cambio en la relación C:N.
Si bien el sustrato no posee nutrimentos de fácil degradabilidad para las bacterias, por sus altos niveles de fibras (lignina, hemicelulosa y celulosa), las CCM son proyectadas para trabajar en periodos largos de tiempo en fase estacionaria con un tiempo de retención hidráulico adecuado, por lo que, al optimizar este tiempo, los porcentajes de remoción de DQO pueden aumentar.
La exploración de variables influyentes en el desempeño de la CCM diseñada permitió confirmar el efecto estadísticamente significativo de las variables de pH, carga orgánica y temperatura sobre la corriente máxima generada y sobre la demanda química de oxígeno. Se observó un comportamiento óptimo bajo condiciones de pH nativo (4,0-5,0), con carga orgánica sin diluir y a una temperatura de 35 °C; un adecuado establecimiento de la comunidad microbiana y un rango óptimo de parámetros para la degradación de materia orgánica permiten que el desempeño de las CCM, empleando agua residual del procesamiento del café, sea posible.
Las CCM son dispositivos bioelectroquímicos de alta complejidad, por lo cual es recomendable repetir el proceso de optimización con otras variables secundarias que no se analizaron en este trabajo; por ejemplo, el tiempo de operación de la celda (periodos más extensos), la inoculación de la celda (emplear un inóculo conocido) y el tipo de ánodo (forma y tipo de grafito que beneficien la formación de una biopelícula exitosa).
En cuanto a la modificación de la superficie del cátodo, se encontró que el catalizador FePc acelera de forma exitosa la cinética de la reacción ORR en una CCM. A una concentración de 1,14 mg/cm2 fue posible observar una disminución en el tiempo de arranque de la CCM (30 veces más rápido), además de un aumento del 60% en la eficiencia coulómbica con respecto al cátodo sin modificar. Si bien estos resultados son prometedores, la CCM exhibió solo un 20% de la potencia descrita en la literatura; esto se atribuye principalmente a la resistencia interna del sistema.
El tipo de sustrato y las reacciones electroquímicas seguirán limitando el rendimiento de las celdas, además que es importante reconocer que muchos residuos no pueden ser adecuados para su alimentación; no obstante, existen diferentes estrategias y oportunidades para mejorar aún más la capacidad de generación de energía en las CCM. Si bien con el estado actual del conocimiento no es posible utilizar las CCM para la generación de una cantidad importante de energía, ya que las densidades de potencia son aún bastante bajas, mediante su uso se puede recuperar parte de la energía empleada durante los procesos agroindustriales. Además, permite la remoción de materia orgánica convirtiéndose en una alternativa interesante para el tratamiento de aguas residuales del procesamiento del café en un beneficiado en Costa Rica.