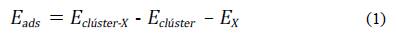Introducción
La combustión incompleta de combustibles fósiles produce monóxido de carbono (CO), un gas incoloro, inoloro, muy venenoso y contaminante [1]. Puede derivarse tanto de actividades antropogénicas como de fuentes naturales. Las principales fuentes humanas son las emisiones realizadas por automóviles, estufas, fogones de gas, sistemas de calefacción, entre otros [1-3]. A nivel mundial, la intoxicación por CO es de 17,5 casos por cada 100.000 habitantes [4]. En Colombia se ha encontrado intoxicación por CO en alrededor de 20.000 a 25.000 casos anualmente [4, 5]. El límite permisible de exposición (PEL, por sus siglas en inglés) establecido por la Administración de Seguridad y Salud Ocupacional de los Estados Unidos de Norteamérica (OSHA) para el CO es de 50 ppm, en promedio, durante un período de 8 h [6]. Otro gas con características similares al CO, que también se produce en la combustión de combustibles fósiles, es el dióxido de carbono (CO2). Este es un gas incoloro e inodoro, cuyas concentraciones al aire libre varían entre 300 y 500 ppm [7-9]. El PEL actual de la OSHA para este gas es de 5.000 ppm en promedio, durante un período de 8 h. Una exposición prolongada a altas concentraciones puede generar varios problemas de salud e incluso la muerte [10]. Sin embargo, el uso de CO2 como fuente alternativa en la producción de nuevas sustancias o materiales es un tópico de especial interés en la actualidad.
Una alternativa para disminuir el impacto en la salud a la exposición a este tipo de gases, es el uso de hidrógeno (H2) como combustible en vehículos automotores [11-13]. Las celdas de combustible con membrana de intercambio protónico (PEMFC, por sus siglas en inglés) generan corriente eléctrica a partir de la combustión de hidrógeno (H2) con oxígeno (O2) en fase gaseosa y generan vapor de agua (H2O) como único producto de la reacción [14, 15]. En la actualidad, más del 95% del hidrógeno se produce mediante el reformado de metano en donde como subproducto se obtiene monóxido de carbono (CO) [1]. Los residuos de CO en el H2 así producido pueden envenenar el catalizador de la PEMFC. Para el óptimo desempeño de las PEMFC, el límite aceptable para las concentraciones de CO en las corrientes de H2 es de 10 ppm cuando se utiliza Pt como catalizador, y de 100 ppm cuando se utilizan aleaciones de platino-rutenio (Pt-Ru) tolerantes a CO [16,17]. Los niveles de CO en el H2 producido por reformado suelen estar por encima de estos límites. Considerando estos hallazgos y la importancia de remover el CO de las fuentes de H2 antes de que este entre a la celda, se considera relevante el planteamiento de nuevas soluciones para la limpieza de corrientes de hidrógeno que alimenten las celdas de combustible, desde el punto de vista experimental y computacional con materiales novedosos y altamente selectivos.
Una posible solución a este problema, es el diseño e implementación de nuevos catalizadores metálicos efectivos para la adsorción del CO y su oxidación selectiva a CO2 [18-20]. Este proceso se conoce como "oxidación preferencial de CO" y es de bajo costo y fácil de implementar. En este sentido, la catálisis con metales de transición desempeña un papel enorme en la industria química moderna, y dedica mucho de su esfuerzo a comprender este fenómeno y al diseño y desarrollo de catalizadores heterogéneos basados en grupos metálicos con alta actividad, selectividad y estabilidad [21, 22]. El rango de propiedades de los sistemas metálicos puede mejorarse y en tanto generar un efecto sinérgico tomando mezclas de elementos. Se ha encontrado que las interacciones intermetálicas en catalizadores bimetálicos conducen a una mejora en el rendimiento catalítico [21, 23]. Estos catalizadores bimetálicos han mostrado ser efectivos en una amplia gama de aplicaciones, como la hidrogenación de hidrocarburos insaturados [24], oxidación de CO [25], epoxidación de propileno [26], desplazamiento de gas de agua [27, 28], entre otras.
Los catalizadores de platino (Pt) tienen la desventaja de tener baja actividad a bajas temperaturas (cercanas a los 100 °C, que es la temperatura máxima de operación de las PEMFC) [29]. El Au ha demostrado ser activo a temperaturas menores a 100 °C, pero su actividad es, por lo general, más baja en comparación con los metales hidrogenantes clásicos (e. g.: Pd, Pt, Ni) [30]. Por esto, se ha propuesto adicionar un segundo metal para mejorar la actividad del catalizador monometálico. El paladio (Pd), por ejemplo, se ha utilizado en diferentes reacciones industriales como oxidación [31], hidrogenación [32], combustión de metano y varias reacciones de acoplamiento [33]. Por su lado, el Pt es un elemento de especial interés por su versatilidad en diferentes reacciones, entre las cuales se encuentran la oxidación y la reducción de compuestos orgánicos [34]. Considerando las ventajas de los tres metales: Au, Pd y Pt en diferentes transformaciones catalíticas, se han ensayado clústeres bimetálicos del tipo Au-Pd y Au-Pt para la oxidación catalítica de monóxido de carbono, encontrándose resultados promisorios [35, 36].
Considerando la problemática de la remoción del CO de las corrientes de hidrógeno por medio de su oxidación selectiva, antes de que estas entren y alimenten las celdas, esta investigación tiene como objetivo principal determinar si hay efecto sinérgico favorable sobre la reactividad de nonámeros de Au, Pt y Pd al reemplazar 1 átomo por otro de los ya mencionados frente a la adsorción y posterior oxidación de CO a CO2 de manera selectiva. Para ello, se optimizó la geometría y se calculó la reactividad de nanoclústeres mono y bimetálicos de Au 9 , Au 8 Pd, Au 8 Pt, AuPd 8 , AuPt 8 , Pd 9 y Pt9 en presencia de CO, mediante el uso de la Teoría del Funcional de la Densidad (DFT). Además, se determinó cuál clúster presentaba una mayor favorabilidad térmica en la oxidación del CO acorde con el mecanismo de reacción propuesto e investigado.
Materiales y métodos
Determinación de la reactividad de los clústeres
Se estudiaron los clústeres de nueve átomos Au 9, Au 8 Pd, Au 8 Pt, AuPd 8, AuPt 8 , Pd 9 y Pt9, con el objetivo de determinar el efecto de incluir un segundo metal en los clústeres de Au 9, Pd 9 y Pt 9. La elección del tamaño de clúster fue realizada acorde con el GapHOMO-LUMO; con base en ello, se obtuvo que el clúster más reactivo es Au 9 para el grupo de clústeres de 6 a 9 átomos de oro. GapHOMO-LUMO (eV): Au6: 0,20, Au7: 0,15, Au8: 0,17, Au9: 0,13; los cuales se calcularon con la aproximación CAMB3LYP/LANL2DZ. Las estructuras más estables se determinaron considerando las tres multiplicidades más bajas (singlete, triplete y quinteto o doblete, cuarteto y sexteto, para número par e impar de electrones, respectivamente), resultando en cada caso la mayor estabilidad para la multiplicidad más baja.
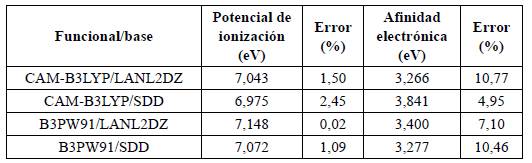
Para esta investigación, se eligió el funcional B3PW91 y la base LANL2DZ, ya que se ha encontrado que predice resultados óptimos para los grupos de metales de transición [37-39]. Además, se realizaron cálculos de propiedades energéticas, tales como el potencial de ionización (PI) y la afinidad electrónica (AE) para el clúster de Au9, combinando los funcionales CAM-B3LYP y B3PW91 con las bases LANL2DZ y SDD. Se compararon dichos resultados con los resultados experimentales reportados en la literatura, y se encontraron los menores errores en el caso del PI para la combinación B3PW91/LANL2DZ (Tabla 1) y en el caso de la afinidad electrónica para CAM-B3LYP/SDD. Considerando el potencial de ionización como parámetro crítico en la selección de la base y el funcional, para la presente investigación se seleccionó la combinación B3PW91/LANL2DZ.
El porcentaje de error se calculó con base en lo reportado experimentalmente en [40] y [41] (potencial de ionización experimental: 7,15 eV, afinidad electrónica experimental: 3,66 eV).
Además, se determinaron los descriptores de reactividad global de potencial químico electrónico (μ), dureza global (η), índice de electro-filicidad global (ω) y la brecha de energía HOMO-LUMO, con el objetivo de determinar el sistema más reactivo, utilizando el programa TAFF con el método de diferencias finitas (TAFF: análisis topológico de la función Fukui) [42]. Como descriptores de reactividad local se calcularon los índices de Fukui. El cálculo de las cargas atómicas se obtuvo a partir del modelo establecido por Hirshfeld [43].
Determinación del mecanismo de reacción
Luego de determinar cuáles eran los clústeres metálicos/bimetálicos más reactivos, se calcularon las energías de adsorción de CO y de O2, con el objetivo de dilucidar la etapa inicial por la que comienza el mecanismo de reacción. Las energías de adsorción se calcularon de acuerdo con la ecuación (1).
Donde X = CO u O2, Eclúster-X es la energía total del complejo formado por el clúster con Xadsorbido, E clúster es la energía total del clúster aislado y EX es la energía total de la molécula de Xaislada. Los estados de transición se calcularon mediante el algoritmo de optimización de Berny. A partir de estos resultados se calcularon los cambios de entalpía y energía libre de Gibbs de las reacciones. Para todos los cálculos puntuales de energía, de optimización, de frecuencias, de IRC y poblacionales se empleó el paquete de programas Gaussian 09 [44, 45]. Para todos los sistemas reportados como mínimos sobre las superficies de energía potencial se corroboró que solo presentaran frecuencias positivas, mientras que para los estados de transición se observó la presencia de una frecuencia negativa. Además, se realizó el cálculo de la IRC con el objetivo de determinar la ruta de reacción para cada uno de los estados de transición determinados.
Resultados y discusión
Análisis estructural
En la Tabla 2 se muestran las distancias promedio encontradas para los enlaces Au-Au, Au-Pt, Au-Pd, Pt-Pt y Pd-Pd para cada clúster optimizado en el presente estudio. Se determinó que para el clúster Au8Pt las distancias promedio de enlace Au-Au y Au-Pt son de 2,73 Å y 2,75 Å, respectivamente; que comparado con lo reportado en la literatura de manera computacional presentan diferencias de 0,02 Å y 0,01 Å, respectivamente. Para el clúster AuPt8 la longitud promedio de los enlaces Au-Pt fue de 2,81 Å y en el caso de los enlaces Pt-Pt fue de 2,87 Å. La Figura 1 muestra que los clústeres con mayor número de átomos de platino son tridimensionales en comparación de aquellos que tienen más átomos de oro; es decir, la inclusión de átomos de Pt convierte la estructura del clúster de Au de plana a tridimensional, lo que está de acuerdo con lo observado en otros estudios reportados [46]. Esto ocurre, tal vez, debido a la inserción de un átomo de menor tamaño atómico (Pt) a la red de clúster de Au. La generación de espacios en la red genera una reorganización del clúster, lo cual conduce al cambio en la estructura del clúster, pero generando isómeros estructurales de esos clústeres debido a la estructura electrónica similar. El cambio a estructuras tridimensionales se ven favorecidas por las interacciones spin-órbita con respecto a las estructuras bidimensionales. Este tipo de peculiaridades ha sido observado en el caso de las típicas configuraciones de dos dimensiones para clústeres de Au [47, 48]. Con respecto a los clústeres de Pd (Pd- Pd y Au-Pd), se puede notar que las distancias son similares a las de los clústeres de Pt (Pt-Pt y Au-Pt), con variaciones de menos de 0,1 Å. Cuando se introduce un átomo de Pd al clúster que contiene solo Au, la distancia Au-Au se hace mayor (2,78 Å) en comparación con el sistema que contiene un átomo de Pt (2,73 Å). Esto es consistente con el hecho de que el Pt y el Au tienen una configuración electrónica similar (diferencia de solo un electrón de valencia) y tanto en su densidad electrónica como en su radio atómico tienen valores semejantes. En el caso del Pd, la menor cantidad de electrones tanto de valencia como de core genera diferencias más notorias en las distancias de enlace.
Tabla 2 Distancia de enlace (Å) entre los átomos Au-Au, Au-Pt (Au-Pd) y Pt-Pt (Pd-Pd) en los diferentes clústeres.
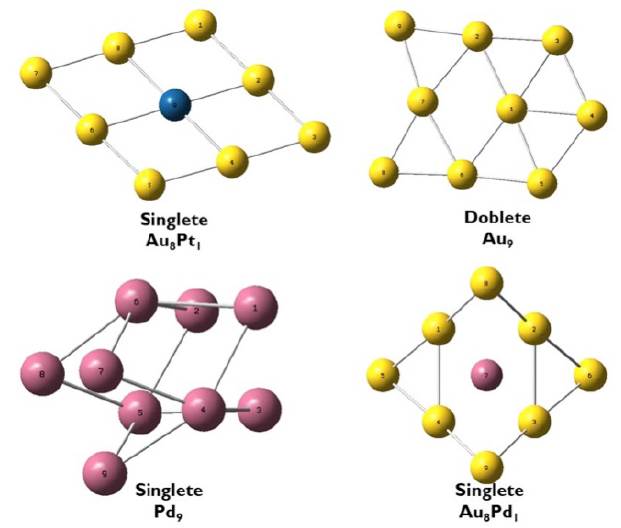
Figura 1 Estructuras estables para sistemas de Au-Pt y Au-Pd, además de los clústeres Pt 9 , Pd 9 y Au 9 . El azul corresponde a Pt, el amarillo a Au y el violeta a Pd.
A medida que se reemplazan los átomos de Au por átomos de Pt, la longitud promedio de los enlaces Au-Pt aumenta y las distancias de los enlaces Au-Au y Pt-Pt disminuyen, hasta llegar al clúster Pt9, el cual tiene la longitud promedio de enlace Pt-Pt más corta entre los sistemas estudiados. Este hecho podría implicar enlaces más fuertes y, con seguridad, más estables. Por otro lado, la estructura de paladio (en Pd9) toma una disposición compacta deltaédrica. Se pensaría, en estos casos particulares, por corresponder a sistemas monometálicos, que la estructura geométrica fuera plana; sin embargo, esto no es lo observado, dado que no corresponden a los mínimos en las superficies de energía potencial local [49].
En cuanto a la multiplicidad de los clústeres, es importante indicar que la multiplicidad es mayor para el átomo de paladio 4d10 en el clúster que contiene solo este tipo de átomo, es decir, quintete [50]. Esto puede explicarse por el hecho de que parte de la densidad 4d se promueve en la órbita de los 5s para proporcionar enlaces metal-metal estables. Por otro lado, la baja multiplicidad del clúster Au9 puede ser atribuida al electrón en la capa 6s, el cual es capaz de inducir un vínculo metal-metal más estable que en el clúster Pd 9 .
Análisis de reactividad global
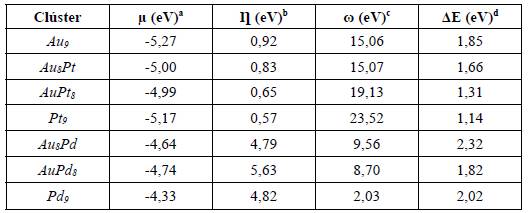
Considerando las propiedades geométricas obtenidas para cada uno de los clústeres seleccionados, se estudiaron otras características tanto topológicas como electrónicas. En la Tabla 3 se presentan los potenciales de ionización y afinidades electrónicas calculados. Como se puede observar, ocurren ligeros cambios después de la incorporación de Pt o Pd al clúster de Au. En comparación con los reportes dados en la literatura para los sistemas compuestos con Pt, se puede observar que el porcentaje de error para el potencial de ionización (PI) no excede el 7,4%, mientras que para la afinidad electrónica (AE) llega hasta un valor de 13,9%. Sin embargo, es importante resaltar que para la mayoría de los casos la incorporación tanto Pt como de Pd cambia de manera ligera los valores de los dos parámetros analizados. Como se comentó antes, el Pt tiene una configuración electrónica similar a la del Au, mientras que el Pd tiene menos electrones (totales y de valencia) con respecto tanto al Pt como al Au. Esto implica que los valores tanto de PI como de AE estarán fuertemente influenciados por el comportamiento electrónico de cada elemento en el clúster, lo cual está ampliamente respaldado por los valores obtenidos indicados en la Tabla 3. En general, el sistema Pd 9 fue el que presentó menor PI mientras que el Pt 9 presentó el valor más alto de PI.
Tabla 3 Valores del potencial de ionización (PI) y afinidad electrónica (AE) para los diferentes clústeres de Au-Pd y Au-Pt.
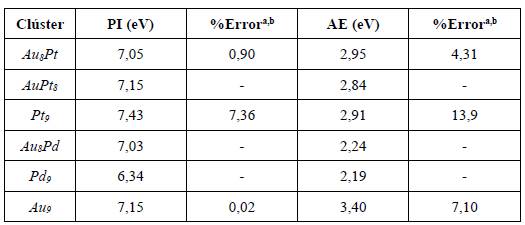
aAusPt: PI = 6,99 eV y AE = 2,83 eV [46, 51]. h Pt g : PI = 6,92 eV y AE = 2,55 eV [52]. Los valores de PI y AE para el clúster de Au> se reportan en la Tabla 1.
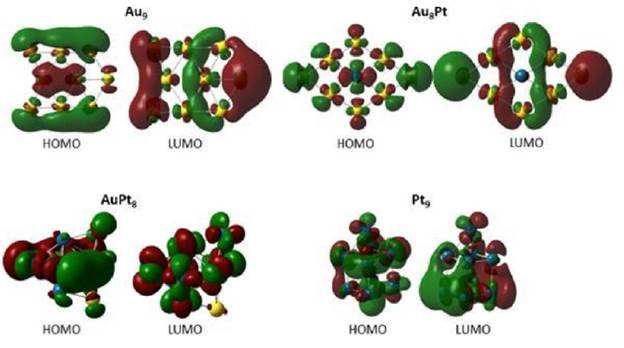
Figura 2 Esquema de los orbitales frontera (HOMO y LUMO) para los diferentes clûsteres Au 9 , AusPt, AuPts y Ptg.
En la Tabla 4 se muestran las diferencias energéticas obtenidas entre los orbitales HOMO y LUMO (GapHoMO-LUMO), la cual se puede utilizar para predecir la estabilidad de los complejos de metales de transición (las representaciones esquemáticas de algunos clústeres seleccionados se muestran en la Figura 2). Es bien reconocido que un valor bajo de la diferencia entre el HOMO y LUMO indica que la especie química (clúster, molécula, átomo, radical, entre otros) será más reactiva [53]. De este modo, los clústeres con mayor separación HOMO-LUMO fueron Au9 y Au s Pt, mientras que los sistemas con menor GapHOMO-LUMO fueron AuPtt y Pt9. Es importante resaltar que la inclusión de ocho átomos de Pt o incluso tener solo átomos de Pt en cada clúster disminuye de manera notoria los valores del GapHOMO-LUMO, volviéndolos entonces más reactivos. Por otro lado, los clústeres que contienen Pd son menos reactivos que aquellos con Pt dado que presentan valores más altos del GapHOMO-LUMO.
En la Tabla 4 se reportan los valores de los otros índices de reactividad global calculadosjunto con el GapHOMO-LUMO. El potencial químico electrónico mide la tendencia de escape de los electrones en un sistema en equilibrio químico. Entre mayor (es decir, más positivo) sea el potencial químico, mayor tendencia a no estar en el equilibrio los electrones del sistema (en este caso particular, del clúster). En la Tabla 4 se observa que el clúster que presenta el menor potencial químico es Au9 continuando con el clúster Pt9 y finalizando con los de Pd,lo cual muestra que los sistemas bimetálicos son los que tienen la mayor capacidad de transferir electrones junto con el clúster Pd9. En particular, para los casos que contienen Pd dentro de la estructura de los átomos de Au es posible observar que, a diferencia de aquellos materiales que contienen Pt, los valores de potencial químico son menores (es decir, más negativos) siendo más bajo para el sistema que contiene solo Pd. El orden general en términos de reactividad (potencial químico) para los clústeres estudiados es: Au9<Pt9<Au8Pt<AuPt8<AuPd8<Au8Pd<Pd9 .
La dureza global (η) es definida como la resistencia de los electrones a ser transferidos desde un sistema en equilibrio (no de escapar, como se definió en el potencial electrónico). De acuerdo con nuestros resultados, el clúster con menor dureza global es Pt9 seguido de AuPts. Los menores valores de dureza corresponden a sistemas más reactivos. De este modo, se espera que estos dos materiales (Pt 9 y AuPt s ) sean los más reactivos entre el conjunto de sistemas que contienen tanto Pt como Pd. La comparación de los sistemas bimetálicos con Pt y con Pd concuerda con los resultados obtenidos para el potencial químico: se cumple que los materiales que tienen el potencial químico más bajo (es decir, los de Pd) son aquellos que tienen la mayor dureza global, los cuales corresponderán a los clústeres menos reactivos. Además, considerando no solo el menor GapHOMO-LUMO, sino también la menor dureza global, se confirma que el clúster más reactivo es el Pt9.
Finalmente, el índice de electrofílicidad global (w) es la energía de estabilización de un sistema electrónico cuando es saturado por electrones que provienen de los alrededores; es decir, permite distinguir los sistemas más susceptibles a aceptar electrones. Un valor numérico alto de w indicará que el material será más electrófilo mientras que los valores bajos (relativos) indican que el sistema tenderá a ser menos electrófilo.
Como se observa en la Tabla 4, el clúster más electrófilo es el Pt9 seguido de AuPt s. En comparación con los sistemas de Pt, se puede determinar que los materiales sustituidos con Pd no solo son los menos reactivos, sino, además, los menos electrófilos entre todos los materiales estudiados, con valores de índice de electrofílicidad global que varían entre 2,03 y 9,56, los cuales están alrededor del 100% de diferencia con respecto a aquellos que contienen Pt. Aunque si bien los clústeres de Pd son los menos reactivos, esto podría deberse, también, a que la composición de ambos átomos (tanto de Au como los de Pt) no es similar, lo cual es sugerido en la literatura. Clústeres bimetálicos con un número similar de átomos maximizan su estabilización [54].
Análisis de reactividad local
Considerando los anteriores hallazgos de reactividad global, se determinaron las funciones de Fukui para los clústeres que contienen Pt y los valores están indicados en la Tabla 5. Las funciones de Fukui estiman la reactividad de diferentes sitios dentro del clúster, es decir, la selectividad en donde la dirección del ataque sea preferida. En este sentido, el acercamiento o el ataque de un sustrato a un átomo específico del clúster se dará cuando la función de Fukui presente los valores más altos. Las funciones de Fukui se calcularon a partir de las cargas atómicas de Hirshfeld y su análisis se estableció a partir de la probabilidad del ataque nucleofílico (dado el tipo de catálisis -oxidativa- a considerar). Se observa en la Tabla 5 que para el clúster que contiene solo Au (es decir, el Au 9), el átomo 4 es el más susceptible a un ataque nucleofílico mientras que para los sistemas bimetálicos Au8Pt y AuPt8 la mayor probabilidad se puede localizar en el átomo 3 o 7 y 1 o 3, respectivamente (véase Figura 1). Por último, para el sistema que contiene solo Pt (Pt9), el átomo 4 es el que presenta la mayor susceptibilidad a un ataque nucleofílico. Como era de esperarse, los átomos obtenidos en los cuales se puede generar una mayor probabilidad de ser atacados nucleofílicamente, son aquellos en donde se observa una contribución alta del orbital LUMO, lo cual está acorde con los resultados ya mostrados en el análisis de los orbitales frontera. En particular, ha sido reportado que incluso la forma y el tamaño del clúster influencia el número y posición de los sitios disponibles para un ataque nucleofílico y electrofílico, y que, además, tienen una carga negativa centrada rodeada por átomos cargados de forma positiva. Estos últimos están enlazados por interacciones interatómicas de larga distancia [55]. Considerando los hallazgos obtenidos previamente para las características fisicoquímicas de los sistemas bimetálicos constituidos por Pt y Pd e incorporados en el clúster de Au, se determinó la efectividad del uso de los sistemas que contienen Pt en la adsorción y oxidación selectiva del monóxido de carbono. Los resultados se describen en la siguiente sección.
Tabla 5 Funciones de Fukui para los ataques nucleofílicos y electrofílicos, calculadas desde las cargas atómicas de Hirshfeld.
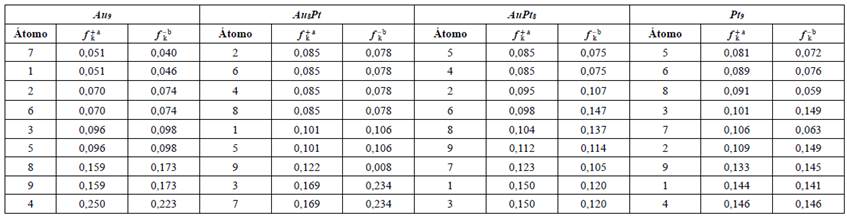
aSusceptibilidad al ataque nucleofílico ( f k + ). b Susceptibilidad al ataque electrofílico ( f k - ) . Véase la numeración de los átomos en la Figura 1.
Mecanismo de reacción
Adsorción de CO
Teniendo en cuenta el análisis de reactividad, se determinó el mecanismo de reacción para los clústeres Au8Pt y el AuPt8, así como de los nonámeros Au9 y Pt9 , para efectos de comparación. Es decir, que, dado el bajo nivel de reactividad de los clústeres con Pd, tales sistemas no fueron incluidos en el análisis general del mecanismo de la reacción de oxidación de CO. Sin embargo, es importante tener en cuenta que estudios previos han reportado también la oxidación del CO en clústeres de Au-Pd, sugiriendo que la adsorción del O2 y del CO es más estable cuando se tiene la mezcla bimetálica, que cuando solo se tienen clústeres monometálicos del mismo tamaño [54]. Esto también es de esperarse para los clústeres reactivos de Au que contienen Pt.
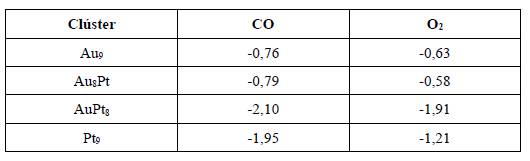
Es bien conocido en la literatura que la adsorción del CO se dará a través del átomo de carbono [54]. Para identificar cuál molécula se adsorbería primero, si CO o el O2. Se realizaron cálculos adicionales considerando la adsorción de ambas moléculas sobre los materiales bimetálicos. Además, se consideraron las funciones de Fukui para el ulterior estudio del átomo, en los cuales existe una mayor probabilidad de adsorción del oxígeno molecular o del monóxido de carbono. Los valores de la energía de adsorción encontrados tanto para el oxígeno como para el monóxido de carbono para cada uno de los clústeres de Au y Pt se indican en la Tabla 6. Los gráficos de los complejos obtenidos después de la adsorción se indican en la Figura 3.
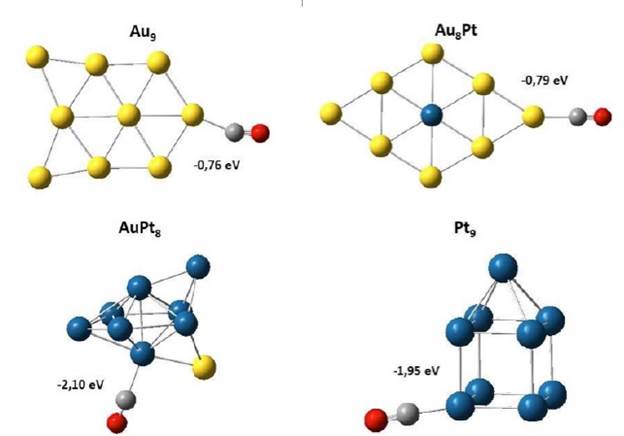
Figura 3 Geometrías optimizadas de la adsorción del CO en los diferentes sistemas monometálicos y bimetálicos de Au y Pt. Los valores en eV indican las energías de adsorción del monóxido de carbono incluyendo la corrección del punto cero. El azul corresponde a Pt, el amarillo a Au, el gris a C y el rojo a O.
La energía de adsorción del CO sobre Au9 fue de −0,76 eV, mientras que para los otros clústeres fueron: Au8Pt = −0,79 eV, AuPt8 = −2,10 eV y Pt9 = −1,95 eV. La comparación de las energías de adsorción indica que los clústeres para los cuales se libera una mayor cantidad de energía y en tanto serán los sistemas más reactivos fueron AuPt8 y Pt9. El sitio más favorable para la adsorción es un átomo de platino enlazado al oro; se encontró que al sustituir un átomo de platino por un átomo de oro se favorece más la adsorción el CO. En este sentido y considerando los hallazgos de la adsorción de CO y oxígeno molecular en cada clúster (véase Tabla 6), se modeló la oxidación de CO sobre cada sistema con el objetivo de determinar las etapas más importantes y los factores electrónicos/superficiales en cada material.
Oxidación de CO
El mecanismo general, incluyendo cada una de las etapas, permite establecer las interacciones de cada uno de los adsorbatos en la superficie de cada clúster. En este sentido, en las Figuras 4 y 5 se muestra la ruta de reacción, incluyendo los estados de transición, de la formación de dióxido de carbono a partir de los sustratos de CO y O2 usando cada uno de los clústeres seleccionados.
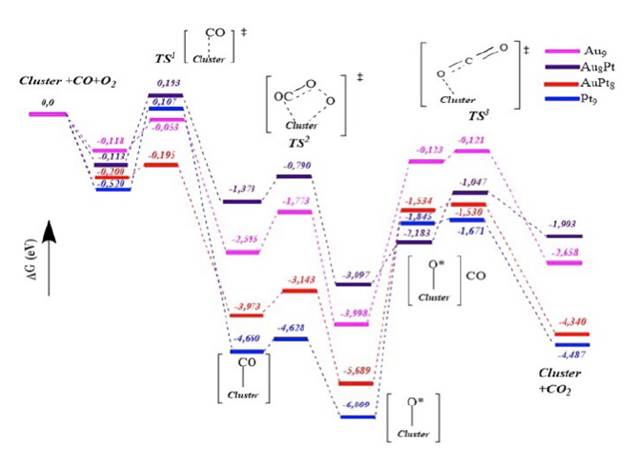
Figura 4 Comparación de los mecanismos de reacción de la oxidación selectiva de CO sobre diferentes clústeres de Au y Pt.
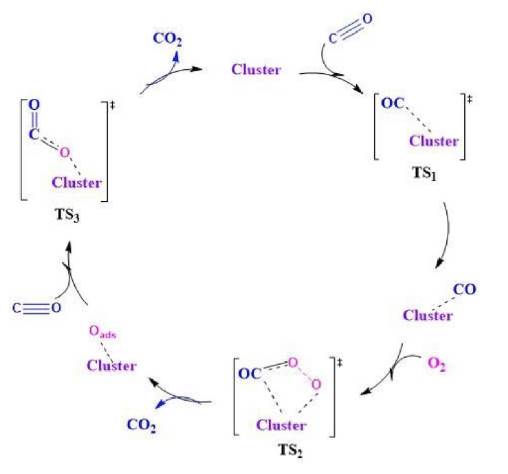
Figura 5 Resumen del mecanismo de reacción de la oxidación de monóxido de carbono sobre las diferentes series de catalizadores seleccionados de Au y Pt.
Se puede apreciar que la reacción se divide en dos etapas: la primera relacionada con la adsorción de una molécula de monóxido de carbono y su oxidación a dióxido de carbono, y luego, la formación de un intermedio oxígeno-clúster que conduce a una descompensación de la superficie del material. En la segunda etapa de la reacción, otra molécula de CO se adsorbe sobre el intermedio oxígeno-clúster y, por último, ocurre una segunda desorción de una molécula de CO2. Como era de esperarse, por cada molécula de oxígeno se producirán dos moléculas de dióxido de carbono generando una alta productividad en los clústeres estudiados. Sin embargo, tanto en los estados de transición como en los intermediarios generados en la adsorción preferencial de oxígeno, cambia drásticamente la adsorción y esto se puede observar en las barreras energéticas obtenidas para cada material.
La comparación de cada uno de los perfiles energéticos se desarrolló en términos de la energía libre de Gibbs, para estudiar la espontaneidad y la favorabilidad termodinámica de cada una de las etapas sobre cada catalizador evaluado. En este sentido, la primera etapa en donde se genera una primera adsorción de las moléculas de CO y O2 presenta energías similares para los clústeres de Au9 y Au8Pt, e incluso para el sistema que contiene un solo átomo de Au en la estructura del material. Sin embargo, resulta más favorable y espontánea para el sistema que contiene solo Pt. En el primer estado de transición que se genera, la adsorción preferencial del CO produce una diferenciación significativa (en términos energéticos) para cada uno de los clústeres, teniendo una energía de activación de 0,065 eV para el clúster Au9, 0,326 eV para el material AuPt8, 0,005 eV para el catalizador AuPt8 y, por último, de 0,107 eV para el sistema Pt9. Teniendo en cuenta estos resultados, se deduce que la primera barrera energética se ve favorecida en el sistema AuPt8 seguido de Au9.
Con posterioridad, la formación de un enlace covalente del carbono sobre cada uno de los clústeres genera un intermediario que se diferencia, en términos energéticos, en ~2 eV. Por ejemplo, para el sistema Au8Pt el valor diferencial de la energía libre de Gibbs fue de −1,37 eV, mientras que para los materiales Au9, AuPt8, Pt9 es de −2,60, −3,97 y −4,66 eV, respectivamente. En el siguiente estado de transición, una molécula de oxígeno se aproxima a cada clúster formando un complejo activado del tipo *OC-O-O* (los * indican reacción o fisisorción con el clúster). En este caso particular, la energía de activación es de 0,830 eV, 0,822 eV, 0,583 eV y 0,032 eV para los clústeres AuPt8, Au9, Au8Pt y Pt9, respectivamente. Al contrario de lo que se expuso en el primer estado de transición, los materiales Au8Pt y Pt9 son los que presentaron menor energía de activación y en tanto los que menos gasto energético requerirán para pasar a la siguiente etapa.
Luego, en la siguiente etapa, se genera la desorción de la primera molécula de dióxido de carbono y se obtiene un oxígeno sobre la superficie produciendo una descompensación electrónica y de masa en el material. De nuevo, en esta etapa, los dos sistemas más espontáneos y en tanto, los más favorecidos termodinámicamente son: AuPt8 y Pt9. Dado que se genera tal descompensación electrónica en el volumen de la superficie de los clústeres, otra molécula de CO se adsorbe y se genera un acercamiento produciendo una etapa adicional. En este caso, el clúster que requiere menor costo energético es el sistema Au8Pt con una diferencia de solo 0,914 eV, mientras que para los otros materiales requiere más de 2 eV para su transformación.
Después del acercamiento entre la molécula de CO hacia la superficie descompensada por el oxígeno incorporado sobre cada uno de los materiales, ocurre un ataque nucleofílico entre la molécula de CO hacia el oxígeno vacante. Esto se da, en particular, por la necesidad de compensar la carga del clúster y generar un balance de masa adecuado en la estequiometría de la reacción. Por último, se genera cada uno de los estados de transición para cada clúster, en donde la energía de activación favorece la formación del dióxido de carbono sobre Au9 y AuPt8, mientras que en los casos de Au8Pt y Pt9 son los materiales donde se requerirá de una barrera energética más alta. De esta manera, se demuestra que, aunque todos los materiales son promisorios en términos de reactividad para la oxidación de CO, el sistema AuPt8 resulta ser uno de los más interesantes para ser evaluado como catalizador heterogéneo, dado que no solo tiene índices de reactividad atractivos, sino que, además, cuenta con las barreras de energías más bajas para la oxidación preferencial del CO.
Conclusiones
En esta contribución, se determinó la reactividad de varios clústeres de Au-Pd y Au-Pt con diferentes características electrónicas. Además, los más promisorios se evaluaron en la reacción de oxidación de CO. En este sentido, se evaluaron diferentes variables electrónicas: dureza global, índice de electrofílicidad, potencial de ionización, análisis del band-gap a partir de los orbitales frontera (HOMO-LUMO) y afinidad electrónica, encontrándose que los clústeres de Au-Pt son más reactivos con respecto a los materiales de Au-Pd. Se pudo observar que el clúster que presenta el mayor potencial químico es AuPt8 continuando con el clúster Au8Pt y finalizando con los de Pd, lo cual muestra que los sistemas bimetálicos son los que tienen la mayor capacidad de transferir electrones. Además, el orden general en términos de reactividad (potencial químico) para los clústeres estudiados es el siguiente: Au9<Pt9<Au8Pt<AuPt8<AuPd8<Au8Pd<Pd9. El análisis de electrofílicidad indicó que el más electrófilo de los clústeres es Pt9 seguido de AuPt8. En comparación con los sistemas de Pt, se determinó que los sistemas sustituidos con Pd (es decir, los clústeres Au-Pd), no solo son los menos reactivos, sino, además, los menos electrófilos entre todos los materiales estudiados, con valores de índice de electrofílicidad global que variaron entre 2,03 y 9,56. De este modo, la segunda etapa de este estudio se centró en la adsorción selectiva de CO sobre cada uno de los clústeres de Au-Pt, constituyendo una herramienta esencial para el entendimiento del mecanismo de reacción. Si bien, para cada uno de los materiales ocurre la misma cantidad de etapas, incluyendo, además, la adsorción del CO, unión con el oxígeno molecular, desorción de una molécula de CO2, descompensación de la superficie y luego la formación de una segunda molécula de CO2; las barreras energéticas cambiaron de manera drástica, favoreciendo en casi la mayoría de las etapas a los clústeres de AuPt8 y Pt9 Además, se determinaron las energías de activación para cada uno de los sistemas, indicando las barreras requeridas para pasar por cada uno de los estados de transición. Este estudio contribuye a la fundamentación básica del entendimiento de reacciones en superficie y, además, genera una estrategia computacional para la selección de un catalizador adecuado para la reacción de oxidación selectiva de monóxido de carbono. Se recuerda que la parte de un estudio de selectividad más a fondo requeriría de estudios posteriores en donde los adsorbatos además de CO y O2 incluyan al H2.