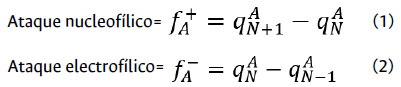Introducción
La isoniacida es uno de los principales fármacos utilizados como parte del tratamiento actual de la tuberculosis bajo las recomendaciones dadas por la OMS [1]. Por otro lado, su isómero, la niacida, ha demostrado propiedades antiinflamatorias, analgésicas y anticonvulsivantes [2].
Por medio de la reacción del grupo NH2 terminal de la niacida y la isoniacida con diferentes tipos de isotiocianatos ha sido posible sintetizar diversas tiosemicarbazidas, las cuales han sido utilizadas en la formación de compuestos heterocíclicos como los 1,2,4-triazoles con un amplio espectro de actividad biológica [3], [4]. La síntesis de estos compuestos puede darse por medio de la ciclación espontánea de su tiosemicarbazida respectiva, o ciclándolos por acción de bases como NaOH, NaOEt o Na2CO3 [5], [6].
Las benzoiltioureas han ganado especial atención en los últimos años, debido a su utilidad como ligandos en la formación de complejos con metales de transición, reactivo de partida en la síntesis de compuestos heterocíclicos y por exhibir una amplia actividad biológica; se destaca su actividad antiviral, antimicrobiana y tuberculostática [7], [8].
Se ha demostrado que la inclusión de restos tipo 1,2,4-triazoles y 1,2,3-tiadiazoles en la estructura de las tioureas ha tenido una importante actividad como agente antituberculoso y antimicrobiano [9]. Los derivados que contienen restos ciclobutil y 1,3-oxazoles han mostrado alta y mejorada actividad inhibidora frente a un aislado clínico Mycobacterium multidrogorresistente [10]. El uso de la teoría del funcional de densidad (DFT) basada en la química cuántica proporciona una herramienta muy importante para la investigación de nuevos compuestos sintetizados. El uso de los descriptores de reactividad local, tales como la función de Fukui, ha demostrado que es posible predecir con gran exactitud la reactividad local de las moléculas analizadas y determinar si existe posibilidad de un ordenamiento intramolecular (ciclación) debido a la presencia de zonas de alta susceptibilidad a ser atacadas cercanas a un grupo altamente reactivo; esto contribuye con proporcionar un sustento teórico a lo que ocurre experimentalmente [11]-[15]. Se debe precisar que las referencias 11 y 15 contienen detalles sobre la síntesis de los compuestos N-(2-nicotinoilhidracina-1-carbonotioil)benzamida y N-(2-isonicotinoilhidracina-1-carbonotioil)benzamida y sus complejos metálicos de cobre y níquel.
Teniendo en cuenta las mejoras de la actividad biológica por la modificación estructural de las tioureas, se han obtenido nuevos compuestos que contienen en una misma estructura molecular a la benzoiltiourea, la niacida y la isoniacida, con la finalidad de potenciar las propiedades antibacterianas, antiinflamatorias y tuberculostáticas de estas. En ese sentido, el objetivo del presente trabajo es sintetizar y caracterizar dos nuevos ligandos, N, O y S dadores derivados de la benzoiltiourea, la isoniacida y la niacida, evaluar preliminarmente las actividades antimicrobianas de los ligandos obtenidos y utilizar las funciones de Fukui como descriptor de la reactividad local con el fin de determinar las zonas de reactividad y dar un sustento teórico a la ausencia de ciclación intramolecular en los ligandos sintetizados.
Materiales y métodos
Los reactivos utilizados en la síntesis fueron: cloruro de benzoilo, Merck (Alemania), para síntesis; tiocianato de potasio, Merck (Alemania), para síntesis; acetato de cobre (II) monohidratado, Merck (Alemania), para síntesis; acetato de níquel (II) hexahidratado, Sigma-Aldrich (EE. UU.), para síntesis; isoniacida, Sigma-Aldrich, (EE. UU.), grado analítico, > 99%(TLC); hidracida nicotínica, Sigma-Aldrich (EE. UU.), grado analítico, > 97%(TLC). Los solventes: metanol JT, Baker® ACS (EE. UU.); acetona JT, Baker® ACS; éter etílico JT, Baker® ACS (EE. UU.); cloroformo JT, Baker® ACS (EE. UU.); etanol JT, Baker® ACS (EE. UU.), fueron secados antes de utilizarlos.
Los espectros de infrarrojo se obtuvieron en un espectrofotómetro modelo Nicolet™ i STM 10 FTIR Spectrometer, marca Thermo Scientific™ (EE.UU). Se preparó la pastilla de bromuro de potasio utilizando 1 mg del compuesto en 10 mg de KBr a temperatura ambiente 20 °C, luego la lectura se realizó en los intervalos de 4000 a 400 cm-1.
Los espectros de los compuestos 1H-RMN, 13C, APT, DEPT, COSY, HSQC, HMBC se obtuvieron de un espectrómetro marca Agilent, modelo Varian Mercury 400 plus (EE. UU.), tomado a 400 MHz para 1H y 100 MHz para 13C utilizando DMSO-d6 como solvente a temperatura del ambiente (20 °C). Los compuestos estudiados fueron recristalizados previamente en etanol y secados a temperatura ambiente. Estas muestras purificadas se enviaron a la Universidad de Leipzig para la obtención de sus espectros por técnicas unidimensionales (C, H) y bidimensionales. De igual manera, las muestras purificadas sirvieron para realizar el análisis elemental en un analizador elemental, marca Perkin Elmer®, modelo 2400 Series II CHNS/O Elemental Analysis (EE. UU.), de la Universidad de Leipzig.
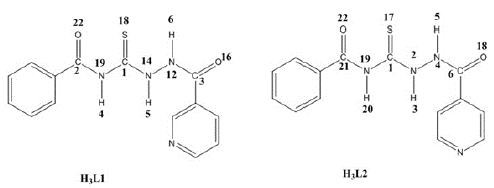
Síntesis del compuesto N-(2-nicotinoilhidraci-na-1-carbonotioil)benzamida (H 3 L1)
Se adicionaron 0,7 mL (6 mmol) de cloruro de benzoilo (PhCOCl) a una suspensión de 0,6 g (6 mmol) de tiocianato de potasio y 10 mL de acetona. La mezcla se dejó en reflujo a 56 °C durante 2 h con vigorosa agitación. Luego se enfrió y el precipitado de KCl se separó por filtración lavándolo con acetona caliente. La disolución obtenida se dejó enfriar en hielo a aproximadamente 10 °C.
En un vaso de 100 mL se depositaron 0,8 g (6 mmol) de niacina, a lo que se añadió la mezcla fría de isotiocianato de benzoilo y se dejó en reflujo a 56 °C por 4 h. La mezcla se dejó enfriar y luego se agregó este contenido en un vaso que contenía una mezcla de 10 mL de etanol con 0,07g de NaOH, la que se sometió a reflujo por 8 h a 56 °C; se observó la aparición de un precipitado amarillo que fue lavado con etanol frío y acidificado con HCl diluido. El precipitado cristalino blanco se filtró y lavó en etanol. El compuesto se recristalizó en etanol y se obtuvo un rendimiento del 68%. Punto de fusión: 200-202 °C; masa molecular: 300,34 g/mol.
Análisis elemental calculado para: C14H12N4O2S: C (55,99%), H (4,03%), N (18,65%), S (10,68%). Encontrado: C (55,36%), H (4,09%), N (18,32%), S (10,53%).
FT-IR (cm-1): 3241 (N-H); 3067 (C-Haromático); 1653 (C=O tiourea); 1668 (C=Ohidracida); 1026 (anillo piridina); 876 (C=S).
1H-RMN (400 MHz, DMSO-d6): 8 (ppm): 12,34 (s, 1H, 1N-H); 11,78 (s, 1H, 2N-H); 11,34 (s, 1H, 3N-H); 7,64 (J = 4Hz, d, 2H, Ar-H); 7,55 (J = 6Hz t, 3H, Ar-H); 7,98(J = 4Hz, d, 2H, Ar-H); 9,08 (s, 1H, Py-H); 8,79 (J = 4Hz, d, 1H, Py-H); 8,27 (J = 4Hz, d, 1H, Py-H); 7,59 (J = 8Hz, t, 1H, Py-H).
13C{1H}-APT-RMN (100 MHZ, DMSO-d6) δ (ppm): 181,3 (C=S); 168,1 (C=O tiourea); 163,7 (C=O hidracida); 132,2 (ipso-Phc=o): 128,4 (ipso-Pyc=o); 153,0 (o-ipso-N-Pyc=o); 149,0 (o-ipso-Pyc=o); 135,9 (o- ipso-Pyc=o); 133,6 (p- ipso-Phc=o); 129,2 (2C, o- ipso-Phc=o); 128,9 (2C, m-ipso-Phc=o); 124,1 (m- ipso-Pyc=o).
Síntesis del compuesto N-(2-isonicotinoilhidracina-1-carbonotioil)benzamida (H3L2)
En un balón de dos bocas se agregó 1 g (10 mmol) del reactivo tiocianato de potasio (KSCN) y 1,20 mL (10 mmol) de cloruro de benzoilo; se utilizó como solvente acetona anhidra (20 mL). La mezcla se dejó en reflujo a 60 °C y agitación continua por dos horas; se separó luego por filtración el precipitado de cloruro de potasio (KCl) formado. La solución de isotiocianato de benzoilo en acetona resultante fue dejada en reposo.
Se preparó una suspensión de 1,12 g (8 mmol) de isoniacida en acetona, la cual se agregó a la solución amarilla de isotiocianato de benzoilo y se obtuvo una suspensión amarilla pálida, que se dejó en agitación continua a temperatura ambiente durante 24 h, luego de las cuales se separó por filtración un precipitado blanco que se lavó varias veces con acetona fría. El compuesto resultante fue finalmente recristalizado en etanol absoluto y se obtuvieron cristales cúbicos blancos con un rendimiento del 60%. Punto de fusión: 207208 °C; masa molecular: 300,34 g/mol.
Análisis elemental calculado para: C14H12N4O2S: C (55,99%), H(4,03%), N (18,65%), S (10,68%). Encontrado: C (55,72%), H (4,03%), N (18,40%), S (10,70%).
FT-IR (cm-1): 3216 (N-H); 2974 (C-H aromático); 1680 (C=O tiourea’hidracina); 900 (C=S).
1H-RMN (400 MHz, DMSO-d6): δ(ppm): 12,31 (s, 1H, 1N-H); 11,80 (s, 1H, 2N-H); 11,44 (s, 1H, 3N-H); 7,99 (J = 4Hz, d, 2H, Ar-H); 7,67 (J = 6Hz t, 3H, Ar-H); 8,80 (d, 2H, Py-H); 7,82 (J = 4Hz, d, 2H, Py-H); 7,55 (J = 8Hz, t, 1H, Ar-H).
13C{1H}-DEPT-RMN (100 MHZ, DMSO-d6) δ (ppm): 181,5 (C=S); 168,1 (C = O hidracida); 163,6 (C = Otiourea); 139,7 (ipso-Pyc=O): 133,6 (ipso-Phc= O); 150,9 (O -ipso-N-Pyc=o); 121,9 (m-ipso-Pyc= O); 128,9 (2C, O - ipso-Phc= O); 132,3 (p- ipso-Phc= O); 129,4 (2C, m-ipso-Phc= O).
Estudio preliminar de enfrentamiento microbiano
Los análisis de eficacia antimicrobiana contra Escherichia coli(bac-teria gram-negativa) con cepa tipo ATCC 11229 y Staphylococcus aureus (bacteria gram-positiva) con cepa tipo ATCC 6538, de los compuestos H3L1 y H3L2, fueron realizados por el método AOAC Oficial Methods of Analysis (Use-Dilution Method (2) Official Final Action), el cual proporciona las diluciones adecuadas y los tiempos de exposición para evaluar la eficacia del candidato a desinfectante.
La evaluación se realizó tomando cantidades entre 46 y 147,5 mg de los compuestos en 6 mL de DMSO sobre un inóculo de concentración 1 x 106 ugfc/mL por un tiempo de contacto de 15 min.
Resultados y discusión
Caracterización infrarroja (FT-IR)
En el espectro FT-IR del compuesto H3L1 se observa que existen dos señales que corresponden a los carbonilos que forman parte de la estructura del compuesto C=O (tiourea) 1653 cm-1 y C=O (hidracida) 1668 cm-1. También se puede observar la presencia del grupo N-H (tiourea- hidracida) 3241 cm-1, C-H (aromático) 3067 cm-1 y C=S (tiocarbonilo) 876 cm-1. Estos valores de número de onda son semejantes a los encontrados en derivados de acil tiosemicarbazi-das [16], [17], lo cual reforzaría la evidencia de que el compuesto está bajo la forma ceto.
En el análisis del espectro FT-IR del compuesto H3L2 se observan las señales correspondientes a los grupos carbonilos C=O (tiourea e hidracida) a 1680,78 cm-1; también se observa la banda asociada al grupo N-H a 3216,39 cm-1, C-H (aromático) a 2974,48 cm-1 y las bandas asociadas al grupo tiocarbonilo (C=S) a 1090, 1010 y 900,30 cm-1 [18]. Los anteriores valores de número de ondas asociadas a las bandas descritas están de acuerdo con los valores encontrados en diversos derivados de las acil tiosemicarbazidas y también en varias tioureas sintetizadas [19]-[21].
Caracterización por espectroscopia RMN CH-RMN, 13 C, APT, DEPT-135, COSY, HSQC, HMBC)
En el espectro 1H-RMN del compuesto H3L1, en DMSO-d6, se observan tres señales pertenecientes a los protones de N-H1, N-H2, N-H3 a 12,34; 11,78 y 11,34 ppm, respectivamente. La señal 12,34 ppm a campos bajos fue asignada a la formación de un puente de hidrógeno intramolecular entre el grupo N-H1 de la hidracida y el oxígeno del grupo carbonilo (N-H---O=C) característicos en derivados de las aroil tioureas [22]. Las otras dos señales a 11,78 y 11,34 ppm fueron asociadas a los grupos N-H2 de la hidracida y la tiourea (N-H3), respectivamente. La señal doblete a 7,98 ppm, las señales tripletes a 7,55 y 7,64 ppm fueron asignadas al grupo fenil. Finalmente, en las señales asociadas al anillo piridínico se hallaron una señal singlete a 9,08 ppm, dos señales dobletes a 8,79 y 8,27 ppm y una señal triplete a 7,59 ppm, las cuales son semejantes a algunos derivados de la hidracida nicotínica [23].
El espectro 13C-{1H}-APT-RMN, en DMSO-d6, muestra que las señales 181,3; 168,2 y 163,7 ppm corresponden respectivamente al grupo tiocarbonilo (C=S), al carbonilo (C=O) adyacente al grupo fenil y al carbonilo adyacente al anillo piridínico; es preciso resaltar que el desplazamiento del grupo C=S es muy característico de las benzoiltioureas [24], [25] y de las acil (aroil) tiosemicarbazidas [26], [27]. Los desplazamientos C-H asociados al grupo fenil se muestran en el rango de 133,11-128,5 ppm, mientras que los desplazamientos C-H relacionados al anillo piridínico se observaron entre 136, 154 y 124 ppm.
El espectro 1H-RMN del compuesto H3L2, en DMSO-d6, como solvente, muestra tres señales singletes a 12,31 (N-H3), 11,80 (N-H20) y 11,44 (N-H5) ppm debido a la presencia de tres protones tipo N-H. La presencia de estas señales confirmaría la existencia del compuesto H3L2 bajo la forma ceto. El desplazamiento del protón N-H3 (12,31 ppm) se encuentra a campos bajos, probablemente debido a la formación de un puente de hidrógeno intramolecular, bastante típico en derivados de aciltioureas [21]. Los protones del anillo aromático bencénico dan señales triplete a 7,55 y 7,67 ppm, además de un doblete a 7,99 ppm, mientras que los protones pertenecientes al anillo piridínico muestran señales dobletes a 7,82 y 8,80 ppm [28].
El espectro 13C-RMN muestra las señales 181,5; 168,19 y 163,61 ppm correspondientes a los grupos tiocarbonilo (C=S), carbonilo (C=O) unido al anillo bencénico y carbonilo (C=O) unido al anillo de piridina, respectivamente. El desplazamiento del grupo tiocarboni-lo (C=S) encontrado en este compuesto es característico de varios compuestos tipo benzoiltioureas [29], [30].
Caracterización por análisis elemental
La composición porcentual obtenida para los compuestos H3L1 y H3L2 por medio del análisis elemental está de acuerdo con los valores esperados teóricamente; de esta manera se confirman las fórmulas moleculares propuestas.
Estudio computacional
Para determinar la distribución de los sitios activos de la molécula se utilizó Ec. (1), y Ec. (2) para calcular los valores de la función de Fukui para un ataque nucleofílico y electrofílico:
En la Tabla 1 se reportan los valores de la función de Fukui elec-trofílica y nucleofílica para los compuestos H3L1 y H3L2 para los átomos más importantes; estos valores han sido calculados con cargas Hirshfeld [31]- [33], las cuales han sido calculadas a nivel de la teoría DFT B3LYP/6-31G++ (d, p), a partir de las estructuras neutras optimizadas con B3LYP/6-31G (d, p). Todos los cálculos fueron realizados con el paquete de programas Gaussian 09W. Rev. A02 [34], implementado en un PC Workstation AMD Fx(tm)-4300 3,80 GHz Quad-Core Processor, 4GB RAM.
Tabla 1 Valores para la función de Fukui para un ataque nucleofílico (f+) y electro-fílico (f-) de los compuestos H3L1 y H3L2.
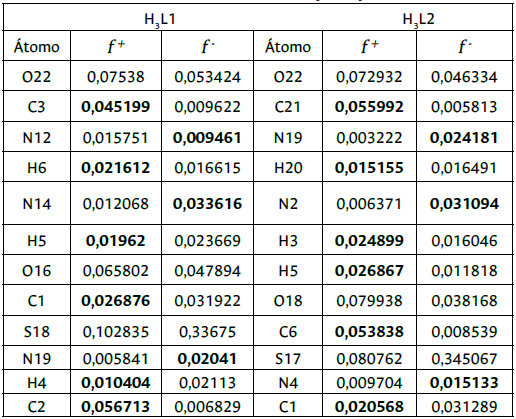
Los valores en negrita, indican la función de Fukui a tomar en cuenta para el análisis de reactividad local.
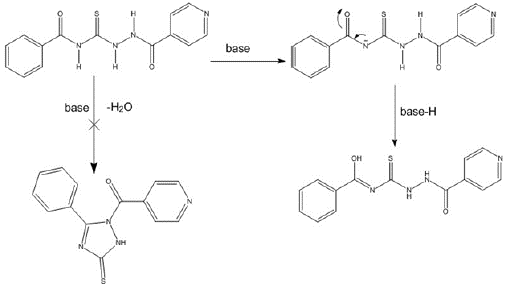
Con la finalidad de explicar la imposibilidad de ciclación de los compuestos se utilizó la función de Fukui para determinar los sitios más probables de desprotonación por parte de una base. Utilizando el concepto de interacción duro-duro conocida como la regla de Li-Evans [35], se consideraron los valores más bajos para la función de Fukui electrofílica ( f + ) correspondientes a los hidrógenos H4 y H20 de los compuestos H3L1 y H3L2, respectivamente.
Los carbonilos C2=O22 y C21=O22 son las zonas más susceptibles a un ataque nucleofílico en H3L1 y H3L2, respectivamente; en el momento de la desprotonación el N19 desplaza su densidad electrónica a estos carbonilos, lo que da lugar a la forma enol en ambos compuestos; esto imposibilita la ciclación intramolecular de los compuestos al no poder disponer de una zona altamente electrofílica para ser atacada por un átomo de nitrógeno nucleofílico (Figura 2).
Para el compuesto H3L1 y su isómero H3L2, se muestra que los mayores valores para la función de Fukui nucleofílica fĀ (susceptible a ataques electrofílicos) fueron para los átomos S18, O22, O16 y N14 en el compuesto H3L1, y S17, O22, O18 y N2 en el compuesto H3L2; los átomos de azufre y oxígeno tienen la mayor posibilidad. Análogamente, en estructuras tipo dihidrotiouracilo-indenopiridopirimi-dinas se ha demostrado que las zonas de mayor preferencia para un ataque electrofílico son las que interactúan de mejor manera con los sitios activos de enzimas como la topoisomerasa humana II ay I I β, y pueden ser fármacos antitumorales potenciales [36].
Análisis de enfrentamiento microbiano
Los resultados del análisis de eficacia antimicrobiana de los compuestos mostrados en la Tabla 2 indican que los compuestos analizados presentan actividad antimicrobiana para cantidades entre 46147,5 mg en 6 mL de DMSO sobre un inóculo de concentración 1 x 106 ugfc/mL frente a Staphylococcus aureus (ATCC 6538) y Escherichia coli (ATCC 11229), desde el primer minuto de contacto.
Conclusiones
Se sintetizaron los compuestos H3L1 y H3L2 tipo aroil tiosemicarbazida por reacción entre el isotiocianato de benzoilo, la hidracida nicotínica y la isoniacida, los cuales se caracterizaron por espectroscopia FT-IR, RMN-1H, 13C y por análisis elemental. Se corroboró de manera preliminar que los compuestos sintetizados presentan actividad antimicrobiana frente a Staphylococcus aureus y Escherichia coli, por lo que serían buenos candidatos a desinfectantes de superficies.
La función de Fukui ayudó a elucidar las zonas más probables de reactividad frente a especies nucleofílicas y electrofílicas, con la finalidad de explicar la imposibilidad de ciclación de los compuestos H3L1y H3L2, además de determinar las zonas más susceptibles a sufrir un ataque electrofílico por parte de iones de metálicos o a interactuar muy probablemente con los sitios activos de sistemas proteicos. Esto proporciona una herramienta muy útil en química para determinar qué partes específicas de las moléculas interactúan de mejor o peor manera.