Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.56 no.2 Palmira Apr./June 2007
1. Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, AA 237. Palmira, Valle del Cauca, Colombia. victabor@telesat.com.co ;
2. Autor para correspondencia: crbonillac@palmira.unal.edu.co ;
3. mssanchezo@palmira.unal.edu.co
REC: NOVIEMBRE 29 / 06 . ACEP: MARZO 10 / 07
RESUMEN
En semillas de caléndula Calendula officinalis y de eneldo Anethum graveolens, se realizaron la descripción morfológica y anatómica y mediciones del contenido de humedad en equilibrio (CHE). La descripción morfológica y anatómica permitió precisar e ilustrar detalladamente los órganos y tejidos internos de la semilla, además, clarificar aspectos en la definición de semilla pura de caléndula. Se elaboraron curvas de secado y se midió el CHE en diferentes ambientes de secamiento artificial, obtenidos con la metodología de curvas de secado con sílica gel en relaciones de peso sílica-semilla de 10:1, 7:1 y 5:1, además de identificar un método y una relación adecuados para la conservación del germoplasma. Se determinó el comportamiento fisiológico ortodoxo en almacenamiento a corto plazo de las semillas de estas especies. Las diferentes metodologías y sustratos no mostraron diferencia significativa sobre la germinación de las semillas; por facilidad se propone la siembra en cajas Petri con papel absorbente.
Además, se logró tipificar e ilustrar plántulas normales, anormales y semillas muertas.
Palabras clave: semillas, Caléndula officinalis, Anethum graveolens morfología, anatomía, humedad, germinación, conservación, germoplasma, almacenamiento.
ABSTRACT
Laboratory tests with seed of Calendula officinalis and Anethum graveolens to describe morphology and anatomy components such as humidity content in balance (CHB) in different atmospheres to get appropriate conservation of the germsplasm to determine physiological behavior in short seed storage to evaluate and to stablish an appropriate methodology for germination, were carried out. The morphological and anatomical description allowed to specify and to illustrate the organs and internal structures of the seed in detail. Also this procedure was important to clarify certain aspects that were managed in wrong way with these species like to confuse the fruit with the seed. It was possible to reach CHB in different atmospheres with artificial drying using the methodology of drying curves with sílica gel in relations of weight-sílica- seed of 10:1, 7:1 and 5:1, besides recommending a method and appropriate relations to conserve the germplasm. The ortodoxal physiological behavior of the seeds of this species was determined.
Germination tests were carried out under different methodologies and materials that statistically didn't show influence on the germination of the seeds. For practical purposes, the sowing methodology in Petri dishes with absorbing paper was recommended. Also this methodology was achieved to identify and to illustrate normal and abnormal plants and seeds of this species that died.
Key words: seeds, Calendula officinalis, Anethum graveolens, morphology, anatomy, humidity, germination, conservation, germplasm.
INTRODUCCIÓN
La mayoría de los recursos fitogenéticos medicinales no se han recolectado y mucho menos caracterizado ni morfológica ni molecularmente (Posso, 1996).
Actualmente la caracterización morfológica continúa siendo la herramienta de mayor uso e importancia (Hidalgo, 1992).
En las semillas predominan los tejidos meristemáticos o embrionales (Esau, 1964) y están expuestas a procesos naturales de envejecimiento que las llevan a la muerte. El contenido de humedad y la temperatura son las variables de más importancia en la conservación de las semillas (Cardozo et al., 2002).
El secado y el almacenamiento de las semillas son exigencias que afectan su calidad. Algunos métodos de secado para conservación de germoplasma implican altas temperaturas del aire (35ºC – 45ºC), que afectan negativamente la integridad y viabilidad de la semilla.
Actualmente se evalúa la utilización de dehumificadores como la sílica gel para el secado de las semillas a temperaturas más bajas. Este compuesto es un precipitado del ácido silícico (H2SiO3) en forma de granos, especialmente preparado y adaptado para absorción de varios vapores (Zhang y Tao, 1989).
Se reconocen tres categorías principales de comportamiento de las semillas en almacenamiento: ortodoxas, intermedias y recalcitrantes. Se pueden conservar satisfactoriamente semillas de especies con comportamiento ortodoxo; el mantenimiento de la viabilidad de especies con comportamiento intermedio o recalcitrante es problemático. En general, el almacenamiento a término medio es posible para semillas de especies con comportamiento intermedio, pero el almacenamiento corto es usualmente el que mejor se puede lograr con semillas de comportamiento recalcitrante.
Para la conservación de germoplasma es esencial conocer el comportamiento de las semillas con el fin de determinar las condiciones de almacenamiento (Hong y Ellis, 1996).
La germinación es una de las pruebas importantes en la medición de la calidad fisiológica de las semillas.
En la discusión de la absorción de agua durante el proceso de germinación se deben considerar las relaciones hídricas en la semilla y entre la semilla y el sustrato, por lo que se hace necesario identificar técnicas y sustratos para la realización de las pruebas.
La investigación busca contribuir al conocimiento y conservación de recursos genéticos en plantas medicinales y aromáticas con los siguientes objetivos:
• Describir componentes morfológicos y anatómicos de semillas de Caléndula officinalis y Anethum graveolens.
• Establecer el contenido de humedad en equilibrio de la semilla (CHE) en diferentes relaciones sílica- semillas para propósitos de conservación de germoplasma.
• Evaluar y comparar varias metodologías para la prueba de germinación con semillas de C. officinalis y A. graveolens.
MATERIALES Y MÉTODOS
La investigación se realizó en la Universidad Nacional de Colombia Sede Palmira. Los lotes de semillas procedían de cosechas manuales realizadas en febrero de 2003 en el jardín de introducciones de la colección de especies medicinales de la Sede. Las semillas se secaron a la sombra (30oC y 70% de humedad relativa) por dos días; se almacenaron en un cuarto frío (15oC y 40% de humedad relativa).
Para la caracterización morfológica se realizaron observaciones de campo, observaciones en estereomicroscopio y microscopio, revisiones de literatura especializada en el tema, estudios histológicos y consultas a expertos.
Se realizó un estudio histológico de semilla completa (50 testas y 50 embriones) de C. officinalis embebidas en agua durante 12 horas. Se utilizó la metodología propuesta por Roth (1966), Ham (1967), Di Fiore (1969) y Di Fiore et al. (1971) y Paniagua et al.
(1997) para el montaje en placas y posterior observación en microscopio. Las fotografías presentadas en el documento fueron tomadas por el autor principal.
La caracterización fisiológica comprendió el contenido de humedad inicial y las curvas de secado.
Para determinar dicho contenido se siguió el método gravimétrico (estufa) a 130o C durante una hora (ISTA, 1999).

Las curvas de secado artificial se efectuaron con tres relaciones de peso de sílica gel – semilla (5:1; 7:1 y 10:1). Se trabajó con 3 g de semilla en bolsas de tela porosa; la sílica se colocó en el fondo del desecador (frasco hermético: 7.5 cmh, Φ: 5.0 cm). Se hicieron pesajes hasta conseguir el contenido de humedad en equilibrio – CHE (humedad final). Se realizó el montaje de cuatro desecadores; dos de ellos con relación de 10:1. Un desecador se desmontó cuando las semillas alcanzaron 5% de humedad (humedad intermedia) para efectuar pruebas de germinación.
El comportamiento fisiológico en almacenamiento se estudió con el protocolo propuesto por Hong y Ellis (1996).
En las pruebas de germinación se evaluaron metodologías y sustratos diferentes: siembra en papel absorbente, papel de germinación (Anchor Paper), siembra en bandeja con papel absorbente, o con papel de germinación, siembra en caja Petri con papel absorbente o con papel de germinación. Se realizaron cuatro repeticiones de 25 semillas cada una por prueba, con lecturas de germinación cada dos días. Los porcentajes promedios de germinación se compararon estadísticamente con análisis de varianza bajo un diseño completamente al azar y con análisis de diferencia mínima significativa para comparación entre medias.
La metodología descrita se utilizó en pruebas de germinación de semillas con humedades iniciales (al recibir los lotes de semilla), intermedias y finales (curvas de secado). En cada caso se efectuaron cuatro repeticiones de 25 semillas. En las pruebas se evaluaron plántulas normales, anormales y semillas muertas (ISTA, 1999).
RESULTADOS Y DISCUSION
Caléndula officinalis L.
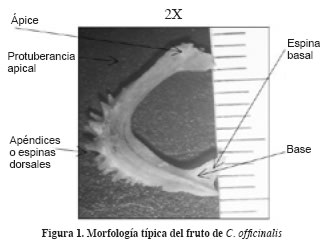
El fruto es un aquenio (Corner, 1976; ISTA, 1999), curvo, simulando la letra “C” o media luna; presenta dos caras, una dorsal o convexa y otra ventral o cóncava (Figura 1). En la cara ventral (cóncava) en cada extremo posee una protuberancia, la de mayor prominencia (base) señala el sitio de emergencia de la radícula durante la germinación. En el costado dorsal posee una serie de apéndices o espinas dorsales que facilitan la dispersión al fijarse y transportarse en otros individuos. La cavidad que alberga la semilla abarca desde la espina basal hasta la mitad del fruto, el resto es tejido de protección altamente resistente. El tamaño varía entre 1 y 2 cm de largo, 2 y 3 mm de ancho y 3 y 4 mm de grosor. En algunos casos presenta tejido del pericarpio en forma de costillas exteriores opuestas, lo que le da el aspecto de fruto alado. Aparecen frutos agregados de aquenios o pluriaquenios.
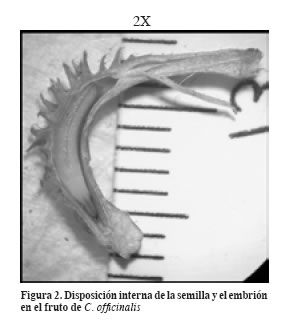
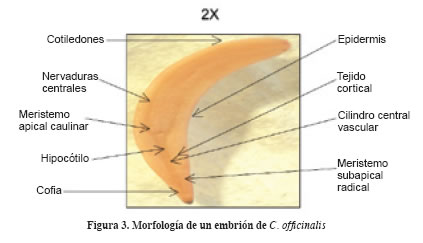
El embrión posee una curvatura en “C” y forma cónica; el extremo puntiagudo hacia la base del fruto corresponde a la radícula, mientras que el redondeado equivale al ápice de los cotiledones y varía entre 0.5 – 1.0 cm (Figura 2). Se encuentra recubierto por una testa delgada y membranosa que regula el intercambio líquido y gaseoso con el fruto y con el ambiente. Posee dos cotiledones convexos que constituyen aproximadamente 70% del volumen; el eje embrional es recto y se compone del meristemo apical caulinar (futura plúmula), del hipocótilo, del meristemo subapical radical y de la cofia (radícula); se encuentra en la sección basal de la semilla, rodeado por la testa y los tejidos corticales (tejidos de protección), inmediatamente debajo de la unión de los cotiledones (mesocótilo) (Figura 3).
En el ápice basal de la semilla se observa la cofia, tejido suberizado negro con alto grado de dureza que actúa como estructura de protección (Figura 3) y facilita la emergencia de la radícula del fruto una vez se encuentre blando por la acción del agua. Sin embargo, aun en estas condiciones, la dureza sigue siendo considerable y por ello la cofia actúa como “escudo” para la normal emergencia de la radícula.
Las semillas de la familia Compositae que provienen de un óvulo anátropo, suspendido y solitario, son pequeñas, encerradas en el aquenio; testa delgada y membranosa; y presencia o ausencia de endospermo (Corner, 1976).
Anatomía
La testa es un tejido muy delgado, fino y membranoso, que recubre la semilla y regula el intercambio líquido y gaseoso con el fruto y con el medio.
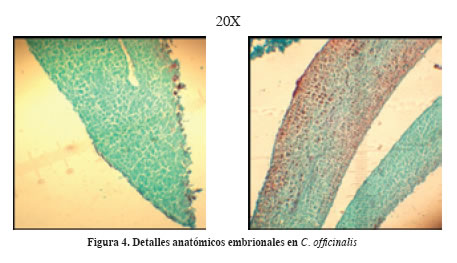
Los cortes de 8 y 12 micras de espesor mostraron la presencia de tejido meristemático de carácter embrional o inmaduro y verde (Di Fiore et al., 1971).
En semilla inmadura se alcanzó a observar formación incipiente de paredes celulares (de color rojizo), meristemo apical caulinar y radical y meristemos secundarios.
En algunos cortes se alcanzó a diferenciar la presencia de vasos conductores (xilema y floema) teñidos de color rojizo (Figura 4).
El momento adecuado para evidenciar la diferenciación puede ser cuando se inicie la emergencia de la plántula del fruto, antes de la emisión de raíces secundarias.
Se observó tejido vivo en la sección basal terminal del embrión, es decir, el futuro meristemo subapical radical y la finalización del cilindro vascular (Figura 4), el cual muere para proteger y facilitar la emergencia de la plántula (Esau, 1964).
Anethum graveolens L.
La semilla de A. graveolens es elíptica, con ápice redondeado y base ligeramente terminada en punta. En la base se ubica el embrión y es el sitio de emergencia de la radícula. El tamaño promedio fue de 5 mm de largo por 3 mm de ancho por 0.5 mm de grosor. Se encuentra recubierta por la testa (Figura 5).
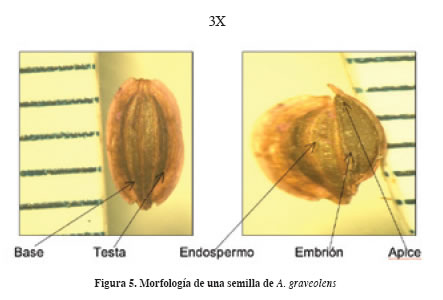
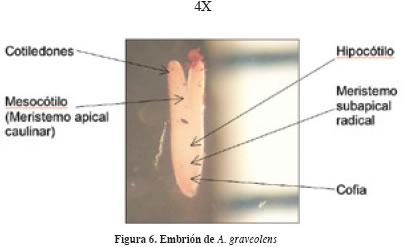
La cara dorsal es convexa, la ventral plana y en ocasiones un poco cóncava. El endospermo constituye 80% del volumen y provee de alimento al embrión durante el proceso de madurez y desarrollo (Figura 5). El embrión es acorazonado de 1 y 1.5 mm, se encuentra situado en la base de la semilla, rodeado por el endospermo y la testa; la disposición es longitudinal siguiendo el eje central de la semilla. Pueden distinguirse un par de cotiledones, el mesocótilo (meristemo apical caulinar), el hipocótilo, el meristemo subapical radical y la cofia (Figura 6). Las semillas de la familia Umbelliferae provienen de un óvulo anátropo, suspendido y solitario, con una testa delgada pero rígida, endospermo persistente pero no especializado y embrión pequeño (Corner, 1976).
Las semillas de C.officinalis y A. graveolens presentaron altos contenidos de semilla pura y germinación (Tabla 1).
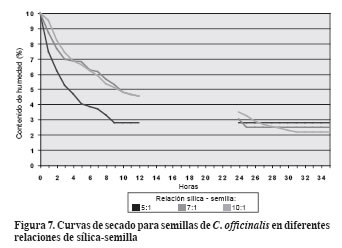
Curvas de secado
La sílica utilizada para el secamiento artificial presentó una capacidad de absorción de 22.6% del peso.
En la relación sílica - semilla 5:1 se observó el descenso más rápido en el contenido de humedad (Figura 7 y Figura 8). La menor cantidad de sílica permite que las semillas ocupen mayor espacio interno de los frascos herméticos, mayor separación entre ellas y, por tanto, menor resistencia a la pérdida de humedad.
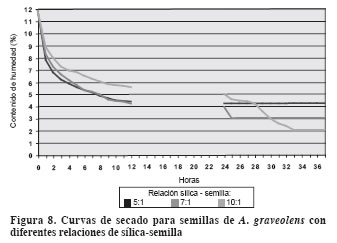
El proceso fue rápido; las semillas de C. officinalis se equilibraron a las 11 horas con un contenido de humedad de 2.78%; el de A. graveolens fue 4.2 %.
De acuerdo con la relación utilizada, para las semillas de C. officinalis se logró un grado de desecación un poco más elevado, es decir, un contenido de humedad en equilibrio de 2.5% a las 25 horas de secamiento, en tanto que para las de A. graveolens fue de 2.0% a las 33 horas.
Se propone la utilización de sílica en una relación 5:1 como método de conservación de semillas en tubos de ensayos herméticos, en los cuales se deposita la sílica en el fondo, una capa de material poroso (algodón) que permita el intercambio gaseoso de la sílica con la semilla y sobre él se sitúan las semillas. Este método resulta conveniente para semillas pequeñas, en bancos que manejen pocas cantidades de semillas (de la clase genética) y que posean dificultades logísticas como poco espacio físico y limitados recursos tecnológicos y financieros.
En la relación 10:1 se obtuvo mayor grado de desecación en las semillas con un contenido de humedad en equilibrio – CHE de 2.17% al cabo de 31 horas para C. officinalis y 2% para semillas de A. graveolens a las 33 horas.
Germinación a diferentes contenidos de humedad
En las semillas de las dos especies no se presentaron diferencias estadísticamente significativas entre los porcentajes de germinación a los diversos contenidos de humedad (Tabla 2).
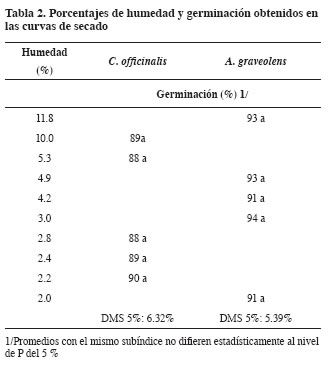
Comportamiento fisiológico
Teniendo en cuenta que el porcentaje de germinación de las semillas de C. officinalis y A. graveolens, luego de dos años de almacenamiento en cuarto frío bajo temperatura promedia de 15oC de y 40% de humedad relativa fue alto (89% y 93%, respectivamente), puede suponerse que las semillas toleran bajas temperaturas.
En cuanto a la humedad, el porcentaje de germinación obtenido con 2% de contenido de humedad no mostró diferencia significativa con el porcentaje de germinación inicial, por lo tanto puede inferirse que las semillas también toleran descensos en el contenido interno de humedad sin afectar su poder germinativo. La respuesta a los dos factores confirma el comportamiento fisiológico ortodoxo en las semillas y ratifica los reportes preliminares publicados por el IPGRI acerca de la posible condición ortodoxa de las semillas de estas especies (Hong y Ellis, 1996).
Sin embargo, se recomienda para próximas investigaciones efectuar un estudio basado en monitoreos periódicos y continuos a través del tiempo (dos o tres años) para evaluar el poder germinativo de las semillas con contenidos de humedad de 2% en relación con las metodologías convencionales de conservación (cuartos fríos y contenidos de humedad del 10% – 12%).
Comparación de metodologías para pruebas de germinación
Las comparaciones estadísticas no mostraron diferencias significativas entre los porcentajes de germinación de las semillas de las dos especies (Tabla 3).
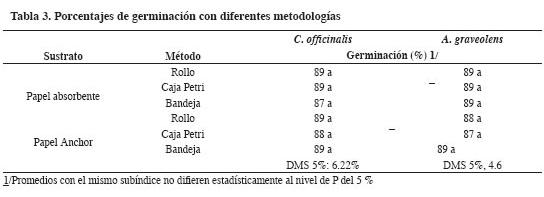
Para realizar la evaluación y selección fue necesario considerar otros indicadores como practicidad y sencillez del método, disponibilidad de recursos económicos y logísticos de la gran mayoría de bancos de germoplasma.
Se podría recomendar la metodología de siembra en caja Petri con papel absorbente como substrato.
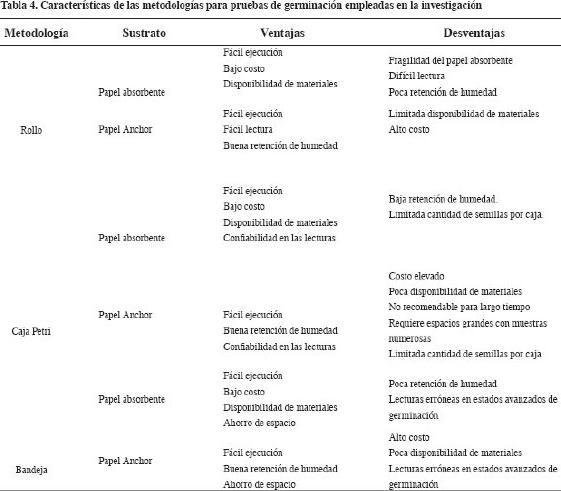
La Tabla 4 compara las ventajas y desventajas de las metodologías evaluadas en la investigación.
BIBLIOGRAFÍA
1. Cardozo, C. I., López, Y., Guevara, C. (2002). Estudio de deterioro de semilla en condiciones controladas de conservación. Acta Agron (Palmira) No 51:89-101 [ Links ]
2. Corner, F.R.S. (1976). The Seeds of Dicotyledons. New York: Cambridge University Press 2 Vol. 312 p. [ Links ]
3. Di Fiore, M.S.H. (1969). Diagnóstico histológico: Síntesis actualizada de histología teórica y práctica y reconocimiento de los tejidos y órganos por su estructura microscópica. 6. ed. Buenos Aires: El Ateneo. 2 v. [ Links ]
4. Di Fiore, M., S.H.; Mancini, R. E.; De Robertis, E. D. P. (1971). Nuevo atlas de histología: Microscopia óptica, histoquímica y microscopia electrónica. México: DF: El Ateneo, 329 p. [ Links ]
5. Esau, K. (1964). Anatomy of Seed Plants. 4th ed. New York: Wiley. 376 p. [ Links ]
6. Ham, A. W. (1967). Tratado de histología. 5. ed. México: DF.: Interamericana, 959 p. [ Links ]
7. Hidalgo, R. (1992). Conservación Ex Situ. En: Curso Internacional de Recursos Fitogenéticos. Vol. 2. Palmira. Noviembre 9 a diciembre 4 de 1992. [ Links ]
8. Hong, T.D; Ellis, R.H. (1996). Protocolo para determinar el comportamiento de las semillas en almacenamiento. Roma: IPGRI. 85 p. [ Links ]
9. (Boletín Técnico No. 1) International Seed Testing Association ISTA. (1999). International Rules for Seed Testing. Seed Science and Technology Vol 27 Supplement. 333 p. [ Links ]
10. Paniagua Gómez-Álvarez, R.; Nistal de S. M.; Sesma E., Álvarez, M. P. -Uría Rico-Valdemoro, M.; Anadón A., R.; Fraile L., B.; Sáez C., F.; De Miguel, G. M. P. (1997). Citología e histología vegetal y animal: biología de las células y tejidos vegetales animales y vegetales. 2. ed. Madrid: McGraw-Hill Interamericana. 960 p. [ Links ]
11. Posso, P. (1996). Plantas aromáticas y medicinales: una alternativa de producción. Cali: Secretaría de Agricultura y Pesca del Valle del Cauca. 60 p. [ Links ]
12. Roth, I. (1966). Anatomía de las plantas superiores. Caracas: Universidad Central de Venezuela. 357 p. [ Links ]
13. Zhang, X-Y.;Tao, K-L (1989). Silica gel seed drying for germplasm conservation-practical guidelines. Plant Gen Res News, 75/76:1-5. [ Links ]














