Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.57 no.1 Palmira Jan./Mar. 2008
RESUMEN
La azacitidina (5-azaC) es una sustancia que actúa inhibiendo la metilación del ADN, es utilizada en experiencias de clonación, transgénesis por transferencia nuclear y estudios de fragilidad cromosómica. Se ha observado la manifestación de diversas patologías en animales domésticos nacidos de experiencias de clonación. Ellas estarían asociadas a una inexacta reprogramación nuclear relacionada con fenómenos epigenéticos de metilación del ADN. En el presente trabajo se realizó una curva de inducción con diferentes concentraciones finales de 5-azaC (0 uM, 5 uM, 10 uM, 20 uM, 50 uM y 70 uM) con el objetivo de estudiar los efectos sobre la estructura cromosómica en cultivos linfocitarios bovinos. Se utilizó la técnica de macrocultivo para análisis cromosómico a partir de sangre de un bovino macho (Bos taurus, Holstein Friesian). Se analizó un total de 50 placas metafásicas por tubo de cultivo y se encontraron diferencias significativas (p<0.01) en cuanto a las fracturas del cromosoma X en el cultivo control frente al cultivo con mayor concentración de 5-azaC. El cromosoma Y no presentó fracturas. En los cultivos con concentraciones de 50 uM y 70 uM se observó descondensación cromosómica (12% y 16%) y fracturas centroméricas en autosomas (2% y 4%).
Palabras claves: 5'-azacitidina C, cromosomas, bovino.
ABSTRACT
Azacytidine (5-azaC) is a substance that inhibits the metilation of DNA, being used in cloning experiments, nuclear transference transgenesis and in chromosomal fragility studies. The manifestation of diverse pathologies has been observed in domestic animals born from cloning experiments. These would be associated to an incorrect nuclear reprogramation related to epigenetic metilation phenomena of the DNA. In the present work an induction curve with different final concentrations of 5-azaC (0 uM, 5 uM, 10 uM, 20 uM, 50 uM and 70 uM) were carried out, with the objective of studying the effects on chromosome structure in bovine lymphocyte cultures. The macroculture technique was used for chromosomic analysis, from a blood sample of a male bovine (Bos taurus, Holstein Friesian). A total of 50 metaphases were analyzed from each culture. Significative differences (p<0.01) were found regarding the break points of chromosome X in the control culture with respect to the culture with higher concentration of 5-azaC. Chromosome Y did not show break points. The cultures with higher concentration of 5-azaC (50 uM and 70 uM) presented chromosomic decondensation (12% and 16%) and autosomic centromeric break points (2% and 4%).
Key words: 5'-azacytidine C, chromosomes, cattle.
La azacitidina (5-azaC) es un análogo de la pirimidina que actúa inhibiendo la enzima ADN metiltransferasa y afecta la metilación del ADN. En humanos es utilizada como fármaco antineoplásico en el tratamiento de leucemias (Niessa y Guerrero, 2004).
En medicina veterinaria la 5-azaC se ha utilizado para estudiar los efectos de la hipometilación sobre la tasa de implantación de blastocistos bovinos producto de trasplante nuclear (Jones et al., 2001). Como resultado de experiencias de clonación y transgénesis por transferencia nuclear se ha observado la manifestación de diversas patologías en animales domésticos (diabetes, cardiomiopatías, distocia, malformaciones, etc.) (Piedrahita et al., 2004). Ellas estarían asociadas a una inexacta reprogramación nuclear. Esta reprogramación consiste en una serie de modificaciones del ADN de tipo epigenético donde uno de los fenómenos más destacables es la metilación. Dicha reprogramación nuclear requiere cambios drásticos en la expresión génica con reorganización de la cromatina. La 5-azaC citológica es capaz de remodelar la cromatina y se constituye en un inductor químico utilizado para estudiar la presencia de sitios frágiles en cromosomas metafásicos. Estos sitios frágiles representarían secuencias de ADN de replicación tardía en donde se produciría una incompleta condensación de la cromatina y se manifiesta citológicamente como fracturas y discontinuidades (Zlotorynski et al., 2003). En humanos se ha observado una inhibición de la condensación de la heterocromatina constitutiva en los cromosomas 1, 9, 15, 16, X e Y, así como la presencia de cromosomas pulverizados cuando la 5-azaC es incorporada en diferentes dosis durante las últimas horas del cultivo de células linfocitarias (Haaf y Schmid, 2000). En células de ratón la utilización de distintas concentraciones de 5-azaC (4 a 6 uM) produjo alteraciones en la separación centromérica y descondensación de la heterocromatina pericentromérica (Rodríguez et al., 2001).
Smeets et al. (1994) observaron que al incubar líneas de células pro-B humanas normales con 5-azaC se incrementaba la frecuencia de rearreglos cromosómicos en la heterocromatina pericentromérica. En distintas especies de mamíferos, incluido el bovino, la 5-azaC produjo la descondensación del cromosoma X inactivo salvo en la región media del brazo q del X y en la región pericentromérica (Haff y Schmid, 2000).
La utilización de drogas que actúan sobre la estructura de la cromatina nos permite comenzar a dilucidar aspectos poco conocidos sobre cómo el ADN es condensado en células en estadio de metafase. En el presente trabajo se realizó una curva de inducción con diferentes concentraciones de la droga 5-azaC con el objetivo de estudiar efectos de fragilidad y descondensación cromosómica en placas metafásicas de cultivos linfocitarios en bovinos.
Se realizó extracción de 10 cm3 de sangre periférica (vena yugular) con jeringa estéril heparinizada a un bovino macho de la raza Holstein Friesian (ternero) proveniente del campo experimental de la Facultad de Veterinaria de la Universidad de Uruguay.
Se utilizó la técnica de macrocultivo para análisis cromosómico linfocitario a partir de 0.2 cm3 de sangre entera en seis tubos estériles que contenía cada uno 5ml de medio de cultivo estándar completo, RPMI 1640 suplementado con 20% de suero fetal bovino y fitohemaglutinina M como estimulante mitótico de los linfocitos T (Llambí, 2002). Las células se cultivaron durante 72 horas a 38°C en estufa de cultivo. A las 65 horas de cultivo se adicionó el inductor 5-azaC a concentraciones finales de 5 uM, 10 uM, 20 uM, 50 uM y 70 uM. Se mantuvo un tubo de cultivo control (0 uM). Dos horas antes del sacrificio celular se adicionó 0.8 cm3 de colchicina (4ug/ml), posteriormente las células se sometieron a un choque hipotónico de KCl (0,075 M) durante 20 minutos para luego pasar a la etapa de fijación en metanol: ácido acético (3:1).
Las preparaciones se realizaron mediante la técnica de goteo a la llama (metanol 70°) y se utilizó el colorante Giemsa para la tinción de las placas metafásicas. Las observaciones de los cromosomas se llevaron a cabo en un microscopio óptico binocular (Olympus BHA).
Para el análisis estadístico de los datos se utilizó el test de chi-cuadrado en tablas de contingencia de 2 x 2 para un grado de libertad (Beiguelman, 1991).
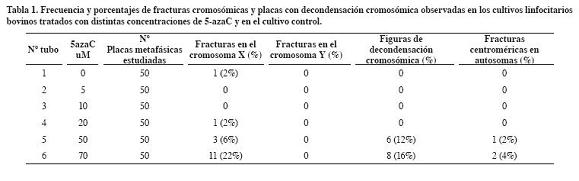
Del análisis citogenético realizado a los seis tubos de cultivo se estudió un total de 300 placas metafásicas (50 placas metafásicas por tubo de cultivo) que corresponden al número normal cromosómico de un Bos taurus macho (2n=60,XY) (Tabla 1). En los cultivos sometidos a la acción de la 5-azaC se contabilizó un total de 15 fracturas en el cromosoma sexual X (93.3% en el brazo q y 6.7% en el brazo p), mientras que en el cultivo control se observó una sola fractura en el brazo q del cromosoma sexual X (2%). Se encontraron diferencias estadísticamente significativas (p<0.01) en cuanto a las fracturas del cromosoma X en el cultivo control frente al cultivo con mayor concentración de 5- azaC (70 uM). El cromosoma Y no presentó fracturas en los cultivos estudiados. En los cultivos sometidos a las concentraciones de 50 uM y 70 uM se registraron placas metafásicas con grados de descondensación cromosómica y fracturas centroméricas en autosomas (Tabla 1, Figura 1).
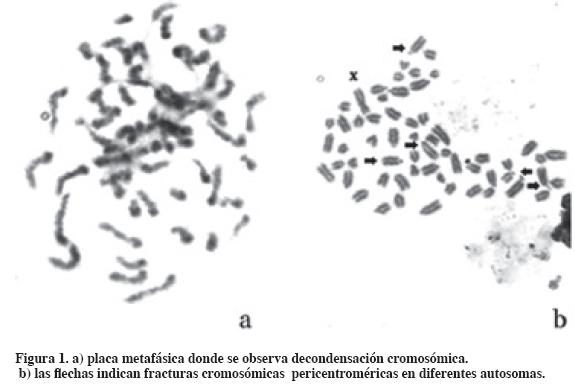
La metilación del ADN es un fenómeno epigenético esencial para el control de la actividad génica en células normales y tumorales. Este proceso incluye la inactivación de uno de los cromosomas sexuales X de la hembra de los mamíferos, el imprinting genómico, estabilidad cromosómica, silenciamiento de retrotransposones, inactivación de genes en cáncer (Dean et al., 2001). En los últimos años en tecnología de la reproducción se ha introducido el uso de la 5-azaC como sustancia inductora de desprogramación nuclear en experimentos de clonación embrionaria a partir de trasplantes nucleares. Enrigth et al. (2003) en clonación de embriones bovinos expuestos a concentraciones de 0.08 a 0.3 uM de 5-azaC observaron que se producía una disminución del desarrollo embrionario.
Llambí y Nuñez (2007) con la utilización de una concentración de 4.92 uM de 5-azaC identificaron un efecto significativo de inducción de fragilidad en el cromosoma sexual X y autosomas en cultivos linfocitarios de una hembra bovina normal. Danielak-Czech y Slota (2004) emplearon concentraciones de 50 ug/ml (205 uM) en cultivos linfocitarios de bovinos normales y bovinos con problemas reproductivos y observaron una diferencia estadísticamente significativa de expresión de fragilidad en el cromosoma sexual X (región Xq2.4 y Xq3.1) en estos últimos. Estos autores sugieren la existencia de una región inestable del cromosoma X donde se estarían expresando inadecuadamente genes asociados a características reproductivas.
En el presente trabajo con concentraciones menores encontramos que el 93.3% de las fracturas inducidas se localizaron en el brazo Xq apoyando la existencia de regiones de inestabilidad en dicho brazo cromosómico. Concentraciones superiores del fármaco (rango de 5uM a 70uM) en células linfocitarias no mostraron inhibición de la división celular, aunque con las concentraciones de 50 y 70 uM se observó un número significativo de células con cromatina decondensada.
Zlotorynski et al. (2003) dicen que si bien el mecanismo de expresión de fragilidad cromosómica inducida por 5-azaC no está bien entendido, se puede atribuir a secuencias de ADN ricas en bases C (citosinas).
Monteagudo et al. (1999), mediante la utilización de sondas del trinucleótido CGG, determinaron señales de hibridización en la región medial del brazo q, región pericentromérica y telomérica del BTAX. Dichas regiones coinciden con las regiones de fragilidad cromosómica identificadas mediante la utilización de otros inductores como la afidicolina (Llambí, 2002, Rodríguez et al., 2002). El hecho de encontrar regiones de fragilidad comunes al utilizar distintos inductores, afidicolina (inhibidor de la replicación del ADN) (Rodríguez et al., 2002) y con 5-azaC (Llambí y Nuñez, 2007) reafirma la idea de revisar la clasificación de los sitios frágiles en función solo al tipo de inductor y su frecuencia en las poblaciones. Según Zlotorynski et al. (2003) deberíamos tener en cuenta la naturaleza molecular de los mismos (contenido de repetidos CG, secuencias ricas en bases AT) debido a la formación de estructuras secundarias con predisposición a una inadecuada organización de la cromatina. Este aspecto ha sido observado en el presente trabajo al obtener figuras de descondensación cromosómica bajo los efectos del inductor utilizado.
En humanos Haff y Schmid (2000) utilizaron sustancias que se ligan a secuencias de ADN ricas en bases A-T y observaron fuerte descondensación a lo largo del cromosoma sexual Y. En el presente trabajo al encontrar estabilidad de dicho cromosoma se apoyaría la naturaleza molecular de secuencias ricas en A-T en el mismo y por ende una no afectación de la cromatina por un inductor como la 5-aza C que actúa durante la replicación del ADN reemplazando citocinas.
Rodríguez et al. (2001) emplearon 5-azaC en cultivos linfocitarios de ratón y observaron descondensación de cromatina pericentromérica con alteración en la separación centromérica durante la meta-anafase. Estos autores proponen las alteraciones epigenéticas como un factor más en la génesis de aneuploidias. En este trabajo hemos observado que las regiones cromosómicas más sensibles en los autosomas han sido las pericentroméricas, lo que podría aportar información al hecho de que en bovinos el tipo de rearreglo cromosómico sean las fusiones céntricas.
Si bien se conoce la función de la 5-azaC, poco se han investigado los efectos en cromatina en mamíferos. Debemos tener en cuenta la posible relación con la generación de alteraciones cromosómicas cuando se utiliza como droga desprogramadora de la impronta genética y la generación de patologías en individuos producto de estas nuevas tecnologías reproductivas.
A Iris Hernández por su asistencia en la preparación técnica de materiales de laboratorio. Este trabajo fue financiado por CIDEC, CSIC-Universidad de la República Oriental de Uruguay. Al Grupo de Investigación en Recursos Fitogenéticos Neo-tropicales de la Universidad Nacional de Colombia, Sede Palmira,organizador del II Simposio Latinoamericano de Citogenética y Evolución (Palmira, Valle del Cauca, Colombia, 15-18 agosto de 2007).
1. Beiguelman, B. 1991. Curso prático de bioestadística. Rev Bras Genet. 224: 1-40. [ Links ]
2. Danielak-Czech, B.; Slota, E. 2004. Mutagen induced chromosome instability in farm animals. J. Anim Feed Sci. 13: 257-267. [ Links ]
3. Enright, B.; Kubota, C.; Yang, X.; Tian, X. 2003. Epigenetic characteristics and development of embryos cloned from donor cells treated by trichostatin A or 5-aza-2'-deoxycytidine. Biol Reprod. 69(3): 896-901. [ Links ]
4. Haaf, T.; Schmid, M. 2000. Experimental condensation inhibition in constitutive and facultative heterochromatin of mammalian chromosomes. Cytogenet Cell Genet. 91:113-123. [ Links ]
5. Jones, K.L.; Hill, J.; Shin, T.Y.; Lui, L.; Westhusin, M. 2001. DNA hypomethylation of karyoplasts for bovine nuclear transplantation. Mol Reprod Dev. 60(2):208-13. [ Links ]
6. Llambí, S.; Núñez, R. 2007. Identificación de fragilidad cromosómica mediante 5'azacitidina en linfocitos de bovinos. Arch Med Vet. 39 (1): 63-66. [ Links ]
7. Llambí, S. 2002. Estudios citogenéticos-moleculares de la fragilidad del cromosoma sexual X y enfermedades hereditarias monogénicas en bovinos de la raza Holando-Uruguayo (Bos taurus). Tesis Doctor. Facultad de Veterinaria. Universidad de Zaragoza-España. [ Links ]
8. Monteagudo, L.; Postiglioni, A.; Llambí, S.; Arruga, M.V. 1999. Detection of chromosome breaks and genetics pathology by molecular genetics. Hung J Anim Produc. 48 (1): 150-152. [ Links ]
9. Neissa, J.; Guerrero, C. 2004. Del código genético al código epigenético: Nuevas estrategias terapéuticas. Rev Fac Med Univ Nac Colomb. 52 (4): 287-303. [ Links ]
10. Piedrahíta, J.A.; Mir, B.; Dindot, S.; Walter, S. 2004. Somatic Cell Cloning: The Ultimate Form of Nuclear Reprogramming? J Am Soc Nephrol 15: 1140-1144. [ Links ]
11. Rodríguez, M.J.; López M.A.; García-Orad, A.; Vig, B.K. 2001. Sequence of centromere separation: effect of 5-azacytidineinduced epigenetic alteration. Mutagenesis 16(2):109-14. [ Links ]
12. Rodríguez, V.; Llambí, S.; Postiglioni, A.; Guevara, K.; Rincón, G.; Fernández, G.; Mernies, B.; Arruga M.V. 2002. Localization of aphidicolin-induced break points in Holstein-Friesian catlle (Bos taurus) using RBG-banding. Genet Sel Evol 34: 649- 656. [ Links ]
13. Smeets, D.; Moog, U.; Weemaes, C.; Vaes-Peeters, G.; Merkx, G.; Niehof, J.; Hamers, G. 1994. ICF syndrome: a new case and review of the literature. Hum Genet 94: 240 246. [ Links ]
14. Wendy Dean, W.; Santos, F.; Stojkovic, M.; Zakhartchenko, V.; Walter, J.; Wolf, E.; Reik, W. 2001. Conservation of methylation reprogramming in mammalian development: Aberrant reprogramming in cloned embryos. Proc Natl Acad Sci USA. 98 (24): 13734-13738. [ Links ]
15. Zlotorynski, E.; Rahat, A.; Skaug,J.; Ben-Porat, N.; Ozeri, O.; Hershberg, R.; Levi, A.; Scherer, W.; Margalit, H.; Kerem.; E. 2003. Molecular Basis for Expression of Common and Rare Fragile Sites. Mol Cell Biol. 23(20): 7143 - 7151. [ Links ]














