Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.57 no.1 Palmira Jan./Mar. 2008
RESUMEN
La translocación Robertsoniana (rob1; 29) está ampliamente distribuida en razas comerciales y en reservas genéticas de bovinos Criollos americanos. Se ha descrito un enlentecimiento en el desarrollo de embriones portadores de esta aneuploidía, frente a embriones normales. La acción de la 5-aza-C, como agente desmetilante, permitiría descondensar la heterocromatina constitutiva o facultativa. En este trabajo se realiza inducción con el análogo de base 5-aza-C(10mM, 2 hrs) en cultivos linfocitarios de una hembra y un macho portadores de la rob1; 29, frente a bovinos Criollos normales. Se controla la acción desmetilante del inductor al identificar la despiralización del cromosoma X de replicación tardía en hembras y permitir el análisis de la despiralización de la cromatina en múltiples regiones de los autosomas (grandes, medianos, pequeños); de la rob1; 29 y del BTA1. Se discute la correlación existente entre regiones desmetiladas con la descondensación de la heterocromatina facultativa (condicional), relacionándola con la inestabilidad genómica, y la reprogramación epigenética.
Palabras claves: es 5-azacitidina-C, descondensación, rob1; 29, bovino Criollo.
ABSTRACT
The Robertsonian translocation (rob1; 29) is widely spread in commercial breeds and specially in genetic reserve of American Creole cattle. It is also described a delay on embryo development in front of normal ones. The action of 5-aza-C, as an hypomethylated agent, could permitted to decondensate the constitutive or facultative heterochromatin. In this work we made induction with the 5-aza-C(10mM, 2 hrs) analogs, in lymphocyte cultures of female and male carriers and normal Creole cattle. The DNA hypometilation is found in the inactive X chromosome of late replication as it is incorporated during the last hours of cell culture. The decondensing effects of 5-aza-C analogs is observed in multiple regions of the autosomes chromatin, the rob1; 29 and the BTA1. A correlation between hypometilated regions and decondensed of facultative (conditional) heterochromatin is related with genomic instability, and epigenetic reprogramming.
Key words: 5-Azacytidine-C, decondensation, rob1; 29, Creole cattle
A partir de los trabajos de Gustavsson (1969), que identifica la translocación Robertsoniana (rob1; 29) en la raza sueca Red and White como causa de sub-fertilidad debido a mortalidad embrionaria temprana, este macroarreglo se describe en múltiples razas europeas que incluye aquellas de la península ibérica que fueron introducidas en el continente americano en el siglo XVI (Arruga y Zarazaga, 1987; Rangel-Figueiredo y Lannuzzi, 1993). Posteriormente se ha descrito en poblaciones de diversos países latinoamericanos: Argentina (Schifferli y col., 2003); Bolivia (De Luca y col., 2002); Colombia (Sánchez y col., 2005); Uruguay (Postiglioni y col., 1996), Venezuela (Muñoz y col., 1994); y es considerada por la distribución amplia y la dificultad de erradicación de rodeos comerciales, un polimorfismo cromosómico con importante papel en la evolución de la familia Bovidae (Wurster y Benirschke, 1968).
Kastelic y Mapletoft (2003) se refieren a la existencia de un enlentecimiento en el desarrollo de embriones portadores de la rob1; 29, y promueven causas endógenas de origen genético que intervienen en las distintas etapas del desarrollo prenatal y provocan disminución de las tasas de fertilidad. Factores genéticos o epigenéticos (metilaciones, transposiciones) incidirían en ciertas problemáticas reproductivas debidas a reordenamientos internos de la cromatina donde estarían involucradas secuencias dinámicas de su genoma.
Di Meo y col. (2006) demuestran una reorganización de secuencias repetidas de la cromatina pericentrómérica con transposición del microsatélite INRA143 -que normalmente hibriza en BTA29q12 banda G+-, a la región proximal del brazo largo de la rob1; 29.
Tellechea y col. (2004) y Artigas y col. (en revisión) inducen cultivos linfocitarios de sangre periférica de bovinos Criollos con afidicolina (APC; 0, 3mM) durante un ciclo celular. Este agente clastogénico compite a nivel de las citocinas con la ADNpolimerasa a, y encuentra respuesta en regiones proximales de los brazos p (rob1; 29p13) y q (rob1; 29q13/21), ambas regiones bandas G+. En esta última región se encuentran mapeados el microsatélite (BMS4015) y el gen tejido específico (Col6A1), entre otros, ambos con cierta influencia sobre esta aneuploidía (King, 1991; Schilber y col., 1998; Joerg y col., 1999).
Un análogo de base, la 5-Azacitidina-C (5.aza-C), actúa como inhibidor en la condensación de la heterocromatina (constitutiva y facultativa) por ser desmetilante de citocinas, con acción sobre las 5-metiltranferasas y por lo tanto involucrado en el silenciamiento y remodelación de la cromatina durante el ciclo celular (Haaf y Schmid, 2000; Pintado y Morón, 2002).
Si la APC permite identificar regiones ricas en citocinas, debido a su efecto de antagonismo competitivo con la ADNpolimerasa a, la 5-aza-C permitirá identificar regiones de despiralización de la heterocromatina al bloquear la acción de la 5-metiltransferasa (Pintado y Morón, 2001).
En esta comunicación se presentan resultados preliminares de la acción de la 5-aza-C en altas concentraciones y al final del ciclo celular (10mM, durante 2 h) en cultivos linfocitarios de bovinos normales y portadores de la rob1; 29. Se tiene como control de las variables tiempo y concentración del inductor, la descondensación del cromosoma X de replicación tardía en hembras bovinas y su antagonismo con el BTAX del macho de replicación temprana (Haaf, 1995; Haaf y Schmid, 2000).
Se procesaron tres muestras sanguíneas de bovinos Criollos por cultivos linfocitarios estándar. a) un macho portador de la rob1; 29; N°Carav=40; b) una hembra portadora de la rob1; 29; N°Carav=767 y c) una hembra normal para la translocación Robertsoniana. Estos animales pertenecen a la reserva genética de bovinos Criollos ubicada en el Parque Nacional de San Miguel (33°40'S y 53°38'W) Rocha, Uruguay.
Las muestras de sangre periférica (0.2mL) de cada animal se cultivaron en medio RPMI-1640 (5mL), suplementado con 15% de suero fetal bovino, penicilina (100 IU. mL-1), estreptomicina (100 µg. mL-1) y fitohemaglutinina (0, 2µg. mL-1) durante 72 horas a 38.5°C. El colcemid (0.06 µg.mL-1) se incorporó 30 minutos antes de procesar el cultivo. Se sembraron por animal dos tubos diferentes: a) control de la inducción; b) inducidos. La inducción se realizó con el análogo de base, 5-azacitidina-C (10mM), introducido al cultivo durante las dos últimas horas (Haaf, 1995; Haaf y Schmid, 2000).
Las preparaciones realizadas en frío de los tubos control e inducidos de los tres animales se tiñeron con Giemsa (pH 6, 8). Las metafases inducidas se sometieron a técnicas de bandeo C para la localización de centrómeros (Summer y col., 1972). Se utilizó microscopio Olympus (BX60) con un software para captura de imágenes (Kodak Digital Science 1D) con un aumento de 100X. El análisis de la estructura cromosómica se realizó de acuerdo con la última nomenclatura estandarizada cromosómica para la familia Bovidae (ISCNDB; Di Berardino y col., 2001).
Los cultivos linfocitarios de las tres muestras sanguíneas de bovinos (tubos control) resultaron normales. Las células inducidas con el análogo de base 5-aza-C (10mM, 2 hrs) mostraron claramente su acción debido a la descondensación observada de uno de los cromosomas X de la hembra (Figuras 1c y 1d). Este correspondió al cromosoma X de replicación tardía que había sufrido desmetilación debido a la alta concentración de 5-aza-C incorporada en el período G2 del ciclo celular. Haaf y Schmid (2000) se refieren a altas concentraciones (10- 100mM) para inhibir la condensación de la cromatina de las bandas G+ donde se encuentran secuencias metiladas CG, interespaciadas con secuencias ricas en AT. La 5-aza-C descondensaría largos bloques de heterocromatina pericentromérica con contenido en ADN Sat, además de ser sensible a regiones de heterocromatina metiladas. Se podría presumir que, como la 5-aza-C induce desmetilación del ADN, éste sería un mecanismo de inhibición de la condensación, lo que permitiría la reactivación génica.
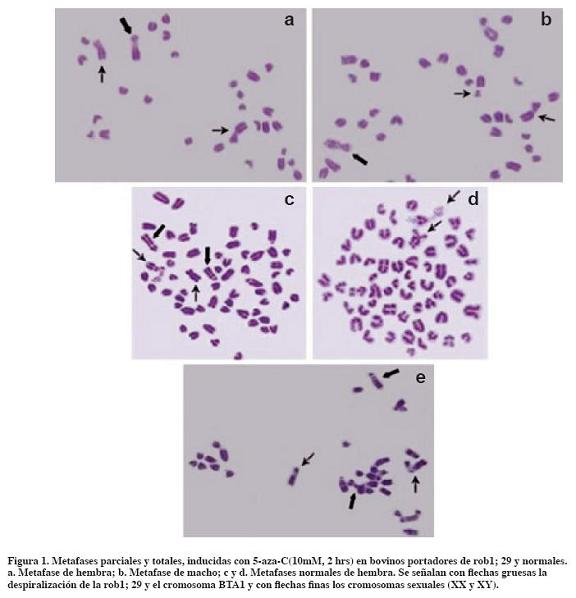
Esta expresión ocurre en regiones con citocinas metiladas, ya que el análogo de base actúa sobre la enzima 5-metiltransferasa y bloquea la acción de los grupos metilos; entonces se muestra una amplia despiralización de esta heterocromatina facultativa condicional (Haaf y Schmid, 2000, Holmquist y Ashley, 2006).
Si las regiones localizadas previamente en la rob1; 29, por la acción de la APC, estuviesen metiladas, tendrían que presentarse despiralizadas luego de ser sometidas a alta concentración de inducción con 5-aza- C (Artigas y col., en revisión).
Se observó descondensación en la región paracéntrica y en regiones bandas G+ de la rob1; 29 y del cromosoma BTA1 (Figuras 1a, 1b, 1e). La acción de la inducción se identificó también en los autosomas, donde se cuantificaron más de diez regiones de cromatina despiralizada en los 58 cromosomas autosómicos que incluyen regiones pericentroméricas, teloméricas y regiones intersticiales. Se observaron regiones condensadas que no fueron alteradas por el inductor. De acuerdo con Holmquist y Ashley (2006), la acción de este inductor desmetilante permite diferenciar regiones de heterocromatina constitutiva de la heterocromatina facultativa condicional, probablemente portadora de genes tejido específico. Este inductor podría reactivar la expresión de genes previamente silenciados si avanza en el tiempo de replicación y establece una estructura de la cromatina no heterocromática.
Estudios de inducción a diferentes concentraciones de 5-aza-C fueron realizados en cultivos linfocitarios de bovinos. Danielak-Czech y Slota (2004) encontraron alteraciones en BTA1q25, y en cuatro regiones del BTAX que corresponden todas a regiones bandas G-, al inducir células linfocitarias con 5-aza-C (50ug/ml, 6 h). Llambí y Núñez (2007) describieron fragilidad cromosómica en el cromosoma X y autosomas a concentraciones menores y durante dos ciclos celulares (4.93uM; 48h). Basándose en nuestras observaciones preliminares y utilizando altas concentraciones de 5- aza-C, accionando al final de G2, y teniendo en cuenta las variables (concentración y tiempo) utilizadas por los otros autores, se desprende que a bajas concentraciones del inductor y en etapas previas al período G2 de la interfase, el efecto despiralizante de la heterocromatina se minimiza, mientras que la desmetilación actuaría en regiones preferentemente ricas en secuencias génicas housekeeping (bandas R+) (Holmquist y Ashley, 2006)
El cromosoma X inactivo se observó claramente despiralizado a diferencia del X activo (Figuras 1c y 1d). Estos resultados coinciden con lo descrito por Haaf y Schmid (2000) en cromosomas X de mamíferos, entre ellos artiodáctilos (Bos taurus) y perisodáctilos (Equus caballus). Se podría establecer una correlación entre la descondensación observada en la región banda G+, la acción desmetilante del inductor y la acción previamente descripta de la APC (0.3mM, 24 h). Mientras ésta actúa sobre las citocinas, en un ciclo completo celular (período S), bloqueando la replicación del ADN, la 5-aza-C(10mM, 2 h) estaría actuando sobre el final de G2, momento de condensación de aquella cromatina replicada tardíamente. Esta cromatina condicional podría estar incluida en genes tejido específico (caso del gen l collagen typeVI-a1) que intervienen en la dinámica y remodelación de su cromatina (Holmquist y Ashley, 2006).
La presencia de múltiples regiones no alteradas por la inducción (Figuras 1c y 1d) permite tener en cuenta los complejos proteicos que mantienen la estructura cromosómica, ubicados en centros de condensación a lo largo de los cromosomas, con implicancia en el empaquetamiento de la cromatina (Holmquist y Ashley, 2006). Nuestros resultados preliminares alientan a aumentar la muestra de metafases analizadas a los efectos de confirmar estadísticamente fallas en la heterocromatina facultativa de células linfocitarias de bovinos frente a inducciones con altas concentraciones al final del período G2. Estudios de arquitectura nuclear y ubicación de dominios de las regiones cromosómicas analizadas en este trabajo permitirán profundizar en las relaciones epigenéticas que llevan a la expresión génica, dinámica y remodelación de la cromatina.
Una evaluación primaria de regiones metiladas y competitivas de las citocinas incorporadas a posibles islas CpG podrían estar implicadas en problemas reproductivos de subfertilidad (Danielak-Czech y Slota, 2004). Estos podrían relacionarse con la mortalidad temprana embrionaria de bovinos portadores de rob1; 29, debiéndose tener en cuenta que, al ser estos efectos específicos de tejido, tienen un importante papel en la reprogramación epigenética.
Los autores agradecen a Iris Hernández por la asistencia técnica y a Pablo Costa por el tratamiento de las imágenes. Este trabajo se realizó con financiación de diferentes organizaciones nacionales: Pedeciba (Programa de Desarrollo de las Ciencias Básicas); CSIC, Universidad de la República Oriental de Uruguay (proyecto I + D), y Beca de Iniciación en la Investigación: CIDEC (Facultad de Veterinaria). También agradecen al Grupo de Investigación en Recursos Fitogenéticos Neo-tropicales de la Universidad Nacional de Colombia, Sede Palmira, organizador del II Simposio Latinoamericano de Citogenética y Evolución (Palmira, Valle del Cauca, Colombia, 15-18 agosto de 2007).
1. Arruga, M. V.; Zarazaga, I. 1987. La translocación Robertsoniana 1/29 en el ganado vacuno. Su incidencia en las razas vacunas españolas. Genet Iber, 39 (1/2):61-75. [ Links ]
2. Artigas, R.; Iriarte A.; Tellechea B.; Llambí S.; De Bethencourt M.; Postiglioni A. Aphidicolin induced break points in heterozygous Robertsonian translocation (rob1; 29) in Creole cattle (en revisión). [ Links ]
3. Danielak-Czech, B ; Slota, E.. 2004. Mutagen-induced chromosome instability in farm animals. J Anim Feed Sci 13:257- 267. [ Links ]
4. De Luca, JC.; Zufriategui, L.; Picco, SJ.; Ripoli, MV.; Giovambattista, G.; Rojas, FV.; Dulout, FN. 2002. Incidente of 1/29 translocation in Bolivian Creole and Brahman Yacumeño cattle. Theriogenology 15; 58(7): 1273-81. [ Links ]
5. Di Berardino, D.; Lannuzzi, L.; Di Meo, G. 1983. Localization of BrdU-induced break sites in bovine chromosomes. Caryologia 36(3)285-292. [ Links ]
6. Di Berardino, D.; Di Meo, G.; Gallagher, D. 2001 ISCNDB International System for Chromosome Nomenclature of Domestic Bovids. Cytogenet Cell Genet 92: 283-299. [ Links ]
7. Di Meo, A.; Perucatti, R.; Chaves, F. 2006 Cattle rob (1; 29) originating from complex chromosome rearrangements as revealed by both banding and FISH-mapping techniques. Chromosome Res 14:649-655. [ Links ]
8. Gustavsson, I. 1969. Cytogenetics, distribution and phenotypic effects of a translocation in Swedish cattle. Hereditas 63:68-169. [ Links ]
9. Haaf, T.1995. The effects of 5-azacytidine and 5-azadeoxicytidine on chromosome structure and function: implications for methylation- associated cellular process. Pharmc.Thr 65:19-46. [ Links ]
10. Haaf, T.; Schmid, M. 2000. Experimental condensation inhibition in constitutive heterochromatin of mammalian chromosomes. Cytogenet. Cell Genet 91.113-123. [ Links ]
11. Holmquist, G.; Ashley, T. 2006. Chromosome organization and chromatin modification: influence on genome function and evolution. Cytogenet & Genome Res 114:96-125. [ Links ]
12. Joerg, H.; Garner, D.; Rieder, S.; Suwattana, D.; Stranzinger, G. 1998 Molecular genetic characterization of Robertsonian translocations in cattle. J Anim Breed Genet 118:371-377. [ Links ]
13. Kastelic, JK.; Mapletoft, RJ. 2003. Causas no infecciosas de muerte embrionaria en ganado bovino. Quinto Simposio Internacional de Reproducción Animal. IRAC.149-159. [ Links ]
14. King, WA. 1991. Embryo-mediated pregnancy failure in cattle. Can Vet J 32:99-103. [ Links ]
15. Llambí, S.; Núñez, R. 2007 Identificación de fragilidad cromosómica mediante 5'azacitidina en linfocitos de bovinos Arch. Med. Vet. 39, N° 1(en prensa). [ Links ]
16. Muñoz, M.G.; Ocanto, D.; Madriz, M.L.; Medina, R.; Vera, O. 1994. Incidence of 1/29 translocation in Venezuelan Creole Bulls. Theriogenology 41: 379-382 [ Links ]
17. Pintado, E.; Morón, F. 2001. Metilación y expresión del gen FMR1. Rev Neurol, 33:57-62. [ Links ]
18. Postiglioni, A.; Llambí, S.; Gagliardi, R.; De Bethencourt, M.1996 Genetic characterization of Uruguayan Creole cattle. I.Cytogenetic Characterization of a sample of Uruguayan Creole cattle. Arch Zootec 45:(170-171)209-213. [ Links ]
19. Postiglioni, A.; Llambí, S.; Guevara, K.; Rincón, G.; Armstrong, E.; Arruga, MV. 2002 Sitios frágiles comunes en marcadores cromosómicos polimórficos. Su identificación en bovinos Criollos del Uruguay.SERGAEl Arca 5(1): 113. [ Links ]
20. Rangel-Figueiredo, T.; Iannuzzi, L. 1993. Frequency and distribution of rob(1; 29) in three Portuguese cattle breeds. Hereditas 119: 233-237. [ Links ]
21. Sánchez, CA.; Bueno, LM. 2005. Translocación Robertsoniana rob1; 29 en bovinos Criollos colombianos. Rev Col Cienc Pec 18:43-79. [ Links ]
22. Schifferli, C.A.; Bonelli, A.M.; Wevar, C.; Scilingo, A.M.; Arruga, M.V. 2003. Presumptive 1/29 Robertsonian translocation observed in the Argentinean Creole cattle breed. Anim.Res.52 119-123. [ Links ]
23. Shibler, L.; Vaiman, D.; Oustry, A.; Giraud-Delville, C.; Cribiu, EP. 1998 Comparative gene mapping: A fine-scale survey of chromosome rearrangements between ruminants and humans. Genome Res 901-915. [ Links ]
24. Sumner, A.T. 1972. A simple technique for demonstrating centromeric heterochromatin. Exp Cell Res 75:304-306 [ Links ]
25. Tellechea, B.; Llambí, S.; De Bethencourt, M.; Rincón, G.; Postiglioni, A. 2004. Avances en el estudio de la heterocromatina en rob1; 29. Un reordenamiento cromosómico que produce mortalidad embrionaria temprana. Jornadas Uruguayas de Buiatría, 32. p 229-231. [ Links ]
26. Wurster, DH.; Benirschke, K. 1968 Chromosome studies in the superfamily Bovidea. Cromosoma. 25: 152-171 [ Links ]














