Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.57 no.3 Palmira July/Sept. 2008
RESUMEN
En el estudio se desarrolló una metodología de transformación genética mediante Agrobacterium tumefaciens en cultivares colombianos de caña de azúcar. La transformación se evaluó mediante la expresión del gen GUS. Callos embriogénicos y explantes meristemáticos de los genotipos CC85-92, CC84-75 y CC87-505 se transformaron usando tres cepas (AGL-1, LBA4404 y EHA105) con el plásmido pCambia 1305.2 y dos (EHA105 y LBA4404) con pCambia 2301. Se usó el medio de infiltración (IM) con acetosiringona y se evaluó el tiempo de cocultivo y la densidad óptica de la bacteria al momento de la inducción. Los genotipos mostraron respuesta diferencial con las combinaciones cepa-plásmido: obtuvieron mayor expresión del gen GUS cuando el genotipo CC85-92 se transformó con la cepa AGL-1-pCambia 1305.2. CC84-75 y CC87-505 mostraron mayor expresión cuando se transformaron con la cepa EHA105-pCambia 1305.2. Mayor eficiencia en la expresión se obtuvo cuando la bacteria se indujo en IM después de siete días de cocultivo y cuando la densidad óptica de la bacteria fue de 0.2600nm al momento de la inducción. Se demostró superioridad de los explantes en la eficiencia de transformación.
Palabras claves: Agrobacterium tumefaciens; Saccharum spp; caña de azúcar; transformación genética.
ABSTRACT
The aim of the present study was to develop a transformation method mediated by Agrobacterium in Colombian cultivars of sugarcane. Transformation was evaluated in each step through transient GUS expression. Embryogenic calli and meristematic explants of CC85-92, CC84-75 y CC87-505 cultivars, were transformed using Agrobacterium tumefaciens AGL-1, LBA 4404 and EHA 105 strains, harboring pCambia 1305.2 plasmid. Furthermore, strains LBA 4404 and EHA 105 harboring pCambia 2301 were also tested. Bacterian activator medium, named infiltration media (IM) with acetosyringone was used. Co-cultivation time and bacteria optical density before induction were tested. Sugarcane cultivars evaluated showed differential response to different strain-plasmid combinations, obtaining higher GUS expression when CC85-92 was transformed using AGL-1 strain harboring the vector pCambia 1305.2. CC84-75 and CC87-505 cultivars showed higher GUS expression using EHA 105 strain harboring pCambia 1305.2 vector. The most efficient expression was evident after 7 days of co-cultivation and when bacteria optical density was 0.2600nm before induction in IM medium. This study demonstrated that meristematic explant is more suitable than embryogenic callus as a target to be transformed by Agrobacterium tumefaciens.
Key words: Agrobacterium tumefaciens; Saccharum spp; sugarcane; genetic transformation
La transformación genética se ha usado en la manipulación genética de más de 120 especies por medio de Agrobacterium tumefaciens. Partiendo de un modelo biológico usado por la naturaleza se ha desarrollado una técnica que no sólo ha permitido transformar genéticamente organismos vegetales, sino el desarrollo de modelos de señalización celular, transporte célula a célula, importe nuclear de proteínas y ADN y mecanismos de integración genómica (Tzfira y Citovsky, 2000).
Esta metodología se ha establecido para dicotiledóneas y recientemente en monocotiledóneas. Ofrece ventajas sobre los otros sistemas de transformación, como transferir ADN a las células vegetales con terminaciones definidas, fragmentos de ADN grandes con pocos o ningún rearreglo, con alta reproducibilidad y sin necesidad de utilizar equipos costosos.
Los cultivares modernos de caña de azúcar son híbridos interespecíficos con alto nivel de ploidía, lo que dificulta el mejoramiento genético convencional debido a la compleja base genética del cultivo. Estas características hacen necesario desarrollar sistemas de mejoramiento utilizando la ingeniería genética con el fin de introducir genes de interés en variedades o híbridos comerciales (Lakshmanan et al., 2005).
Son varios los reportes de éxito en la transformación de caña de azúcar usando diferentes metodologías como el bombardeo de partículas (Gallo-Meagher e Irvine, 1996), electroporación (Arencibia et al., 2000) y usando Agrobacterium (Manickavasagam et al., 2004). Algunas de las características que se han introducido en el germoplasma son resistencia a herbicidas (Falco et al., 2000; Leibbrandt y Snyman 2003), resistencia a virus (Rangel et al., 2002; Gilbert et al., 2005) y resistencia a insectos (McAllister et al., 2004).
El objetivo del presente trabajo fue desarrollar una metodología de transformación genética de variedades comerciales colombianas de caña de azúcar usando Agrobacterium tumefaciens. La transformación en cada paso se evaluó mediante la expresión transitoria del gen GUS en callos embriogénicos y en explantes meristemáticos con alta capacidad de regeneración.
Se utilizaron dos tipos de tejido (explantes meristemáticos y callos embriogénicos) de tres genotipos de caña de azúcar (CC85-92, CC84-75 y CC87-505). Los callos embriogénicos se indujeron a partir de tejido meristemático de la parte basal del tallo de plantas de 3 meses de edad crecidas en invernadero, en medio de inducción de callos MIC (Gallo-Meagher e Irvine, 1996). Los callos se mantuvieron en condiciones de oscuridad a 28°C por aproximadamente seis semanas. Los callos producidos se subcultivaron cada dos semanas en medio nuevo de inducción. Los explantes meristemáticos consistieron en rodajas tomadas de los 10 primeros centímetros de la parte apical del tallo de plantas crecidas en campo de 6 a 8 meses de edad. Ambos tejidos se esterilizaron y se mostraron una capacidad de regeneración preliminar superior al 85%.
En los ensayos se usaron tres cepas de Agrobacterium (AGL-1, EHA105 y LBA4404) que llevan el vector pCambia 1305.2, el cual contiene el gen de selección hptII (higromicina fosfotransferasa II), que confiere resistencia al antibiótico higromicina B para la selección del tejido transformado. Además posee el gen reportero GUSPlus® (b-glucuronidasa), que contiene la secuencia de un péptido rico en glicina (PRG), la cual facilita la excreción extracelular de la b-glucuronidasa acelerando la expresión del gen GUS in vivo. El plásmido también posee un gen fuera de la región del ADN-T, que confiere resistencia a la kanamicina, antibiótico con el cual se selecciona la bacteria.
También se evaluaron dos cepas (EHA105 y LBA4404) que llevan el plásmido pCambia 2301, el cual contiene el gen de selección nptII (neomicina fosfotransferasa II) para la selección del tejido transformado y otorga resistencia a los antibióticos aminoglicósidos (neomicina, kanamicina, paromomicina y gentamicina). También posee el gen reportero GUS y un gen fuera de la región del T-DNA que confiere resistencia a kanamicina.
Las cepas bacterianas se activaron en medio LB (Sambrook et al., 1989), suplementado con 50 mgL-1 de kanamicina durante 16 horas a 28°C en agitación continua (240 rpm). El cultivo se diluyó hasta alcanzar una densidad óptica de 0.2600nm en el medio IM (Vaquero, 1999), en agitación a 240 rpm a 28°C durante 2 horas en oscuridad. Las condiciones se establecieron en ensayos preliminares con diferentes medios de activación y densidades ópticas (0.2, 0.4, 0.6, 0.8 y 1.0 a 600nm de absorbancia).
Los callos se sumergieron en solución bacteriana y se sometieron a infiltración por vacío de 84.43 kPa por cinco minutos. Los explantes de rodajas de tejido meristemático se infiltraron durante una hora. Los tejidos se secaron en papel filtro estéril Whatman N° 1 y se transfirieron a medio de cocultivo sólido (Gallo- Meagher e Irvine, 1996) suplementado con acetosiringona. El cocultivo se realizó en condiciones de oscuridad y humedad relativa de 49% y 21° C. El tiempo de cocultivo se evaluó desde 1 a 7 días.
Después del cocultivo los tejidos se lavaron con cefotaxima 500 mgL-1 para eliminar la bacteria del tejido. El tejido se secó y se realizó la prueba de expresión transitoria del gen GUS.
La evaluación transitoria del gen reportero GUSPlus® y GUS se realizó según Jefferson et al. (1987) y McCabe et al. (1988). El tejido se mantuvo en esta solución a 37° C por 24 horas.
Los ensayos de transformación se realizaron en un arreglo multifactorial donde se evaluaron las variables medio de activación bacteriana (3) y fase de crecimiento de la bacteria (5); para variable combinación cepa-plásmido se evaluaron dos combinaciones cepa plásmido para los genotipos CC 85-92 y CC 87-505; y tres para el genotipo CC 84-75 (Tabla 1). Se evaluaron en 30 tratamientos para los genotipos CC 85-92 y CC 87-505 y 45 para el genotipo CC 84-75; se evaluaron 32 callos embriogénicos por tratamiento. La variable de respuesta fue la expresión transitoria del gen reportero GUS. El análisis de los datos fue descriptivo debido a la carencia de repeticiones y el bajo número de datos por tratamiento. Para los ensayos con los explantes meristemáticos (20 por tratamiento) se evaluó sólo la densidad óptica de la bacteria a 0.2 a 600nm. En la prueba transitoria del gen reportero GUSPlus® y GUS se incluyó como control positivo tejido vegetal de arroz transformado

Expresión transitoria del gen GUS utilizando callos embriogénicos
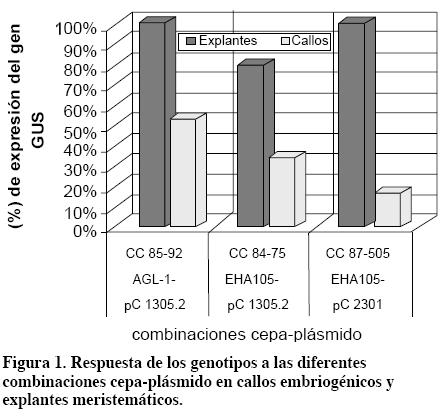
Los resultados indicaron respuesta diferencial de los genotipos a las combinaciones cepa-plásmido evaluadas (Figura 1). El genotipo CC85-92 mostró mayor expresión del gen GUS cuando se transformó con la cepa AGL-1-pCambia 1305.2 (Tabla 2). El vector pCambia 1305.2 evaluado con tres cepas de A. tumefaciens mostró comportamiento diferencial en la capacidad de transformación, similar a lo obtenido con el plásmido pCambia 2301 evaluado con dos cepas. Sin embargo, los ensayos con las dos cepas no mostraron buena expresión del gen GUS, excepto con el genotipo CC87-505. Con la cepa LBA 4404 no hubo expresión. Esto coincide con lo sugerido por Amoah et al. (2001) acerca de la habilidad de diferentes vectores en la misma cepa de Agrobacterium para transferir el ADN-T.
Se lograron mejores resultados cuando la bacteria se encontraba a una D.O de 0.2600nm al momento de la inducción con acetosiringona. A medida que la densidad óptica fue mayor, el porcentaje de callos GUS positivo disminuyó, llegando en algunos casos a cero. Esto indica la importancia de la concentración de la bacteria al momento de inducir los genes vir.
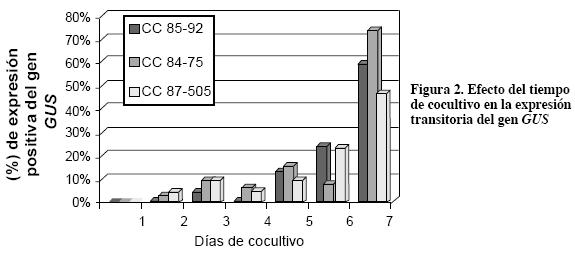
La respuesta en la expresión fue significativamente superior en el día 7 de cocultivo (Figura 2). Similar resultado reportaron Hoshi et al. (2004) en la transformación genética de lirio mediada por Agrobacterium. Sin embargo, se ha reportado que periodos prolongados de cocultivo pueden favorecer sobrecrecimiento de la bacteria y muerte del tejido (Manickavasagam et al., 2004). En caña de azúcar se ha reportado como tiempo óptimo de cocultivo 3-4 días (Manickavasagam et al., 2004; Zi-Zhang, 2004). En el presente estudio se evaluaron estos días de cocultivo, pero además se evaluaron los días 1 y 2 al igual que los días 5, 6 y 7. En los días de cocultivo 3 y 4 las expresiones del gen GUS fueron de 7.8% y 3.7% en promedio, respectivamente. En el séptimo día de cocultivo se obtuvo en promedio para los tres genotipos el 60.86% de expresión. La expresión del gen GUS en callos embriogénicos se observa en la Figura 3.
Expresión transitoria del gen GUS utilizando explantes meristemáticos
Con explantes meristemáticos se obtuvieron porcentajes superiores de transformación (Figura. 1). El genotipo CC85-92 con la cepa AGL-1-pCambia 1305.2 en el medio de activación IM presentó expresión transitoria del gen GUS de 100%. El genotipo CC84-75 presentó la mayor expresión con la cepa EHA105 pCambia 1305.2. de 75% El genotipo CC87-505 presentó mejor expresión con la cepa EHA 105 pCambia 2301 con 100%, y 75% con la cepa EHA105-pCambia 1305.2 (Tabla 3). La expresión del gen GUS en explantes meristemáticos se observa en la Figura 4.
En caña de azúcar se han reportado resultados positivos de transformación mediante la vía de embriogénesis directa utilizando explantes meristemáticos. Los resultados obtenidos por Snyman et al. (2006); Desai et al. (2004) y Mulleegadoo y Dookun- Saumatally (2005) han demostrado ciertas ventajas del uso de explantes sobre callos embriogénicos para la transformación utilizando el bombardeo de partículas. La regeneración por la vía de embriogénesis directa ha permitido obtener hasta 72% de plantas transgénicas a partir de explantes meristemáticos. Estas ventajas se refieren a la reducción en el tiempo de cultivo. Además, se ha evidenciado reducción de variación somaclonal debido a que se acorta el tiempo de exposición a hormonas de crecimiento como el 2,4D (Hoy et al., 2003).
Los resultados indican que con el uso de explantes meristemáticos se desarrolla un sistema rápido y eficiente de transformación para la obtención de plantas transgénicas. Además, permitiría mejorar la eficiencia de transformación de genotipos recalcitrantes a la transformación cuando se usan callos embriogénicos.
Se identificó respuesta diferencial de los genotipos a las combinaciones cepa–plásmido evaluadas.
La mayor expresión del gen GUS fue evidente cuando la bacteria fue inducida en el medio de activación IM conteniendo MES pH 5.6, MgCl2 y acetosiringona (200 mM). Así mismo, se determinó que la bacteria debe tener una densidad óptica de 0.2 600nm al momento de la inducción de los genes vir. La mayor expresión del gen GUS se obtuvo después de siete días de cocultivo.
Se demostró superioridad de los explantes meristemáticos en la respuesta a la expresión transitoria del gen GUS.
A las entidades financiadoras Colciencias (código 22141216771) y Cenicaña; a la Universidad Nacional de Colombia, sede Palmira, y a los doctores Carlos Moreno, Ricardo Acuña, Paul Chavarriaga, Claudia Flórez y Eddie Tabares, por sus valiosos aportes durante el desarrollo de la investigación.
El artículo se derivó de la tesis de maestría de M. L. Bonilla.
1.Amoah, B.K.; Wu, H.; Sparks, C.; Jones, H.D. 2001. Factors influencing Agrobacterium- mediated transient expression of uidA in wheat inflorescence tissue. J Exp Bot 52 ( 38): 1135-1142. [ Links ]
2.Arencibia, A.D.; Carmona, E.; Cornide, M.T.;Menéndez, E.; Molina, P. 2000. Transgenic sugarcane (Saccharum spp). p188-206 In: Bajaj, S.S (ed) Biotechnology in agriculture and forestry 46. Heidelberg: Springer. (Transgenic crops 1). [ Links ]
3.Desai, N.S.; Suprasanna, P.; Bapat, V.A. 2004. Simple and reproducible protocol for direct somatic embryogenesis from cultured immature inflorescence segments of sugarcane (Saccharum spp.). Curr Sci. 87: 764-768. [ Links ]
4.Falco, M.C.; Tulmann, Neto A.; Ulian, E.C. 2000. Transformation and expression of a gene for herbicide resistance in Brazilian sugarcane. Plant Cell Rep 19:1188–1194. [ Links ]
5.Gallo-Meagher, M.; Irvine, J.E. 1996. Herbicide resistant sugarcane containing the bar gene. Crop Sci 36:1367–1374. [ Links ]
6.Gilbert, R.A.; Gallo-Meagher, M.; Comstock, J.C.; Miler, J.D.; Jain, M.; Abouzid, A. 2005. Agronomic evaluation of sugarcane lines transformed for resistance to Sugarcane mosaic virus Strain E. Crop Sci 45: 2060–2067. [ Links ]
7.Hoshi, Y.; Kondo, M.; Mori, S.; Adachi, Y.; Nakano, M.; Kobayashi, H. 2004. Production of transgenic lily plants by Agrobacterium–mediated transformation. Plant Cell Rep 22: 359 -364. [ Links ]
8.Hoy, J.W.; Bischoff,K.P.; Milligan, S.B.; Gravois, K.A. 2003. Effect of tissue culture explant source on sugarcane yield components. Euphytica 129: 237-240. [ Links ]
9.Jefferson R.A.; Kavanagh T.A.; Bevan M.W. 1987. GUS fusions: β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J 6: 3901-3907. [ Links ]
10.Lakshmanan P.; Geijskes, J.; Aitken, K.; Grof, C.; Bonnett, G.; Smith, G. 2005. Sugarcane Biotechnology: The challenges and opportunities. In Vitro Cell Develop Biol Plant 41: 345–363 [ Links ]
11.Leibbrandt, N. B.; Snyman, S.J. 2003. Stability of gene expression and agronomic performance of a transgenic herbicide-resistant sugarcane line in South Africa. Crop Sci 43: 671–677. [ Links ]
12.Manickavasagam, M.; Gavapathi, A.; Anbazhagan, V.R.; Sudhakar, B.; Selvaraj, N.; Vasudevan, A.; Kasthurirengan, S. 2004. Agrobacterium-mediated genetic transformation and development of herbicide-resistant sugarcane (Saccharum species hybrids) using axillary buds. Plant Cell Rep 23: 134–143. [ Links ]
13.McAllister, C.D.; Bischoff, K.P.; Gravois, K.A.; Schexnayder, H.P.; Reagan, T.E. 2004. Transgenic Bt-corn affects sugarcane borer in Louisiana. Southwest Entomol 29: 263–269. [ Links ]
14.McCabe, D.E.; Swain, W.F.; Martinell, B.J.; Christou, P. 1988. Stable transformation of soybean (Glycine max) by particle acceleration. Bio/ Technol 6: 923-926. [ Links ]
15.Mulleegadoo, K.D.; Dookun-Saumtally, A. 2005. Genetic transformation of sugarcane by microprojectile bombardment of young leaf rolls. Proc Int Soc Sugar Cane Technol 25: 579–583. [ Links ]
16.Rangel, M.; Tabares, E.; Lentini, Z.; Tohme, J.; Mirkov, E.; Victoria, J.; ángel, F. 2002. transformación de plantas de caña de azúcar susceptibles al síndrome de la hoja amarilla. Rev Col Biotec 4 (1): 54-60. [ Links ]
17.Sambrook, J.; Fritsch, E.F.; Maniatis, T. 1989. Molecular cloning: a laboratory manual, 2nd ed. N.Y.: Cold Spring Harbor Laboratory Press. (PAGINAS) [ Links ]
18.Snyman, J.S.; Meyer, M.G.; Richards, M.J.; Haricharan, N.; Ramgareeb, S. Huckett, I.B. 2006. Refining the application of direct embryogenesis in sugarcane: effect of the developmental phase of leaf disc explants and the timing of DNA transfer on transformation efficiency. Plant Cell Rep 25: 1016- 1023. [ Links ]
19.Tzfira, T.; Citovsky V. 2000. From host recognition to T-DNA integration: the function of bacterial and plant genes in the Agrobacterium-plant cell interaction. Mol Plant Pathol 1( 4): 202-212. [ Links ]
20.Vaquero, C. 1999. Transient expression of a tumor specific single- chain fragment and chimeric antibody in tobacco leaves. Proc Natl Acad Sci USA. 96: 11128-11133. [ Links ]
21.Zi Zhang Wang. 2004. Trehalose synthase gene transfer mediated by Agrobacterium tumefaciens enhances resistance to osmotic stress in sugarcane. p 529-534. In: Proc Internl Symp. On Sustain Sugarcane and Sugar Production Technol, Naming, P.R. China. [ Links ]














