Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.57 no.3 Palmira July/Sept. 2008
RESUMEN
Se caracterizó un virus transmitido por la mosca blanca Bemisia tabaci al tomate en el Valle del Cauca como una variante del Virus del mosaico amarillo del tomate (Tomato yellow mosaic virus = ToYMV). Plantas de tomate (FLA 496-11-6-1-0, FLA 478-6-3-1-11, FLA 456-4 y FLA 653-3-1-0) de 20 días de edad se confinaron en jaulas individuales con 10 individuos virulíferos de B. tabaci (biotipo B) por planta, en condiciones de invernadero. La infección por el virus se confirmó por el desarrollo de los síntomas y las pruebas moleculares de PCR e hibridación dot blot. Las características agromorfológicas se evaluaron en campo en un diseño de bloques completos al azar con tres repeticiones. Las líneas FLA 653-3-1-0, FLA 496-11-6-1-0 y FLA 478-6-3-1-11 desarrollaron síntomas muy leves; el ADN viral fue apenas detectable para algunos individuos y presentaron características del fruto y rendimientos deseables.
Palabras claves: Solanum lycopersicum; Bemisia tabaci; ToYMV.
ABSTRACT
A virus transmitted by the whitefly Bemisia tabaci to tomato was characterized in the Cauca Valley like a variant of Tomato yellow mosaic virus (ToYMV). Artificial whitefly-mediated inoculation in the greenhouse was done with 20 days-old tomato plants (FLA 496-11-6-1-0, FLA 478-6-3-1-11, FLA 456-4 y FLA 653-3-1-0) exposed to 10 viruliferous individuals of B. tabaci (biotype B) per plant in individual insect-proof cages. The presence of the begomovirus was evaluated by symptoms development and was confirmed using dot blot hybridization and PCR. Agronomical characteristics were evaluated in the field in a completely randomized blocks design with 3 replications. The lines FLA 653-3-1-0, FLA 496-11-6-1-0 and FLA 478-6-3-1-11 developed mild symptoms, viral DNA was barely detectable in some individuals, and they showed characteristics of the fruit and desirable yield.
Key words: Solanum lycopersicum; Bemisia tabaci; ToYMV.
El tomate es una hortaliza de importancia económica. La producción mundial de 4.599.000 ha se incrementó en 3.5 % entre 2000 y 2005. En Colombia, mientras en 2000 se cosecharon 17.264 ha, en el 2006 se sembraron 8.688 ha para una reducción estimada entre 241.987 y 375.082 toneladas (Corporación Colombia Internacional, 2006). Una de las causas principales de la disminución en la producción es la aparición de nuevas enfermedades virales (Morales et al., 2002), en especial las causadas por virus del género Begomovirus (familia Geminiviridae).
La mayoría de los begomovirus tienen genomas bipartitos (ADN-A y B) empaquetados en partículas geminadas (Fauquet et al, 2003). Son transmitidos por la mosca blanca Bemisia tabaci Genn y causan pérdidas significativas en cosecha (Morales y Anderson, 2001).
En Colombia se han registrado brotes de begomovirus en cultivos de importancia económica en varios departamentos (Morales et al. 2000, 2002). En los últimos años el Valle del Cauca ha sufrido la incidencia de estos virus en plantaciones de tomate y habichuela. Estas epidemias también están asociadas con la aparición del biotipo B de B. tabaco, más agresivo que el biotipo A. La invasión también ha sido favorecida por periodos de sequía prolongada que favorecieron la reproducción de esta mosca blanca y el desplazamiento de Trialeurodes vaporariorum Westwood (Morales et al., 2002).
El control de virus está orientado a disminuir las poblaciones del vector mediante el uso de insecticidas, pero la mosca blanca ha desarrollado resistencia a los insecticidas tradicionales y los nuevos productos son costosos y no logran controlar las altas poblaciones de B. tabaci. Igualmente el control biológico y las prácticas culturales no logran disminuir las altas poblaciones.
Por estas razones el desarrollo y uso de variedades resistentes a los begomovirus son la mejor alternativa de control. Sin embargo, a pesar de que el tomate es una especie originaria del neotrópico, el mejoramiento genético se ha llevado a cabo en la zona templada (Morales, 2001) y las variedades comerciales no están adaptadas a las condiciones y plagas del trópico.
En este trabajo se evalúan líneas -desarrolladas en Florida, Estados Unidos, contra un begomovirus de origen neo-tropical (Tomato mottle virus) e incluidas dentro de un grupo de fuentes de resistencia a diversos begomovirus por el Centro Asiático para el Mejoramiento y Desarrollo de la Horticultura (AVRDC)- como posibles fuentes de resistencia para el mejoramiento de la variedad Unapal Maravilla, con características agronómicas deseables, pero altamente susceptible a begomovirus.
El trabajo se realizó en el laboratorio y los invernaderos de la Unidad de Virología del Centro Internacional de Agricultura Tropical (CIAT), Palmira, Colombia. La evaluación de campo se realizó en el Centro Experimental de la Universidad Nacional de Colombia, sede Palmira (CEUNP).
Las semillas de la variedad Unapal Maravilla se obtuvieron del CEUNP. Las semillas de las líneas resistentes FLA 496-11-6-1-0, FLA 478-6-3-1-11, FLA 456-4, FLA 653-3-1-0, y de la susceptible CLN 206 D fueron proporcionadas por el AVRDC. Las semillas de la variedad Kyndio fueron adquiridas a Semillas Arroyave. La germinación se realizó en bandejas en condiciones de casa de malla y se trabajó con plántulas en la etapa de dos hojas verdaderas.
El virus se obtuvo de plantas sintomáticas provenientes de Rozo (Valle del Cauca). El aislamiento se mantuvo en el invernadero para transmisión con mosca blanca (B. tabaci, biotipo B) a la variedad Kyndio. Las plantas se renovaban periódicamente de acuerdo con el ciclo de vida de la mosca blanca.
Se extrajo ADN de hojas jóvenes (Giltberson et al., 1991). La caracterización del componente A del begomovirus se realizó mediante PCR utilizando las parejas de cebadores PAR1c715 y PAL1v1978, PAR1C496/PAL1v1978 y PAL1c1960/PAR1v722 (Zhou et al., 1997). Para la caracterización parcial del ADN-B se utilizó la pareja de cebadores PCRc2 y PBL1v2040, que amplifican un fragmento de aproximadamente 600 pb (Rojas et al., 1993). La concentración final fue Buffer 1X, 1.5 mM de MgCl2, 0.2 mM de dNTPs y 0.2 μM de cebadores y una U de Taq polimerasa (Promega, Madison, WI). Las condiciones de amplificación incluyeron un primer ciclo de denaturación a 94 °C durante un minuto, alineamiento de los cebadores a 52 °C por 90 s y extensión a 72 °C por 90 s, seguido de 30 ciclos de 94 °C por 30 s, 52 °C por un minuto y 72 °C por un minuto con una extensión final de cinco minutos a 72 °C. Se utilizaron como control positivo muestras de ADN en las que se había detectado begomovirus, y como control de reacción la mezcla sin ADN. Los productos amplificados se observaron en geles de agarosa al 1.2 %, se tiñeron en solución de bromuro de etidio y se visualizaron en luz ultravioleta.
Los productos de tamaño esperado se clonaron en el vector pGEM-T Easy (Promega, Madison, WI), utilizado para transformar células competentes DH5α. Los plásmidos se purificaron con el Kit QIAprep (QIAGEN GmbH, Hilden, Germany) utilizando los cebadores M13 y T7 y el Kit Big-Dye Terminator v1.1 Cycle Sequencing (Applied Biosystems, Foster City, CA) en un secuenciador automático ABI Prism -377 (Applied Biosystems, Foster City, CA).
Las secuencias se editaron en el programa SEQUENCHER 4.6 y se formaron grupos, contigo. La totalidad de la secuencia ADN-A y las secuencias parciales de los genes se compararon mediante el algoritmo blast con la base de datos del Nacional Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov).
Para estandarizar el método de inoculación del virus para la evaluación de las líneas se hizo un ensayo preliminar en invernadero. Plantas de la variedad susceptible Unapal Maravilla fueron expuestas a 5, 10, 15 y 20 moscas blancas infectadas con el biotipo B del virus en jaulas individuales (cilindros de acetato de 8 cm de diámetro y 11 cm de alto tapados en uno de los extremos con tul pintado de negro) durante 48 horas. El ensayo se montó en un diseño completamente al azar con 10 repeticiones de una planta. A las 48 horas se retiraron por succión las moscas. En las evaluaciones posteriores se utilizaron diez moscas por planta (incidencia del 80%) y diez plantas por genotipo (28 °C durante el día y 23 °C en la noche, 80% de humedad).
La incidencia de la enfermedad (porcentaje de plantas infectadas por genotipo) y la severidad se midieron semanalmente por tres veces y después de quince días de la inoculación. La severidad se calificó como ausencia de síntomas (0), leves visibles después de búsqueda cuidadosa (1), leves más visibles (2), moderados sobre la mayoría de la planta (3) y síntomas severos (4) (Piven et. al., 1995). La infección por begomovirus se confirmó mediante hibridación dot blot y PCR.
El ADN viral se detectó en hojas jóvenes de plantas inoculadas por las técnicas de dot blot y PCR. La PCR se hizo con la pareja de cebadores PAR1c715/PAL1v1978. Para el dot blot se homogenizaron 5 mg de tejido fresco macerado con nitrógeno líquido con 50 μl NaOH 0.4M. Cinco microlitros de cada muestra se puntearon en una membrana de nylon (Hybond N+- Amersham), incluyendo plantas sanas e infectadas como control positivo. La membrana se sumergió durante cinco minutos en solución de Tris 1M (pH 7.4)/ NaCl 0.5 N y por 5 minutos en etanol al 95% para eliminar el color verde de los puntos y se fijó el ADN utilizando luz ultravioleta. La sonda para la detección se produjo a partir de un clon generado en la caracterización molecular parcial del virus con el Dig High Prime DNA Labeling and Detection Kit II (Roche, Penzberg, Germany). La prehibridación e hibridación se hicieron a 42 °C y los lavados a temperatura ambiente. Las membranas se expusieron a películas fotográficas para detectar la reacción de quimioluminiscencia.
La presencia del virus se confirmó por PCR en 100 individuos. El ADN se extrajo según el método de De Barro y Driver (1997) con algunas modificaciones. Cada mosca, colocada en un eppendorf de 1.5 ml, se maceró con un pistilo de vidrio humedecido con el buffer de lisis (KCl 50 mM, Tris-HCl pH 8.4 10 mM, Tween 20 0.45%, NP-40 0.45%, proteinasa K 500 μg/ml) y se agregaron 20 μl del mismo buffer. Se incubó a 65 °C por 20 minutos con una denaturación final por 10 minutos a 94 °C. Finalmente se agregaron 25μl de agua bidestilada estéril, utilizando 5μl por reacción de PCR.
Se realizó análisis de varianza utilizando el paquete SAS versión 7 para Windows (SAS Institute Inc., Cary, NC, USA).
La evaluación agromorfológica de las líneas (entre abril y julio de 2007, precipitación promedio diaria de 2.8 mm y acumulado de 338.9 mm y 23 °C) se hizo en un diseño de bloques completos al azar con 3 repeticiones, cada repetición con 5 plantas. Las plántulas se sembraron en campo a los 20 días. Se tomaron datos de rendimiento, longitud, ancho, peso y número de lóculos del fruto (5 frutos por planta). Los análisis se realizaron utilizando el paquete SAS versión 7 para Windows.
Caracterización molecular del virus
Se obtuvo un contig de 2.596 nucleótidos del ADN-A del begomovirus. El aislamiento mostró identidad de 91% con el virus del mosaico amarillo del tomate, aislamiento de Guadalupe (Tomato yellow mosaic virus¬- ToYMV). La identidad de la secuencia de aminoácidos con el gen de la replicasa fue del 90% y para la proteína de la cápside fue mayor de 98%, compartida con los aislamientos de ToYMV de Panamá, Guadalupe y Venezuela. Con el clon 600 pb., obtenido de la amplificación del ADN-B, se alcanzó 98% de identidad de aminoácidos con la proteína de movimiento viral.
Evaluación de los genotipos para la resistencia al ToYMV
Los valores de incidencia fueron altos. Desde los 14 días después de la inoculación (DDI) las variedades Kyndio y Unapal Maravilla ya habían alcanzado 100% de incidencia. Este mismo porcentaje se presentó a los 28 DDI en las líneas FLA 653-3-1-0 y CLN2026D, reportadas como susceptibles. La línea FLA 478-6-3-1-11 tuvo el valor más bajo seguida por FLA 496-11-6-1-0, y FLA 456-4 (Tabla 1).
Los índices de severidad mostraron diferencias en la respuesta de los genotipos. En la línea FLA 653-1-0, que al final de la evaluación presentó síntomas en todas las plantas, el índice de severidad promedio fue uno. Las variedades Unapal Maravilla y Kyndio, en las que la incidencia fue del 100%, los índices de severidad fueron 3.4 y 3.5, respectivamente.
Los análisis de varianza, con confiabilidad de 95%, mostraron diferencias significativas entre los genotipos evaluados. Las pruebas de Duncan, a partir de los 21 DDI, formaron el grupo de las variedades Unapal Maravilla y Kyndio (severidad promedio 3.0), un segundo grupo conformado por la línea CLN 2026D (1.7) y el tercer grupo que reunió las líneas FLA (severidad inferior a 1.0).
En detección del virus la técnica dot blot fue más sensible y reproducible en el tiempo; se observó correlación general de 73% entre plantas con síntomas y plantas con ADN viral, mientras que para la PCR la correlación fue de 68%. Para las líneas FLA 653-3-1-0 y FLA 496-11-6-1-0 la detección del virus se hizo solo después de los 21 DDI y en porcentaje bajo. En la línea FLA 478-6-3-1-11, que tuvo la menor incidencia y el menor valor de severidad, no se detectó el virus. En la línea FLA456-4 las plantas con virus (100%) fueron mayores que la incidencia (70%). En los genotipos susceptibles Unapal Maravilla y Kyndio la incidencia fue de 100% desde los 14 DDI, pero no se registraron los mismos valores de detección del virus aunque en Kyndio alcanzó el 80% de las plantas. La línea CLN2026D también alcanzó el 100% de las plantas infectadas a los 28 DDI y se detectó el virus por dot blot en 70% (Figura 1). La presencia del virus se confirmó en 60% de las moscas blancas evaluadas.
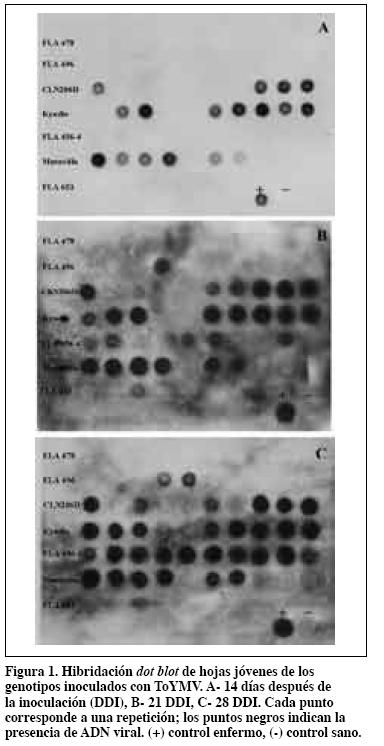
Evaluación agromorfológica
Los resultados se vieron fuertemente afectados por el barrenador del fruto (Neoleucinodes elegantalis).
El análisis de varianza mostró que, con significancia de 95%, el bloqueo no era necesario en las condiciones en las que se desarrolló el ensayo. Sin embargo, se lograron observar diferencias significativas entre los tratamientos (genotipos evaluados) para las variables evaluadas (Tabla 2).
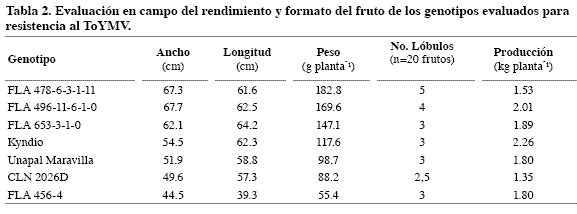
La línea con mayor peso de fruto fue FLA 478-6-3-1-11, pero tuvo una de las producciones más bajas. La línea FLA 456-4 tuvo los frutos de menor tamaño, pero la producción fue de 1.8 kg planta-1. La variedad Kyndio fue la de mayor producción.
Las variedades comerciales utilizadas como control tienen formato de fruto tipo redondo-alargado (chonto), al igual que la línea CLN2026D (IPGRI, 1996); las líneas FLA 478-6-3-1-11, FLA 496-11-6-1-0 y FLA 653-3-1-0 tienen formato ligeramente achatado; y la línea FLA 456-4, redondeado. Esta línea se caracterizó, además, por tener frutos de color naranja.
A pesar de la alta precipitación a lo largo del ensayo se observaron poblaciones de mosca blanca hacia el final del ciclo del cultivo y algunos síntomas virales. La incidencia de la enfermedad fue bastante clara en Unapal Maravilla y Kyndio, con síntomas de mosaico generalizado pero moderado. La línea CLN2026D fue la más afectada y presentó amarillamiento intenso, deformación de las hojas hacia arriba (concavidad), necrosis foliar y muerte. En las otras líneas (FLA 478-6-3-1-11, FLA 496-11-6-1-0, FLA 653-3-1-0 y FLA 456-4) no se observaron síntomas de tipo viral.
La caracterización del aislamiento del ToYMV concuerda con lo reportado en Colombia en los departamentos de Cundinamarca y Tolima (Morales et al., 2002; Corrales et al., en prensa) y confirma la diseminación del virus (Morales et al., 2002), asociada con la capacidad de adaptación del biotipo B de B. tabaci.
Para evaluar la resistencia de los genotipos al ToYMV se hicieron inoculaciones artificiales, ya que las naturales en campo llevan a una infección más suave probablemente por lo tardío y por la falta de sincronización. La inoculación en jaula individual es un buen método para diferenciar la resistencia de los cultivares y también permite distribución más uniforme del vector, previniendo los mecanismos de no preferencia (Picó et al., 1998).
Con 10 moscas por planta se logró buena expresión de síntomas e incidencia de 80%. El resultado concordó con estudios de evaluación que han utilizado de 10 a 20 moscas por planta (Zakay et al., 1991, Santana et al., 2001, Giordano et al., 2005). La menor incidencia de la enfermedad al aumentar el número de individuos de B. tabaci se debió a interferencia y estrés en un espacio limitado.
El tiempo de inicio y el nivel de acumulación del virus son indicadores fiables de resistencia. El procedimiento de hibridación (dot blot) fue más efectivo que la técnica del PCR para detectar la presencia del begomovirus en plantas sintomáticas o asintomáticas sistémicamente infectadas. La técnica dot blot permitió detectar ADN viral en hojas jóvenes, desde 14 DDI, incluso en plantas asintomáticas. La desventaja de la técnica PCR es la dificultad de purificar el ADN, y la efectividad decrece en estados avanzados de infección, alrededor de 30 DDI, cuando las plantas exhiben síntomás severos y el nivel de contaminantes incrementan los resultados erráticos (Picó et al., 1999). En el trabajo, la correlación entre el porcentaje de plantas con síntomas y el porcentaje de plantas detectadas con el virus varió de 71% (14 DDI) a 46%(28 DDI).
Los genotipos evaluados incluyeron líneas seleccionadas en Florida (FLA) como fuentes de resistencia a begomovirus del Nuevo Mundo (Tomato mottle virus) y del Viejo Mundo (Tomato yellow leaf curld virus = TYLCV), el control susceptible CLN2026D y variedades comerciales utilizadas en Colombia susceptibles al ToYMV. Para las variedades comerciales Unapal Maravilla y Kyndio se obtuvo una incidencia del 100% desde los 14 DDI. Sin embargo, la detección del ADN viral no se logró en la totalidad de las plantas afectadas. En el desarrollo de los síntomas se observaron diferencias entre las plantas en las que se detectó el virus y aquellas en las que no. Para las primeras, el índice de severidad estuvo más cerca de 4 (síntomas severos distribuidos en la totalidad de la planta), mientras que en las otras estuvo en un rango de 2-3 (conspicuos, pero leves a moderados), principalmente en hojas viejas. La respuesta diferencial podría sugerir que las dos variedades poseen algún mecanismo de resistencia, como la habilidad de escapar a la infección, lo cual se manifiesta en baja incidencia de la enfermedad en presencia del patógeno y del vector.
En las líneas FLA hubo infección y desarrollo de síntomas, pero la severidad máxima fue 1.0 (síntomas leves visibles solo después de búsqueda cuidadosa). En las líneas FLA 496-11-6-1-0 y FLA 653-3-1-0 se detectó el virus en plantas que desarrollaron síntomas sólo a partir de los 21 DDI; en la línea FLA 478-6-3-1-11, además de baja incidencia, no se detectó el virus. El comportamiento sugiere un mecanismo de resistencia, por el cual el virus puede o no multiplicarse en algún grado, pero la dispersión se restringe y los síntomas son localizados y no evidentes. La línea FLA 456-4, en la cual se detectó ADN viral en la totalidad de las plantas evaluadas a los 28 DDI, es un caso de resistencia a la enfermedad en el que el virus puede moverse sistémicamente en el hospedero sin manifestar síntomas (Kang et al., 2005).
Las líneas FLA buscaron introgresión de genes de resistencia al TYLCV presentes en accesiones de especies silvestres de Solanum (Lycopersicon). La línea FLA 456-4 viene del cruce de LA 2779 (S. chilense), que posee el gen Ty-3 (parcialmente dominante para resistencia al TYLCV, y ligado a otro gen de resistencia, el Ty-1) (Bian et al., 2007), y el híbrido comercial 'Tyking', el cual aparentemente posee otro tipo de resistencia al TYLCV y a begomovirus bipartitos presentes en Brasil (Giordano et al., 2005). Esta línea ya había sido reportada como resistente a begomovirus presentes en el Valle de Zapotitán, El Salvador (Pérez y Hanson, 2004). El origen de la resistencia para FLA 653-3-1-0 viene igualmente de la accesión LA 2779 de L. chilense y el híbrido Tyking, y se ha reportado como fuente de resistencia a infecciones de TYLCV controlada por un alelo recesivo (tgr-1) que afecta el movimiento del virus. Para la línea FLA 478-6-3 la fuente de resistencia es la accesión LA1938 de L. chilense (Bian, et al., 2007).
Los resultados mostraron algún grado de resistencia al ToYMV en todas las líneas FLA, con lo que se confirmó que algunos genotipos resistentes a begomovirus monopartito TYLCV se comportan como resistentes a begomovirus bipartitos (Santana et al., 2001; Pérez y Hanson, 2004; Lapidot y Friedmann, 2002). Las observaciones sugieren que existen genes de resistencia a begomovirus, tanto monopartitos como bipartitos, en especies silvestres de tomate, como S. chilense.
Cualquiera de las líneas FLA podría ser fuente potencial de resistencia al ToYMV. Sin embargo, en un programa de mejoramiento es necesario conocer los mecanismos de resistencia para aumentar la vida útil de las variedades mejoradas. Van Den Bosch y colaboradores (2006) definieron cuatro tipos de resistencia que pueden o no ejercer presión evolutiva sobre el virus y disminuir la durabilidad de la resistencia. El primero es la resistencia que reduce el título del virus (restringe la multiplicación), como consecuencia la acumulación del virus es muy baja y no se desarrollan síntomas. El segundo es la resistencia a la expresión de síntomas a pesar de la existencia de un título alto del virus. Y los otros dos implican la resistencia en el momento de la inoculación o de la adquisición del virus por el vector, donde además de los factores bioquímicos puede estar involucrada la arquitectura de la planta (ej. densidad de tricomas). La línea FLA 456-4 fue un claro ejemplo de la resistencia que disminuye los síntomas a pesar de la multiplicación irrestricta del virus a los 28 DDI. Este tipo de resistencia debe ser manejado con cuidado, pues según el modelo planteado este genotipo sería una buena fuente de inóculo en el campo.
Para las otras líneas (FLA 496-11-6-1-0, FLA 653-3-1-0 y FLA 478-6-3-1-11) el mecanismo de resistencia sería similar al descrito donde la multiplicación del virus se restringe, particularmente a partir de cierta edad de la planta o condiciones de inoculación o adquisición del virus, que permite el escape a la infección en algunos individuos, mientras en otros evita los efectos adversos en las etapas iniciales, las más susceptibles al daño. Piven y colaboradores (1995), evaluando accesiones de L. chilense, fuente de resistencia para las líneas FLA, sugieren que en algunos materiales la resistencia podría estar asociada con evitar la transmisión del virus por el vector o con la inhibición de la entrada del virus. Este tipo de resistencia no genera presión de selección en el virus, por lo que sería más favorable en el inicio de un programa de mejoramiento en el que se busca entregar cultivares que pongan la mínima presión de selección en el virus para que evolucione en cepas más agresivas (Van Den Bosch et al, 2006). Sin embargo, la experiencia con el mosaico dorado amarillo del fríjol común demuestra que este tipo de resistencia varía según la dosis (incidencia) del virus, y que estos materiales gradualmente disminuyen el nivel de resistencia (Morales, 2001).
Según la caracterización agromorfológica las líneas FLA se adaptaron a las condiciones de evaluación en campo y en general, a excepción de la línea FLA 456-4 que produce frutos pequeños de color naranja, todas tienen buen tamaño de fruto con características similares al tomate milano, con rendimientos que oscilaron entre 1.5 y 2.0 kg planta-1.
Evaluando las características de resistencia y las condiciones agro-morfológicas se pueden seleccionar las líneas FLA 653-3-1-0, FLA 496-11-6-1-0 y FLA 478-6-3-1-11 como fuentes de resistencia al ToYMV detectado en el Valle del Cauca. La importancia que ha cobrado la distribución del ToYMV en Colombia genera la necesidad de construir programas de mejoramiento en tomate para el desarrollo de variedades resistentes, base de cualquier proyecto de control de begomovirus (Morales, 2006). La selección de fuentes de resistencia y la estandarización de las técnicas de inoculación y detección del virus logradas en el estudio para el ToYMV constituyen la base para el inicio de un proyecto de mejoramiento para la variedad Unapal Maravilla que busque reducir las pérdidas económicas provocadas por las enfermedades virales en los últimos años tratando de no afectar la producción y calidad del cultivo.
Al doctor Peter Jones, del Centro Asiático para el Desarrollo e Investigación de Vegetales (AVRDC), por el envío de las semillas de las líneas FLA y CLN2026D; a Alejandro Quintero del CIAT, por la colaboración en los trabajos en invernadero y campo; y a los trabajadores de CEUNP, por la colaboración en el montaje y control de los ensayos de campo que hicieron parte de la tesis de maestría de A. K. Martínez A.
1.Bian, X.-Y.; Thomas, M.R.; Rasheed, M.S.; Saeed, M.; Hanson, P.; De Barro, P.J.; Resaian, M.A. 2007A recessive allele (tgr-1) conditioning tomato resistance to geminivirus infection is associated with impaired viral movement. Phytopatho 97: 930-937. [ Links ]
2.Corporación Colombia Internacional. 2006. Plan Hortícola Nacional [http://www.cci.org.co/publicaciones/1_PHNfinal.pdf] 08-2006. [ Links ]
3.Corrales, A.R.; Martínez, A.K.; Morales, F.J. Caracterización molecular de los begomovirus que afectan la producción de tomate (Solanum lycopersicum) en Cundinamarca y Tolima, Colombia. En prensa. [ Links ]
4.De Barro, P.J.; Driver, F. 1997. Use of RAPD PCR to distinguish the B biotype from other biotypes of Bemisia tabaci (Gennadius) (Hemiptera: Aleyrodidae). Aust. J. Entom. 36: 149-152. [ Links ]
5.Fauquet, C. M.; Bisaro, D. M.; Briddon, R.W.; Brown, J. K.; Harrison, B. D.; Rybicki, E. P.; Stenger, D. C.; Stanley, J. 2003. Revision of taxonomic criteria for species demarcation in the family Geminiviridae, and an updated list of begomovirus species. Arch. Virol. 148: 405–421. [ Links ]
6.Gilbertson, R. L.; Rojas, M. R.; Russel, L.D.; Maxwell, D. P.1991. The use of the asymetric polymerase chain reaction and DNA sequencing to determine genetic variability among isolates of bean golden mosaic geminivirus in the Dominican Republic. J. Gen. Virol. 72: 2843-2848. [ Links ]
7.Giordano, L.B.; Silva-Lobo, V.L.; Santana, F.M.; Fonseca, M.E.N.; Boiteux, L.S. 2005. Inheritance of resistance to the bipartite Tomato chlorotic mottle begomovirus derived from Lycopersicon esculentum cv. 'Tyking'. Euphytica 143: 27–33. [ Links ]
8.IPGRI. 1996. Descriptores para el tomate Lycopersicon spp. Instituto Internacional de Recursos Fitogenéticos, Roma, Italia. [ Links ]
9.Kang, B-C.; Yeam, I.; Jahn, M.M. 2005. Genetics of Plant Virus Resistance. Annu. Rev. Phytopathol. 43: 581-621. [ Links ]
10.Lapidot, M.; Friedmann, M. 2002. Breeding for resistance to whitefly-transmitted geminiviruses. Ann Appl Biol 140: 109-127. [ Links ]
11.Morales, F.J. 2001. Conventional breeding for resistance to Bemisia tabaci-transmitted geminiviruses. Crop Prot. 20: 825-834. [ Links ]
12.Morales, F.J. 2006. History and Current Distribution of Begomovirus in Latin America. Adv. Virus Res.67:127-162. [ Links ]
13.Morales, F.J; Anderson, P. 2001. The emergence and dissemination of whitefly-transmitted geminiviruses in Latin America. Arch. Virol. 146: 415–441 [ Links ]
14.Morales, F. J.; Muñoz, C.; Castaño, M.; Velasco, A.C. 2000. Geminivirus transmitidos por mosca blanca en Colombia. Fitopatol. Colomb. 24: 95-98. [ Links ]
15.Morales F.J.; Martínez A. K.; Velasco A.C. 2002.Nuevos brotes de begomovirus en Colombia. Fitopatol. Colomb. 26: 75-79. [ Links ]
16.Pérez, J.E; Hanson, P. 2004. Breeding for resistance to whitefly- transmitted begomoviruses. En: Integrated Pest and Disease Management In Major Agroecosystmes Project PE-1. Annual Report, 2004, CIAT; p. 376-378. [ Links ]
17.Picó, B.; Díez, J.; Nuez, F. 1998. Evaluation of whitefly-mediated inoculation techniques to screen Lycopersicon esculentum and wild relatives for resistance to Tomato yellow leaf curl virus. Euphytica 101: 259-271. [ Links ]
18.Picó, B.; Díez, M.J.; Nuez, F. 1999. Improved techniques for tomato yellow leaf curl virus in tomato breeding programs. Plant Dis. 83: 1006-1012. [ Links ]
19.Piven, N.M.; de Uzcátegui, R.C.; Infante, H.D. 1995. Resistance to tomato yellow mosaic virus in species of Lycopersicon. Plant Dis. 79: 590-594. [ Links ]
20.Rojas, M.R.; Giltberson, R.L.; Rusell, D. R.; Mawell, D.P. 1993. Use of degenerate primers in the polymerase chain reaction to detect whitefly-transmitted geminiviruses. Plant Dis. 77: 340-347. [ Links ]
21.Santana, F.V.; Ribeiro, S.; Moita, A.W.; Moreira, D.J.; Giordano, L.B. 2001. Sources of resistance in Lycopersicon spp. to a bipartite whitefly-transmitted geminivirus from Brazil. Euphytica 122: 45–51. [ Links ]
22.Van Den Bosch, F.; Akudibilah, G.; Seal, S.; Jeger, M. .2006. Host resistance and the evolutionary response of plant viruses. J. Appl. Ecol. 43: 506-516. [ Links ]
23.Zakay, Y.; Navot, N.; Zeidan, M.; Kedar, N.; Rabinowitch, H.; Czosnek, H.; Zamir, D. 1991. Screening Lycopersicon accesions for resistance to tomato yellow leaf curl virus: Presence of viral DNA and symptom development. Plant Dis. 75: 279-281. [ Links ]
24.Zhou, X.; Liu, Y.; Calvert, L.; Munoz, C.; Otim-Nape, W.; Robinson, D. J; Harrison, B.D. 1997. Evidence that DNA-A of a geminivirus associated with severe cassava mosaic disease in Uganda has arisen by interspecific recombination. J. Gen. Virol. 78: 2101–2111 [ Links ]














