Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.57 no.3 Palmira July/Sept. 2008
RESUMEN
Se evaluó la producción in vitro de microtubérculos de papa (cuatro accesiones de S. tuberosum ssp andigena y tres de S. phureja de la Colección Central Colombiana). Se emplearon dos protocolos (líquido-líquido y sólido-líquido) en un diseño completamente al azar con arreglo factorial. Las variables evaluadas al momento de la cosecha fueron número de microtubérculos con tamaño inferior a 0.5cm, superior a 0.5cm y número total. La producción de microtubérculos estuvo determinada por el genotipo, el protocolo y las diferentes concentraciones de las hormonas Benzilaminopurina (BAP) y Cloruro de Cloro Colina (CCC). La producción fue mayor en el protocolo sólido – líquido, y entre concentraciones la de mejor producción de microtubérculos fue C1 (Sales MS 100%, sacarosa 8%, 10mg BAP/ 500mg CCC y oscuridad). Los mejores productores de microtubérculos fueron las accesiones C.C.C. 4318 (Carriza), C.C.C. 4981 (Guata negra) y Solanum phureja 50 (sin nombre).
Palabras claves: Solanum tuberosum ssp. andigena; S. phureja; microtuberización, Benzilaminopurina; Cloruro de Cloro Colina.
ABSTRACT
The in vitro microtuberization of potato, four accessions of S. tuberosum ssp. andigena and three accessions of S. phureja of the Colombian Central Collection was evaluated. Two protocols were used (liquid-liquid and solid-liquid) in a complete random analysis design with a factorial arrangement. The traits evaluated at the time crop were: number of microtubers with size under 0.5cm, microtubers with size over 0.5cm and total number of microtubers. The microtubers production was higher in the solid-liquid protocol. On the other hand, when comparing the microtuber production among the hormones BAP and CCC, the C1 (MS salts at 100%, sucrose 8%, 10mg BAP / 500mg CCC and darkness) showed the higher microtubers production.The most efficient microtubers producer were the accessions C.C.C. 4318 (Carriza), C.C.C. 4981 (Guata negra) and Solanum phureja 50 (without common name).
Key words: Solanum tuberosum ssp. andigena, S. phureja, microtuberization, benzylaminopurine, chlorocholine chloride.
La Corporación Colombiana de Investigación Agropecuaria (Corpoica) está encargada de la conservación de la Colección Central Colombiana de Papa (C.C.C.), conformada por 2.985 accesiones de variedades cultivadas y silvestres conservadas en condiciones de campo ( 1.607), en cuartos fríos (2.062) e in vitro (818). Las especies incluidas son Solanum tuberosum subespecie andígena; S. tuberosum subespecie tuberosum (papa de año); S. phureja (papa criolla o chauchas); S. chaucha (papa amarilla) y especies silvestres como S. colombianum y S. estradae (Cerón et al., 2005). Geográficamente representan regiones del país (Nariño, Cauca, Boyacá, Cundinamarca, Santander, Norte de Santander, Caldas, Quindío y Sierra Nevada de Santa Marta) e introducciones de Perú, Bolivia, Ecuador, México, Argentina, Inglaterra, Escocia, Alemania, Holanda y Bélgica.
La microtuberización in vitro de papa ha despertado interés en la producción de semilla asexual y en los bancos de germoplasma debido al tamaño, buena condición sanitaria e intercambio de germoplasma (Jara, 1996; Borda et al., 2001; Donelly et al., 2003; Gopal et al., 2004).
El objetivo principal de la investigación fue estudiar la producción de microtubérculos en cultivo in vitro de siete accesiones de papa de la Colección Central empleando dos protocolos (líquido – líquido y sólido-líquido) en diferentes concentraciones de BAP (6 Benzil Amino Purina) y CCC (Cloruro de Cloro Colina) como parte de los proyectos de investigación para encontrar estrategias alternas para la conservación eficiente del germoplasma de papa.
El estudio se adelantó en la Corporación Colombiana de Investigación Agropecuaria (Corpoica), en el Centro de Investigación Tibaitatá situado en el municipio de Mosquera, Cundinamarca (4° 71' 28.2" N, 74° 18' 30.5" W, 2516 m.s.n.m.), en el laboratorio de Cultivo de Tejidos Vegetales del Programa Nacional de Recursos Genéticos y Mejoramiento Vegetal. Se emplearon cuatro accesiones de S. tuberosum ssp. Andigena, y tres de S. phureja, seleccionadas por la habilidad para producir microtubérculos (mínimo cuatro por planta) en condiciones de conservación (Tabla 1). Con el fin de aumentar la población se realizó la multiplicación de ápices y entrenudos en medio convencional de propagación de papa, compuesto por sales Murashigue & Skoog (1962), tiamina (1ml L-1), mioinositol (0.1g L-1), sacarosa (3%) y phytagel (3g L-1).
Debido a que en la literatura relacionada con este tema los resultados han sido diversos y a que el factor genético es determinante en el proceso se optó por utilizar dos protocolos (líquido – líquido y sólido – líquido) y niveles de hormonas para la producción de microtubérculos.
El medio de cultivo estuvo compuesto por 80% sales MS, 0.4 mg L-1 de ácido giberélico y 20 mg L-1 de ácido pantoténico, donde la variante entre protocolos fue la ausencia o presencia del gelificante (phytagel). Los esquejes de un entrenudo se distribuyeron en grupos de nueve explantes en 21 contenedores (30 ml de medio de cultivo). Las plantas propagadas en medio de cultivo líquido se llevaron a un agitador orbital a 45 r.p.m. para garantizar la permanente oxigenación de los explantes y facilitar la difusión de fenoles en el medio. Las condiciones de crecimiento fueron 16 horas-luz/día y 20°C durante un mes (Jara, 1996; Gómez y Reyes, 1998).
Para la fase de inducción de tuberización se utilizaron 6 – Benzil Amino Purina (BAP) y Cloruro de Cloro Colina (CCC) (Tabla 2). Se adicionaron 20 ml del medio de inducción, conservándolas en total oscuridad a 20°C durante un mes (Gómez y Reyes, 1998; Borda et al., 2001) y posteriormente 15 días con fotoperiodo 16h-luz/día con el fin de permitir que los microtubérculos terminaran de madurar en forma más uniforme antes de la cosecha.
El diseño experimental empleado fue completamente al azar con arreglo factorial (siete accesiones x dos protocolos x siete concentraciones y tres repeticiones). El análisis de la información se efectuó mediante el programa estadístico SAS Versión 9.0, empleando el análisis de varianza y la prueba de comparación de promedios de Tukey para matriz desbalanceada entre accesiones, protocolos y concentraciones para las variables número de microtubérculos con tamaño inferior a 0.5 cm, superior a 0.5cm y total de microtubérculos.
Producción promedio de microtubérculos por accesión
En el análisis de varianza para microtubérculos con tamaño inferior o superior a 0.5cm y al número total de microtubérculos se encontraron diferencias significativas al 5%, ya que la producción de microtubérculos está determinada por el genotipo y el tamaño por la edad del estolón. Microtubérculos formados en los primeros estolones tuvieron mayor tiempo para desarrollarse y realizar el llenado. Además, también influye la posición, pues los desarrollados en los estolones de la parte basal del tallo fueron de mayor tamaño.
Según la prueba de comparación de promedios de Tukey, las accesiones andigenas fueron las de mayor producción de microtubérculos inferiores a 0.5 cm, sin diferenciarse significativamente; el orden fue el siguiente: C.C.C. 4981 (Guata negra), C.C.C. 4318 (Carriza), Solanum phureja 50 – SN y andigena C.C.C. 4067 –SN. Las de menor producción fueron la andigena C.C.C. 310 (Careta blanca) y las Solanum phureja 27 (Ratona chincheña) y 26 (Uva) (Tabla 3).
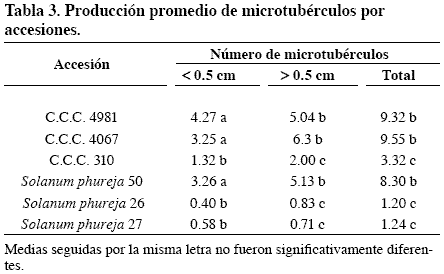
Para la variable tamaño superior a 0.5cm la accesión C.C.C. 4318 (Carriza) presentó los promedios más altos y diferencias significativas con las demás accesiones, seguida por C.C.C. 4067 – SN, Solanum phureja 50 - SN, C.C.C. 4981 (Guata negra). Las más bajas producciones de microtubérculos en esta variable se encontraron en C.C.C. 310 (Careta blanca), Solanum phureja 26 (Uva), Solanum phureja 27 (Ratona chincheña) (Tabla 3).
La variación en la respuesta de cada una de las accesiones en cuanto a la producción de microtubérculos en ambas categorías de tamaño esta determinada principalmente por el genotipo. En general las accesiones C.C.C. 310 (Careta blanca), Solanum phureja 26 (Uva) y Solanum phureja 27 (Ratona chincheña) producen muy baja cantidad de microtubérculos a diferencia de la buena producción en las accesiones C.C.C. 4318 (Carriza) y C.C.C. 4981 (Guata negra), seguidas por Solanum phureja 50 – SN y C.C.C. 4067 - SN. En segundo lugar el proceso de inducción para tuberización puede ser más lento en estas accesiones de aparente baja producción, por tanto, la producción puede también haber sido afectada por esto.
Para el número total de microtubérculos cosechados por accesión, según la prueba de comparación de promedios de Tukey, la accesión de mayor producción de microtubérculos fue la C.C.C. 4318 (Carriza), seguida por C.C.C. 4067 -SN, C.C.C. 4981 (Guata negra), Solanum phureja 50 – SN y en último lugar se situaron C.C.C. 310 (Careta blanca), Solanum phureja 27 (Ratona chincheña) y Solanum phureja 26 (Uva), respectivamente (Tabla 3).
Algunas accesiones que presentaron buena producción de microtubérculos (Solanum phureja 50 - SN y C.C.C. 4067 – SN) mostraron hiperhidratación en los medios de propagación e inducción líquidos. Además se observó reducción en el número de yemas, aumento en el tamaño de las lenticelas y formación de "callosidad" sobre el periderma de los microtubérculos; al parecer estuvieron relacionados con concentraciones de los inductores de tuberización BAP/CCC, principalmente en la dosis alta (C5) o cuando se empleó solamente CCC (C3, C4 y C6). También se observó en estos tratamientos mayor tendencia a hiperhidratarse cuando los microtubérculos se formaron dentro del medio, que en aquellos formados a partir de las raíces de las yemas superiores de los tallos (Figura 1 y Figura 2). Donnelly et al. (2003) mencionan que la presencia de BAP y CCC en los medios de cultivo causó anomalías en el cultivar Desiree, incluyendo elongación de los tubérculos, reducción del número de ojos (yemas), aumento del tamaño de lenticelas y desorganización del periderma.
Producción de microtubérculos por protocolo
La producción de microtubérculos para las variables estudiadas fue mayor en el protocolo sólido –líquido (Tabla 4).

La producción de microtubérculos presentó diferencias significativas debido a que el desarrollo de las plantas fue mayor en el protocolo sólido – líquido (Tabla 4). Las plántulas producidas en medio líquido – líquido tuvieron mayor estrés, el vigor no fue muy bueno y en muchos casos se observó hiperhidratación (Figura 3 y Figura 4).


En el protocolo líquido – líquido se requirieron 3 meses aproximadamente para la producción de los microtubérculos, mientras en el sólido – líquido se necesitaron 2 meses.
Producción de microtubérculos por concentración de BAP/CCC
Para la variable concentración, el análisis de varianza y la prueba de comparación de promedios de Tukey mostraron diferencias significativas. En la producción de microtubérculos inferiores a 0.5cm no se presentaron diferencias significativas entre las concentraciones C1, C2 y C5 (Tabla 5), lo cual demuestra el sinergismo de los dos inductores (Hussey y Stacey, 1984). A nivel biológico los microtubérculos en C1 y C2 presentaron buena esfericidad y coloración y ausencia de hiperhidratación y callosidad sobre el periderma. En C5 se presentaron problemas de hiperhidratación y callosidad sobre el epiderma, principalmente con phurejas.
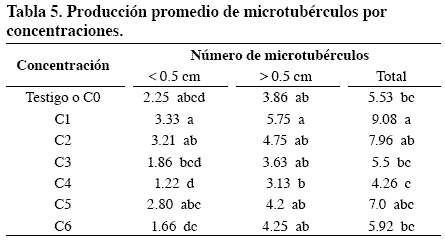
Las concentraciones con más baja producción de microtubérculos con tamaño inferior a 0.5 cm fueron C3, C6 y C4, debido a que la ausencia de BAP no incrementó el efecto del CCC. El testigo (C0) se situó en un punto intermedio, debido en parte a que el medio de cultivo tuvo 8% de sacarosa, indispensable para la tuberización in vitro, sumado a la capacidad de cada genotipo de producir microtubérculos en mayor o menor cantidad. Para la variable microtubérculos superiores a 0.5 cm C1 mostró diferencias significativas con las demás concentraciones (Tabla 5).
Para la variable número total de microtubérculos la mejor concentración fue C1 y presentó diferencias significativas con C2, C5, C6, C0, C3 y C4. (Tabla 5). Las concentraciones C1, C2, C5 tuvieron las más altas producciones de microtubérculos en total, confirmando el sinergismo entre los dos inductores de tuberización. La menor producción en C6 se atribuye a la menor respuesta a esta concentración de las accesiones de S. phureja, especialmente S phureja 50 – SN, agravado por la hiperhidratación en plántulas y microtubérculos.
La producción promedio de número total de microtubérculos de papa fue mayor en el protocolo sólido- líquido (10.24 vs. 4.88).
El protocolo sólido – líquido requirió menor tiempo para la producción de microtubérculos (2 meses vs 3 meses).
Las accesiones de S. phureja fueron más susceptibles a la hiperhidratación, la cual se observó en 8mgBAP/800mgCCC. y en las concentraciones que contuvieron solamente CCC.
Los microtubérculos de las accesiones que presentaron problemas de hiperhidratación formaron sobre el periderma una especie de "callosidad", bajo número de brotes, lenticelas de mayor tamaño.
La producción de microtubérculos estuvo determinada por el genotipo. Las accesiones C.C.C. 4318 (Carriza), C.C.C. 4981 (Guata negra), C.C.C. 4067 (SN) y Solanum phureja 50 (SN) presentaron las más altas producciones en ambos protocolos. Las accesiones C.C.C. 310 (Careta blanca), Solanum phureja 26 (Uva) y Solanum phureja 27 (Ratona chincheña) presentaron las más bajas producciones.
Entre las concentraciones utilizadas para la inducción de microtubérculos se encontraron diferencias significativas, principalmente para C1 (MS 100%, 8% Sacarosa, 10mg BAP/500mgCCC), el cual obtuvo en promedio 9.083 microtubérculos.
Al Programa de Recursos Genéticos y Mejoramiento Vegetal de la Corporación Colombiana de Investigación Agropecuaria (Corpoica) C.I. Tibaitatá; a Alba Lucía Villa, Ligia Suescún y Pablo Edgar Jiménez del Laboratorio de Cultivo de Tejidos, Corpoica C.I. Tibaitatá; a los profesores Edgar Iván Estrada, Mario García, Carlos Iván Cardozo y Manuel Sánchez, de la Escuela de Posgrados de la Universidad Nacional de Colombia, sede Palmira, y a Juan Diego Palacio, del Instituto Alexander von Humboldt.
1.Borda, C.C.; Toledo, J.; Golmirzaie, A.; Roca., W. 2001. Efecto de inductores de tuberización y fotoperiodo sobre la microtuberización de Solanum tuberosum L. in vitro. http://www.redbio.org/portal/encuentros/enc_2001/posters/01/posterpdf/01-100.pdf Descargado: Noviembre 20 de 2005. [ Links ]
2.Cerón, M. S.; Valbuena, I.; Moreno, J. D. 2005. Informe técnico de bancos de germoplasma del C. I. Tibaitatá. Bogotá: Corpoica. 22p. [ Links ]
3.Donnelly, D; Coleman, W.; Coleman, S. 2003. Potato microtuber production and performance: A review. Am Potato J 80:103-115. [ Links ]
4. Gómez, M.M.; Reyes, P.L. 1998. Propagación y tuberización in vitro de tres variedades de papa criolla (Solanum phureja) de la Colección Central Colombiana. Trabajo de Grado Biología. Bogotá: Universidad Distrital Francisco José de Caldas. 71 p.
5.Gopal, J.; Chamail, A.; Sarkar, D. 2004. In vitro production of microtubers for conservation of potato germplasm: effect of genotype, abscisic acid and sucrose. In vitro Cell. 40: 485 – 490. [ Links ]
6.Hussey. G.; Stacey, J. 1984. Factors Affecting the Formation of In vitro Tubers of Potato (Solanum tuberosum L.). Ann Bot 53: 565-578. [ Links ]
7.Jara, G.C., 1996. Propagación in vitro y microtuberización de cultivares de Solanum tuberosum L. ssp. tuberosum Hawkes en medios líquidos. Tesis de Grado Magíster en Ciencias Mención Botánica. Universidad Austral de Chile. 81 p. [ Links ]
8.Jaramillo, A.; Rivera, A. M.; Montaño, H.; Lozano, J.J. 2003. Microtuberización in vitro de cuatro variedades de papa. (Solanum tuberosum L). http://www.uaaan.mx/DirInv/Rdos2003/ecologia/microtuber.pdf Descargado: Noviembre 20 de 2005. [ Links ]
9.Murashigue, T.; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 15:473-497. [ Links ]
10.SalaS, J.E. 2005. Producción y almacenamiento de tubérculos in vitro de papa Solanum tuberosum L. cv Granola. http://bibagr.ucla.edu.ve/ALEXANDR/CATALOGOS/bvetucla/Cat.Tit_12.HTM Descargado: Noviembre 11 de 2005. [ Links ]














