Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.58 no.1 Palmira Jan./March 2009
RESUMEN
El cultivo de algas mixtas se realizó en el Instituto de Piscicultura Tropical de la Corporación Autónoma Regional del Valle del Cauca (Buga 25 °C y 969 m.s.n.m.) utilizando fertilizantes inorgánicos en baldes plásticos, se produjeron en promedio 386 x 103 células/ml de cultivo. En el cultivo de Philodina en frascos de vidrio alimentado con algas y levadura, se obtuvieron 410 rotíferos/ml de cultivo. Se evaluaron tres tratamientos: rotíferos enriquecidos con aceite de pescado; rotíferos más algas (Chlorella, Scenedesmus, Pediastrum, Spyrogira y Anabaena) y Artemia salina + Spirulina, usando 100 post-larvas de bocachico/acuario, alimentadas dos veces al día según biomasa sembrada. El mayor porcentaje de sobrevivencia, peso y talla se obtuvo con el alimento constituido por rotíferos enriquecidos con aceite de pescado (93 %,3.2mg, 6.86mm)), seguido de rotíferos + algas (80.67 %,2 mg, 6.1mm) y Artemia+ Spirulina (60.6 %,1.6mg, 6.06mm) respectivamente
Palabras claves: Prochilodus reticulatus magdalenae; Philodina; Rotíferos; Levadura; Enriquecimiento nutricional.
ABSTRACT
In the Tropical Piscicultural Institute of the Regional Autonomous Corporation of Buga, Cauca, Valley, Colombia (25°C temperature, 969 m a s l,) a research was carried out with the objective to produce and use algaes and rotifers (living food) cultures to feed bocachico post-larvas (Prochilodus reticulatus magdalenae). A complete random design with three treatments and three repetitions was established. 100 bocachico/aquarium post larva were used and fed twice a day according to sown biomass. The cultures of mixed algaes were established by using inorganic fertilizers produced in plastic pails and obtaining an average of 386 x 103 cells/ml of culture. On the other hand, the cultures of Philodina rotifers were established in glass bottles and feeding them with algaes and yeast. An average of 410 rotifers/ml of culturing was obtained . To evaluate the highest rate of survival, growing and weight of bocachico post-larvas, three kind of food were used: Rotifers enriched with fish oil; rotifers plus algaes (Chlorella, Scenedesmus, Pediastrum, Spyrogina and Anabaena) and only Artemia salina and Spirulina. The highest survival, weight and size percentage was obtained with food formed of rotifers enriched with fish oil (93% 3.2mg, 6.86mm) respectively, followed by rotifers + algaes (80.67%, 2mg, 6.1mm) and Artemia + Spirulina (60.6%, 1.6mg, 6.06mm).
Key words: Prochilodus reticulates magdalenae; Philodina; Rotifers; yeast; Nutritional enrichement.
El bocachico, Prochilodus reticulatus magdalenae, carácido de hábitos migratorios ampliamente distribuido en las principales cuencas hidrográficas de Colombia, presenta tres períodos críticos para la supervivencia de las larvas: al momento de la primera alimentación, a los 15 días cuando ocurre la primera curvatura del aparato digestivo y a los 30 días cuando empieza a alimentarse de detritus del estanque (De Fex, 1996).
El rotífero Philodina ( Clase: Bdelloidea, Familia: Philodinidae) filtra partículas orgánicas en suspensión (bacterias, detritus, algas, protozoos), tiene una longevidad de 48 días en promedio, la hembra pone 45 huevos y el intervalo de una generación a otra es de cuatro días (Ruppert y Barnes, 1996; Barnabé, 1996); la composición nutricional varía de 6.0% a 7.9% de proteína cruda, 1.4% a 3.7% de lípidos, 0.16mg/g de calcio y 1.1 a 1.5mg/g de fósforo (Watanabe et al., 1983).Los rotíferos se pueden alimentar en cultivo masivo con Chlorella, obteniendo enriquecimiento en ácidos grasos de 12.7% a 18.8 % (Torrentera y Tacon, 1989); el cultivo resulta más sencillo y menos costoso cuando se usa Geotricum candidum, hongo que crece en ácido láctico, suero de leche, vinagre, leche, quesos y mantequilla.
Como es necesario establecer las técnicas de cultivo que permitan obtener el alimento vivo de tamaño óptimo y alto contenido nutricional que favorezca la tasa de crecimiento y supervivencia de las post-larvas de bocachico, la investigación se propuso evaluar la producción en laboratorio de algas para alimentar los rotíferos junto con Geotrichum candidum. En la investigación la dieta de las post-larvas se enriqueció con aceite de pescado y se compararó con el alimento convencional (Spirulina y nauplios de Artemia salina).
El estudio, que se llevó a cabo en el Laboratorio del Instituto de Piscicultura Tropical de la CVC (Buga, Valle del Cauca, 969 msnm y 25°C), se desarrolló en dos fases: cultivo de algas y rotíferos y ensayo de alimentación de post-larvas de bocachico).
Ensayo 1. Cultivo de algas y rotíferos
Entre el plancton recolectado en estanques (red de 60 micrones con recipiente colector) se identificaron las algas: Chlorella, Scenedesmus, Pediastrum, Spyrogira y Anabaena y los rotíferos: Brachionus, Phylodina y Polyartra (Nedham y Nedham, 1978). Las algas se cultivaron al aire libre en recipientes plásticos (11 l), sembrando inicialmente 300 ml de muestra y empleando agua del río Guadalajara con pH de 6.8.
Los cultivos mixtos de algas se adelantaron en un diseño completamente al azar con 3 tratamientos (T1: 1 g de urea + 0.5 g de agrimins por litro de agua; T2: 2 g de urea + 0.5 g de agrimins por litro de agua; T3: 1 g de triple 15 + 0.5 g de agrimins por litro de agua) y 3 repeticiones por tratamiento.
Se evaluó diariamente el número de células/ml de agua utilizando el muestreo al azar tomando una muestra de 100 ml extraídos de cada recipiente. Con los conteos diarios se graficaron las curvas de crecimiento con el paquete estadístico Curve Expert y el modelo gaussiano de regresión con coeficientes de correlación mayores a 0.9 y con un conteo mínimo de 138.000 células/ ml. La curva de crecimiento se estableció mediante el modelo y = a*exp ((-(-b-x)2)/(2*c2)) donde la derivada es la tasa de crecimiento diario. Posteriormente se ajustó al modelo de regresión lineal y = a+ bx obteniéndose la tasa de crecimiento diaria promedio por tratamiento.
Después de repetidos ensayos de aislamiento de rotíferos con micropipeta se separó cada género en tubos de ensayo de 5 cm3, con agua destilada alimentados con G. candidum durante cinco días. Como se obtuvo mayor población de Phylodina, se sembró a razón de 30 individuos/ml en frascos de vidrio (3 l) con agua destilada a 23 °C y pH neutro.
En el cultivo de Phylodina se emplearon dos dietas (0.003 g. de G. candidum enriquecidos con aceite de pescado por cada 10 cm3 de agua de cultivo; la misma dosis de G. candidum más algas cultivadas artificialmente). El conteo se realizó empleando una cámara McMaster. Una vez establecidos los cultivos se esperó durante cuatro días que el crecimiento poblacional del rotífero promediara 400 individuos/ml, reanudándolos mediante adición de agua destilada y levadura.
Ensayo 2. Alimentación de post-larvas de bocachico
En el ensayo se usaron 900 larvas de 3 días, con peso vivo inicial promedio de 6 X 10-4g y longitud promedia de 4 mm. Se distribuyeron en grupos de 100 por acuario. Se empleó un diseño completamente al azar, con tres tratamientos (T1:rotíferos enriquecidos con aceite de pescado; T2: Chlorella, Scenedesmus, Pediastrum, Spyrogira y Anabaena; T3: Artemia salina más Spirulina ) y tres repeticiones. Se suministraron dos raciones diarias (7:00 am y 12:00 m), ofrecidas de la siguiente manera: T1: 6 l de cultivo de rotíferos (415 rotíferos/ml), T2: 6 l de cultivo de rotíferos más 1000 ml diarios de cultivo de algas/acuario, T3: 0.98 g de Spirulina seca en 600 ml de agua destilada y 0.03 g de Artemia salina eclosionada en recipientes cilíndricos de acrílico a 25 ppt de salinidad en un litro de agua.
La duración del ensayo fue de 10 días y se inició tras la reabsorción del saco vitelino. Se realizaron mediciones de longitud (mm), peso (g) y supervivencia (10% de la población extraída al azar/acuario) (De Fex, 1996). Las variables se sometieron a Análisis de Varianza (Andeva) y Test de rangos múltiples de Duncan para separación de promedios.
Cultivo mixto de algas
En el tratamiento 1 la máxima producción de células/ml se obtuvo en el día 6 y el día 9 en los tratamientos 2 y 3. El agotamiento de nutrientes se empezó a manifestar a partir del día 12 (Tabla 1)
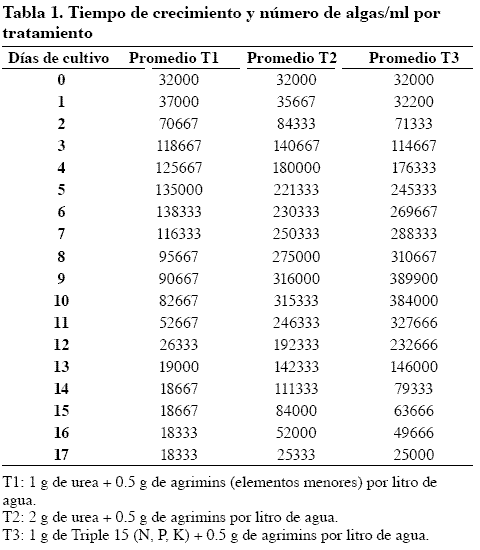
El modelo de regresión que mejor describió el crecimiento fue el gaussiano dado el coeficiente de correlación (0.967, 0.982 y 0.979) (Tabla 2). Como en T3 se obtuvo la mayor tasa de crecimiento tanto observada como estimada (Tabla 3 y Tabla 4) se seleccionó para el cultivo de algas. No se encontró diferencia en número de individuos (rotíferos/ml) en las dos dietas utilizadas (Tabla 5 ).
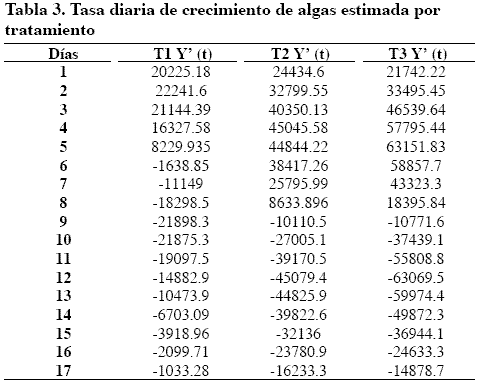
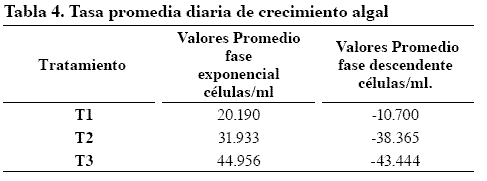

Alimentación de post-larvas de bocachico
Se presentó diferencia estadística significativa (P < 0.01) en peso y longitud entre tratamientos, pero no en supervivencia de post-larvas (Tabla 6 ). Los mejores resultados del tratamiento 1 se atribuyen a la adición de aceite de pescado fuente de ácidos grasos poliinsaturados (Omega 3 y Omega 6), nutrientes limitantes para el desarrollo y supervivencia de larvas (Barnabé, 1996; Dantagnan et al., 1999). También el tamaño de Philodina (90 µm) facilita la captura por la larva, lo que no ocurre con nauplios de A. salina por el tamaño (2.4 mm) y la presencia de apéndices (De Fex, 1996).
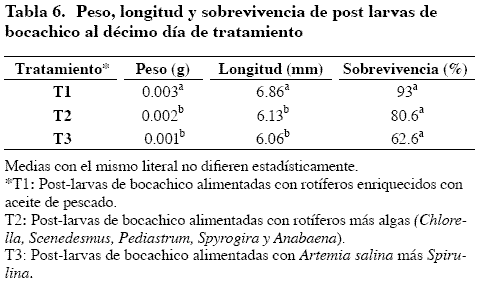
Aunque las diferencias en supervivencia no fueron estadísticamente significativas, la distancia del T1 sobre el tratamiento convencional (93% Versus 62.6%) mostró la ventaja del alimento vivo. Además el resultado superó investigaciones que emplearon Brachionus plicatillis (60%) (Verreth, 1999), rotíferos y copépodos entre 150 – 230 µm (34 %), nauplios de A. salina (46 %), rotíferos más nauplios de A. salina (77 %) (Valderrama, 1992). También superó la supervivencia de post-larvas de "boquichico" (Prochilodus nigricans) alimentadas con plancton producido en estanques de tierra (78 %), nauplios de A. salina (62 %) y plancton más nauplios de A. salina (80 %) (Ascón, 1999) y la de P. magdalenae alimentada con zooplancton silvestre tamizado entre 250 – 400 µm (49.9%) (Kerguelén et al., 2003).
El mayor crecimiento poblacional en el cultivo de algas (44.956 células ml-1 día-1) se logró con 1 g de triple 15 (N, P, K) + 0.5 gl-1 de agrimins.
En la fase de alimentación de post-larvas de bocachico el mejor resultado (93% de supervívencia, 0.0032g de peso y 6.86 mm de longitud) se obtuvo empleando rotíferos enriquecidos con aceite de pescado.
A la División de Investigación Palmira DIPAL, de la Universidad Nacional de Colombia, por la financiación del trabajo de grado en Zootecnia de A. M. Cardona y F. Grisales.
1. Ascón, D. 1999. Sobrevivencia de larvas de Gamitana, Colossoma macropomum y boquichico, Prochilodus nigricans, utilizando dos tipos de alimento. Puerto La Cruz. p193–195. En: Acuacultura. Memorias [ Links ]
2. Barnabé, G. 1996. Bases biológicas y ecológicas de la acuicultura. Zaragoza, España: Acribia. 519 p [ Links ]
3. Dantagnan, D., H.; Borquez R. A. ; Bariles J., S.; Valdevenito I, I.; Vega R., A.; Mardones L., A. 1999. Larvicultura del puye (Galaxias maculatus) en sistema intensivo de producción. P 172-173. En: Acuatic (ed). Acuacultura 99, Puerto La Cruz, nov 17 – 20. Memorias Tomo I [ Links ]
4. De Fex, De S., R. 1996 Experiencias obtenidas con bocachico (Prochilodus magdalenae). p 77-84. En: curso y seminario internacional de acuacultura, 1, Santa Marta, Mayo 8 – 31. Memorias. [ Links ]
5. Kerguelén, E.; Sánchez, I.; Atencio, V. 2003. Influencia de la presa en la primera alimentación del bocachico (Prochilodus magdalenae Steindachner,1878). p 295 – 302. En: Congreso Iberoamericano Virtual de Acuicultura- CIVA, 2.http://www.civa2003.org [ Links ]
6. Needhan, J. G.; Needham, P.R. 1978. Guía para el estudio de los seres vivos de las aguas dulces. Barcelona: Reverte. 121 p. [ Links ]
7. Ruppert, E; Barnes, R. 1996. Zoología de los Invertebrados. México: McGraw-Hill Interamericana Ediciones. p1 – 9, 306-316. [ Links ]
8. Torrentera B. L; Tacon A. 1989. La producción de alimento vivo y su importancia en acuacultura para la agricultura y la alimentación. Brasilia. 1–43 p. [ Links ]
9. Valderrama, M. 1992. Estado actual de la pesca del bocachico y algunos aspectos sobre la ecología de sus pesquerías. p15-22. En: Seminario Taller del Bocachico (Prochilodus magdalenae), Barrancabermeja, Instituto Nacional de Pesca y Acuacultura INPA. [ Links ]
10. Verreth, J. 1999. Curso internacional sobre nutrición de larvas de peces, 1, Medellín, Universidad de Antioquia, Facultad de Medicina Veterinaria y Zootecnia. 57p. Memorias [ Links ]
11. Watanabe, T.; Kitajima, Ch.; Fujita, S. 1983. Nutritional values of live organisms used in Japan for mass propagation of fish: a review. Aquaculture 34: 115 - 143 [ Links ]














