Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.60 no.2 Palmira Apr./June 2011
1Departamento de Biología, Facultad de Ciencias, Universidad del Valle, A.A.25360, Santiago de Cali, Valle del Cauca, Colombia. 2Programa de Posgrado, Facultad de Ciencias Agropecuarias, Universidad Católica de Oriente, A.A.008, Carrera 46 # 40B-50, Ríonegro, Antioquia, Colombia. *Autor para correspondencia: aleydaacosta@gmail.com; †enrique.pena@correounivalle.edu.co; ‡dcastro@uco.edu.co
Annona muricata (guanábana) es una planta cultivada por la calidad nutritiva y organoléptica de su fruto. No obstante el carácter recalcitrante de las yemas vegetativas de esta especie ha dificultado la micropropagación de material seleccionado por su alta productividad. Esta investigación tuvo como objetivo evaluar medios de cultivo combinados con la técnica de microinjertación seriada para promover el desarrollo vegetal in vitro de A. muricata. En medios de cultivo específicos para cada material vegetal, se sembraron semillas y estacas para la formación de microinjertos; luego se aplicaron tres tratamientos de microinjertación (M1, M2, M3) y un control, donde el número indica las veces en las que una estaca es injertada en un portainjerto. M1 es una microinjertación monofásica o estacas microinjertadas en un portainjerto. M2 son estacas microinjertadas dos veces, es decir, permanecen en dos portainjertos diferentes con un lapso de un mes entre cada traspaso. M3 son estacas microinjertadas tres veces, es decir, permanecen en tres portainjertos diferentes con un lapso de un mes entre cada traspaso. Las estacas fueron separadas del portainjerto y sembradas en medio de cultivo para evaluar su revigorización; se realizaron pruebas de Anova y Freedman para los datos paramétricos y no paramétricos, respectivamente. Los resultados indicaron que la microinjertación monofásica es suficiente para estimular el desarrollo in vitro de material adulto de A. muricata; sin embargo, en los tratamientos no se logró el desarrollo de un sistema radicular adecuado.
Palabra clave: Annona muricata, compatibilidad de injerto, guanábana, injerto, propagación de plantas, regeneración in vitro, revigorización.
Annona muricata is grown due to the nutritional and organoleptic quality of the fruit. The recalcitrance of the vegetative buds of this species has hindered the micropropagation of selected material according to its high productivity. This research aimed to evaluate culture medium combined with the technique of serial micrografting to promote in vitro plant growth of Annona muricata. In specific culture media for each plant material, seeds and cuttings were planted for the formation of micrografts. Three micrografting treatments were applied (M1, M2, M3) and a control, where the number indicates the times when a shoot is micrografted onto a rootstock. M1 is a monophasic micrografting or cuttings micrografted in one rootstock. M2 are micrografted cuttings for two times, that is, these remain on two different rootstocks with a lapse of one month between each transfer. M3 are micrografted cuttings three times, that is, these remain in three different rootstocks with a lapse of one month between each transfer. The shoots were separated from the rootstock and planted in culture medium to assess their reinvigoration, ANOVA and Freedman tests were performed for parametric and nonparametric data respectively. The results indicated that the monophasic micrografting is sufficient to stimulate the in vitro development of adult material of Annona muricata; however, none of the treatments was able to develop a root system in the shoots.
Key words: Annona muricata, graft, graft compatibility, in vitro regeneration, plant propagation, reinvigoration, soursop.
Annona muricata L. (guanábana, en Colombia) es una planta originaria del neotrópico, perteneciente a la familia de las anonáceas y distribuida ampliamente en la región tropical. En Colombia, la fruta de esta especie es muy apetecida por su excelente sabor y por sus beneficios como fuente de fibra, calcio, fósforo y vitamina C; además de poseer propiedades medicinales y sustancias como las acetogeninas que tienen actividad como anticancerígena y biopesticida (Badrie y Schauss, 2010).
En varios estudios (Alzate, 2002; Perdomo- Aguirre; 2001; Bridg, 2000) se ha demostrado la dificultad para su propagación in vitro debido a la oxidación, la latencia y la fenolización de explantes, así como problemas para la formación de raíces. Las yemas de árboles adultos de A. muricata tienen problemas para su desarrollo in vitro; lo que se explica por la edad de los árboles fuente del explante. Cuando madura, la planta presenta cambios progresivos como la pérdida de la capacidad morfogénica y de su totipotencialidad, en los niveles hormonales, en el tipo de crecimiento y en la capacidad para florecer. Además, el tejido vegetal de plantas adultas tiende a permanecer latente, desarrollar callo y/o morir. Estos cambios se van consolidando a través de sucesivas generaciones celulares. El tejido vegetal de plantas jóvenes tiene un mayor potencial para regenerar órganos y plántulas in vitro, a partir de un pequeño explante.
Las microinjertaciones monofásica y seriada son técnicas utilizadas para regenerar plantas a partir de tejido vegetal con problemas de propagación in vitro o proveniente de árboles adultos. La primera fue desarrollada en la década de los años ochenta del siglo XX y es una técnica de propagación in vitro que consiste en unir un portainjerto (plántula decapitada) con una estaca que contenga al menos una yema para que continúen su desarrollo como una sola planta (Burger, 1985). La microinjertación seriada consiste en la reinjertación n veces de una estaca, en espera de que cada nuevo portainjerto le confiera características juveniles a la estaca y pueda generar nuevos brotes in vitro, fenómeno conocido como revigorización. Mejía et al. (2000) lograron la producción in vitro de material de A. muricata usando la técnica de microinjertación monofásica, no obstante, la yema extraída de la planta madre corresponde a la copa del microinjerto que luego sale al campo, por lo cual no existe una multiplicación in vitro de esta especie. Las técnicas de microinjertación actualmente son utilizadas para revigorizar material adulto con problemas de propagación in vitro, producción de plantas libres de virus y estudios de compatibilidad del injerto (Meera y Manjushri, 2006). El objetivo de esta investigación fue evaluar varios medios de cultivo combinados con la técnica de microinjertación seriada para promover la revigorización y multiplicación in vitro de material adulto de A. muricata.
Material vegetal
Para la formación de plantas por injertación convencional se utilizaron árboles adultos de A. muricata (de más de veinte años) seleccionados por su productividad. Estas plantas fueron mantenidas en casa de malla durante cuatro años y constituyeron las plantas madre de las cuales se extrajeron las estacas utilizadas en esta investigación. La unidad experimental correspondió a cada estaca semileñosa de 2 cm de alto que contenía una yema axilar. Para la extracción de la semilla se seleccionaron frutos por su apariencia saludable y buen estado de maduración.
Formación del microinjerto
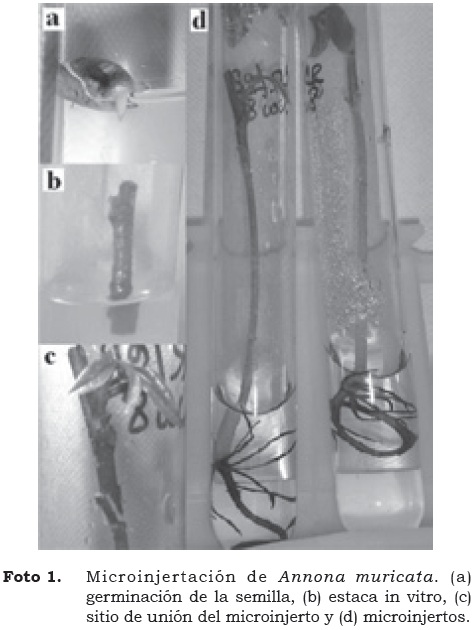
De acuerdo con la metodología de Mejía et al. (2000), tanto las semillas como las estacas de A. muricata L. fueron desinfectadas superficialmente utilizando detergente, etanol al 70% e hipoclorito de sodio al 1%. En la cabina de flujo laminar, se removió la testa de las semillas para facilitar su germinación. Se sembraron 460 semillas en medio de cultivo (Cuadro 1) y luego de 45 días se seleccionaron como material óptimo para servir de portainjerto las plántulas normales no contaminadas y con diámetro en la base del tallo > 4 mm. En la cabina de flujo laminar se sembraron 240 estacas en medio de cultivo apropiado (Cuadro 1), que se mantuvieron en oscuridad por cinco días y con luz natural por diez días, al cabo de los cuales se seleccionaron las estacas saludables y libres de contaminación. Para la formación del microinjerto, se decapitó la plántula y se hizo un corte longitudinal en el centro de la base (portainjerto); por otro lado, la base de la estaca se cortó en forma de 'V' para favorecer el acople de los conductos vasculares. Finalmente se unieron ambas partes que conforman el microinjerto, el cual se sembró en medio de cultivo líquido. Se registraron los porcentajes de germinación para semilla, contaminación, mortalidad y latencia del material vegetal.
Microinjertación seriada
En un diseño completamente al azar se realizaron tres tratamientos de microinjertación en serie (M1, M2 y M3) más un control. M1 consistió en una microinjertación monofásica o estacas microinjertadas en un portainjerto. M2 consistió en estacas microinjertadas dos veces, es decir, permanecen en dos portainjertos diferentes con un lapso de un mes entre cada traspaso. M3 o estacas microinjertadas tres veces, permanecieron en tres portainjertos diferentes con un lapso de un mes entre cada traspaso. El tratamiento control consistió en estacas sin microinjertar extraídas directamente de la planta madre y sembradas en el medio de elongación de brotes. Se utilizaron, en promedio, 17 estacas por tratamiento y tres repeticiones del experimento para un total de 199 estacas. Al finalizar la microinjertación seriada se contabilizó el porcentaje de estacas con brotes, latencia de la yema, mortalidad y contaminación.
Prueba de revigorización
Con el objeto de probar si la microinjertación en serie incentiva el desarrollo vegetal, se tomaron y separaron estacas del portainjerto de todos los tratamientos, las cuales fueron sembradas en un medio de elongación de brotes durante 60 días y de enraizamiento por un tiempo igual de 60 días (Cuadro 1). Se tomaron datos del número de brotes, elongación promedio del brote, número de nudos por estaca y de hojas. Los datos fueron registrados a 0, 15, 60 y 120 días de finalizados los tratamientos. Estas variables fueron analizadas utilizando el programa Statistica versión 6.0. Se realizó una prueba de Anova de medidas repetidas y una prueba de Tukey modificada (Unequal N HSD) para los datos paramétricos y las pruebas de Freedman y coeficiente de correlación de Kendall para los datos no paramétricos (número de brotes). Las estacas no microinjertadas (control) fueron excluidas del análisis comparativo por no presentar respuesta morfológica.
Formación del microinjerto
Los resultados de la metodología utilizada para formar microinjertos se detallan en el Cuadro 2. Las estacas mostraron formación de compuestos fenólicos (oxidación) aunque no fue un impedimento para la supervivencia de las mismas. La muerte de estacas se presentó por el daño al material vegetal en el momento de la desinfección superficial. La adición de BAP (1 mg/lt) en el medio de cultivo para estimular el desarrollo de brotes no produjo efecto morfológico en las estacas sembradas antes del inicio de los tratamientos.
Con base en los porcentajes de material óptimo para la microinjertación (72% de portainjertos y estacas sanas producidos, y 95% de microinjertos con buen acople), este proceso tiene una efectividad de 68%, es decir, que por cada 100 unidades de material vegetal sembrado se originan 68 microinjertos (Foto 1). Este porcentaje es favorable si tenemos en cuenta el beneficio de la producción de material sano para cultivo.
Microinjertación seriada
Los porcentajes de estacas con brotes, yemas latentes, mortalidad y contaminación fueron similares en los tratamientos (P > 0.05) como se muestra en el Cuadro 3. En promedio, 61% del material vegetal desarrolló brotes, 19% permaneció latente, 13% murió y 7% se contaminó. La microinjertación en serie no incrementa el riesgo de contaminación de las estacas ni la muerte del explante debida al estrés por el traspaso a un nuevo patrón. El rompimiento de la latencia en las yemas se presentó únicamente cuando las estacas se unieron al primer portainjerto y no se incrementó a medida que aumentaron las microinjertaciones, como se esperaba. Las estacas que no recibieron tratamiento de microinjertación (control) no desarrollaron brotes (Foto 2) y las características no-deseables se duplicaron, en el caso de la mortalidad y contaminación, y se triplicaron en el caso de la latencia.

Prueba de revigorización
En general el desarrollo vegetal fue afectado por el cambio de las estacas al medio de enraizamiento realizado sesenta días después de los tratamientos de microinjertación, a excepción del número de hojas que decreció antes del cambio del medio (Foto 1). La longitud del brote, el número de nudos y el número de hojas variaron con el tiempo (P < 0.001) (Figura 1) pero no ocurrió lo mismo para los tratamientos ni para la interacción tiempo x tratamientos (P > 0.05) (Cuadro 4). Resultados similares se presentaron para el número de brotes (P < 0.001, Coef. K = 0.33, r = 0.32), lo cual confirma que los tratamientos de microinjertación no difieren entre sí.
El rompimiento de la latencia, presentado sólo cuando las estacas se unieron al primer portainjerto en todos los tratamientos, significa que una sola microinjertación es suficiente para estimular el máximo número de yemas que pueden entrar en un proceso de organogénesis. El número de brotes, la longitud y el número de nudos expresaron su mejor desarrollo a los sesenta días del cultivo después de la revigorización. No obstante, cuando se cambió el medio para inducir el enraizamiento del material vegetal, dichas variables decrecieron. El sostenimiento y formación de nuevas hojas es viable mientras los brotes se encuentran unidos al portainjerto. Cuando los brotes son sembrados directamente en el medio de cultivo, las reservas acumuladas permiten el sostenimiento de las hojas en los primeros quince días, posteriormente éstas se reducen progresivamente hasta desaparecer (Foto 1).
Se observó un deterioro en el crecimiento al finalizar el tiempo de estudio y en ninguno de los casos los brotes generados por microinjertación en serie desarrollaron raíces en el medio de cultivo utilizado. Por lo general los medios de enraizamiento son pobres en nutrientes para inducir en la planta el desarrollo de raíces y la búsqueda de nutrientes. El medio para inducir la formación de raíces tenía una concentración baja de sales y vitaminas y carecía de hormonas. Debido a que el material vegetal en esta investigación no tuvo la capacidad de desarrollar un sistema radicular, los explantes perdieron masa vegetal por la poca disponibilidad de nutrientes en el medio.
El enraizamiento es fundamental en el proceso de propagación in vitro de plantas y la microinjertación en serie promueve la formación de raíces en varias especies difíciles de propagar in vitro como Garcinia indica (Meera y Manjushri, 2006) y Faidherbia albida (Danthu et al., 2002). No siempre hay resultados positivos con esta metodología, puesto que el tipo de explante, las concentraciones hormonales y de sales en los medios también influyen en el desarrollo vegetal in vitro de las plantas, como es el caso de Pista vera (Can et al., 2006) y Castanea satina Mill (Fernández- Lorenzo y Fernández-López, 2005).
- La microinjertación de una serie o monofásica es suficiente para incentivar el desarrollo vegetal in vitro de A. muricata y el incremento de las series en esta técnica no produce un beneficio adicional.
- Los medios utilizados con la técnica de microinjertación no lograron inducir un desarrollo radicular en esta especie; es probable que el tipo de explante utilizado haya sido ontogénicamente muy maduro y hubiese requerido de técnicas de revigorización más complejas para lograr su competitividad radicular.
Los autores agradecen al personal del Departamento de Biología de la Universidad del Valle, a la Corporación Biotec por la financiación brindada, al vivero Profrutales y a Colciencias por la ayuda dentro del marco del Proyecto Modelo Comercial de Producción Clonal de Materiales Seleccionados de Guanábano, y a Armando Muñoz por su asesoramiento en la investigación.
Alzate, A. 2002. Optimización de la metodología de propagación in vitro del guanábano desarrollada por Corporación Biotec y CIAT, como mecanismo para asegurar cultivos productivos y con frutos de óptima calidad sanitaria y organoléptica. Informe final de pasantía Joven Investigador convenio Colciencias - CIAT. Santiago de Cali. (manuscrito). [ Links ]
Badrie, N. y Schauss, A. 2010. Soursop (Annona muricata L.): Composition, nutritional value, medicinal uses, and toxicology. Bioactive Foods in Promoting Health. p. 621 - 643. [ Links ]
Bridg, H. 2000. Micropropagation and determination of the in vitro stability of Annona cherimoya Mill. and Annona muricata L. Berlin, Humboldt- University. Landwirtschaftlich-Gärtnerische Fakultät, Disponible en: http://edoc.hu-berlin.de/dissertationen/bridg-hannia.html. [Fecha revisión: Marzo 4 de 2008]. [ Links ]
Burger, D.W. 1985. Micrografting: a tool for the plant propagator. Comb. Proc. Int. Plant Prop. Soc. 34:244 - 253. [ Links ]
Can, C.; Ozaslan, M.; Toremen, H.; Sarpkaya, K.; y Iskender, E. 2006. In vitro micrografting of pistachio, Pistacia vera L. van Siirt, on wild pistachio rootstocks. J. Cell Mol. Biol. 5:25 - 31. [ Links ]
Danthu, P.; Hane, B.; Sagna, P. Y.; y Gassama, Y. 2002. Restoration of rooting competence in mature Faidherbia albida, a sahelian leguminous tree, through serial root sucker micrografting. New Forests 24:239 - 244. [ Links ]
Fernández-Lorenzo, J. y Fernández-López, M. 2005. Reinvigoration of mature Castanea sativa by serial micrografting onto a juvenile clone. ISHS Acta Hortic. 693: III International Chestnut Congress. [ Links ]
Meera, Ch. y Manjushri, D. 2006. Restoration of rooting competente in a mature plant of Garcinia indica through serial shoot tip grafting in vitro. Scientia Hortic. 108:194 - 199. [ Links ]
Mejía, A; Royero, N; Cabra, J.; y Roca, W. 2000. Proceso para la propagación clonal in vitro de plantas adultas de guanábano (Annona muricata L.) por medio de la microinjertación cíclica. Patente solicitada conjuntamente por la Corporación BIOTEC y el CIAT SIC # 00076031, 06-10-2000. [ Links ]
Perdomo-Aguirre, G. 2001. Evaluación de una tecnología de microinjertación en clones promisorios de guanábana (Annona muricata L.). Tesis. Universidad del Valle, Cali, Valle, Colombia. 70p. [ Links ]














