Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.60 no.3 Palmira July/Sep. 2011
Artículo científico
1 Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas –UNICAMP, Campinas, SP, Brasil.
2 Facultad de Ingeniería Agronómica, Universidad del Tolima, Ibagué, Tolima, Colombia.
3 Facultad de Ingeniería y Administración, Universidad Nacional de Colombia sede Palmira, Palmira, Valle, Colombia.
*Autor para correspondência: hamartinezco@unal.edu.co
Neste trabalho foi estudado o processo de extração da papaína presente no látex de frutos de mamão (Carica papaya L.) cultivar Maradol. As variáveis estudadas na extração da papaína foram proporção de látex:álcool (1:2.1 e 1:3) e tipo de secagem (à vácuo e por refractance window). As respostas obtidas foram atividade enzimática da enzima e rendimento do processo de extração. O melhor resultado em termos de atividade enzimática e rendimento foi obtido nas condições de secagem à vácuo e proporção látex:álcool de 1:3. A enzima obtida foi caracterizada por testes físico-químicos, microbiológicos e de atividade enzimática e comparada com uma amostra comercial usada como padrão.
Palavras chave: Látex, papaína, processo de extração.
In this work, we studied the Papain extraction process, from the latex of papaya fruit (Carica papaya L.) cv. Maradol. The variables studied in the extraction of papain were: the proportion of latex:alcohol (1:2.1 and 1:3) and type of drying( vacuum and refractance window) and the responses obtained in terms of enzymatic activity of the enzyme papain and yield of the extraction process. The best result in terms of enzyme activity and yield was the procedure used to vacuum drying and the proportion latex:alcohol 1:3. The enzyme obtained was characterized by physico-chemical, microbiological and enzymatic activity when compared with a commercial sample used as standard.
Key words: Extraction method, latex, papain.
A papaína (E.C. 3.4.22.2) é uma enzima proteolítica com massa molecular de 23,406, a qual possui uma cadeia de poilipetideos de 212 aminoácidos. Sua importância comercial deve-se aos variados usos nas indústrias têxteis, farmacêutica, cosméticas e alimentaria (Galindo-Estrella et al., 2009). Nesta última, destaca-se sua ação como amaciante de carnes, agindo nas fibras musculares e nos componentes do tecido conectivo e, na indústria de bebidas é usada para hidrolisar as proteínas de alto peso molecular na clarificação da cerveja, evitando a turbidez deste produto durante seu armazenamento e refrigeração prolongada (Aehle, 2007). O látex obtido de frutos verdes do mamoeiro (Carica papaya L.) corresponde a uma mistura de enzimas proteolíticas que incluem papaína, quimopapaína A e B (EC 3.4.22.6), papaia endopeptidase III, papaia endopeptidase IV, e papaia endopeptidase ômega (Azarkan et al., 2003). Vários estudos têm reportado a extração de papaína empregando diferentes reagentes na etapa de precipitação (Marrero, 1977; Monti et al., 2000). A etapa de secagem na produção desta enzima é de grande importância, pois durante este processo, as enzimas podem perder sua estrutura nativa e em consequencia, afetar sua atividade enzimática (Sloth et al., 2008). Diante disso, este trabalho teve como objetivo estudar a influência das condições do processo de extração, a saber:proporção látex:álcool (1:2.1 e 1:3) na etapa de precipitação e tipo de secagem: à Vácuo(50 °C) e refractance window (95 °C para o meio calefator) na produção de enzima a partir do látex de frutos verdes. Como variáveis respostas foram avaliadas o rendimento do processo de extração. A atividade enzimática foi medida pelos métodos de produção de tirosina e de coagulação do leite, além disso a enzima obtida foi testada em processos de clarificação de cerveja.
Material
Foram empregados frutos verdes de Carica papaya L. da variedade Maradol, entre 5 e 6 meses de idade, os quais foram colhidos em um plantio localizado a 240 m.s.n.m., com temperatura meia de 28 °C e tipo de solo franco-arenoso, na região de Flandes (Tolima, Colômbia). Para a colheita dos frutos foram selecionadas aleatoriamente 59 árvores e de cada árvore foram escolhidos 4 frutos verdes com diâmetro entre 15 e 35 cm, longitude entre 35 e 41 cm e massa entre 1.8 e 2.5 Kg. Todos os reagentes empregados (sulfato de amônio, EDTA, etanol (96% v/v) e metabisulfito de sódio) foram de grau analítico (Merck Chemicals), e papaína comercial empregada como padrão foi fornecida pela Merck Chemicals (Alemanha).
Obtenção do látex
O látex foi extraído a partir de 4 incisões longitudinais na casca dos frutos usando instrumentos em aço inoxidável, coletado por gotejamento, conservado com a adição de metabisulfito de sódio (0.5% p/p) e estocado a -5 °C até seu uso.
Extração da papaína
A papaína foi obtida através de uma serie de operações esquematizadas na Figura 1. A primeira etapa compreendeu a eliminação de pequenas moléculas orgânicas e inorgânicas e outras proteínas presentes no látex extraído, por meio da adição de sulfato de amônio e EDTA. Durante esta etapa o látex foi solubilizado e posteriormente diluído com álcool (etanol, 96% v/v) até atingir uma concentração alcoólica de 10%. As impurezas precipitadas na etapa anterior foram eliminadas por filtração empregando terras diatomáceas. O líquido filtrado foi adicionado de etanol (96% v/v) em duas proporções látex:álcool: 1:2.1 ou 1:3, para obter um precipitado, o qual foi recuperado por filtração á vácuo usando papel Wathman no.1.
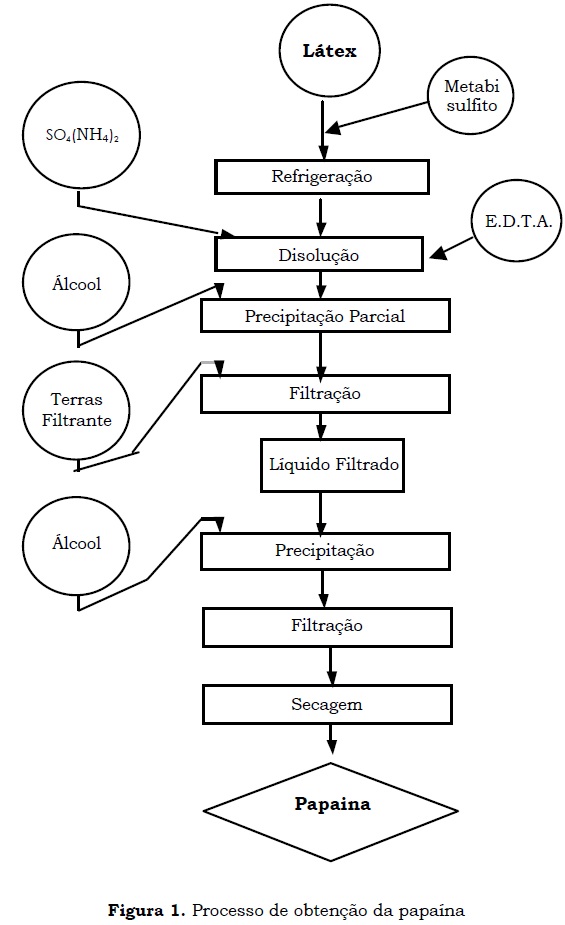
O sólido foi finalmente secado, empregando dois métodos diferentes: (1) secagem a vácuo (com temperatura 50 °C, Lab live duo-vac oven, Lab Line Instruments), ou (2) secagem por refractance window (MCD Technologies, Inc.) empregando agua a 95 °C como meio calefator e finalmente a enzima foi moída para a obtenção de um pó fino.
Análises físico-químicas e microbiológicas
Umidade final pelo método 925.09 (A.O.A.C., 2005), Cinzas segundo método 923.03 (A.O.A.C., 2005), pH, medido com pHmetro (Schoot-gerate CG818), solubilidade foi determinada com os solventes água, éter etílico, ácido clorídrico, hidróxido de sódio, bicarbonato de sódio e ácido sulfúrico. Para detectar a presença de proteínas foi usado o teste do Biureto e, espectroscopia de absorção no infravermelho (FTS-2400) para verificar a existência de grupos funcionais característicos desta enzima.
Foram realizadas análises microbiológicas como mesófilos (UFC/g), NMP de coliformes totais/g, bolores e leveduras (UFC/g).
Atividade enzimática
Método da tirosina. A atividade proteolítica foi determinada usando caseína como substrato a 37 °C e pH de 8.2. Na proteólise da caseína a tirosina é liberada e pode ser medida por espectrofotometria em 280 nm, a atividade é calculada pela equação 1. Uma unidade de enzima para este procedimento é definido como a atividade a uma determinada quantidade de enzima degrada a caseína, sob condições específicas de pH e temperatura, para produzir um mol de tirosina por minuto (Afaq e Iqbal, 2001).
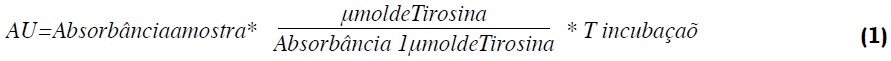
Método de coagulação do leite
Através deste teste é calculada a potência da enzima em quebrar a estrutura de proteínas do leite (substrato). Em este método 10 mg de solução de papaína a uma concentração de 1 g de enzima em 10 g de ácido acético (0.01%) foi adicionado a uma solução de 10 ml do leite (2.5 g do leite em pó em 100 g de agua) a qual foi aquecida em banho a 50 °C (Ming et al., 2002). O conteúdo de tubo foi agitado até o primeiro sinal de formação de coágulos. O tempo que demora na formação do coagulo e registrado e empregado na equação 2. A atividade da enzima é expressa em unidade de potência de coagulação do leite por grama de enzima seco (Upe).
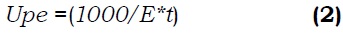
onde, E: miligramos de papaína usada para precipitar 10 ml do substrato (o leite) no tempo t (min).
Aplicação de papaína em cerveja
Durante a fermentação e a maturação da cerveja formam-se redes coloidais que podem precipitar e ocasionar a turvação da cerveja engarrafada, durante o armazenamento a frio. Esses precipitados coloidais são frações de compostos coloidais como polifenóis e proteínas, assim a ação da papaína procura a estabilização da cerveja por meio da hidrólise desses compostosde modo que a formação da rede de proteína-polifenol é inibida (Rehmanji et al., 2005).
No teste 10 mg de enzima foram adicionados a 100 ml de cerveja sem tratamento enzimático, mantendo-a em reposo durante 1 h, ao final é medido o índice de turbidez (turbidímetro HACH modelo 2100N) e comparado com o do produto acabado (cerveja após o tratamento enzimático) (Rehmanji et al., 2005). A turbidez é expressa em NTU (Unidades Nefelométricas de Turbidez).
Delineamento experimental
Foi usado um delineamento experimental foi o inteiramente casualizado com 4 tratamentos, e 2 repetições (Tabela 1) para avaliação da influência dos fatores: proporção látex:álcool (1:2.1 ou 1:3) e tipo de secagem: (1) secagem a vácuo (temperatura 50 °C), ou (2) secagem por Refractance window (agua a 95 °,C como meio calefator). As variáveis respostas foram: rendimento (expressado como a quantidade de enzima seca obtida em relação a quantidade de látex fresco), e atividade enzimática. As determinações analiticas foram conduzidas em duplicata, e os valores das meias foram comparados pelo teste de Tuckey (P < 0.05) utilizando o software Statistica (V.7.0).
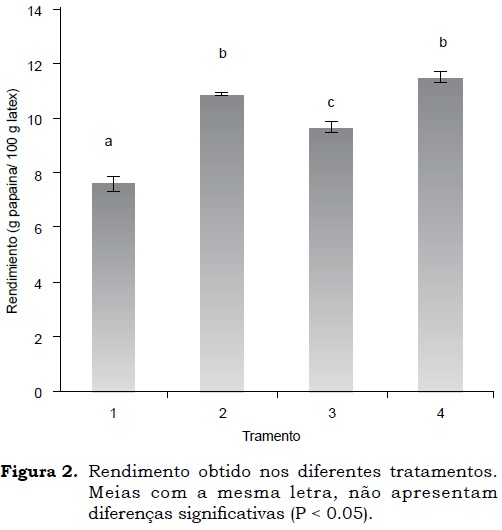
Na Figura 2 é apresentado o rendimento de extração (papaína (g)/100g látex) para os tratamentos experimentais. Pode se observar que o rendimento mais alto no processo de extração de papaína foi obtido nos tratamentos 2 e 4, ou seja aqueles que usaram secagem á vácuo e proporções látex:álcool de 1:2.1 e 1:3. Os rendimentos (g papaína/látex) foram de 10.83 ± 0.04 e 11.53 ± 0.2, respectivamente. Foram encontradas diferenças significativas (P < 0.05) quando comparado com os tratamentos 1 e 3, os quais empregaram secagem por refractance window. Os fatores estudados permitiram confirmar a grande influência do tipo de secagem no rendimento final do processo, a interação entre as variáveis proporção látex:álcool e tipo de secagem resultou igualmente importante. Obtendo-se com tratamento 4 o maior rendimento de extração (g papaína/g látex) com valor de 11.53/100. Este valor foi diferente ao reportado por Monti et al. (2000) os quais obtiveram rendimentos em torno de 1.51 mg/g látex em um processo que emprega nitrogênio e EDTA na sequencia de resfriamentos e cristalizações, a partir de látex de frutos de C. papaya oriundos do estado de São Paulo (Brasil). Esta diferença pode ser explicado pela procedência dos futos e as condiçoes operativas do processo de extração, neste sentido Galindo-Estrella et al. (2009) confirmaram que nos frutos de C. papaya L. da variedade Maradol é encontrada a maior atividade proteolítica quando comparado com extratos de caule e folhas.
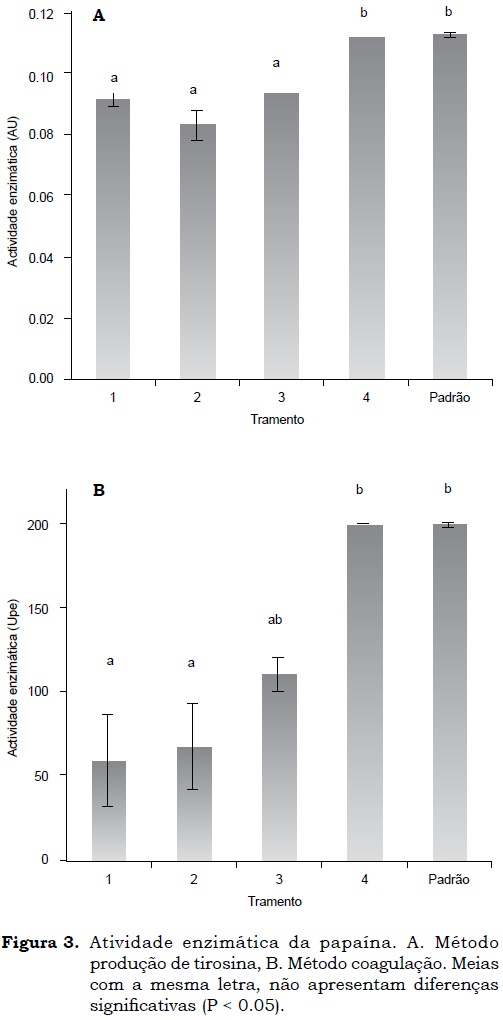
Na Figura 3 podem se observar os resultados dos testes de atividade enzimática pelo método de produção de tirosina (Figura 3a) e pelo método de coagulação do leite (Figura 3b). Foi evidenciado que a amostra do tratamento 4 teve a mesma atividade enzimática da enzima comercial (padrão), e só apresentaram diferenças significativas quando comparados com os tratamentos 1, 2 e 3 (P < 0.05). Sendo então a relação látex:álcool e o tipo de secagem fatores importantes na atividade enzimática. Estes resultados concordam com o reportado por Puig et al. (2008) que estudaram diferentes métodos de secagem de papaína crua (látex) encontrando alta atividade da enzima quando é sometida a que secagem à vácuo (50 °C) e liofilização (-30 °C). As diferenças em atividade das enzimas nos tratamentos com secagem à vácuo e refractance window podem-se dever à perda de atividade por causa de mudanças produzidas na sua estrutura nativa no processo de secagem, como foi reportado por Devakate et al. (2009) e Sloth et al. (2008).
Os resultados da caracterização físico-química realizada para a enzima obtida (papaína) são apresentados na Tabela 2. Os testes físico-químicos foram realizados para a amostra do tratamento 4, onde valores de pH, umidade e solubilidade próximos aos da enzima comercial (padrão). A diferença no conteúdo de cinzas pode-se dever à ação quelante do EDTA empregado no processo de extração, o qual forma um complexo com íons metálicos acrescentando sua solubilidade, a procedência diferente das amostras explica as diferenças.
A reação com biureto confirma a presença de aminoácidos e proteínas, pois o reagente de biureto reage com ligações peptídicas em polipeptídeos tanto na enzima obtida quanto na enzima comercial. A presença dos grupos funcionais característicos da papaína é confirmada por meio da espectroscopia de infravermelho o qual reporta a existência dos grupos carboxila, amino, carbono e hidrogênio alifáticos tanto na enzima obtida quanto na enzima padrão (Tabela 2).
Os resultados apresentados na Tabela 2 revelaram a qualidade microbiológica da enzima obtida comparada com a enzima padrão, quanto à presença de microorganismos mesófilos, coliformes totais e bolores e leveduras. Os resultados dessas análises se encontraram dentro dos padrões aceitos pela legislação colombiana.
Quanto ao resultado do teste de clarificação em cerveja (Tabela 3) observou-seque a papaína obtida pelo tratamento 4 conseguiu a diminuição da turbidez da cerveja até um nível comparável com o produto final (comercial). Este teste permitiu concluir que a enzima obtida teve ação efetiva na ruptura de complexos coloidal proteína-polifenolde alto peso molecular (medida pelo decréscimo na turbidez), melhorando a clarificação da cerveja.

- Foi comprovado que a proporção látex: álcool e o tipo de secagem foram fatores determinantes na extração de papaína a partir do látex de Carica papaya L. da variedade Maradol. Com o tratamento que empregou secagem à vácuo e proporção látex:álcool de 1:3 foi possível obter o melhor rendimento (g de enzima seca/100 g de látex fresco) no processo de extração: 11.53 ± 0.2 e uma atividade enzimática da mesma ordem de grandeza da enzima padrão.
- As propriedades físico-químicas da papaína obtida foram muito semelhantes ás da enzima padrão (pH, solubilidade e umidade). A espectroscopia no infravermelho permitiu confirmar a presença dos grupos funcionais característicos desta enzima. Através do teste de clarificação da cerveja, foi confirmada a efetividade da papaína obtida na ruptura de proteínas de alto peso molecular, causantes de turbação quando refrigerada.
Aehle, W. 2007. Enzymes in industry, production and applications. Weinheim: WILEY-VCH Verlag GmbH & Co. 517 p. [ Links ]
Afaq, S. e Iqbal, J. 2001. Immobilization and stabilization of papain on chelating sepharose: a metal chelate regenerable carrier. Electronic J. Biotech. 4 (3): 120 - 124. [ Links ]
AOAC. Official methods of analysis of AOAC. 2005. 18th edn. Association of Official Analytical Chemists. Washington (DC). [ Links ]
Azarkan, M.; Moussaoui, A. E.; Wuytswinkel, D.; Dehon, G.; e Looze, Y. 2003. Fractionation and purification of the enzymes stored in the latex of Carica papaya. J. Chrom. B. 790:229 - 238. [ Links ]
Devakate, R. V.; Patil, V. V.; Waje, S. S.; e Thorat, B. N. 2009. Purification and drying of bromelain. Separation and Purification Technology 64 (3):259 - 264. [ Links ]
Galindo-Estrella, T.; Hernández-Gutiérrez, R.; Mateos-Díaz, J.; Sandoval-Fabián, G.; Chel-Guerrero, L.; Rodríguez-Buenfil, I.; e Gallegos-Tintoré, S. 2009. Proteolytic activity in enzymatic extracts from Carica papaya L. cv. Maradol harvest byproducts. Proc. Biochem. 44(1):77 - 82. [ Links ]
Marrero, M. 1977. Obtención industrial de papaína purificada a partir del látex del fruto de la Carica papaya L. Rev. Cubana de Farmacia 11(1):35 - 39. [ Links ]
Ming, C. C.; Bono, A.; Krishnaiah, D.; e Han, T. S. 2002. Effects ionic and non-ionic surfactants on papain activity. Borneo Sci. 12:71 - 77. [ Links ]
Monti, R.; Basilio, C. A.; Trevisan, H. C.; e Contiero, J. 2000. Purification of papain from fresh latex of Carica papaya. Braz. arch. biol. technol. 43(5):501 - 507. [ Links ]
Puig, A.; Gil, I.; e Sánchez, O. 2008. Evaluation of drying techniques measuring proteolytic activity of papain obtained from unripe fruit and skin juice. Ind. Biotechn. Intern. Conference. June 8-11, Italy. [ Links ]
Rehmanji, M.; Gopal, C.; e Mola, A. 2005. Beer stabilization technology-clearly a matter of choice. MBAA TQ. 42(4):332 - 338. [ Links ]
Sloth, J.; Bach, P.; Jensen, A. D.; e Kiil, S. 2008. Evaluation method for the drying performance of enzyme containing formulations. Bioch. Eng. J. 40(1):121 – 129 [ Links ]














