Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.60 no.4 Palmira Oct./Dec. 2011
Facultad de Ciencias Agrarias y del Ambiente, Universidad Francisco de Paula Santander, Cúcuta, Norte de Santander, Colombia.
*Autor para correspondencia: clgardel23@gmail.com; †asigarroa@ufps.edu.co
Se evaluó una técnica de micropropagación de plantas de mora (Rubus glaucus) de la variedad sin espinas, a partir de ápices meristemáticos. En la fase de establecimiento se evaluó un protocolo de desinfección utilizando por 5 min solución de jabón detergente comercial y agua + alcohol 70% por 2 min + hipoclorito 3% con dos tiempos de exposición diferentes: T1 por 5 min y T2 por 10 min. Después de desinfectar las microestacas se extrajeron los ápices meristemáticos y se establecieron in vitro bajo un diseño completamente al azar para evaluar dos medios de cultivo: M1 y M2. A partir de las plántulas desarrolladas se efectuó la multiplicación en los medios de cultivo M1, M3 y M4. Ambos tratamientos de desinfección resultaron efectivos alcanzando 100% de desinfección de los explantes con cada uno de ellos. La siembra de ápices meristemáticos permitió el establecimiento de cultivos asépticos y un adecuado desarrollo de los explantes después de seis semanas de cultivo, con prendimiento de 83.4% para M1 y 66.6% para M2. El análisis de varianza (Anova) y la prueba de rangos múltiples mostraron que la multiplicación fue mejor en el medio M1 con una mayor tasa de crecimiento y desarrollo del explante, al obtener coeficientes de multiplicación de 7.5 brotes/plántula y una altura promedio de 1.95 cm.
Palabra clave: Cultivo de meristemas, cultivo in vitro, micropropagación, mora sin espinas, Rubus glaucus.
We evaluated a technique of micropropagation in a thornless variety of blackberry (Rubus glaucus) from shoot apical meristems. In the establishment phase, we evaluated a disinfection protocol: soapy solution (commercial detergent and water) for 5 minutes + 70% alcohol for 2 minutes + 3% hypochlorite with two different exposure times: T1 for 5 minutes and T2 for 10 minutes. When the microcuttings were disinfected, the meristematic shoots were removed and established in vitro in a completely random design to evaluate two cultivation mediums: M1 and M2. From the seedlings developed, the multiplication was performed, which tested three cultivation mediums: M1, M3 and M4. Both disinfection treatments were effective achieving 100% disinfection of explants in each of them. Meristematic shoot planting allowed the establishment of aseptic cultivation and adequate development of the explants after six weeks of cultivation with rates of germination of 83.4% for M1 and 66.6% for M2. The analysis of variance (ANOVA) and multiple range test with Fisher's method (LSD), showed that multiplication the M1 medium favored better growth and development of the explant to obtain a multiplication coefficient of 7.5 shoots per seedling and an average height of 1.95 cm.
Key words: In vitro cultivation, meristems, micropropagation, Rubus glaucus, thornless blackberry.
La mora de castilla (Rubus glaucus Benth.) es uno de los frutales más conocidos y cultivados en Colombia por pequeños y medianos agricultores y constituye una de las principales fuentes de ingresos, generación de empleo rural, oferta de alimento e insumo para la agroindustria (Barrero, 2009). Debido a su importancia, para el 2020 se espera que el área cultivada aumente en 10,000 ha nuevas con una producción de 104,265 t de fruta cosechada (Tafur et ál., 2006). A pesar de la riqueza y el gran potencial de la mora, su cultivo presenta grandes limitaciones como la carencia de semillas certificadas, la escasa introducción de nuevas variedades y problemas fitosanitarios relacionados con los sistemas de propagación asexual por acodos y estacas, lo que favorece la trasmisión de plagas y enfermedades (Avilán et ál., 1989; Angulo, 2003, citados por Barrero, 2009). La multiplicación de la mora sin espinas es cada vez mayor debido a la alta capacidad de producción de fruta, relacionada con un mayor número de ramas productoras y un macollamiento entre 15% y 20% superior a la mora tradicional con espinas (Bernal y Díaz, 2006).
En Colombia se ha incrementado el uso de la micropropagación de meristemos en frutales mediante la técnica de cultivo de tejidos. E ste s istema, a demás d e p ermitir la propagación masiva de clones específicos libres de patógenos, garantiza alta calidad, mayor uniformidad y semillas limpias (Marulanda et ál., 2000). Los resultados de las investigaciones con plantas propagadas por acodo tradicional y por micropropagación, permiten establecer que las plantas propagadas in vitro por este último sistema producen frutos más limpios y de mayor tamaño, peso y homogeneidad (Barrero, 2009).
El objetivo de este trabajo fue evaluar una técnica para micropropagación de mora de castilla (Rubus glaucus) variedad sin espinas, mediante el cultivo de ápices meristemáticos.
Obtención del material vegetal
Para la recolección del material vegetal, con la colaboración de la Unidad Municipal de Asistencia Técnica Agropecuaria (UMATA), se efectuó un reconocimiento y se analizaron las zonas productoras de mora del municipio de Labateca, Norte de Santander. Como fuente de las plantas madre se seleccionaron cultivos de la finca Miralindo ubicada en la vereda San Bernardo de Balsa a 1.850 m.s.n.m. El material vegetal fue recolectado en las primeras horas del día (06:00 a.m.) a partir de plantas con crecimiento activo, desarrollo vigoroso y sin signos de enfermedad visible. Una vez recolectado se envolvió en papel periódico antes de depositarlo en una caja hermética para ser trasladado al Laboratorio de Biotecnología Vegetal de la Universidad Francisco de Paula Santander, municipio de Los Patios, Norte de Santander.
Fase de establecimiento
Del material seleccionado en campo se extrajeron microestacas de 1 cm de longitud, con una yema axilar, que se introdujeron en una solución de 150 mg/lt de ácido ascórbico (antioxidante). En área estéril, se evaluó un protocolo de desinfección con dos tiempos de exposición del tejido (Cuadro 1). Una vez concluyeron los tiempos de exposición a cada desinfectante, se efectuaron tres enjuagues con agua destilada estéril antes de colocar las microestacas en una solución de 150 mg/lt de ácido ascórbico para su conservación, mientras se procedía a la extracción y siembra de los ápices meristemáticos. L a e xtracción de estos ápices se realizó con la ayuda de un estereoscopio y la incubación se hizo a 20 °C ± 2 °C y un fotoperiodo de 16 h luz/8 oscuridad.

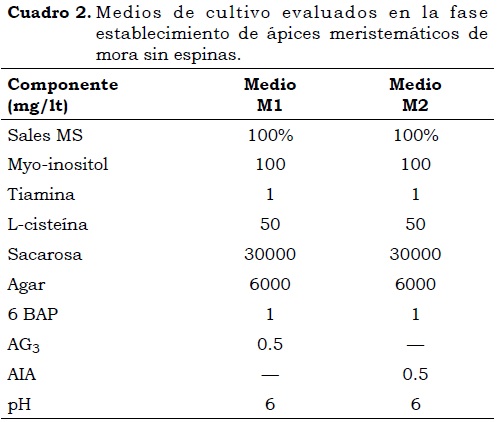
La selección de los medios de cultivo evaluados (Cuadro 2) se hizo de acuerdo con los resultados previos obtenidos por Ballesta (2008). En el experimento se emplearon 30 ápices meristemáticos (unidad experimental) por tratamiento, con tres repeticiones cada uno en un diseño de bloques al azar. En esta fase de seis semanas de duración, se midieron la longitud (cm), el número de hojas y el porcentaje de desinfección, teniendo en cuenta la fenolización y el porcentaje de prendimiento.
Fase de multiplicación
En esta fase se utilizaron plántulas desarrolladas en el medio de cultivo M1 de la fase establecimiento ya que presentaban una conformación general adecuada con promedio de altura de 1.2 cm, desarrollo foliar abundante y buen alargamiento de entrenudos; por el contrario, las plántulas en el medio M2 presentaban una altura < 0.6 cm y escaso desarrollo foliar. El proceso de multiplicación consistió en eliminar las hojas y la parte basal necrótica y finalmente seleccionar microestacas con una yema axilar y longitud entre 0.3 y 0.5 cm.
En esta fase se evaluaron la longitud (cm) y el coeficiente de multiplicación (número de plántulas finales/número de explantes establecidos) en tres medios de cultivo adaptados de Najaf-Abadi y Hamidoghli (2009); Marulanda et ál. (2000), y Erig et ál. (2002) (Cuadro 3).

Durante cuatro semanas se evaluó la formación de callo de los explantes en cada uno de los medios de cultivo y los resultados obtenidos se analizaron siguiendo el modelo inferencial, completamente al azar, utilizando el programa Statgraphics Centurion XVI (2009) y el análisis de varianza para la comparación de medias mediante la prueba de F (P < 0.05).
Fase de establecimiento
La utilización de ápices meristemáticos como explantes primarios permitió el establecimiento de cultivos totalmente asépticos, en ambos tratamientos se logró un 100% de desinfección, pues no se manifestó contaminación endógena en ninguno de los explantes.
En las condiciones de este mismo laboratorio, Ballesta (2008) utilizando el mismo protocolo de desinfección, pero tomando como explantes microestacas de 7 mm, observó niveles de contaminación endógena hasta del 70%. Lo anterior sugiere que el empleo de ápices meristemáticos como explantes permite reducir la contaminación endógena hasta un nivel mínimo, sin necesidad de emplear protocolos más agresivos para la desinfección del material vegetal.
El efecto de los medios de cultivo sobre el desarrollo de los explantes durante la fase de establecimiento se observa en el Cuadro 4. Se encontraron diferencias (P < 0.05) en longitud y número de hojas entre medios de cultivo, observándose un mayor crecimiento y desarrollo de ápices meristemáticos en el medio M1, lo que permitió una mejor formación de plántulas antes del inicio de la fase Multiplicación (Foto 1). Muñoz y Reyes (2006) encontraron que en el cultivo de meristemos de mora de castilla (R. glaucus) la utilización de AG3 presentó los mejores desarrollos cuando se aplicó en combinación con BAP, resultando en una mayor producción de hojas y propágulos para la multiplicación masiva. Marulanda et ál. (2000) emplearon un medio de cultivo con BAP (1 mg/lt) y AG3 (1mg/lt) para el establecimiento in vitro de plantas de R. glaucus, y obtuvieron explantes con buen desarrollo y un promedio de tres brotes en cada uno, los cuales fueron transferidos con éxito al medio de multiplicación. Esto comprueba, una vez más, que los tipos de reguladores de crecimiento así como su combinación en un medio de cultivo, son necesarios para la obtención de plántulas viables en la iniciación de un proceso de micropropagación.
En ambos medios de cultivo se presentó desarrollo de los ápices meristemáticos por la presencia de la citoquinina 6BAP, hormona que induce la división celular, sin embargo, la mayor elongación en el medio M1 se manifestó por la presencia de AG3. Fisiológicamente las giberelinas inciden en el alargamiento celular, principalmente de entrenudos e incrementan la producción de auxinas endógenas, según Torres et ál. (1996) su concentración óptima se halla en el rango 0.1 – 1 ppm. Debido a que el crecimiento de R. glaucus ocurre principalmente en los entrenudos, el AG3 mostró ser más indicado que el ácido indolacético (AIA) para el crecimiento de las plántulas. La combinación del 6BAP (1 mg/lt) con una concentración no tóxica de AG3 (0.5 mg/lt) permitió obtener plántulas de mayor altura y con mejor desarrollo foliar (Foto 2).
El fenómeno de fenolización se presentó en un porcentaje muy bajo para ambos medios de cultivo (Cuadro 4). Esto se explica tanto por el uso de agentes antioxidantes (ácido ascórbico y L- cisteína) en los enjuagues y medio de cultivo, como por la ubicación del explante, debido a que el ápice meristemático está protegido por los primordios foliares y no es expuesto directamente al agente desinfectante, adicionalmente el procedimiento de extracción no implica la realización intensa de cortes que favorezcan la liberación de compuestos fenólicos. Azofeifa (2009) señala que los procesos de oxidación son causados principalmente por el efecto abrasivo del agente desinfectante aplicado durante la asepsia del explante, los cortes que sufre el mismo y la composición del medio de cultivo, resaltando como principales sustancias antioxidantes el ácido ascórbico y L-cisteína.
Fase de multiplicación
Después de cuatro semanas de crecimiento, las plántulas generadas en el medio M1 alcanzaron mayores longitudes y número de brotes que los medios M3 y M4 (P < 0.01) (Cuadro 5). Los mejores resultados en el medio M1 se debieron a la combinación hormonal 6BAP + AG3, en contraste con los medios M3 y M4, que además del 6BAP, contienen la hormona AIA del grupo de las auxinas para el M3, y ácido indolbutírico (AIB) para el M4. Villa et ál. (2005) al evaluar el efecto de 6BAP en diferentes concentraciones sobre la multiplicación in vitro de Mora (Rubus sp.) hallaron el mayor número de brotes (3.99) en un medio de cultivo con 1 mg/lt de BAP y concluyeron que este regulador de crecimiento no es responsable de la elongación de los tallos. Por otra parte Najaf-Abadi y Hamidoghli (2009) en estudios de micropropagación de mora sin espinas, encontraron una altura máxima de 5.87 cm en medio de cultivo con 2 mg/lt de BA y 0.5 mg/lt de GA3, pero con menor número de brotes.
Con los medios de cultivo M3 y M4 no se encontraron resultados satisfactorios como lo indican los bajos coeficientes de multiplicación y de longitud de las plántulas, básicamente por las combinaciones hormonales citoquinina + auxina. Erig et ál. (2002) al evaluar 6BAP y AIB en la multiplicación in vitro de frambuesa (R. idaeus) observaron que en medios de cultivo con niveles crecientes de BAP y concentraciones variables de AIB, se presenta reducción en el promedio de longitud de los tallos, señalando que el uso de AIB es tóxico en niveles altos de citoquinina, lo cual se manifiesta con la falta de elongación y crecimiento en forma de roseta de las plántulas, característica que en el presente estudio se evidenció en los medios de cultivo M3 y M4 (Foto 3).
En fase de multiplicación la formación de callos se presentó en todos los medios de cultivo, pero con diferentes intensidades. En los medios M3 y M4 la mayoría de las plántulas desarrollaron callos (81% y 84%, respectivamente); no obstante, en M1 fue muy baja la población con presencia de callo (10%), lo que muestra nuevamente que la combinación hormonal en el M1 es la más adecuada. Marulanda et ál. (2000) trabajaron con dos medios de cultivo compuestos: 1.5 mg./lt BA + 1.5 mg/lt AG3, y 2 mg/ lt BA + 2 mg/lt AG3 y encontraron que el incremento de la dosis de la citoquinina BA aumenta de manera significativa la producción de callos. Este fenómeno no es deseable en un proceso de micropropagación masiva ya que aumenta el riesgo de aparición de variantes somaclonales (Pérez et ál., 1998). Los resultados obtenidos indican que es posible disminuir la concentración de BA al menos a 1 mg/lt para reducir la formación de callos, manteniendo buenos coeficientes de multiplicación y aceptable longitud en las plántulas.
- El ápice meristemático es un tejido que resulta eficaz como explante primario para iniciar un proceso de micropropagación de mora sin espinas. Sus células en división permiten un rápido crecimiento, siempre y cuando se encuentren en el medio de cultivo apropiado; además, facilita la obtención de plántulas libres de contaminantes endógenos para la fase de multiplicación.
- La desinfección con solución jabonosa (agua + detergente comercial), cinco minutos; alcohol al 70% durante dos minutos e hipoclorito de sodio al 3% (cinco o diez minutos) permite un 100% de desinfección de los ápices meristemáticos.
- Para las fases establecimiento y multiplicación, el mejor medio de cultivo fue M1 (6 benzilaminopurina 6BAP 1 mg/lt y ácido giberélico AG3 0.5 mg/lt), lo que permite aumentar progresivamente la longitud, el desarrollo foliar y el número de brotes.
- Para un proceso de micropropagación de R. glaucus sin espinas, la combinación hormonal citoquinina/giberelina permite obtener resultados significativamente superiores a la combinación citoquinina/ auxina.
- La metodología evaluada es apropiada y promisoria para la obtención de plántulas de mora sin espinas, mediante técnicas de micropropagación.
Azofeifa, Á. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados In vitro. Agron. Mesoam. 20(1):153 - 175. [ Links ]
Barrero, L. 2009. Caracterización, evaluación y producción de material limpio de mora con alto valor agregado. Corporación Colombiana de Investigación Agropecuaria (Corpoica). Regional 1. Cundinamarca. p. 5. [ Links ]
Ballesta, M. 2008. Establecimiento y multiplicación in vitro de mora de castilla (Rubus glaucus) en el Laboratorio de Biotecnología Vegetal de la Universidad Francisco de Paula Santander. Tesis de grado. Universidad Francisco de Paula Santander. Cúcuta, Norte de Santander. 75 p. [ Links ]
Bernal, J. y Díaz, C. 2006. Materiales locales y mejorados de tomate árbol, mora y lulo sembrados por los agricultores y cultivares, disponibles para su evaluación en Colombia. Corporación Colombiana de Investigación Agropecuaria (Corpoica)-La Selva. Bol. Div. no. 7. p. 10 - 13. [ Links ]
Erig, A; Rossi, A.; y Luces, G. 2002. 6-benzilaminopurina e ácido indolbutírico na multiplicação in vitro da amoreira preta (Rubus idaeus L.) cv. Tupy. Ciência Rural 32(5):765 - 770. [ Links ]
Marulanda, M.; Carvajalino, M.; y Vento H. 2000. Establecimiento y multiplicación in vitro de plantas seleccionadas de Rubus glaucus Benth. para el departamento de Risaralda (Colombia). Actual. Biol. 22(73):121 - 129. [ Links ]
Muñoz, I. y Reyes, H. 2006. Efecto de reguladores de crecimiento, L-cisteína y ácido ascórbico en el cultivo in vitro de mora de Castilla (Rubus glaucus Benth.). Tesis de grado. Universidad Nacional Agraria, Managua, Nicaragua. 27 p. [ Links ]
Najaf-Abadi, J. y Hamidoghli, Y. 2009. Micropropagation of thornless trailing blackberry (Rubus sp.) by axillary bud explants. Aust. J. Crop Sci. 3(4):191 - 194. [ Links ]
Pérez, J.; Alvarado, Y.; Gómez, R.; Jiménez, E.; y Orellana., P. 1998. Propagación y mejora genética de plantas por biotecnología. Santa Clara, Cuba. Instituto de biotecnología de las plantas. p. 105 - 116. [ Links ]
Statgraphics Centurion. 2009. Versión XVI. StatPoint Technologies, Inc. Warrenton, U.S.A. [ Links ]
Tafur, R.; Toro, J.; Perfetti, J.; Ruiz, D.; y Morales, J. 2006. Plan Frutícola Nacional (PFN). Ministerio de Agricultura y Desarrollo Rural, Fondo Nacional de Fomento Hortofrutícola, Asohofrucol, SAG. 43 p. [ Links ]
Torres, A. C.; Teixeira, A.; y Campos, M. 1996. Medio de cultivo. Centro Brasileiro Argentino de Biotecnología. Brasilia. 21 p. [ Links ]
Villa, F.; Gomes, A.; Salles, L.; y Pasqual, M. 2005. Multiplicação In vitro da amoreira-preta 'Ebano' em diferentes concentrações de meio MS e BAP. Ciência e Agrotecnologia 29(3):582 - 589. [ Links ]













