Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.61 no.1 Palmira Jan./Mar. 2012
1Ingeniero Agrónomo, M.Sc. Coordinador del Laboratorio Cultivo de Tejidos Vegetales. Subdirección de Ecosistemas, Corporación Autónoma Regional del Centro de Antioquia (Corantioquia), A.A. 95400, Medellín, Colombia. Tel.: (+57-4) 4938888. 2Ingeniera Agrónoma M.Sc. Docente jubilada de la Universidad Nacional de Colombia, sede Medellín.
*Autor para correspondencia: odquinte@unal.edu.co; †sjaramal@unal.edu.co
Embriones inmaduros de cedro negro (Juglans neotropica) (Juglandaceae) con 16 y 20 semanas de desarrollo fueron removidos asépticamente de los frutos y sembrados durante 60 días en los medios de cultivo MS (Murashige y Skoog, 1962), WPM (Lloyd y McCown, 1980) y DKW (Driver y Kuniyuki, 1984), sin reguladores de crecimiento. Se observó que embriones con 16 semanas de desarrollo no germinaron en los tres medios de cultivo; por el contrario, los embriones con 20 semanas de desarrollo presentaron una germinación de 100%. Se encontró un marcado efecto del medio en el crecimiento de los embriones, siendo el medio MS mejor (P < 0.05) que los medios DKW y WPM, debido a que en él los embriones presentaron mayor altura y proporción tallo/raíz para la obtención de plántulas completas.
Palabra clave: Cedro negro, cultivo de embriones, cultivo in vitro, embriones vegetales, germinación, Juglans neotropica, medio de cultivo, nogal, rescate.
Immature embryos of Juglans neotropica (Juglandaceae) with 16 and 20 weeks of development were aseptically removed from the fruits and placed in different culture media MS (Murashige and Skoog, 1962), WPM (Lloyd and McCown, 1980) y DKW (Driver and Kuniyuki, 1984) without growth regulators for 60 days. It was observed that embryos with 16 weeks of development did not germinate in any of the three culture media. The embryos with 20 weeks of development germinated 100% in the three culture media. It was found a marked effect of the culture media on the growth of the embryos, the MS medium was significantly better than the DKW and WPM medium (P < 0.05), due to the fact that in MS medium embryos had the highest height and a better proportion of stem/root to obtain complete plantlets. After this, seedlings were adapted to environmental conditions (greenhouse).
Key words: Black cedar, culture media, embryo culture, germination, in vitro culture, Juglans neotropica, plant embryos, rescue, walnut.
El cedro negro (Juglans neotropica Diels), especie forestal de los bosques alto andinos de Colombia, ha sufrido las consecuencias de la deforestación y la desaparición progresiva en algunas zonas por la expansión de las fronteras ganadera y agrícola (IAvH, 1998). Actualmente las poblaciones naturales de esta especie se hallan en peligro de extinción debido a la intensiva explotación de su madera la cual es usada en la construcción de mobiliario lujoso (Cárdenas y Salinas, 2006).
Desde 1999 la Corporación Autónoma Regional del Centro de Antioquia (Corantioquia) incluyó la especie J. neotropica como prioritaria para conservación e inició un proyecto de búsqueda y selección de árboles semilleros, que permitieran su propagación en condiciones de vivero con el fin de favorecer su recuperación ex situ y uso en los programas de fomento para la reforestación en su jurisdicción (Gómez y Toro, 2007); no obstante la propagación sexual de la especie en condiciones de vivero tiene entre sus limitantes: una baja producción de semillas por árbol en condiciones naturales causada por la pérdida de frutos durante el desarrollo y la dificultad de conservar los pocos genotipos en condiciones silvestres, la semilla tiene latencia natural, la cual produce baja uniformidad en la germinación en condiciones de vivero (Gómez y Toro, 2007).
En relación con lo anterior, Atwater (1980) mencionó que el principal bloqueo en la germinación del J. neotropica se asocia con la retención de inhibidores, los cuales están contenidos en la testa que es permeable al agua y semi o impermeable a algunos químicos o gases, la cual, además, ejerce resistencia mecánica contra el desarrollo del embrión. López (1997), menciona en su revisión sobre el tema, que el grado de lignificación de la testa está relacionado con la latencia que limita la cantidad de oxígeno dentro de la semilla, lo que lleva a la producción de sustancias inhibidoras del crecimiento en los tejidos embriogénicos. Por su parte, Ospina et al. (2003) añaden que los altos contenidos de aceites en los cotiledones, disminuyen la capacidad y uniformidad de germinación, sobre todo en condiciones de alta temperatura.
Debido a este problema en la germinación, se han evaluado diferentes tratamientos pregerminativos, entre los cuales están la imprimación y la estratificación. Según López y Piedrahíta (1999), se destaca la combinación de ambos tratamientos al utilizar la imprimación por quince días, seguida de 60 días de estratificación, ensayo en el que se alcanzó un 30.8% de germinación y una velocidad de germinación de 40 días (inicio de la germinación) con respecto al grupo de semillas utilizadas en el tratamiento control, en el cual se obtuvieron un 18% de germinación y 95 días para el inicio de la germinación, al cabo de 180 días de evaluación. En otro estudio se encontró una incidencia favorable de la estratificación por 40 días entre 20- 33°C, en la cual se lograron porcentajes de germinación del 80% y 24 días para el inicio de la germinación (Gómez, 2002).
Las técnicas de rescate y multiplicación de embriones in vitro son una solución alternativa complementaria para el sector forestal en el corto plazo. Así, se ha demostrado que estas técnicas son importantes en los programas de protección y conservación de especies que presentan dificultades de propagación sexual, viabilidad, escasez de semillas, cruzamientos interespecíficos, latencia prolongada y problemas de recalcitrancia (Shibu y Gillespie, 1998; Benson, 2000; Azofeifa, 2009).
La técnica también ha servido para evitar la presencia de contaminantes endógenos y la liberación de compuestos fenólicos, entre los que se incluye el aleloquímico juglona que interfiere con el crecimiento celular de Juglans spp. (Rietveld, 1983). Evidencias de estas dificultades en el establecimiento y micropropagación de este género son los trabajos de Cornu y Jay-Allemand (1989), Revilla et al. (1989), Leslie y McGranahan (1992), Pijut (1997), Cruz y Cruz (2003), Ríos et al. (2007). Por otra parte, el cultivo in vitro de embriones de Juglans ha facilitado el establecimiento y la posterior micropropagación de J. nigra (Heile–Sudholt et al., 1986), J. regia y cruces interespecíficos (Jay- Allemand y Cornu, 1986; Scaltsoyiannes et al., 1997; López, 2004; Bosela y Michler 2008).
Un aspecto importante de varios trabajos in vitro realizados con embriones inmaduros y maduros del género Juglans, es el marcado efecto del medio de cultivo y de los reguladores de crecimiento vegetal sobre la germinación. En J. regia se han observado diferentes respuestas; así, Rodríguez (1982) en un primer trabajo usó el medio K(h), y en otro cultivar de la misma especie utilizó el medio MS (Rodríguez et al., 1989). Jay-Allemand (1982) en la misma especie utilizó inicialmente el medio Knop a la mitad de la concentración y posteriormente, el medio Miller (MI). Cossio y Minotta (1983) después de comparar ocho diferentes combinaciones salinas nutritivas en J. regia, concluyeron que el medio MS fue el más adecuado para el desarrollo y crecimiento de la especie. Fernández et al. (2000) estimularon el crecimiento de embriones de J. regia en medio MS líquido suplementado con 5 mg/lt de BA durante 7 días y luego en el mismo medio sin hormona. En forma paralela, Kaur et al. (2006) al evaluar diferentes reguladores de crecimiento (BAP, Kinetina y GA3) en el medio MS con cinco cultivares de J. regia, sólo obtuvieron 66% de germinación con el mejor de los tratamientos (MS, Kin 0.5 mg/lt, BAP 0.5 mg/lt y GA3 2 mg/lt). Sánchez et al. (2006) encontraron diferencias significativas en el porcentaje de germinación de embriones provenientes de un cultivar de J. regia, después de evaluar los medios WPM, MS, DKW y NGE libres de reguladores de crecimiento. El porcentaje más alto de germinación fue obtenido en WPM (81%), seguido de los medios NGE (62%), DKW (54%) y MS (27%), además, observaron la liberación de sustancias fenólicas y el oscurecimiento de los embriones en el medio DKW.
Ante la diversidad de resultados observados en la propagación del género Juglans, surge la necesidad de estandarizar las condiciones de cultivo in vitro para cedro negro (J. neotropica). Por tanto, el objetivo de este trabajo fue evaluar la respuesta de embriones extraídos de frutos inmaduros de esta especie cultivados in vitro en tres medios diferentes, buscando reducir la problemática en su propagación.
Obtención de embriones
Los embriones de cedro negro (J. neotropica) provinieron de una fuente semillera previamente identificada por Corantioquia en el municipio de Olaya, situado a 2000 m.s.n.m. (06° 38' N, 75° 45' O), con una precipitación mayor de 1900 mm y temperatura media de 17°C (Gómez, 2003). La investigación se realizó en el Laboratorio de Cultivo de Tejidos Vegetales de la Estación Biodiversidad de Corantioquia, ubicado en el corregimiento de Santa Elena, al oriente del municipio de Medellín, el cual se encuentra a 2400 m.s.n.m. y una temperatura media anual de 17°C, condiciones pertenecientes a la zona de vida bosque húmedo montano bajo (bh-MB) (Holdridge, 1967). Los frutos inmaduros fueron recolectados del árbol cada cuatro semanas hasta la semana 24, después de la polinización de la flor. La superficie de los frutos de cuatro, ocho y doce semanas de desarrollo fue desinfectada con hipoclorito de sodio al 2.5% (v/v) durante 20 minutos y lavada con abundante agua estéril por diez minutos. En los frutos de 16, 20 y 24 semanas de desarrollo se removieron el epicarpo y el mesocarpo con una navaja antes de proceder a lavar el endocarpo (testa) con agua corriente. A continuación, este último fue desinfectado en cabina de flujo laminar sumergiendo las semillas en etanol a 90% (v/v) y flameando tres veces.
Posteriormente, los frutos con endocarpo endurecido (16-24 semanas de desarrollo) se abrieron ejerciendo presión con una prensa metálica manual sobre la cicatriz de unión del pedúnculo para extraer los embriones y proceder a sembrarlos en medios MS (Murashige y Skoog, 1962), WPM (Lloyd y McCown, 1980) y DKW (Driver y Kuniyuki, 1984) (Cuadro 1). Cada medio fue suplementado con 0.1 mg/lt de tiamina HCl, 100 mg/lt de mio-inositol, 2 mg/lt de glicina, 0.5 mg/lt de piridoxina y ácido nicotínico, sacarosa 3% (p/v) (Cuadro 1). El pH de los medios fue ajustado a 5.7 y se adicionó Phytagel 0.2% (p/v) antes de dispensarlos en frascos de vidrio de 128 cc, los cuales fueron esterilizados a 121 °C por 30 min. Todos los cultivos fueron incubados en oscuridad por 15 días para continuar su crecimiento por 45 días, con luz suministrada por bombillas luz blanca fluorescente de 20 Watts, con fotoperiodo de 12/12 h y una temperatura de 22 ± 1 °C.
Análisis de datos
Después de sesenta días de cultivo de los embriones inmaduros se determinaron los porcentajes de germinación in vitro, las longitudes del tallo y de la raíz, y se calculó la relación tallo/raíz de cada plántula en los tres medios de cultivo. Los tratamientos (medio de cultivo) se dispusieron en un diseño completamente al azar, con diez repeticiones (embriones) y se realizaron análisis de varianza para cada variable, seguido de la prueba de Tukey cuando se detectaron diferencias (P < 0.05). Se calcularon los coeficientes de Pearson para determinar el efecto del contenido total de nitrógeno y la relación NO3-/NH4+ sobre la longitud del tallo y la relación tallo/raíz. Todos los análisis se efectuaron con el programa Statistica versión 7.1 (StatSoft, 2005).
Adaptación de las plántulas
Después de sesenta días de crecimiento in vitro, las plántulas fueron removidas de los medios de cultivo y las raíces lavadas con agua destilada. A continuación cada plántula se sembró en forma individual en vasos plásticos de doce onzas de capacidad conteniendo una mezcla estéril de suelo y arena en proporción (2:1), los cuales fueron cubiertos con vasos similares a los anteriores pero transparentes para evitar la deshidratación. Las plántulas, una vez sembradas, se asperjaron semanalmente con medio MS diluido a 25% de la concentración original, hasta completar cuatro aplicaciones. Esta fase se realizó en invernadero cubierto con tela polisombra de 65% de sombrío en la parte superior y laterales en vidrio. Las plántulas permanecieron durante un mes en estas condiciones con un régimen de luz natural y temperatura de 23 ± 1 °C. Después de treinta días se hicieron perforaciones en la parte superior de los vasos para favorecer la adaptación de las plantas. La finalización de la adaptación se determinó cuando las plántulas formaron una o dos hojas nuevas (90 días).
Obtención de los embriones
Durante el seguimiento del desarrollo de los frutos de J. neotropica para la obtención de los embriones se observó que los inmaduros recolectados de cuatro, ocho y doce semanas de desarrollo no tenían aún formado el embrión. A partir de la semana 16 los frutos tenían embrión formado y fueron utilizados para el montaje de los experimentos, al igual que aquellos con 20 semanas de desarrollo; los embriones de estos frutos inmaduros se caracterizaron por su color blanco nacarado. Según López y Piedrahíta (1999) y Gómez (2002) las semillas con 24 semanas de desarrollo provienen de frutos que ya han alcanzado la madurez fisiológica y son aptas para iniciar tratamientos pregerminativos que permitan la propagación sexual convencional.
Siembra y germinación
Los embriones inmaduros provenientes de frutos de dieciséis semanas no se desarrollaron en los medios in vitro del estudio y algunos de ellos se necrosaron o permanecieron quiescentes después de 30 días de cultivo. Por el contrario, los embriones de frutos inmaduros con 20 semanas de desarrollo iniciaron la germinación entre los días 5 y 7 después de sembrados en todos los medios de cultivo, alcanzando después de 15 días de cultivo el 100% de germinación (Foto 1), estos valores son superiores a la potencia germinativa y velocidad de germinación reportados por López y Piedrahíta (1999) y Gómez, (2002). Estos resultados son para tener en cuenta, más aun cuando se trata de propagar una especie vulnerable a la extinción, cuya semilla requiere de prolongados tratamientos pre-germinativos (40-60 días) para romper la latencia natural que presenta, demostrando en parte que el principal bloqueo que tiene la semilla para germinar se encuentra asociado a la testa.
No se observó oscurecimiento en el medio de cultivo, el cual es causado por la liberación de exudados tóxicos del explante, ni la formación de callo en las plántulas como se ha encontrado en J. nigra (Heile-Sudholt et al., 1986), en cultivares de J. regia (Jay-Allemand y Cornu, 1986, Sánchez et al., 2003; Sánchez et al., 2006) y en híbridos de estas especies (Cornu y Jay-Allemand, 1989). En los medios evaluados se presentó 100% de germinación de embriones inmaduros de J. neotropica (Foto 1b), en contraste con lo encontrado en otros estudios con J. regia (Sánchez et al., 2003; Sánchez et al., 2006; Toosi y Dilmagani, 2010).
Los resultados mostraron diferencias (P < 0.05) entre los medios de cultivo sobre el crecimiento y desarrollo de los embriones después de 60 días (Cuadro 2). Los embriones sembrados en medio MS presentaron la mayor longitud de tallo y la mejor relación o conformación de plántula (tallo/raíz) en comparación con los establecidos en los medios DKW y WPM. Por otra parte, la longitud de la raíz fue diferente (P < 0.05) entre los medios DKW y MS con respecto al medio WPM. En el mismo Cuadro se observa que los embriones que crecieron en los medios DKW y WPM se caracterizaron por una mayor longitud de raíz (dos y cinco veces, respectivamente) con respecto al tallo (Cuadro 2).
La fase de aclimatización se inició después de sesenta días con las plántulas que crecieron en medio MS, mientras que los embriones que germinaron en medios DKW y WPM debieron ser resembrados una o dos veces más en sus respectivos medios de cultivo hasta alcanzar un mayor tamaño después de 120-150 días, que permitiera iniciar su adaptación ex vitro. Esto significa una reducción de dos o tres meses en el proceso de establecimiento in vitro y un menor gasto de medios de cultivo, cuando se utiliza el medio MS.
Los macronutrientes son esenciales para el crecimiento de explantes de Juglans (Amiri, 2004), lo que se confirmó en este estudio con J. neotropica en medio MS rico en altas concentraciones salinas, seguido del medio DKW; en contraste con el medio WPM que no tiene la suficiente concentración de nitrógeno para mantener el crecimiento de los embriones (ver Cuadro 2). Resultados similares se encontraron con medios MS y DKW, en J. regia (Revilla et al., 1989; Fernández et al., 2000; Saadat y Hennerty, 2002; Kaur et al., 2006) y en J. nigra (Bosela y Michler, 2008).
Uno de los nutrientes más importantes en el cultivo in vitro es la cantidad de nitrógeno total en el medio de cultivo, así como la relación nitrógeno oxidado (NO3-)/nitrógeno reducido (NH4+). Los resultados de varias investigaciones sugieren que en los medios de cultivo es más importante la relación de las fuentes de nitrógeno que la concentración de nitrógeno total en el medio. En este estudio se realizaron los cálculos del coeficiente de correlación de Pearson (r) para cada una de las variables longitud del tallo, longitud de la raíz y relación tallo/raíz con los contenidos de nitrógeno total y las relaciones iónicas (NO3-)/ (NH4+) (Cuadro 3).
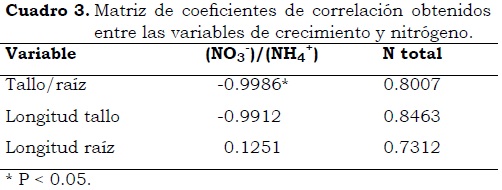
Se encontraron valores de correlación cercanos a 1, para la relación tallo/raíz y la longitud del tallo con las relaciones iónicas (NO3-)/(NH4+) que las obtenidas con el contenido de nitrógeno total de los medios de cultivo evaluados, pero solo se encontró causalidad con P<0.05 para las plántulas que mostraron un mejor crecimiento proporcional (tallo/raíz) en el medio MS seguido del medio DKW y WPM en sentido negativo (Figura 1), lo que se ajusta con las observaciones realizadas por George et al. (2007), quienes afirman que las plántulas in vitro responden mejor a la relación de ambos tipos de iones (NO3-)/ (NH4+) que al contenido total de nitrógeno.
Aclimatización ex vitro de las plántulas
La adaptación de las plántulas en condiciones ex vitro se hizo evidente al observar la formación de hojas nuevas y el crecimiento de las raíces (color blanco-crema). Después del trasplante las plántulas permanecieron cubiertas durante 30 días para evitar la deshidratación. Posteriormente, se redujo la humedad durante 120 días hasta condiciones de vivero. Una característica del material vegetal producido por la técnica de rescate de embriones es la homogeneidad de crecimiento en condiciones de invernadero (Foto 2).
- Este estudio reporta por primera vez la obtención de plantas de J. neotropica a partir de embriones procedentes de frutos inmaduros con 20 semanas de desarrollo. El medio MS (Murashige y Skoog, 1962) ofreció el mejor soporte para el crecimiento y desarrollo de las plántulas in vitro listas para el proceso de adaptación ex vitro, con una reducción en tiempo equivalente a dos y tres meses con respecto a los medios DKW y WPM. Por tanto, MS puede ser considerado como el medio estándar para la siembra de embriones inmaduros y para la propagación de esta especie.
- La siembra de embriones inmaduros en condiciones in vitro evitó los problemas de latencia y de tratamientos pregerminativos que presentan las semillas en condiciones naturales para su propagación en vivero.
Al Ingeniero Forestal Juan Lázaro Toro Murillo, Jefe del Proyecto Conservación y Manejo Sostenible de los Bosques, la Flora y la Fauna, adscrito a la Subdirección de Ecosistemas de la Corporación Autónoma Regional del Centro de Antioquia (CORANTIOQUIA) por la financiación de la investigación y la oportunidad de participar en su grupo de trabajo. Este artículo hace parte de la Tesis de Maestría Multiplicación in vitro de Cedro Negro (Juglans neotropica Diels).
Amiri, M. E. 2004. Effect of mineral concentration on tissue-cultured walnut (Juglans regia var. Zeiabadi) growth. Acta Hortic. 05:383 - 386. [ Links ]
Atwater, B. 1980. Germination dormancy and morphology of seeds of herbaceous. Seed Science and Technology. 8: 523-573. [ Links ]
Azofeifa, A. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agron. Mesoamer. 20(1):153 - 175. [ Links ]
Benson, E. E. 2000. Special symposium: in vitro plant recalcitrance, an introduction. In vitro Cell Dev. Biol Plant. 36:141 - 148. [ Links ]
Bosela M. J. y Michler C. H. 2008. Medias effects on black walnut (Juglans nigra L.) shoot culture growth in vitro: evaluation of multiple nutrient formulations and cytokinin types. In Vitro Cell Dev. Biol. Plant. 44:316 - 329. [ Links ]
Cárdenas, D. y Salinas, R. (eds.). 2006. Nogal: Juglans neotropica. Libro rojo de plantas de Colombia. Primera parte: Especies maderables amenazadas. La serie de Libros Rojos de Especies Amenazadas de Colombia. Instituto Amazónico de Investigaciones de Científicas Sinchi, Ministerio de Ambiente, Vivienda y Desarrollo Territorial. p. 162 - 167. [ Links ]
Cornu, D. y Jay-Allemand, C. 1989. Micropropagation of hybrid walnut trees (Juglans nigra x Juglans regia) through culture and multiplication of embryos. Ann. Sci. For. 113 - 116. [ Links ]
Cossio, F. y Minotta, G. 1983. Prove preliminary di coltura in vitro di embrioni isolate di noce (Juglans regia L.) e conformo tra diferente combinación di sali minerali. Riv. Ortoflorofrutt It. 67:287 - 298. [ Links ]
Cruz, D. Z. y Cruz, D. M. 2003. Inducción de brotación in vitro vía organogénesis de Juglans neotropica Diels. Trabajo de grado. Programa de Biología, Facultad de Ciencias Básicas, Universidad del Tolima. [ Links ]
Driver, J. A. y Kuniyuki, A. H. 1984. In vitro propagation of Paradox Walnut rootstock. HortSci. 19(4):507 - 509. [ Links ]
Fernández, H.; Pérez, C.; y Sánchez-Tames, R. 2000. Modulation of the morphogenic potential of the embryonic axis of Juglans regia by cultural conditions. Plant Growth Regul. 30:125 - 131. [ Links ]
George, E. F.; Hall, M. A.; Klerk, G.; y Springerlink. 2007. Plant propagation by tissue culture: The background. Online service. Dordrecht: Springer. 3rd. ed. vol.1 [ Links ]
Gómez, M. L. 2002. Incidencia de la estratificación y el sustrato en la germinación de semillas de Juglans neotropica. Crónica Forestal y el Medio Ambiente 17:41 - 51. [ Links ]
Gómez, M. L. 2003. Estudio fenológico de 25 especies forestales en la jurisdicción de Corantioquia. Informe Final Contrato 3881. Medellín. Corporación Autónoma Regional del Centro de Antioquia (Corantioquia). 2003. [ Links ]
Gómez, M. L. y Toro, J. L. (eds.). 2007. Cedro negro. Boletín Técnico Biodiversidad: Manejo de las semillas y propagación de diez especies forestales del Bosque Andino. Medellín. Corporación Autónoma Regional del Centro de Antioquia (Corantioquia). 1:17 - 24. [ Links ]
Heile-Sudholt, C.; Huettemann, C.; Preece, J.; Van Sambeek, J.; y Gaffney, G. 1986. In vitro embryonic axis and seedling shoot tip culture of Juglans nigra L. Plant Cell Tissue Organ. Culture. (6):189 - 197. [ Links ]
Holdridge, L. R. 1967. Life Zone Ecology. Tropical Science Center. San José, Costa Rica. 206 p. [ Links ]
IAvH (Instituto de Investigaciones de Recursos Biológicos Alexander Von-Humboldt). 1998. Enfrentar el riesgo de extinción en la flora Colombiana. Biosíntesis 6:1 - 4. [ Links ]
Jay-Allemand, C. 1982. Culture in vitro du noger (Juglans sp.). En: Etude Experimentale sur l´ensemencement d´embryons isoles et de bourgeons. Mem D, Univ Sci Tchn Languedoc, Mompelier, Fr. 1982. [ Links ]
Jay-Allemand, C. y Cornu, D. 1986. Culture in vitro d'embryons isolés de noyer commun (Juglans regia L.). Ann Sci For. 43(2):189 - 198. [ Links ]
Kaur, R.; Sharma, N.; Kumar, K.; Sharma, D. R.; y Sharma, S. D. 2006. In vitro germination of walnut (Juglans regia L.) embryos. Sci Hortic. 09:385 - 388. [ Links ]
Leslie, C. y Mcgranahan, G. 1992. Micropropagation of persian walnut (Juglans regia L.). En: Bajaj YPS (ed.). Biotechnology in agriculture and forestry, high-tech and micropropagation. 1. Springer- Verlag Berlin Heidelberg. 18:136 - 150. [ Links ]
Lloyd, G. y McCown, B. 1980. Commercially feasible micropropagation of mountain laurel (Kalmia latifolia) by use of shoot tip culture. Comb. Proc. Intl. Soc. 30:421 - 427. [ Links ]
López, J. 1997. Tratamientos pregerminativos aplicados a la semilla de cedro negro (Juglans neotropica) para reducir su periodo de germinación. (Tesis Ingeniería Forestal). Universidad Nacional de Colombia. Sede Medellín. Medellín. Antioquia, Colombia. 75 p. [ Links ]
López, J. M. 2004. Walnut tissue culture: research and field applications. En: Michler, C.H. et al. (eds.). Black walnut in a new century proceedings of the 6th Walnut Council research symposium. St. Paul, MN: U.S. Department of Agriculture, Forest Service, North Central Research Station. Citado 21 de septiembre de 2008. 2004; 146 -152. Disponible en: http://www.ncrs.fs.fed.us. [ Links ]
López, J. y Piedrahíta, E. 1999. Tratamientos pregerminativos aplicados a la semilla de cedro negro (Juglans neotropica) para reducir su periodo de germinación. En: Arboleda, O. (ed.). Segundo simposio sobre avances en la producción de semillas forestales en América Latina. 18-22 de Octubre. CATIE. Santo Domingo, República Dominicana. p. 191 - 199. [ Links ]
Murashige, T. y Skoog, F. 1962. A revised medium for rapid growth and bio-assays with tobacco tissue culture. Physiol. Plant. 15:473 - 497. [ Links ]
Ospina, C.; Hernández, J.; Patiño, J. y Salazar, J. 2003. El Cedro Negro: una especie promisoria de la zona cafetera. Chinchiná-Caldas. Federación Nacional de Cafeteros de Colombia. CENICAFE. Boletín Técnico No. 25; p. 40. ISSN 0120-047X. [ Links ]
Pijut, P. M. 1997. Micropropagation of Juglans cinerea L. (Butternut). En: Bajaj, YPS (ed.). Biotechnology in agriculture and forestry, high-tech and micropropagation V. Berlin Heidelberg: Springer- Verlag. 39:345 - 357. [ Links ]
Revilla, M. A.; Majada, J.; y Rodríguez, R. 1989. Walnut (Juglans regia L.) micropropagation. Ann. Sci. For. 46:149 - 151. [ Links ]
Rietveld, W. J. 1983. Allelopathic effects of juglone on germination and growth of several herbaceous and woody species. J. Chem. Ecol. 9(2):295 - 308. [ Links ]
Ríos L. D.; Sánchez-Olate, M.; Aviles, F.; Materan, M. E.; Uribe, M.; Hasbún, R.; Y Rodríguez, R. 2007. Micropropagación de Juglans regia L. En: Jain, S.M. y Häggman, H. (eds.). Protocols for micropropagation of woody trees and fruits. Dordrech , Netherlands. Springer. p. 381 - 390. [ Links ]
Rodríguez, R. 1982. Stimulation of multiple shootbud formation in walnuts seeds. HortSci. 17(4):592. [ Links ]
Rodríguez, R.; Revilla, A.; Albuerne, M.; y Pérez, C. 1989. Walnut (Juglans spp). En: Bajaj YPS. (ed.). Biotechnology in agriculture and forestry Trees. II. Berlin Heidelberg New York: Springer. 5:99 - 126. [ Links ]
Saadat, Y. A y Hennerty, M. J. 2002. Factors affecting the shoot multiplication of Persian walnut (Juglans regia L). Sci Hortic. 95:251 - 260. [ Links ]
Sánchez, M. A.; CosTerrer, J.; Frutos, D.; y García, L. R. 2003. Germinación y desarrollo in vitro de embriones maduros de nueces de la selección Peralta. Actas de Hortic. 39:345 - 347. [ Links ]
Sánchez, M. A.; Cos Terrer, J.; Frutos, T. D.; y García, L. R. 2006. Embryo germination and proliferation in vitro of Juglans regia L. Sci Hortic. 108(3):317 - 321. [ Links ]
Scaltsoyiannes, A.; Tsoulpha, P.; Panetsos, K. P.; y Moulalis, D. 1997. Effect of genotype on micropropagation of walnut trees (Juglans regia). Silvae Genet. 46(6):326-332. [ Links ]
Shibu, J. y Gillespie, A. R. 1998. Allelopathy in black walnut (Juglans nigra L.) alley cropping spatiotemporal variation in soil juglone in a black walnut– corn (Zea mays L.) alley cropping system in the midwestern USA. Plant Soil. 203:191 - 197. [ Links ]
Statsoft. 2005. Statistica data analysis software system [Programa de ordenador] Version 7.1. Disponible en: www.statsoft.com 2005. [ Links ]
Toosi, S. y Dilmagani, K. 2010. Proliferation of Juglans regia L. by in vitro embryo culture. J. Cell Biol. Genet. 1(1):12 - 19. Disponible en: http://www.academicjournals.org/JCBG. [ Links ]













