Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.61 no.1 Palmira Jan./Mar. 2012
1 Zootecnista. 2Zootecnista, M.Sc. (c). 3Docente, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Sede Medellín, A.A. 1779, Colombia. 4Grupo BIOGEM.
*Autor para correspondencia: jeparrasu@unal.edu.co
El destete de cerdos está asociado con múltiples factores que generan respuestas inflamatorias tempranas en órganos internos y alta incidencia de diarreas. En el Centro de Investigación San Pablo de la Universidad Nacional de Colombia sede Medellín, se evaluaron los parámetros clínicos y las lesiones en órganos internos en dieciséis cerdos destetados a veintiún días de edad, que fueron alimentados durante diez días con una dieta a base de leche. Cada uno, cinco, siete y diez días posdestete, se sacrificaron cuatro cerdos y se tomaron para estudio muestras de intestino delgado, estómago, hígado, páncreas, corazón, pulmones, riñones y bazo. Las lesiones determinadas fueron congestión, edema, y hemorragia; se asignó un valor según el grado de presentación: ausente (0), leve (1), leve-moderada (2), moderada-severa (3), severa (4). Los animales fueron pesados al destete y en el momento de sacrificio. Se encontraron diferencias (P < 0.01) en la aparición macroscópica de lesiones, peso de órganos, temperatura rectal y ganancia de peso. Los mayores valores se encontraron en el día uno posdestete y los menores en el día cinco; no obstante, para el día diez posdestete se observó una recuperación de las lesiones. La variable ocurrencia de diarreas presentó un comportamiento posdestete diferente y tendió a disminuir (P < 0.01).
Palabra clave: Cerdos, destete, diarreas, fiebre.
To evaluate the effect of early weaning on clinical parameters, development and occurrence of lesions in organs of systemic importance, and weight gain in pigs evaluations were carried out. The experiment was conducted in the San Pablo Production Research Center of the Universidad Nacional de Colombia (Medellín). We used 16 weaned pigs at 21 days of age. The animals were fed for 10 days with a basal diet (milk). Four pigs were slaughtered on days 1, 5, 7 and 10 post-weaning and samples of intestine, stomach, liver, pancreas, heart, lungs, kidneys and spleen were extracted. Congestion, edema, and hemorrhage were the lesions determined; a value according to the degree of presentation was assigned: absent (0), mild (1), mild-moderate (2), moderate-severe (3), severe (4). The animals were weighed on weaning day, and the day of slaughter. Statistical difference (P < 0.01) was found in macroscopic appearance of lesions, organ weight, rectal temperature, and weight gain. On the first day of post-weaning the highest values were observed. On the other hand, the lowest values were observed in the day fifth. However by day 10 after weaning an increase of the injuries was observed. The variable occurrence of diarrhea showed an opposite performance (P < 0.01). Weaning is associated with multiple factors leading to the early inflammatory response and the high incidence of diarrhea during post-weaning period.
Key words: Diarrheas, fever, pigs, weaning.
Además de sus funciones digestivas, la pared intestinal desempeña un papel activo en la defensa corporal, impidiendo el paso de bacterias y endotoxinas del tracto gastrointestinal a la circulación sistémica (Pitman y Blumberg, 2000). Sin embargo, el intestino contiene grandes cantidades de antígenos (inocuos) de alimentos y de bacterias comensales y está sujeto a infecciones por patógenos. Debido a lo anterior, las células epiteliales del intestino tienen la capacidad de actuar como receptores para el sistema inmune (Eckmann et al., 1995) y de respuesta a organismos patógenos, pero no a los antígenos inocuos (Pluske et al., 1997).
Después del destete, especialmente si se realiza en forma intempestiva, se presentan varias manifestaciones de estrés caracterizadas por un período breve de ayuno, cambios en la población microbiana intestinal y activación de la respuesta inmune adaptativa (Lallès et al., 2004). El consumo de una nueva ración sólida después del destete, resulta en la alteración de la disponibilidad del sustrato específico para los microorganismos y en un cambio gastro-fisiológico que favorece el aumento de la flora patógena en todos los segmentos del tracto digestivo. Debido a lo anterior, el destete provoca la disminución de la población microbiana de los lactobacilos predominante en el estómago y en el intestino y el aumento de la población de Escherichia coli, una bacteria que libera productos proinflamatorios como el lipopolisacárido (LPS) (Amador et al., 2007).
El LPS es un agente causante de sepsis reconocido por cualquier hospedero mamífero como una entidad patogénica importante (Pitman y Blumberg, 2000; García-Herrera et al., 2003) que puede activar la respuesta inmune innata y adquirida a través de la producción de pequeños péptidos llamados citoquinas (Pié et al., 2004). Las citoquinas juegan un papel patofisiológico dual como mediadores químicos de la inflamación y como moléculas inmunoreguladoras importantes en la defensa contra infecciones bacterianas y en las manifestaciones clínicas de la enfermedad (García-Herrera et al., 2004). Además, estas citoquinas provocan cambios importantes en la estructura y en la capacidad funcional del intestino.
Debido a que el conocimiento de la relación entre la respuesta inmune y las diferentes manifestaciones de estrés en los animales domésticos es escaso, se considera necesario desarrollar un modelo experimental que permita evaluar los efectos del destete temprano sobre los parámetros clínicos, el desarrollo y presentación de lesiones en órganos de importancia sistémica y la ganancia de peso vivo en cerdos.
Consideraciones éticas
Todos los procedimientos experimentales fueron realizados de acuerdo con las guías propuestas por la International Guiding Principles for Biomedical Research Involving Animals (CIOMS, 1985). Esta investigación fue avalada por el Comité de ética en la Experimentación Animal de la Universidad Nacional de Colombia, sede Medellín (CEMED 001, del 26 de enero de 2009).
Localización
El trabajo de campo se realizó en el Centro de Investigación San Pablo, perteneciente a la Universidad Nacional de Colombia, sede Medellín, ubicado en el paraje El Tablacito, municipio de Rionegro, a 2100 m.s.n.m. con una temperatura entre 12 y 18 °C, que corresponde a una zona de vida bosque muy húmedo montano bajo (bmh-MB) (Holdridge, 1967).
Animales
Se utilizaron dieciséis cerdos resultantes de un cruce alterno Duroc x Landrace, destetados exactamente a los veintiún días de edad, con un peso de 6.5 ± 0.5 kg. Fueron luego alojados en grupos de cuatro animales en jaulas provistas de comedero de canoa y bebedero de chupón, las cuales fueron ubicadas en un cuarto con temperatura controlada a 26 ± 3 °C. Los animales dispusieron de agua a voluntad durante el tiempo experimental y no recibieron alimento sólido en la lactancia.
Dieta
La dieta basal ofrecida a los lechones estuvo compuesta de leche en polvo y algunos de sus derivados; además, fue enriquecida con vitaminas, minerales y lisina HCL. La dieta se balanceó para cumplir con los mínimos nutricionales requeridos y propuestos por el NRC (1998) (Cuadro 1 y Cuadro 2). La cantidad de alimento ofrecido por jaula fue de 300 g/día; sin embargo, se suministró alimento adicional cuando los animales lo requirieron. La dieta experimental se proporcionó desde el día uno hasta el día diez posdestete.


Evaluación de las manifestaciones clínicas
Para no incluir animales previamente enfermos o con presencia de diarreas, el monitoreo clínico y paraclínico de los animales se realizó antes de iniciar el experimento. Dicho monitoreo se hizo diariamente (tres veces al día) durante toda la investigación. En el tiempo experimental se registraron todas las alteraciones que presentaron los animales. La temperatura rectal se midió diariamente en las primeras horas de la mañana (08:00 h) con un termómetro rectal de mercurio, el cual era introducido durante 60 segundos; como temperatura de referencia se tenía 38°C. La consistencia de las heces se midió diariamente por observaciones en los animales durante la toma de temperatura empleando una escala (0 - 3), en que 0 indicaba heces normales (ausencia de diarrea); 1, diarrea ligera, pastosa; 2, diarrea moderada, semiliquida y 3, diarrea severa, muy líquida. Las calificaciones diarias se sumaron durante el periodo experimental para calcular el índice de severidad de diarrea (Reis de Souza et al., 2010), según la ecuación siguiente:
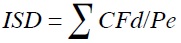
donde:
ISD = índice de severidad de la diarrea.
CFd = Calificación de la consistencia fecal diaria.
Pe = Periodo experimental (días).
Extracción de órganos
En forma escalonada con intervalos de cuatro días, se sacrificaron dieciséis cerdos. El día uno, o inicial de destete, se sacrificaron cuatro lechones que representaron el grupo de referencia para verificar el estado general de salud y sirvieron para la evaluación macroscópica del estado de los órganos antes de suministrar la dieta experimental. Los órganos evaluados fueron estómago, intestino delgado, hígado, páncreas, corazón, pulmones, riñones y bazo. Los días cinco, siete y diez posdestete se sacrificaron igualmente cuatro cerdos cada vez. Todos fueron sacrificados 2.5 horas después de su última comida. Los animales se sedaron por inhalación de dióxido de carbono durante tres minutos y fueron sacrificados por exanguinación, mediante sección de la vena yugular.
Después del sacrificio, los cerdos se colocaron en posición decúbito dorsal. Para la apertura de las cavidades se hizo una incisión hasta la entrada del tórax y se dejó al descubierto toda la caja torácica. Siguiendo el corte, se procedió a la apertura de la cavidad abdominal hasta el pubis. A continuación, se realizó una ligadura en el cardias y se extrajeron el hígado, el estómago y el intestino delgado; posteriormente, los riñones junto con la vejiga urinaria y el aparato genital. Para el estudio de los órganos torácicos se extrajeron conjuntamente los pulmones y el corazón (Segalés y Domingo, 2003). Finalmente, los órganos extraídos fueron lavados con solución salina fría (Reis de Souza et al., 2005).
Procesamiento histotécnico
Las muestras obtenidas de los diferentes órganos fueron procesadas y analizadas en el Laboratorio de Patología Animal de la Universidad de Antioquia. Las muestras conservadas fueron incluidas en parafina, cortadas a 4 µm de espesor y coloreadas con Hematoxilina- Eosina de acuerdo con el método reportado por Nabuurs et al. (1993). En cada lámina se montaron tres cortes transversales.
Evaluación microscópica de lesiones en órganos
Las lesiones determinadas en cada corte histológico fueron congestión, edema y hemorragia; y se les asignó valor teniendo en cuenta el grado de presentación, así: ausente (0), leve (1), leve a moderada (2), moderada a severa (3), severa (4). Posteriormente, se calculó el porcentaje de presentación de lesiones totales en cada órgano.
Estimación de la ganancia de peso
Todos los animales utilizados en el experimento (dieciséis cerdos) fueron pesados el día del destete (día uno) y el día final del experimento (día del sacrificio), y la variación del peso fue expresada como un porcentaje del peso inicial.
Diseño experimental
El experimento se realizó según un diseño completamente al azar, para un total de cuatro repeticiones por tratamiento (edad posdestete). El análisis estadístico de los datos obtenidos se hizo utilizando el procedimiento de modelos lineales generales de SAS (2006). Para realizar la comparación de promedios entre tratamientos se utilizó una prueba de Duncan (P < 0.05).
Los lechones presentaron un buen estado de salud al momento del sacrificio, aunque algunos mostraron incrementos en la temperatura rectal por encima de los 38 °C. Durante todo el periodo experimental, no presentaron síntomas de enfermedad que causara su retiro o sacrificio inmediato. La cantidad de alimento ofrecido fue suficiente sin que se presentara rechazo o sobrantes.
La presentación general de porcentajes de lesiones para los animales que consumieron la dieta basal se puede observar en la Figura 1. Los datos obtenidos muestran que entre los días uno y cinco posdestete ocurre un incremento considerable en la presentación macroscópica de lesiones en los diferentes órganos estudiados. Con excepción de los órganos del aparato digestivo (estómago e intestino delgado) en los demás se observó una reducción en dichas lesiones a partir del día cinco posdestete, con un valor mínimo el día diez. Las lesiones más comunes en ambos órganos fueron hiperqueratosis y en los demás órganos, congestiones y hemorragias.
En la Figura 2 se observa que a partir del día uno y hasta el día cinco posdestete ocurre un incremento considerable en la presentación de diarreas; sin embargo, a partir de ese día el problema disminuye y llega a su nivel mínimo el día diez posdestete.
En este estudio se evaluó además, el efecto del destete sobre las variaciones del peso de los diferentes órganos durante los periodos de experimentación (Cuadro 3). Para todos los órganos se presentó una disminución significativa (P < 0.01) en peso vivo en cada uno de los períodos, cuyo valor más alto fue el día uno y el más bajo el día cinco posdestete. No obstante, entre los días uno y diez no se presentaron diferencias (P > 0.01) en esta variable, lo cual indica que el peso de los órganos en el día diez posdestete alcanza los obtenidos durante el día uno posdestete.
En el Cuadro 4 se observa que la temperatura corporal varió en forma significativa (P < 0.01) entre los diferentes períodos posdestete y su menor valor (38.3 °C) se alcanzó el día 10. Ello indica quea partir del día del destete ocurre un incremento de temperatura que continúa hasta el día cinco para luego disminuir el día diez.
La ganancia diaria de peso (Cuadro 4) fue diferente (P < 0.01) en los días posdestete, la cual fue más baja en el periodo cinco (-7.2), valor que indica que los lechones perdieron peso en el transcurso de la experimentación, en comparación con el peso al ingreso del experimento. Entre los días uno y diez posdestete se presentaron diferencias (P < 0.01) en esta variable; en el día diez se presenta una recuperación total que superó el peso obtenido durante el día uno posdestete.
En este trabajo se comprobó nuevamente que el destete temprano de lechones disminuye el peso de los órganos en estudio a la vez que genera la aparición de diarreas. Shan et al. (2007) demostraron que los cerdos destetados a mayores edades poseen un sistema inmune más desarrollado y complejo y un sistema digestivo caracterizado por órganos con mayor peso y capacidad funcional. Este desarrollo gastrointestinal disminuye los episodios de diarreas observados durante el período posdestete debido a que favorece el pronto consumo de alimento por parte de los cerdos (Vente-Spreeuwenberg et al., 2004), mejorando con ello el crecimiento y el desempeño del animal (Main et al., 2004).
La aparición de diarreas en los animales durante el período posdestete se debe, posiblemente, a que durante el destete se presentan varias manifestaciones de estrés (Lallès et al., 2004) caracterizadas por el cambio en la población microbiana intestinal, la presentación de signos de inflamación aguda y las reacciones alérgicas (Rodrigues et al., 2007). La inflamación intestinal asociada con el destete ocurre en varias especies animales de tipo productivo, principalmente en cerdos (Manzano et al., 2002) y está representada por atrofia severa, desequilibrio de la función inmune y liberación de mediadores inflamatorios como el TNF-a (Jiang et al., 2009; Wang et al., 2008). El incremento en la expresión del TNF-a durante la respuesta inflamatoria provoca la estimulación de cloro (Cl-) en íleon a la altura de las criptas (Burrell, 1994). El incremento en la secreción de Cl- y la disminución en la absorción de sodio (Na+) por las vellosidades intestinales están altamente relacionados con la aparición de diarreas (Berkes et al., 2003).
Además, el TNF-a altera el transporte paracelular de compuestos tóxicos hacia la circulación sistémica y los procesos de recambio celular (Manzano et al., 2002), lo que conlleva una respuesta sistémica no regulada que puede progresar a fallo orgánico múltiple (FOM). El FOM está asociado con una alta mortalidad y se caracteriza por disfunción pulmonar, cardiovascular, renal y gastrointestinal (Bertelsen et al., 2004). Por lo anterior, la aparición de lesiones y la disminución del peso de los diferentes órganos en estudio, pueden deberse a que durante la inflamación intestinal se liberan mediadores inflamatorios como el TNF-a que activa una gran variedad de rutas de señalización (Pié et al., 2004) y afectan el recambio y el crecimiento celular por estimulación de la apoptosis (Yu y Perdue, 2000).
La disminución en la tasa de crecimiento observada en este estudio después del destete en los animales que consumieron la dieta basal, puede estar asociada con las respuestas inflamatoria e inmune provocadas por el estrés del destete, como son la separación abrupta de la madre, la reubicación en nuevos grupos sociales y el cambio a un alimento sólido (Kojima et al., 2007). Durante esta fase, algunos nutrientes destinados al crecimiento y el desarrollo son utilizados por las células involucradas en dichas respuestas (Rodrigues et al., 2007). Además, las respuestas fisiológicas al estrés implican interacciones y respuestas complejas por parte de los sistemas nervioso central, endocrino e inmunológico, los cuales influyen en la salud y el bienestar animal como respuesta a las condiciones ambientales y de manejo (Davis et al., 2006).
La activación y posterior respuesta del sistema inmune a los diferentes tipos de estrés puede afectar algunas funciones productivas del animal, como el desarrollo, el crecimiento, la deposición de proteína muscular y el metabolismo de nutrientes (Williams et al., 1997). Estos cambios en el metabolismo nutricional pueden avivar la competencia entre los diferentes tipos celulares por la utilización de algunos nutrientes, específicamente aminoácidos (Le Floc'h et al., 2009).
La aparición de episodios febriles en los animales de este trabajo pudo deberse al efecto de la producción de citoquinas proinflamatorias, específicamente TNF-a, y a los factores inmunológicos que los componen, los cuales pueden estar involucrados en los procesos de desarrollo de un estado séptico y febril (Liu et al., 2008).
El destete está asociado con múltiples factores que generan la presentación de estrés en los animales y favorecen la respuesta inflamatoria temprana, provocando con ello inhibición del crecimiento de los órganos, disminución en la eficiencia productiva (representada como la ganancia de peso) y alta incidencia de diarreas durante esta etapa.
Amador, P.; Garcia-Herrera, J.; Marca, M. C.; de la Osada, J.; Acin, S.;et al. 2007. Intestinal Dgalactose transport in an endotoxemia model in the rabbit. J. Membr. Biol. 215:125 – 133. [ Links ]
Berkes, J.;Viswanathan, V. K.; Savkovic, S.D.; y Hecht, G. 2003. Intestinal epithelial responses to enteric pathogens: effects on tight junction barrier, ion transport, and inflammation. Gut.52:439 – 451. [ Links ]
Bertelsen, L. S.;Eckmann, L.; y Barrett, K. E. 2004. Prolonged interferon-exposure decreases ion transport, NKCC1, and Na+-K+-ATPase expression in human intestinal xenografts in vivo. Am. J. Physiol.Gastrointest. Liver Physiol. 286:G157 - G165. [ Links ]
Burrell, R. 1994. Human responses to bacterial endotoxin. Circ. Shock. 43:137 - 153. [ Links ]
CIOMS (Council for International Organizations of Medical Sciences). 1995. International Guiding Principles for Biomedical Research Involving Animals.Genova. p. 28. [ Links ]
Davis, M. E.; Sears, S. C.; Apple, J. K., Maxwell, C. V.; y Johnson, Z. B. 2006. Effect of weaning age and commingling after the nursery phase of pigs in a wean-to-finish facility on growth, and humoral and behavioral indicators of well-being. J. Anim. Sci. 84:743 – 756. [ Links ]
Eckmann, L.;Kagnoff, M. F.; y Fierer, J. 1995. Intestinal epithelial cells as watchdogs for the natural immune system. Trends Microbiol. 3:118 – 120. [ Links ]
García-Herrera, J.; Abad, B.; y Rodríguez-Yoldi, M. J. 2003. Effect of lipopolysaccharide on D-fructose transport across rabbit jejunum. Enflamm. Res. 52:177 – 184. [ Links ]
García-Herrera, J.; Navarro, M. A.; Marca, M. C.; Osada, J.; y Rodríguez-Yoldi, M. J. 2004. The effect of tumor necrosis factor-a on D-fructose intestinal transport in rabbits. Cytokine 25:21 - 30. [ Links ]
Holdridge, L. R. 1967. Life Zone Ecology. Tropical Science Center. San José, Costa Rica. 206 p. [ Links ]
Jiang, Y.; Sun, L. H.; Lin, Y. C.; Ma, X. Y.;Zheng C. T.;et al. 2009. Effects of dietary glycyl-glutamine on growth performance, small intestinal integrity, and immune responses of weaning piglets challenged with lipopolysaccharide. J. Anim. Sci. 87:4050 - 4056. [ Links ]
Kojima, C. J.; Carroll, J. A.; Matteri, R. L.;Touchette, K. J.; y Allee, G. L. 2007. Effects of weaning and weaning weight on neuroendocrine regulators of feed intake in pigs. J. Anim. Sci.85:2133 – 2139. [ Links ]
Lallès, J. P.; Konstantinov, S.;Rothkötter, H. J. 2004. Bases physiologiques, microbiologiques et immunitaires des troubles digestifs du sevrage chez le porcelet : données récentes dans le contexte de la suppression des antibiotiques additifs alimentaires. J. Rech. Porcine 36:139 - 150. [ Links ]
Le Floc'h, N.; LeBellego, L.; Matte, J. J.; Melchior, D.; y Sève, B. 2009. The effect of sanitary status degradation and dietary tryptophan content on growth rate and tryptophan metabolism in weaning pigs. J. Anim. Sci. 87:1686 - 1694. [ Links ]
Liu, Y.; Huang, J.; Hou, Y.; Zhu, H.; Zhao, S.; et al. 2008. Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs. Brit. J. Nutr. 100:552 – 560. [ Links ]
Main, R. G.; Dritz, S. S.; Tokach, M.D.; Goodband, R. D.; y Nelssen, J. L. 2004. Increasing weaning age improves pig performance in a multisite production system. J. Anim. Sci. 82:1499 – 1507. [ Links ]
Manzano, M.; Abadia-Molina, A. C.; Garcia-Olivares, E.; Gil, A.; y Rueda, R. 2002.Absolute counts and distribution of lymphocyte subsets in small intestine of BALB/c mice change during weaning. J. Nutr. 132:2757 – 2762. [ Links ]
Nabuurs, M. J.; Hoogendoorn, A.; Van der Molen, E. J.; Van Osta, L. M. 1993. Villus height and crypt depth in weanead and unweanead pigs, reared under various circumstances in the Netherlands. Res. Vet. Sci. 55: 78 – 84. [ Links ]
NRC (National Research Council). 1998. Nutrient Requirements of Swine. 10thed.Washington DC: National Academy Press. p. 211. [ Links ]
Pié, S.; Lallès, S. P.;Blazy, F.; Laffitte, J.; Sève, B.; et al. 2004. Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets. J. Nutr. 134:641 - 647. [ Links ]
Pitman, R. S.; y Blumberg, R. S. 2000 First line of defense: the role of the intestinal epithelium as an active component of the mucosal immune system. J. Gastroenterol. 35:805 – 814. [ Links ]
Pluske, J. R.; Hampson, D. J.; y Williams, I. H. 1997. Factors influencing the structure and function of the small intestine in weaned pigs: a review. Livest. Prod. Sci. 51:215 - 236. [ Links ]
Reis de Souza, T. C.; Guerrero, C. M.; Aguilera, B. A.; y Mariscal, L. G. 2005. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Téc.Pecu.Mex. 43:309 - 321. [ Links ]
Reis de Souza, T. C.; Mariscal, L. G.; y Escobar, G. K. 2010. Algunos factores fisiológicos y nutricionales que afectan La diarrea posdestete en lechones. Vet. Mex. 41(4):275 - 288. [ Links ]
Rodrígues, M. M.; Silva, O. D.; Taketomi, A. E.; Hernández-Blazquez, F. J. 2007. IgA production, coliforms analysis and intestinal mucosa morphology of piglets that received probiotics with viable or inactivated cells.Pesq. Vet. Bras. 27:241 - 245. [ Links ]
SAS®. SAS/STAT User's Guide. 2006. Institute Inc. Statistical Analysis Systems Institute. Version 9.1thed. Cary, NC: SAS Institute Inc. [ Links ]
Shan, T.; Wang, Y.; Wang, Y.; Liu, J.; y Xu, Z. 2007. Effect of dietary lactoferrin on the immune functions and serum iron level of weanling piglets. J.Anim.Sci.85:2140 - 2146. [ Links ]
Segalés, J.; y Domingo, M. 2003. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras. Madrid (España). BoehringerIngelheim. p. 10 - 14. [ Links ]
Vente-Spreeuwenberg, M. A.; Verdonk, J. M.; Bakker, G. C.; Beynen, A. C.; y Verstegen, M.W. 2004. Effect of dietary protein source on feed intake and small intestine morphology in newly weaned piglets. Livest. Prod. Sci.86:169 - 177. [ Links ]
Wang, J.; Chen, L.; Li, P.; Li, X.; Zhou, H.; et al. 2008. Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation. J. Nutr. 138:1025 – 1032. [ Links ]
Williams, N. H.; Stahly, T. S.; y Zimmerman, D. R. 1997. Effect of chronic immune system activation on the growth and dietary lysine needs of pigs fed from 6 to 112 kg. J. Anim. Sci. 75:2481 - 2492. [ Links ]
Yu, L. C.; y Perdue, M. H. 2000. Immunologically mediated transport of ions and macromolecules. Ann. [ Links ]













