Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.61 no.3 Palmira July/Sept. 2012
1Centro Internacional de Agricultura Tropical (CIAT), Apartado Aéreo 6713, Cali, Valle del Cauca, Colombia. 2Universidad Nacional de Colombia, sede Palmira, AA 237. Palmira, Valle del Cauca, Colombia. 3Universidad de los Llanos, Villavicencio, Meta, Colombia. *Autor para correspondencia: h.ceballos@cgiar.org
La deficiencia de vitamina A es un problema de enormes consecuencias en la salud pública de muchos países en desarrollo. El perfeccionamiento y difusión de variedades con altos contenidos de carotenoides provitamina A es una estrategia para resolver este problema. La yuca es un cultivo relevante en muchas regiones del mundo cuyos habitantes padecen deficiencia crónica y generalizada de vitamina A. A pesar de que se ha logrado incrementar significativamente el contenido total de carotenoides (CTC) en raíces de yuca mediante el mejoramiento genético, es poco lo que se conoce sobre la herencia de CTC. En este estudio se analizaron numerosas familias de hermanos completos y S1 (resultantes de autofecundaciones). La heredabilidad, estimada por regresión padre-progenies, resultó ser alta (> 0.60) y el análisis de las segregaciones no permitió definir patrones de segregación mendeliana simple que explicaran la variación en todas las familias. Sin embargo, hay suficiente evidencia para plantear la hipótesis de que la herencia es relativamente simple y depende de dos o tres genes mayores, cuya expresión es afectada por unos pocos genes modificadores menores. Se propone que al menos uno de los genes mayores inhibiría la acumulación de carotenoides.
Palabras clave: Caroteno, herencia, raíces de yuca, variabilidad genética.
Vitamin A deficiency (VAD) is a major problem with huge public health implications. One strategy to overcome this problem is the development of varieties with increased levels of pro-vitamin A carotenoids. Cassava is a relevant crop in many regions of the world where VAD is prevalent. Significant progress has already been achieved increasing the content of total carotenoids (CTC) in cassava roots. However, little is known on the inheritance of this trait in cassava. In this study the segregations for CTC in several full-sib and self-pollinated (S1) families were analyzed. Parent-offspring regression was used to estimate heritability, which was found to be high (>0.60). The analyses of segregations did not allow for the identification of simple Mendelian patterns that could explain the variation in CTC in every family analyzed. However, enough evidence has been generated for a hypothesis that few (2-3) major genes control most of the variation in CTC but their action is modified by few minor genes. Mounting evidence was also found that at least one single dominant gene may inhibit carotenoids accumulation in the roots.
Key words: Carotene, cassava roots, genetic variability, inheritance.
La yuca (Manihot esculenta Crantz) es un cultivo nativo de América tropical cuyo consumo se ha extendido a África y Asia. El cultivo se caracteriza por usos contrastantes que van desde la seguridad alimentaria hasta una fuente competitiva y confiable para las industrias de almidón, alimentación animal y etanol.
La deficiencia de vitamina A (DVA) constituye uno de las principales limitantes nutricionales en muchas poblaciones humanas en países en desarrollo (West, 2003). La DVA es un grave problema de salud pública en 37 países y afecta un porcentaje considerable de la población en regiones donde la yuca es cultivada (WHO, 1995). Una estrategia para solucionar este problema es aumentar la calidad nutritiva de los cultivos utilizando el mejoramiento genético para incrementar los niveles de los factores nutricionales más importantes, mediante procesos de selección y recombinación (Underwood, 2000, Chávez et al., 2005; Morillo-C. et al., 2011). Entre numerosos carotenoides, b-caroteno es el de mayor actividad vitamínica y el más prevalente en las raíces de yuca amarilla (Ceballos et al., 2012a). El desarrollo de variedades de yuca con raíces de mayor contenido total de carotenoides (CTC) no sólo ofrece beneficios para la salud humana, sino también para la alimentación animal (Posada et al., 2006).
Los estudios de la herencia del CTC en raíces de yuca son escasos y se refieren más a variación en el color de la raíz que a la calidad nutritiva (Hershey y Ocampo, 1989; Iglesias et al., 1997). El objetivo de este trabajo, basado en una tesis doctoral (Morillo-Coronado, 2009), fue desarrollar poblaciones segregantes para CTC; determinar la variabilidad en cuanto al contenido de estos pigmentos en esas poblaciones y producir así información que permita entender mejor la herencia de esta característica.
Los cruzamientos para producción de semilla botánica, evaluaciones de campo y cuantificación de carotenoides se realizaron en el Centro Internacional de Agricultura Tropical (CIAT), Palmira, Colombia.
Material vegetal
En el trabajo para aumentar el CTC en yuca se generó un alto número de familias de hermanos completos (FHC). Para el efecto se realizó una inspección visual de las raíces producidas por cada genotipo y se seleccionaron aquellos con pigmentación intensa para cuantificación de CTC. Sin embargo, ocasionalmente se analizaron todos los individuos de FHC lo que permite estudios genéticos. En este estudio se presentan resultados de tres grupos de FHC generados a través de los años e identificados como primera, segunda y tercera generación de FHC. Entre las familias de la primera generación se seleccionaron tres que ofrecían un rango de variación para CTC amplio. Para cada una de estas familias se seleccionaron cuatro individuos con niveles de carotenoides muy bajo, intermedio, o muy alto. Estos individuos fueron clonados y plantados en viveros de cruzamiento para producir semilla autopolinizada (S1). Como resultado, se generaron 12 familias S1.
También se autopolinizaron dos clones élites adaptados a la región Caribe de Colombia (MTAI8 y CM4919-1) los cuales no están relacionados con los materiales antes descritos. Estas dos familias S1 fueron generadas para realizar distintos estudios genéticos, entre los que se cuenta el análisis de CTC.
Crecimiento del material vegetal en campo
La semilla obtenida (tanto las FHC como las provenientes de las autofecundaciones) fue germinada y las plántulas trasplantadas al campo siguiendo los protocolos usados rutinariamente por el programa de mejoramiento de yuca del CIAT (Ceballos et al., 2012b, 2012c). En el manejo de los materiales en campo también se aplicaron las prácticas establecidas de riego, fertilizantes y control de malezas. Las plantas fueron cosechadas entre 10 y 11 meses después del trasplante en campo. Se usaron entre dos y cinco raíces de cada genotipo obtenidas aleatoriamente y se tomó como único criterio de selección el que estuvieran libres de daños mecánicos o de insectos y sin pudrición aparente. De cada una de ellas se desecharon las partes distal y proximal y las fracciones restantes se partieron en cuartos longitudinales. De cada raíz se escogieron dos cuartos opuestos los cuales se picaron y mezclaron para extraer tres muestras: una de 5 g para el análisis de carotenoides, otra de 50 g para calcular el porcentaje de materia seca y una última de 30 g como copia de seguridad durante los análisis (Ortiz et al., 2011). Esta última muestra fue guardada en tubos de fondo cónico de 50 ml en ultra congelador (-80°C).
Extracción de carotenoides
Se modificó la extracción de carotenoides sugerida por Safo-Katanga et al. (1984) utilizando éter de petróleo (Chávez et al., 2005; Ortiz et al., 2011, Ceballos et al., 2012a). La cuantificación fue hecha por espectrofotometría visible utilizando un espectrofotómetro Shimadzu UV-VIS 160A. La detección fue hecha a 450 nm (Rodríguez-Amaya 2001; Rodríguez-Amaya y Kimura 2004). El CTC fue estimado utilizando la fórmula siguiente:
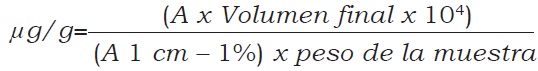
donde:
A = Absorbancia a 450 nm.
Volumen final = Volumen en mililitros de la solución antes de la lectura.
A 1cm-1% = C oeficiente d e a bsorción d el b-caroteno en éter de petróleo = 2592.
Peso de la muestra = en gramos.
Todos los valores presentados en el presente trabajo están basados en concentración de carotenoides con base en peso fresco.
Contenido de materia seca
Para estimar el contenido de materia seca, se secaron en horno a 60 °C por 24 h 50 g de raíces frescas finamente picadas. La materia seca fue expresada como porcentaje de peso seco en relación con peso fresco.
Análisis estadístico
Para los datos cuantitativos (medidas de tendencia central, de variación y de desviación) se utilizaron estadísticas descriptivas e histogramas de frecuencia para una mejor interpretación de la información. El análisis de regresión lineal fue utilizado para estimar la heredabilidad de CTC mediante la regresión padre–progenie (Hallauer y Miranda, 1988; Lynch y Walsh, 1998). Se ha demostrado que el coeficiente de regresión, cuando se relaciona el promedio fenotípico de los progenitores con el de las progenies de FHC por ellos generadas, es un estimador adecuado de la heredabilidad en sentido estricto (s2A/ s2F, donde s2A es la variancia aditiva y s2F es la variancia fenotípica). En el caso de familias autofecundadas, existe un solo progenitor y la regresión se hace utilizando el valor de este único progenitor. En este caso, el significado del coeficiente de regresión, en términos de genética cuantitativa, es ligeramente diferente al caso de FHC y resulta en una estimación conservadora de la heredabilidad. Sin embargo, si se acepta que las frecuencias alélicas p = q = 0.5 o bien que hay ausencia de dominancia, el significado del coeficiente de regresión es similar en S1 y FHC (Hallauer y Miranda, 1988).
En el estudio se evaluaron numerosas familias de la primera generación de FHC, pero algunas de ellas contaban con pocos individuos (menos de ocho), por tanto no serán presentadas en este artículo (Cuadro 1). Muchos materiales de yuca florecen tardíamente y producen pocas flores, lo que constituye una de las limitaciones en el mejoramiento genético y por tanto la producción de material segregante no es siempre segura. En algunos casos, la ausencia de floración impide totalmente la realización de cruzamientos (Ceballos et al., 2012b; 2012c), problema que limitó el número de familias con suficiente cantidad de individuos para representarlas.
Los datos cuantitativos mostraron una amplia distribución de CTC en las raíces de las 21 FHC de la primera generación (678 genotipos en total) listadas en el Cuadro 1. El rango de variación para CTC en este grupo de FHC varió entre 0.14 y 11.16 µg/g (peso fresco), con un promedio de 2.65 µg/g. En el Cuadro 1 aparecen en negrilla las tres FHC (CM9816, GM 708 y GM 893) que fueron elegidas para generar familias S1 a partir de individuos contrastantes para CTC que se describen más adelante.
En el Cuadro 2 se presentan los resultados de la segunda y tercera generación de FHC. En la segunda generación se incluyeron nueve familias representadas por 294 genotipos. El rango de variación para CTC fue entre 0.21 y 13.92 µg/g con un promedio de 5.71 µg/g. En la tercera generación se evaluaron sólo cuatro familias representadas por 292 genotipos (Cuadro 2). Los valores de CTC variaron entre 0.56 y 26.30 µg/g, con un promedio de 6.07µg/g
Es significativo que el mejor promedio de familias en la primera generación de FHC fue de 4.83 µg/g, mientras que en la segunda el mejor promedio aumentó a 7.27 µg/g y en la tercera a 9.92 µg/g. Los aumentos en los mejores promedios reflejan el máximo valor observado en genotipos individuales en la primera, segunda y tercera generación de FHC (11.16, 13.92 y 26.30 µg/g, respectivamente) y son una evidencia del progreso genético que se puede obtener para aumentar CTC en raíces de yuca.
En el Cuadro 1 también se incluyen los valores del coeficiente de asimetría para cada familia. El promedio a través de las 21 FHC fue de 0.578, lo que indica que las distribuciones tienden a tener picos de frecuencias más altos en valores de CTC bajos, con colas en los histogramas de distribución que se extienden hacia la derecha, es decir, hacia las zonas con valores de CTC más altos. En cierta medida esto tiene sentido, ya que existe un límite físico en la izquierda de los histogramas y las raíces no pueden tener valores negativos para CTC. Sin embargo, existen seis familias con coeficientes de asimetría muy bajos (entre -0.200 y 0.200) lo que sugiere una distribución más simétrica. Las asimetrías en las FHC de la segunda y tercera generación se incluyen en el Cuadro 2. El valor promedio para las 13 familias descritas en este Cuadro fue de 0.660 y sólo una familia (GM 1546), presenta un valor cercano a cero.
Los resultados de las familias S1 se incluyen en el Cuadro 3. Los problemas para obtener suficiente semilla botánica en yuca se agravan cuando se busca efectuar autopolinizaciones por la protoginia típica de este cultivo (Ceballos y De la Cruz, 2002). Es necesario notar que la familia AM700 sólo produjo dos individuos que pudieron ser evaluados. Los valores de CTC de los progenitores de cada familia autofecundada igualmente aparecen en el Cuadro 3. Se observa una relación clara entre estos valores y los promedios de las familias que generaron estos individuos, excepto para la familia AM 700 que presentó un limitado número de individuos.
El rango de variación observado en el análisis de materiales segregantes en las familias S1 resulta de particular interés. Si la herencia se debiera a uno o dos genes, como inicialmente fue postulado, entonces al autofecundar materiales de alto o bajo CTC se debería fijar la variación para esta característica con una reducción drástica en los rangos de variación, lo que parece haber sucedido sólo en la familia AM697 (proveniente de un genotipo con bajos niveles de CTC) en la cual ninguno de sus 38 individuos presentó niveles de CTC superiores a 1.0 µg/g. Sin embargo, la familia AM 689 que también se originó de un individuo con bajos niveles de CTC y proviene de la misma FHC, presentó un rango de variación más amplio (entre 0.30 y 6.56 µg/g), aunque el promedio de la familia también fue notablemente bajo (1.10 µg/g). El coeficiente de asimetría en esta familia es alto (3.298) sugiriendo con ello una alta concentración de frecuencias para valores bajos de CTC y una muy tenue y larga cola hacia la derecha del histograma. De hecho, esta familia tenía 34 individuos y sólo cuatro de ellos presentaron niveles de CTC superiores a 2.00 µg/g.
En ningún caso los resultados de autofecundaciones de genotipos con altos niveles de CTC sugieren que se haya podido fijar la variación alrededor de niveles altos de CTC (Cuadro 3). Se destaca el rango de variación observado en la familia AM702 (0.63 - 19.1 µg/g). Ambas familias (AM710 y AM718) derivadas de individuos con niveles altos de CTC de la FHC GM893 parecen haber fijado capacidad para acumular, al menos, un nivel mínimo de CTC por encima de 3 µg/g; algo similar ocurrió con la familia AM692.
En general, las segregaciones observadas en las familias S1 presentaron tres tipos de comportamientos (Figura 1). En algunas familias se observa una clara asimetría con prevalencia de frecuencias concentradas en la izquierda de los histogramas, con una drástica reducción de genotipos con niveles intermedios o altos de CTC. En otros casos (Figura 1) se observa una distribución más bien simétrica con las frecuencias más altas alrededor de valores intermedios de CTC. Existe un tercer tipo de gráficos en los cuales se insinúa una distribución trimodal. Las familias autofecundadas de progenitores con niveles bajos de CTC tienden a producir numerosos genotipos con valores de CTC hasta 5 - 6 veces más altos que los de los progenitores. Cuando el nivel de CTC de los progenitores fue intermedio o alto, sólo unos pocos genotipos superaron los niveles del progenitor y una gran mayoría presentó valores más bajos. Esto explica la tendencia del coeficiente de asimetría a presentar valores negativos sólo en familias de progenitores cuyo CTC fue intermedio o alto. En la Figura 2 se presenta la segregación observada en la familia S1 AM 320, derivada del clon élite MTAI 8. Se hace un especial énfasis en esta familia porque estuvo representada por 177 individuos, por lo que los resultados de esta segregación son muy sólidos.
La relación entre promedios de progenitores y sus respectivas progenies, expresada mediante análisis de regresión lineal, es un buen estimador de la heredabilidad de los caracteres. Ofrece la ventaja de tener en cuenta la precisión con la que se realizan las valoraciones fenotípicas, el modo como los alelos son transmitidos a la descendencia, incluidos ligamientos potenciales, y las interacciones genéticas (dominancia y epistasis) en la expresión final de los caracteres. En este estudio, la regresión padre progenie se realizó con base en 36 observaciones (ver Figura 3). Estos valores se originan de la manera siguiente: de las 21 FHC (primera generación) en sólo diez se conocía el CTC de sus respectivos progenitores, de modo que esta primera generación contribuye con diez observaciones; todas las familias de la segunda y tercera generaciones de FHC (nueve y cuatro familias, respectivamente) fueron consideradas al conocer también el CTC de los respectivos progenitores. De las 14 familias S1 que aparecen en el listado del Cuadro 3 no se consideró AM700, que tuvo sólo dos individuos por lo que existen 13 observaciones derivadas de este tipo de familia.
El coeficiente de regresión lineal (estimador de la heredabilidad) fue de 0.60 cuando se integraron valores de familias HC y S1. Como el significado de este coeficiente –en términos de genética cuantitativa– puede ser ligeramente diferente en progenies de familias HC o S1 según la importancia de los efectos no aditivos y las frecuencias alélicas, también se estimó la heredabilidad y se ignoraron las familias autofecundadas, caso en el cual la heredabilidad aumentó a 0.65. Esto apoya el concepto de que la estimación de heredabiliad mediante la regresión padre-progenie en familias S1 tiende a ser conservadora (Hallaurer y Miranda, 1988). Estos valores, relativamente altos, resultan muy útiles y explican cómo la selección recurrente de ciclo corto implementada en el CIAT prácticamente triplicó en un periodo de diez años los valores máximos con los que se inició el proyecto para mejorar el CTC en las raíces de yuca (Ceballos et al., 2012c). Todas estas observaciones gradualmente convergen para apoyar la hipótesis de que el control genético de CTC en raíces de yuca es relativamente simple y no es muy afectado por el ambiente.
Si bien la relación padre-progenies muestra una tendencia clara, existen algunos puntos que llaman la atención (Figura 3). En dos casos los promedios de los progenitores variaron entre 8mg/g y 9 µg/g, mientras que los de las respectivas progenies presentaron promedios de 2 µg/g, aproximadamente. Para estos casos se pueden proponer algunas explicaciones y la más obvia es que se da un comportamiento recesivo en relación con CTC. Esta situación, sin embargo, va en contravía de lo que el resto de los materiales analizados sugiere. Aunque se tuvieron todos los cuidados del caso, otra explicación es que ocurrió un problema con las polinizaciones que dieron origen a esas familias; por ejemplo, la identificación equivocada de uno de los progenitores. También es posible que haya ocurrido una sobreestimación en la cuantificación de CTC en los progenitores. Una de estas familias forma parte de la segunda generación de hermanos completos (GM 705- 5 x GM 708-63), mientras que la otra forma parte de la tercera generación de hermanos completos y se originó de la cruza entre MBRA 496 y MBRA 1321.
No se observó relación entre los cuatro progenitores que originaron estas dos familias de comportamiento anormal. Por su parte los progenitores GM 705-5 y GM 708-63 fueron utilizados en numerosas ocasiones para producir otras FHC o autofecundaciones. En los demás casos restantes no se observa este comportamiento aparentemente recesivo.
En estudios iniciales de genética básica efectuados en yuca, fueron identificados genes para dos caracteres: forma del lóbulo foliar y color de las raíces. Graner (1942) y Jos y Hrishí (1976) demostraron que la segregación para lóbulos de las hojas ancho o angosto está controlada por un solo gen, influenciado además por la edad y el ambiente. Graner (1942) encontró que el color oscuro de la corteza de la raíz es dominante sobre el claro. La coloración roja o verde de las nervaduras foliares también ha sido utilizada como marcador genético, pero el número de genes que controla este carácter no ha sido estudiado (Kawano et al., 1978). Más recientemente se confirmó una segregación mendeliana normal y una recuperación del 25% de progenies con la expresión del carácter recesivo de almidón sin amilosa a partir de una población de más de 12,000 individuos (Aiemnaka et al., 2012).
Estudios en distintos cultivos sugieren que la heredabilidad para contenido de carotenoides o color de parénquima en distintos tipos de raíces y tubérculos es alta (Jones 1977; Haynes et al., 2011), depende de relativamente pocos genes (dos o tres) (Fernandes Santos y Simon, 2006) y que el contenido de carotenoides tiende a ser dominante sobre ausencia de estos pigmentos (Goldman y Breitbach, 1995). La relación entre el color amarillo y la concentración de compuestos de provitamina A en raíces de yuca ha sido ampliamente demostrada (Hershey y Ocampo, 1989). Para establecer la hipótesis de que un gen simple controla la característica y el amarillo es dominante sobre el blanco, se utilizaron datos de varios cruzamientos. Iglesias et al. (1977) sugirieron que la síntesis y acumulación de carotenoides en raíces de yuca pueden estar regulados por dos genes mayores. Más recientemente, Akinwale et al. (2010) demostraron que la herencia para color de raíces de yuca puede estar controlada por dos o más genes, sin que se hayan observado efectos recíprocos. Todos los estudios de segregación mencionados se refieren al color de parénquima sin cuantificación del contenido de caroteno.
Recientemente apareció publicado el primer estudio sobre aspectos moleculares de la síntesis y acumulación de carotenoides en raíces de yuca (Welsh et al., 2010). En él se describe por primera vez la regulación del gen PSY (fitoeno sintasa) en raíces de yuca, el cual tiene un comportamiento dominante e influye en la síntesis de carotenos mediante diferencias en la eficiencia de la actividad enzimática.
Los resultados del presente estudio presentan por primera vez una estimación de la heredabiliad para CTC en yuca que resultó ser relativamente alta (> 0.60), lo que significa una contribución importante al conocimiento y explica las ganancias rápidas en los incrementos de CTC en raíces de yuca obtenidos luego de una selección recurrente de ciclo corto en el CIAT (Ceballos et al., 2012c).
Los resultados sugieren también una herencia relativamente simple pero basada en más de un factor genético, lo que coincide con estudios moleculares basados en microsatélites (Morillo et al., 2011). Las segregaciones observadas en distintas familias permiten postular una hipótesis sobre las bases genéticas de CTC en yuca. Esta hipótesis se utiliza para explicar la segregación que se ilustra en la Figura 2 y está basada en la existencia de dos genes mayores (tentativamente llamados I y C). El gen I sería dominante e inhibiría la acumulación de carotenoides en raíces de yuca. Desde el punto de vista metabólico no se trata, necesariamente de una inhibición que bloquea la síntesis o acumulación de carotenoides. Es posible que el modo de acción de este gen sea desviar el proceso metabólico hacia otros compuestos diferentes de los carotenoides. Datos no publicados (J. Arango Mejía, comunicación personal, 2012) sugieren que en el caso de la zanahoria la sobreexpresión del gen b-caroteno hidroxilasa (b-HYD) resulta en una disminución de los contenidos de carotenoides en esa raíz, situación ya demostrada en trigo (Qin et al., 2012). Otra alternativa podría ser genes de degradación como CCD (dioxigenasa de rotura de carotenoides) que favorecen la metabolización de carotenos a otros compuestos (xantofilas). Estudios futuros podrán confirmar con más precisión la naturaleza de este factor recesivo.
El segundo gen (C) favorecería la acumulación de carotenoides y podría estar relacionado con PSY. Se postula, por tanto, que tiene un modo de acción aditivo. De acuerdo con esta hipótesis, el genotipo de MTAI 8 sería IiCc. Cuando se autofecunda un individuo con este genotipo, las progenies generadas segregarían para producir las clases fenotípicas siguientes:
- IICC, IICc, IIcc, IiCC, IiCc, e Iicc, que tenderían a un bajo nivel de carotenoides como resultado del efecto dominante del alelo I. Las frecuencias acumuladas de todos estos genotipos sería de 12/16 (para las frecuencias típicas de una segregación mendeliana en un dihíbrido).
- iiCC, por no tener el efecto inhibidor de I podría acumular carotenoides. Por tener el máximo número de alelos que favorecen la acumulación de carotenoides (C), resulta en niveles altos de CTC. La frecuencia de este genotipo sería de 1/16.
- iiCc, por no tener el efecto inhibidor de I podría acumular carotenoides. Por tener un solo alelo C resulta en niveles intermedios de CTC. La frecuencia de este genotipo sería de 2/16.
- iicc, si bien no tiene el efecto inhibidor de I, no acumularía carotenoides porque no tiene alelo C. La frecuencia de este genotipo sería de 1/16.
La frecuencia esperada de individuos con bajo CTC (numerales 1 y 4 anteriores) sería de 13/16. Las frecuencias esperadas de individuos con niveles intermedios de CTC (numeral 3 anterior) y altos (numeral 2 anterior) serían, respectivamente, 2/16 y 1/16. La prueba de chi cuadrado apoya los fundamentos de esta hipótesis. En general, cuando se realiza este tipo de trabajo se debe definir, quizás arbitrariamente, los puntos de corte entre materiales con niveles bajos, intermedios y altos de CTC. Sin embargo, se ha tratado de aplicar los mismos puntos de separación a todas las progenies derivadas de una misma FHC (Cuadro 4) con resultados generalmente satisfactorios.
La cuantificación de carotenoides es altamente confiable y repetible. No obstante, en ocasiones ha sido posible observar variación no esperada en CTC de una raíz para otra en una misma planta (Ortiz et al., 2011). Esta variación puede ser una molestia en programas de mejoramiento porque podría llevar a rechazar genotipos con alto CTC o aceptar genotipos indeseables, pero es aún más grave cuando se busca estudiar las segregaciones porque genera puntos que son muy difíciles de explicar.
Además de los dos genes mayores propuestos existe, quizás, un tercer gen mayor y muy posiblemente un grupo adicional de genes modificadores que generan una variación cuantitativa alrededor de las clases fenotípicas producidas por los genes mayores. No se puede especificar el número de genes menores pero hay suficiente evidencia para justificar que no son muchos (posiblemente menos de cinco). Estas hipótesis están basadas en la información presentada en el Cuadro 4. Las familias S1 derivadas de los genotipos con el más alto CTC (AM690 y AM702) requirieron puntos de separación más altos entre las distintas clases fenotípicas que en las otras familias relacionadas.
- La heredabilidad en sentido estricto para CTC en raíces de yuca es alta (> 0.60).
- Integrando la información generada en este estudio con observaciones y resultados en el proceso de selección para alto CTC, se consolida la idea de que CTC depende de pocos genes mayores (dos o tres) y que existe un grupo de genes modificadores que altera las escalas en las cuales actúan los genes mayores. Se enfatiza que el modelo hipotético planteado es sólo un punto de partida y se postula principalmente para motivar estudios futuros que lo validen y perfeccionen.
- Existe evidencia de que al menos uno de estos genes mayores podría tener una acción recesiva posiblemente mediante el proceso de los carotenoides hacia otros destinos metabólicos, como las xantófilas. Algo similar pudo haber ocurrido en la segregación de la autofecundación de MTAI8.
Aiemnaka, P.; Wongkaew, A.; Chanthaworn, J.; Nagashima, S. N.; Boonma, S.; Authapun, J.; Jenweerawat, S.; Kongsila, P.; Kittipadakul, P.; Nakasathien, S.; Sreewongchai, T.; Wannarat, W.; Vichukit, V.; López-Lavalle, L. A; Ceballos, H.; Rojanaridpiched, C. y Phumichai, C. 2012. Molecular Characterization of a spontaneous waxy starch mutation in cassava (Manihot esculenta Crantz). Crop Sci. (en imprenta) [ Links ]
Akinwale, M. G.; Aladesanwa, R. D.; Akinyele, B. O.; Dixon, A. G. O. y Odiyi, A. C. 2010. Inheritance of b-carotene in cassava (Manihot esculenta Crantz). International J. Gen. Mol. Biol. 2(10):198 - 201. [ Links ]
Ceballos, H. y De la Cruz, G. A. 2002. Taxonomía y morfología de yuca. En: B. Ospina y H. Ceballos (eds.). La yuca en el tercer milenio, sistemas modernos de producción, procesamiento, utilización y comercialización. Publicación CIAT. Cali, Colombia. Cap. 2, p. 17 - 33. [ Links ]
Ceballos, H.; Luna, J.; Escobar, A. F.; Pérez, J. C.; Ortiz, D.; Sánchez, T.; Pachón, H. y D. Dufour, D. 2012a. Spatial distribution of dry matter in yellow fleshed cassava roots and its influence on carotenoids retention upon boiling. Food Res. Intern. 45:52 - 59. [ Links ]
Ceballos, H.; Kulakow P. y Hershey, C. 2012b. Cassava breeding: current status, Bottlenecks and the potential of biotechnology tools. Trop. Plant Biol. 5:73 - 87. [ Links ]
Ceballos, H.; Hershey C.; y Becerra-López-Lavalle L. A. 2012c. New approaches to cassava breeding. Plant Breeding Rev. vol. 35 (en imprenta) [ Links ]
Chávez, A. L.; Sánchez, T.; Jaramillo, G.; Bedoya, J. M.; Echeverri, J.; Bolaños, E. A.; Ceballos, H. e Iglesias, C. A. 2005. Variation on quality traits in cassava roots evaluated in landraces and improved clones. Euphytica 143:125 - 133. [ Links ]
Fernandes Santos C. A. y Simon, P. W. 2006. Heritabilities and minimum gene number estimates of carrot carotenoids. Euphytica 151:79 - 86. [ Links ]
Goldman, I. L. y Breitbach, D. N. 1995. Inheritance of a recessive character controlling reduced carotenoid pigmentation in carrot (Daucus carota L.). J. Heredity 87(5):380 - 382. [ Links ]
Graner. E 1942. Genética de la yuca; 1: Heredabilidad de la forma de la hoja y de la coloración de la película externa de las raíces en Manihot utilisima Pohl. Bragantia 2(1):13 - 22. [ Links ]
Hallauer, A. R. y Miranda Filho, J. B. 1988. Quantitative genetics in maize breeding. Iowa State University Press, Ames, Iowa, EE.UU. p. 49 - 52. [ Links ]
Haynes, K. G.; Clevidence, B. A.; Rao, D. y Vinyard, B. T. 2011. Inheritance of carotenoid content in tetraploid x diploid potato crosses. J. Am. Soc. Hortic. Sci. 136(4):265 -272. [ Links ]
Hershey, C. H. y Ocampo, C. 1989. Description of new genetic markers in cassava. Cassava Newsl. 13:1 - 5. [ Links ]
Iglesias, C.; Mayer, J.; Chávez, L. y Calle, F. 1997. Genetic potential and stability of carotene content in cassava roots. Euphytica 94:367 - 373. [ Links ]
Jones, A. 1977. Heritabilities of seven sweet potato root traits. J. Am. Soc. Hort. Sci. 102(4):440 - 442. [ Links ]
Jos, J. S y Hrishi, N. 1976. Inheritance of leaf shape in cassava. J. Root Crops 2(2):10 - 12. [ Links ]
Kawano, K; Amaya, A; Daza, P y Ríos, M. 1978. Factors affecting efficiency of hybridization and selection in cassava. Crop Sci. 18 (3):373 - 376. [ Links ]
Lynch, M. y Walsh, B. 1998. Genetics and analysis of quantitative traits. Sinauer Associates Inc. Publishers. Sunderland, Massachusetts, EE.UU. p. 48 - 50. [ Links ]
Morillo-Coronado, Y. 2009. Herencia del contenido de carotenos en raíces de yuca (Manihot esculenta Crantz). Tesis de Doctorado. Universidad Nacional de Colombia sede Palmira. 225 p. [ Links ]
Morillo-C., A. C.; Morillo-C., Y.; Fregene, M.; Ramirez, H.; Chávez, A.L.; Sánchez, T.; Morante, N. y Ceballos-L., H. 2011. Diversidad genética y contenido de carotenos totales en accesiones del germoplasma de yuca (Manihot esculenta Crantz). Acta Agronómica 60(2):97 - 107. [ Links ]
Ortiz, D.; Sánchez, T.; Morante, N.; Ceballos, H.; Pachón, H.; Duque, M.C.; Chávez, A.L. y Escobar, A. F. 2011. Sampling strategies for proper quantification of carotenoids content in cassava breeding. J. Plant Breed. Crop Sci. 3(1):14- 23. [ Links ]
Posada, C. A.; López-G., A. y Ceballos, H. 2006. Influencia de harinas de yuca y de batata sobre pigmentación, contenido de carotenoides en la yema y desempeño productivo de aves en postura. Acta Agronómica 55(3):47 - 54. [ Links ]
Qin, X.; Zhang, W.; y Dubcovsky, J. 2012. Cloning and comparative analysis of carotenoid b-hydroxilase genes provides new insights into carotenoid metabolism in tretraploid (Triticum turgidum ssp. durum) and hexaploid (Triticum aestivum) wheat grains. Plant Mol. Biol. DOI 10.1007/s11103-012-9972-4. [ Links ]
Rodríguez-Amaya, D. B. 2001. A Guide to carotenoid analysis in foods. ILSI Press, Washington DC, USA. [ Links ]
Rodriguez-Amaya D.B., y Kimura M. 2004. HarvestPlus handbook for carotenoid analysis. HarvestPlus Technical monograph 2. Washington, DC and Cali, Colombia. International Food Policy Research Institute (IFPRI) and International Center for Tropical Agriculture (CIAT). [ Links ]
Safo-Katanga, O.; Aboagye, P.; Amartey, S. A. y Olaham, J. H. 1984. Studies on the content of yellow-pigmented cassava. En: E. R. Terry, E. V. Doku, O. B Arene, N. M. Mahungu (eds.). IDRC, Ottawa, Canada. Trop. Roots Crops Prod. Uses in Africa. p. 103 -104. [ Links ]
Underwood, B. A. 2000. Overcoming micronutrient deficiencies in developing countries: Is there a role for agriculture? Food Nutr. Bull. 21:356 - 360. [ Links ]
Welsch, R.; Arango, J.; Bär, C.; Salazar, B.; Ál-Babili, S.; Beltrán, J.; Chavarriaga, P.; Ceballos, H.; Tohme, J.; y Beyer, P. 2010. Provitamin A - accumulation in cassava (Manihot esculenta) roots driven by a single nucleotide polymorphism in a phytoene synthase gene. Plant Cell 22:3348 - 3356. [ Links ]
West, K. P. Jr. 2003. Vitamin A deficiency disorders in children and women. Food Nutr. Bull. 24S:78 - 90. [ Links ]
WHO. 1995. Global prevalence of vitamin A deficiency. MDIS Working Paper No 2. W.H.O., Genova, Suiza. [ Links ]













